Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Etiquetado inmunohistológica de microtúbulos en las dendritas neurona sensorial, tráqueas y los músculos en el Drosophila Larva pared del cuerpo
En este artículo
Resumen
Para entender cómo las formas complejas de células, como las dendritas neuronales, se obtienen durante el desarrollo, es importante ser capaz de precisión organización de microtúbulos ensayo. Aquí se describe un método robusto de etiquetado inmunohistoquímico para examinar la organización de microtúbulos de las dendritas arborización dendrítica neurona sensorial, la tráquea, músculos y otros Drosophila Larva tejidos de la pared del cuerpo.
Resumen
Para entender cómo las diferencias en las formas de células complejas se consiguen, es importante seguir con precisión la organización de los microtúbulos. El muro de las larvas de Drosophila cuerpo contiene varios tipos de células que son modelos para el estudio celular y morfogénesis de tejidos. Por ejemplo tráqueas se utilizan para examinar la morfogénesis del tubo 1, y la arborización dendrítica (DA), las neuronas sensoriales de la larva de Drosophila se han convertido en un sistema principal para el esclarecimiento de los generales y las neuronas específicas de la clase de mecanismos de diferenciación 5.2 dendríticas y degeneración 6 .
La forma de dendritas pueden variar significativamente entre las clases de neuronas, e incluso entre las diferentes ramas de una sola neurona 7,8. Los estudios genéticos en las neuronas DA sugieren que la organización del citoesqueleto diferencial puede subyacen a las diferencias morfológicas en forma de ramas dendríticas 4,9-11. Ofrecemos un método inmunológico etiquetado robusta a unssay en la organización de los microtúbulos en vivo DA sensorial cenador neurona dendrita (Figuras 1, 2, Movie 1). Este protocolo se muestra la disección y la inmunotinción de larva de primer estadio, una etapa en la actividad sensorial consecuencia dendritas neuronales y la organización de ramificación se está produciendo 12,13.
Además de la tinción de las neuronas sensoriales, este método logra el etiquetado robusto de organización de microtúbulos en los músculos (Películas 2, 3), la tráquea (Figura 3, Movie 3), y otros tejidos de la pared del cuerpo. Es valioso para los investigadores que deseen analizar la organización de microtúbulos in situ en la pared del cuerpo en la investigación de los mecanismos de control que el tejido y la forma celular.
Protocolo
1. Preparación de los reactivos
Notas antes de comenzar: la disección y la tinción inmunohistoquímica se llevan a cabo en una cámara magnética y la larva se fija por el uso de clavos de insectos de forma especial. Las instrucciones detalladas para la construcción de una cámara magnética, y la preparación de estos pines se pueden encontrar en las referencias relacionadas con 14,15. En resumen, un agujero cuadrado 1x1cm se corta en una hoja magnética y un cubreobjetos colocado en la parte posterior de la hoja para hacer una pequeña cámara. Los lados de la cámara está sellada con pegamento epóxico, después de esta cola se ha fijado la cámara se lava varias veces con etanol al 70% antes de su uso. Pines disección de insectos son preparados por la flexión a la forma deseada y luego pegado a una lengüeta metálica 14,15. Como alternativa a una ficha de metal, se ha utilizado una invertida de cabeza plana chincheta de acero con un mango de una punta amarilla de corte. Uso de esta cámara magnética permite un estrecho control over posicionamiento pin y el tejido se extiende durante la disección.
Para conducir la expresión del gen en diferentes subgrupos de neuronas DA investigadores pueden utilizar varias líneas diferentes Gal4 (resumidos por Shimono y sus colegas 16). Muchas de estas líneas están disponibles de los centros públicos de acciones. En este protocolo representante, llevamos a cabo la inmunotinción de una línea en la que dos clases opuestas de neuronas DA son co-etiquetado: el más simple de clase I y la mayoría de los complejos de clase IV (P10-Gal4 17,18, UAS-mCD8:: Kusabira-Orange (KO)).
- Prepare Ca + + libre HL3.1 solución salina
- En mM: 70 NaCl, 5 KCl, 20 de MgCl 2, 10 NaHCO 3, 5 HEPES, sacarosa 115, y trehalosa 5, pH 7,2 19. Filtro-esterilizar y almacenar a 4 ° C. Nota: Ca + + sin solución impide la contracción muscular durante la disección.
- Prepare 2x tampón PHEM
- En mM: 130 TUBOS, 60 HEPES, 20 EGTA, 4 MgSO4, pH 7,0. Filtro-esterilizar y almacenar a 4 ° C.
Nota: Estos materiales no se disuelven hasta que se acerque el pH 7,0.
- En mM: 130 TUBOS, 60 HEPES, 20 EGTA, 4 MgSO4, pH 7,0. Filtro-esterilizar y almacenar a 4 ° C.
- Preparar el fijador recién inmediatamente antes de la fijación.
- Con el fin de preparar una solución de 25 ml, paraformaldehído primera mezcla de 2 g, 100μl 1M NaOH y 10 ml de agua en un tubo de 50 ml Falcon.
- Agite el fijador en un baño de agua a 55 ° C con agitación hasta que la solución es clara. (Volumen total será de unos 11,5 ml.)
- Fijador de enfriar en hielo.
- Añadir buffer 12.5ml 2x PHEM.
- Ajustar el pH a 7.0 con HCl 1M.
- Llene la solución con agua hasta que el volumen es de 25 ml.
- Filtrar la solución con papel Whatman.
2. Disección de las larvas
Tenga en cuenta antes de empezar: las redes de microtúbulos, y en particular los de las dendritas sensorial, se descompondrá rápidamente después del inicio de la disección. Corriente alternahieving disección rápida en menos de cinco minutos, seguido de la fijación inmediata son factores clave en el éxito de este protocolo.
- Lave la larva en el agua y rápidamente pasar a esta caída con un bucle de cabello.
- Orientar la larva hasta la parte dorsal y la parte ventral en el cristal. Nota: Esta orientación es el de examinar las neuronas grupo ventral. Para examinar las neuronas dorsales cluster, invertir la orientación.
- Use el centro de insectos-pin a pin del extremo anterior cerca de los ganchos de la boca. Coloque el pasador cerca del final para obtener mejores resultados.
- Ponga una gota de solución salina HL3.1 en la cámara de disección.
- Cortar la punta posterior de la larva de con micro tijeras. Nota: Este paso se abre una abertura en el extremo posterior de la larva que va a permitir el acceso de la micro tijeras (paso 2.7).
- Coge con las pinzas de la región del intestino que está asomando de la abertura en el extremo posterior de la larva. Retire con cuidado todo el intestino.
- Coloque elpunta de una hoja de la micro tijeras a través de la apertura y corte a lo largo de la línea media ventral hacia la parte anterior.
- Utilizando los pines esquina, las esquinas del ahora libre, posterior, luego anterior. Al mismo tiempo estira suavemente abrir el filete de larvas.
3. Fijación, bloqueo, tinción y montaje de los filetes de larvas
Notas antes de empezar: Todas las medidas de fijación y tinción se llevó a cabo en la sala de disección. Durante este proceso, tenga cuidado de no tocar los pines de la celebración de la larva del insecto, ya que puede conducir a daños en los tejidos. Para evitar que el experimento de la desecación, se todos los pasos de tinción en un pequeño recipiente Tupperware rodeado por tejidos húmedos.
- Aspirar el Ca + + libre HL3.1 buffer usando una punta amarilla. Inmediatamente añadir el fijador con otro pipetteman.
- Pipeta suavemente arriba y abajo para mezclar el fijador con las trazas restantes de Ca + + libre HL3.1 bufferen la cámara. Inmediatamente aspirado y luego añadir el fijador fresco en la cámara.
- Incubar a temperatura ambiente durante 20 minutos.
- Lavado de 10 minutos 6 veces en PBST (0,1% Triton X-100 en PBS).
- Bloquear con suero de cabra al 5% en PBST durante 20 minutos a temperatura ambiente.
- Vuelva a colocar la solución de bloqueo con anticuerpos primarios diluidos en suero de cabra al 5% en PBST. Los anticuerpos primarios utilizados son el ratón anti-α-tubulina (DM1A) y la rata anti-CD8 (5H10), tanto diluido 1 / 1000.
Nota: El investigador puede desear a sustituir el ratón anti-α-tubulina (DM1A) con el ratón anti-Futsch (22C10) diluido 20,21 1 / 1000 en algunas circunstancias (véase la discusión).
- Incubar toda la noche (por lo menos a las 16h) a 4 ° C.
- Lavado de 10 minutos 6 veces en PBST.
- Añadir la solución de anticuerpo secundario diluido en suero de cabra al 5% en PBST. Los anticuerpos secundarios utilizados son Alexa Fluor 488 cabra anti-ratón IgG y Cy3 burro IgG anti-rata. Mantener la muestra cubierta para evitar fluoróforofoto-blanqueo 22.
- Incubar ya sea a temperatura ambiente durante dos horas, o durante la noche a 4 ° C, seguida de una hora a temperatura ambiente.
- Lavado de 10 minutos 6 veces en PBST.
- Coloque los filetes de larvas en la diapositiva de la cutícula hacia abajo, monte en el 80% de glicerol, y el sello de los lados del cubreobjeto con esmalte de uñas para un "rápido" de montaje.
Nota: Para limpiar el tejido mejora, y una muestra de estabilidad permanente, montar en DPX como se describió previamente 23.
4. Los resultados representativos:
Tinción fluorescente se examinan bajo un microscopio confocal. En las Figuras 1-2 ramas, diferentes dentro de un jardín de dendritas tienen la organización del citoesqueleto diferentes. La figura 1 muestra una región de la glorieta de la clase IV DA neuronas en la 1 ª fase estadio larval. La pérgola entera está marcada con mCD8:: KO y detectado usando un anticuerpo anti-CD8 y fluorescentes secundaria (Cy3). Tubulina se detecta el uso de anti α-tubulina de anticuerpos y fluorescent secundario (Alexa Fluor 488). Las ramas principales son positivos para la tubulina, algunas ramas laterales delgadas son tubulina-negativo. Movie 1 es un conjunto de secciones en serie a través de una coloración similar de una clase I DA neuronas. La figura 2 muestra una región de la glorieta de la clase IV DA neuronas teñidas con anticuerpos contra Futsch y CD8 en la 1 ª fase estadio larval. Las ramas principales son Futsch-positivas, algunas ramas laterales delgadas son Futsch negativo. Figura 3. Tráqueas en la pared del cuerpo de larvas muestran una organización compleja de microtúbulos. Películas 2 y 3 muestran las secciones de serie de manchas a través de los músculos de la pared del cuerpo y la tráquea.
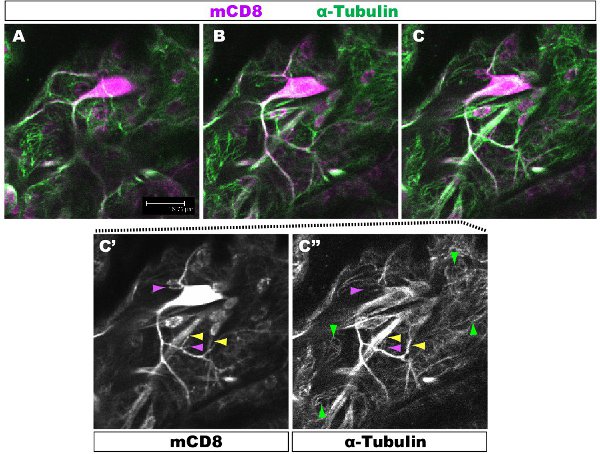
Figura 1. Fig. 1 muestra una región de la glorieta de la clase IV DA neuronas en la 1 ª fase estadio larval. La pérgola entera está marcada con mCD8:: KO y detectado usando anticuerpo anti-CD8 y fluorescentes secundaria (Cy3). Tubulina se detecta el uso de anti-&-túbulosn de anticuerpos fluorescentes y secundario (Alexa 488). Paneles AC secuencial confocal z-secciones (0.5μm), C '-C ", la tinción de anticuerpos única desde el panel de C. Ejemplo de ramas con (punta de flecha amarilla) o sin (púrpura punta de flecha) se destacan los microtúbulos. Puntas de flecha roja microtúbulos destacar en el subyacente las células epiteliales.
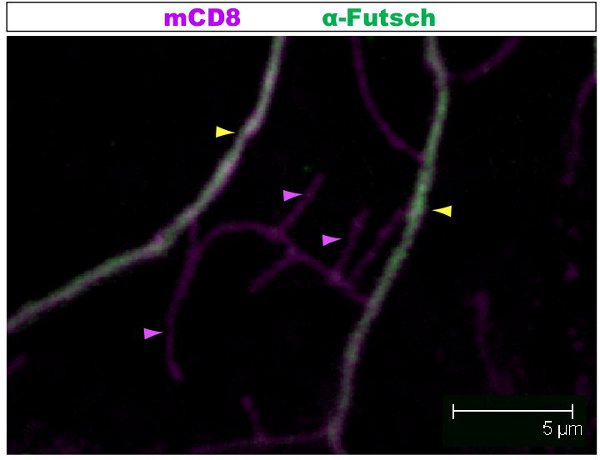
Figura 2. Fig. La figura 2 muestra una región similar de la glorieta de la clase IV da neuronas teñidas con anticuerpos contra Futsch y CD8 en la 1 ª fase estadio larval. La pérgola entera está marcada con mCD8:: KO y detectado usando anticuerpo anti-CD8 y fluorescentes secundaria (Cy3). Futsch se detecta el uso de anti-anticuerpos fluorescentes y Futsch secundario (Alexa 488). Las ramas principales son Futsch-positivas, algunas ramas laterales delgadas son Futsch negativo. Ejemplo de las ramas con (punta de flecha amarilla) o sin (púrpura punta de flecha) Futsch se destacan.
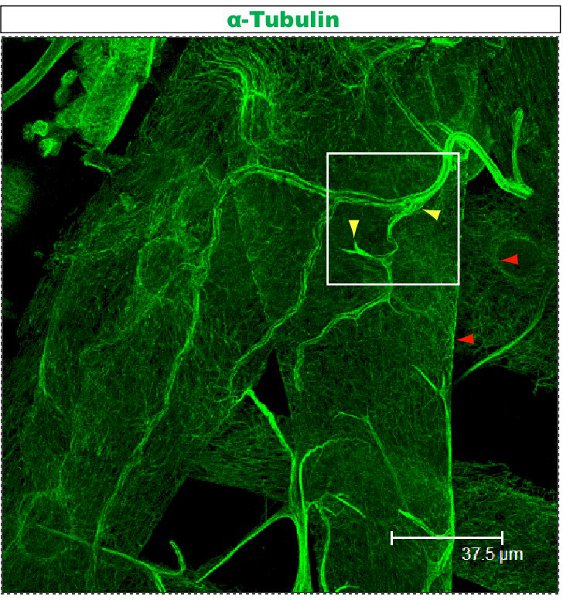
Figura 3. Tráquea teñidas utilizando el protocolo anti-tubulina se ha descrito anteriormente. Esta larva es el tercer estadio y diseccionado como se describió previamente 23,24. Movie 3 muestra ampliada de serie de secciones en el campo marcado por un cuadrado.
Secciones de cine 1. Serie trazado tinción tubulina a través de la glorieta dendríticas de una clase que las neuronas. La pérgola entera está marcada con mCD8:: KO (Magenta) y detectado usando anticuerpo anti-CD8 y fluorescentes secundaria (Cy3). Tubulina (verde) se detecta mediante un anticuerpo anti-α-tubulina y fluorescentes secundario (Alexa Fluor 488). Escala: de un lado de la imagen de vídeo se corresponde con 46.88μm en la sección. Haga clic aquí para ver la película.
Movie 2. Serie secciones trazado tinción tubulina en cuerposy la pared muscular de un tercer instar de la larva. Tubulina se detecta el uso de anti-α-tubulina de anticuerpos fluorescentes y secundario (Alexa Fluor 488). Escala: de un lado de la imagen de vídeo se corresponde con 46.88μm en la sección. Haga clic aquí para ver la película.
Movie 3. Las secciones seriadas búsqueda tinción tubulina en un cuerpo de la pared de la tráquea tercera instar de la larva, marcado con un cuadrado en Figure.3. Tubulina se detecta el uso de anti-α-tubulina de anticuerpos fluorescentes y secundario (Alexa Fluor 488). Escala: de un lado de la imagen de vídeo se corresponde con 46.88μm en la sección. Haga clic aquí para ver la película.
Discusión
Para entender la complejidad de las formas celulares se logró es importante ser capaz de precisión organización de microtúbulos ensayo. Aquí se describe un método robusto de etiquetado inmunohistoquímico para la organización de los microtúbulos ensayo dendríticas dendritas arborización neurona sensorial. Además de la tinción de las neuronas sensoriales, este método logra tinción inmunohistoquímica robusta de la tráquea, músculos y otros tejidos de la pared del cuerpo.
Nosot...
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Damos las gracias a RIKEN para su financiación. P10-Gal4 fue una especie de regalo de Alain Vicente (Université Paul Sabatier, Toulouse, Francia).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Catálogo número | Comentarios (Opcional) |
|---|---|---|---|
| Fórceps | Dumont | 11251-20 | |
| Microtijeras | FST | 15000-08 | |
| Mouse anti-α-tubulina (Clon: DM1A) | Sigma | T9026 | Dilución 1 / 1000 |
| Anti-ratón Futsch (Clon: 22C10), sobrenadante | De desarrollo Estudios Banco hibridoma | 22C10 | Dilución 1 / 1000 |
| Rata anti-CD8 (clon: 5H10) | Caltag | MCD0800 | Dilución 1 / 1000 |
| Alexa Fluor 488 IgG anti-ratón | Invitrogen | A-11.001 | Dilución 1 / 500 |
| Cy3 anti-IgG de rata | Jackson Immunoresearch | 712-166-150 | Dilución 1 / 200 |
Referencias
- Schottenfeld, J., Song, Y., Ghabrial, A. S. Tube continued: morphogenesis of the Drosophila tracheal system. Curr. Opin. Cell. Biol. 22, 633-639 (2010).
- Gao, F. B., Brenman, J. E., Jan, L. Y., Jan, Y. N. Genes regulating dendritic outgrowth, branching, and routing in Drosophila. Genes Dev. 13, 2549-2561 (1999).
- Corty, M. M., Matthews, B. J., Grueber, W. B. Molecules and mechanisms of dendrite development in Drosophila. Development. 136, 1049-1061 (2009).
- Moore, A. W. Intrinsic mechanisms to define neuron class-specific dendrite arbor morphology. Cell. Adh. Migr. 2, 81-82 (2008).
- Grueber, W. B., Jan, L. Y., Jan, Y. N. Tiling of the Drosophila epidermis by multidendritic sensory neurons. Development. 129, 2867-2878 (2002).
- Nishimura, Y. Selection of Behaviors and Segmental Coordination During Larval Locomotion Is Disrupted by Nuclear Polyglutamine Inclusions in a New Drosophila Huntington's Disease-Like Model. J. Neurogenet. 24, 194-206 (2010).
- Ramon y Cajal, S. . Histology of the nervous system of man and vertebrates, 1995 translation. , (1911).
- London, M., Hausser, M. Dendritic computation. Annu. Rev. Neurosci. 28, 503-532 (2005).
- Jinushi-Nakao, S. Knot/Collier and cut control different aspects of dendrite cytoskeleton and synergize to define final arbor shape. Neuron. 56, 963-978 (2007).
- Li, W., Gao, F. B. Actin filament-stabilizing protein tropomyosin regulates the size of dendritic fields. J. Neurosci. 23, 6171-6175 (2003).
- Ye, B. Differential regulation of dendritic and axonal development by the novel Kruppel-like factor Dar1. J. Neurosci. 31, 3309-3319 (2011).
- Parrish, J. Z., Xu, P., Kim, C. C., Jan, L. Y., Jan, Y. N. The microRNA bantam functions in epithelial cells to regulate scaling growth of dendrite arbors in drosophila sensory neurons. Neuron. 63, 788-802 (2009).
- Sugimura, K. Distinct developmental modes and lesion-induced reactions of dendrites of two classes of Drosophila sensory neurons. J. Neurosci. 23, 3752-3760 (2003).
- Budnik, V., Gorczyca, M., Prokop, A. Selected methods for the anatomical study of Drosophila embryonic and larval neuromuscular junctions. Int. Rev. Neurobiol. 75, 323-365 (2006).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila Protocols. , (2000).
- Shimono, K. Multidendritic sensory neurons in the adult Drosophila abdomen: origins, dendritic morphology, and segment- and age-dependent programmed cell death. Neural. Dev. 4, 37-37 (2009).
- Colomb, S., Joly, W., Bonneaud, N., Maschat, F. A concerted action of Engrailed and Gooseberry-Neuro in neuroblast 6-4 is triggering the formation of embryonic posterior commissure bundles. PLoS One. 3, 2197-2197 (2008).
- Dubois, L. Collier transcription in a single Drosophila muscle lineage: the combinatorial control of muscle identity. Development. 134, 4347-4355 (2007).
- Feng, Y., Ueda, A., Wu, C. F. A modified minimal hemolymph-like solution, HL3.1, for physiological recordings at the neuromuscular junctions of normal and mutant Drosophila larvae. J Neurogenet. 18, 377-402 (2004).
- Hummel, T., Krukkert, K., Roos, J., Davis, G., Klambt, C. Drosophila Futsch/22C10 is a MAP1B-like protein required for dendritic and axonal development. Neuron. 26, 357-370 (2000).
- Zipursky, S. L., Venkatesh, T. R., Teplow, D. B., Benzer, S. Neuronal development in the Drosophila retina: monoclonal antibodies as molecular probes. Cell. 36, 15-26 (1984).
- Brent, J., Werner, K., McCabe, B. D. Drosophila Larval NMJ Immunohistochemistry. J. Vis. Exp. (25), e1108-e1108 (2009).
- Karim, M. R., Moore, A. W. Morphological Analysis of Drosophila Larval Peripheral Sensory Neuron Dendrites and Axons Using Genetic Mosaics. J. Vis. Exp. (57), e3111-e3111 (2011).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila Larval NMJ Dissection. J. Vis. Exp. (24), e1107-e1107 (2009).
- Tao, J., Rolls, M. M. Dendrites have a rapid program of injury-induced degeneration that is molecularly distinct from developmental pruning. J. Neurosci. 31, 5398-5405 (2011).
- Yamamoto, M., Ueda, R., Takahashi, K., Saigo, K., Uemura, T. Control of axonal sprouting and dendrite branching by the Nrg-Ank complex at the neuron-glia interface. Curr. Biol. 16, 1678-1683 (2006).
- Mattie, F. J. Directed microtubule growth, +TIPs, and kinesin-2 are required for uniform microtubule polarity in dendrites. Curr. Biol. 20, 2169-2177 (2010).
- Pawson, C., Eaton, B. A., Davis, G. W. Formin-dependent synaptic growth: evidence that Dlar signals via Diaphanous to modulate synaptic actin and dynamic pioneer microtubules. J. Neurosci. 28, 11111-11123 (2008).
- Williams, D. W., Tyrer, M., Shepherd, D. Tau and tau reporters disrupt central projections of sensory neurons in Drosophila. J. Comp. Neurol. 428, 630-640 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados