Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Immünohistolojik Duyusal Nöron Dendritler Mikrotübüller Etiketleme, trakea ve kaslar Drosophila Larva Vücut Duvar
Bu Makalede
Özet
Nöron dendritler gibi karmaşık hücre şekilleri, geliştirme sırasında nasıl elde edilir anlamak için, bu, doğru tahlil mikrotübül organizasyonu edebilmek için önemlidir. Burada dendritik arborization duyusal nöron dendritler mikrotübül organizasyonu, trakea, kas incelemek için sağlam bir immünohistolojik bir etiketleme yöntemi açıklamak ve diğer Drosophila Larva vücut duvar dokuları.
Özet
Karmaşık hücre şekilleri farklılıklar nasıl elde edilir anlamak için, doğru mikrotübül organizasyonu takip etmek önemlidir. Drosophila larva vücut duvarı, hücre ve doku morfolojilerinden çalışma modelleri çeşitli hücre tipleri içerir . Örneğin trakea tüp morfolojilerinden 1 ve Drosophila larva duyusal nöronlar, genel ve dendritik farklılaşma 2-5 ve 6 dejenerasyon nöron sınıf özel mekanizmaların aydınlatılması için birincil sistem haline gelmiştir dendritik arborization (DA) incelemek için kullanılır . .
Dendrit dallarının şekli nöron sınıflar arasında önemli farklılıklar ve hatta tek bir nöron 7,8 farklı dalları arasında. DA nöronların genetik çalışmalar diferansiyel sitoskeletal organizasyon dendritik şube şekli 4,9-11 morfolojik farklılıklar altında olduğunu göstermektedir. Biz sağlam bir immünolojik etiketleme yöntemiDA duyusal nöron dendrit çardak in vivo mikrotübül organizasyonu (Şekil 1, 2, Movie 1) ssay. Bu protokol ilk instar larva diseksiyonu ve immün aktif duyusal nöron dendrit akıbet ve dallanma organizasyon 12,13 meydana gelen bir aşama göstermektedir.
Duyusal nöronlar boyama ek olarak, bu yöntem güçlü kas mikrotübül organizasyonu etiketleme (Film 2, 3), soluk borusu (Şekil 3, Film 3), ve diğer vücut duvarı dokulara ulaşır. Kontrol doku ve hücre şekli, bu mekanizmaların araştırılması vücut duvarı in situ mikrotübül organizasyonu analiz etmek isteyen araştırmacılar için değerli .
Protokol
1. Reaktiflerin hazırlanması
Başlamadan önce Notlar: Diseksiyon ve immünohistokimyasal bir manyetik odasında yapılmakta ve larva özel şekilli böcek pimleri kullanarak aşağı tutturulmuş. Manyetik bir odasının inşaat, ve bu pimlerin hazırlanması ile ilgili ayrıntılı talimatlar, ilgili referanslar 14,15 bulunabilir . Kısaca, bir 1x1cm kare delik bir manyetik levha ve küçük bir oda yapmak için kağıdın arka tarafına yapıştırılmış bir lamel bölünür. Odanın iki epoksi yapıştırıcı ile mühürlenir; sonra bu tutkal odası kullanmadan önce% 70 etanol ile birkaç kez yıkanır. Diseksiyon böcek pimleri istenilen şekil bükme tarafından hazırlanan ve daha sonra bir metal sekmesini 14,15 yapıştırılmış . Alternatif metal bir sekmesinde, bir cut-off sarı ucundan yapılan bir kolu ile ters bir düz başlı çelik raptiye kullandım. Bu manyetik oda düzenleme kullanın, yakın kontrolü ove sağlarr pin konumlandırma ve doku diseksiyonu sırasında germe.
DA nöronlar araştırmacılar farklı alt muhabiri gen ekspresyonu sürücü için birkaç farklı Gal4 hatları (Shimono ve arkadaşları 16 tarafından özetlenmiştir) kullanabilirsiniz. Bu satırları çoğu kamu stok merkezlerinden mevcuttur. Bu temsili protokolde, DA nöron iki zıt sınıfların ortak etiketli olduğu bir çizgi immün yürütmek en basit sınıf I ve en karmaşık sınıf IV (P10-Gal4 17,18, UAS-mCD8: Kusabira-Orange (KO)).
- Ca + + ücretsiz HL3.1 tuzlu su hazırlayın
- MM: 70 NaCl, 5 KCl, 20 MgCl 2, 10 NaHCO 3, 5 Hepes, 115 sakkaroz ve 5 trehaloz pH 7,2 19. Filtre sterilize ve 4 saklamak ° C Not: Ca + + ücretsiz bir çözüm diseksiyonu sırasında kas kasılması önler.
- 2x PHEM tampon hazırlayın
- MM: 130 BORU, 60 Hepes, 20 EGTA, 4 MgSO4, pH 7.0. Filtre sterilize ve 4 saklamak ° C
Not: Bu malzemeler, pH 7.0 yaklaşana kadar çözülmez.
- MM: 130 BORU, 60 Hepes, 20 EGTA, 4 MgSO4, pH 7.0. Filtre sterilize ve 4 saklamak ° C
- Fiksatif taze fiksasyon hemen önce hazırlayın.
- 50 ml Falcon tüp 25ml çözüm, ilk karışımı 2g paraformaldehid, 100μl 1M NaOH ve 10 ml su hazırlamak için.
- Çözüm netleşene kadar çırpıcı ile 55 ° C su banyosunda fiksatif çalkalayın. (Toplam hacmi 11.5 ml olacaktır.)
- Buz üzerinde soğuk fiksatif.
- 12.5ml 2x PHEM tampon ekleyin.
- 1M HCl ile pH 7.0 'a ayarlayın.
- Çözüm hacmi 25ml kadar su ile doldurun.
- Filtre whatman kağıt kullanılarak çözüm.
2. Larvaların diseksiyonu
Başlamadan önce Not: duyusal dendritler özellikle Mikrotubul ağları ve arıza diseksiyon başladıktan sonra hızla. Achemen fiksasyonu takiben en az beş dakika içinde hızlı diseksiyon hieving Bu protokolün başarısında önemli faktörlerdir.
- Larva suda yıkayın ve hızlı bir şekilde saç bir döngü kullanarak bu düşüş içine taşıyabilirsiniz.
- Orient camına larva dorsal yüzü yukarı ve ventral tarafta. Not: Bu yönelim ventral küme nöronlar incelemektir. Dorsal küme nöronlar incelemek için, yönünü ters çevirin.
- Ön ucunu ağzına kanca yakın pin merkezinde böcek-pin kullanın. En iyi sonuçları elde etmek için sonuna kadar yakın pin yerleştirin.
- Diseksiyonu odasında bir damla serum fizyolojik HL3.1 yerleştirin.
- Microscissors ile larva çok arka ucu kesti. Not: Bu adım, microscissors (adım 2.7) için erişim sağlayacak larva posterior sonunda bir diyafram açılır.
- Forseps larva arka sonunda diyafram dışarı alay bağırsak bölgesi tut. Bütün bağırsak yavaşça çekin.
- Yeriventral orta hat boyunca öne doğru diyafram ve kesme yoluyla microscissors bir bıçak ucu.
- Köşesinde pimleri kullanarak, ilk arka sonra ön artık ücretsiz köşelerinde, pin. Aynı zamanda larva fileto yavaşça açın germek.
3. Fiksasyon, engelleme, boyama, ve larva filetosu montaj
Başlamadan önce Notlar: Tüm fiksasyon ve boyama adımları diseksiyonu odasında yürütülür. Bu süreçte, bu doku hasarına yol açabilir larva tutan böcek pinleri devirmek için dikkatli olun. Deney kurumasını önlemek için, boyama nemlendirilmiş dokuları ile çevrili küçük bir Tupperware konteyner bütün adımları uygulayın.
- Sarı bir uç kullanarak Ca + + ücretsiz HL3.1 tampon aspire. Hemen başka bir pipetteman kullanarak fiksatif ekleyin.
- Ca + + ücretsiz HL3.1 tampon kalan izleri ile yavaşça fiksatif karıştırmak için aşağı yukarı pipet veOdanın. Hemen aspirat ve sonra odasına taze fiksatif ekleyin.
- 20 dakika oda sıcaklığında inkübe edin.
- PBST 6x 10mins (% 0.1 PBS içinde Triton X-100) yıkayın.
- RT 20 dakika PBST% 5 keçi serumu ile engelleyin.
- PBST% 5 keçi serumu seyreltilmiş primer antikorlar ile bloke çözüm değiştirin. Kullanılan birincil antikorlar fare anti-α-tubulin (DM1A) ve sıçan anti-CD8 (5H10) seyreltilmiş 1 / 1000.
Not: Araştırmacı, fare anti-Futsch (22C10) 20,21 seyreltilmiş bazı durumlarda 1 / 1000 ile fare anti-α-tubulin (DM1A) yerine (tartışma) isteyebilirsiniz .
- 4 (en az 16h) bir gece inkübe ° C
- PBST 6x 10mins yıkayın.
- PBST% 5 keçi serumu seyreltilmiş ikincil antikor çözüm ekleyin. Kullanılan sekonder antikor Alexa Fluor 488 keçi anti-fare IgG ve Cy3 eşek anti-sıçan IgG. Fluorofor önlemek için kapalı örnek tutun22 foto-kasar.
- Ya iki saat boyunca oda sıcaklığında inkübe edin, ya da bir gecede 4 ° C oda sıcaklığında bir saat izledi.
- PBST 6x 10mins yıkayın.
- % 80 gliserol monte slayt aşağı manikür-yan larva fileto yerleştirin ve bir 'hızlı' monte etmek için oje ile lamel iki mühür.
Not: gelişmiş doku temizleme ve kalıcı istikrarlı bir örnek için, DPX monte edilir, daha önce 23 açıklandığı gibi.
4. Temsilcisi Sonuçlar:
Floresan boyama konfokal bir mikroskop altında incelendi. Sayılarla dendrit bir çardak içinde 1-2 farklı dallarında farklı sitoskeletal organizasyon var. Şekil 1, 1. instar larva aşamasında sınıf IV DA nöron mili bir bölge gösterir . KO ve ikincil bir anti-CD8 antikor ve floresan (Cy3) kullanarak tespit: bütün mili mCD8 ile işaretlenir. Tubulin anti-α-tubulin antikor ve Florlu kullanarak tespitescent ikincil (Alexa Fluor 488). Tubulin ana dalları için olumlu, bazı ince yan dalları tubulin negatif. Film 1 sınıf I DA nöron benzer bir boyama ile seri bölümleri bir dizi. Şekil 2, 1. instar larva aşamasında Futsch ve CD8 karşı antikorlar ile boyanarak sınıf IV DA nöronun mili bir bölge gösterir . Ana dalları Futsch pozitif, bazı ince yan dalları Futsch negatif. Şekil 3. Trakea larva vücut duvarı karmaşık bir mikrotübül organizasyonu göstermektedir. Filmler 2 ve 3, vücut duvarı kasları ve trakea ile boyama seri bölümleri göstermektedir.
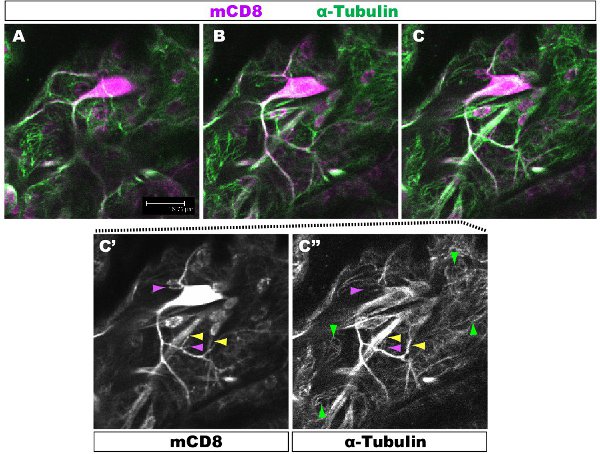
Şekil 1. Şekil 1, 1. instar larva aşamasında sınıf IV DA nöron mili bir bölge gösterir . Bütün mili mCD8 ile işaretlenir: KO ve anti-CD8 antikor ve floresan ikincil (Cy3) kullanarak algılandı. Tubulin anti-&-Tubuli kullanarak tespitn antikor ve floresan sekonder (Alexa 488). Altta yatan Panelleri AC sıralı konfokal z bölümler (0.5μm) C'-C ", panel C. Örnek (sarı ok ucu) veya mikrotübül vurgulanır (mor ok ucu) olmadan şubeleri tek antikor boyama Kırmızı ok uçları vurgulamak mikrotübül epitel hücreleri.
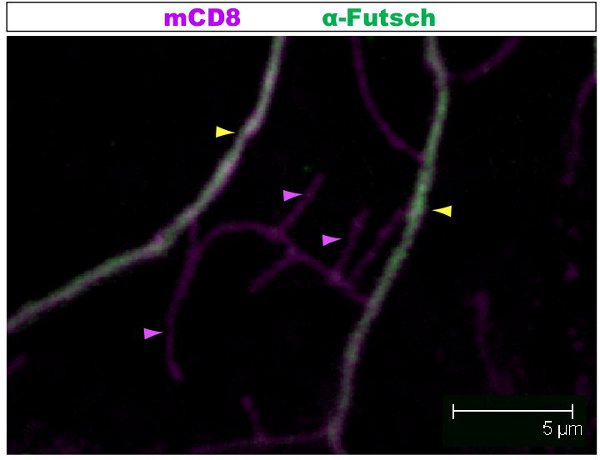
Şekil 2. Şekil 2, 1. instar larva aşamasında Futsch ve CD8 karşı antikorlar ile boyanarak sınıf IV da nöronun mili benzer bir bölgeyi gösterir . Bütün mili mCD8 ile işaretlenir: KO ve anti-CD8 antikor ve floresan ikincil (Cy3) kullanarak algılandı. Futsch Futsch anti-antikor ve floresan ikincil (Alexa 488) ile tespit edilir. Ana dalları Futsch pozitif, bazı ince yan dalları Futsch negatif. (Sarı ok ucu) ya da (mor ok ucu) Futsch olmadan şubeleri örneği vurgulanır.
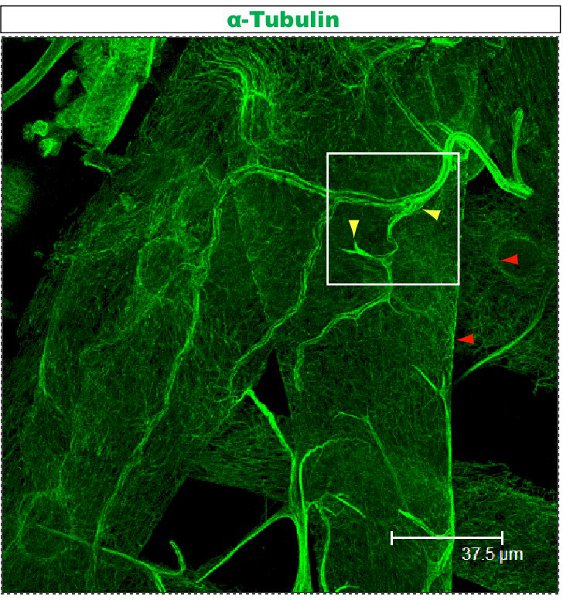
Şekil 3. Trakea, yukarıda açıklanan anti-tubulin protokolü kullanılarak boyandı. Bu larva, üçüncü instar ve daha önce 23,24 açıklandığı gibi disseke. Movie 3, bir kare ile işaretlenmiş alan genişlemiş seri bölümleri gösterir.
Film 1 Seri bölümleri ben nöron bir sınıfın dendritik mili boyunca tubulin boyama izleme. KO (Kırmızı) ve ikincil anti-CD8 antikor ve floresan (Cy3) kullanarak tespit: bütün mili mCD8 ile işaretlenir. Tubulin (Yeşil) bir anti-α-tubulin antikor ve floresan ikincil (Alexa Fluor 488) kullanılarak tespit edilir. Ölçek: video görüntüsünün bir yan bölümünde 46.88μm karşılık gelir. Movie görmek için buraya tıklayın.
Bod tubulin boyama izleme Film 2 Seri bölümleriüçüncü bir instar larva y duvarı kasları. Tubulin anti-α-tubulin antikor ve floresan ikincil (Alexa Fluor 488) kullanılarak tespit edilmiştir. Ölçek: video görüntüsünün bir yan bölümünde 46.88μm karşılık gelir. Movie görmek için buraya tıklayın.
Film 3 Seri üçüncü bir instar larva Şekil.3 bir kare ile işaretlenmiş bir vücut duvar trakea, tubulin boyama izleme bölümleri. Tubulin anti-α-tubulin antikor ve floresan ikincil (Alexa Fluor 488) kullanılarak tespit edilmiştir. Ölçek: video görüntüsünün bir yan bölümünde 46.88μm karşılık gelir. Movie görmek için buraya tıklayın.
Tartışmalar
Ne kadar karmaşık hücre şekiller elde edilir anlamak için, doğru tahlil mikrotübül organizasyonu edebilmek için önemlidir. Burada dendritik arborization duyusal nöron dendritler tahlil mikrotübül organizasyonu sağlam bir immünohistolojik etiketleme yöntemi açıklar. Boyama duyusal nöronlar ek olarak, bu yöntem, trakea, kaslar ve diğer vücut duvarı dokuları sağlam immünohistolojik boyama ulaşır.
Biz DA nöronlarının gelişmekte olan duyusal dendritler mikrotübül...
Açıklamalar
Biz ifşa etmek başka bir şey var.
Teşekkürler
Biz finansman için RIKEN teşekkür ederim. P10-Gal4 Alain Vincent (Université Paul Sabatier, Toulouse, Fransa) bir tür hediye edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktifi Adı | Şirket | Katalog numara | Yorumlar (Isteğe bağlı) |
|---|---|---|---|
| Forseps | Dumont | 11251-20 | |
| Microscissors | FST | 15000-08 | |
| Fare anti-α-tubulin (Klonlama: DM1A) | Sigma | T9026 | Seyreltme 1 / 1000 |
| Mouse anti-Futsch (Klonlama: 22C10) süpernatant | Gelişim Çalışmalar Hibridoma Bankası | 22C10 | Seyreltme 1 / 1000 |
| Sıçan anti-CD8 (Klonlama: 5H10) | Caltag | MCD0800 | Seyreltme 1 / 1000 |
| Alexa Fluor 488 anti-fare IgG | Invitrogen | A-11001 | Seyreltme 1 / 500 |
| Cy3 anti-Rat IgG | Jackson Immunoresearch | 712-166-150 | Seyreltme 1 / 200 |
Referanslar
- Schottenfeld, J., Song, Y., Ghabrial, A. S. Tube continued: morphogenesis of the Drosophila tracheal system. Curr. Opin. Cell. Biol. 22, 633-639 (2010).
- Gao, F. B., Brenman, J. E., Jan, L. Y., Jan, Y. N. Genes regulating dendritic outgrowth, branching, and routing in Drosophila. Genes Dev. 13, 2549-2561 (1999).
- Corty, M. M., Matthews, B. J., Grueber, W. B. Molecules and mechanisms of dendrite development in Drosophila. Development. 136, 1049-1061 (2009).
- Moore, A. W. Intrinsic mechanisms to define neuron class-specific dendrite arbor morphology. Cell. Adh. Migr. 2, 81-82 (2008).
- Grueber, W. B., Jan, L. Y., Jan, Y. N. Tiling of the Drosophila epidermis by multidendritic sensory neurons. Development. 129, 2867-2878 (2002).
- Nishimura, Y. Selection of Behaviors and Segmental Coordination During Larval Locomotion Is Disrupted by Nuclear Polyglutamine Inclusions in a New Drosophila Huntington's Disease-Like Model. J. Neurogenet. 24, 194-206 (2010).
- Ramon y Cajal, S. . Histology of the nervous system of man and vertebrates, 1995 translation. , (1911).
- London, M., Hausser, M. Dendritic computation. Annu. Rev. Neurosci. 28, 503-532 (2005).
- Jinushi-Nakao, S. Knot/Collier and cut control different aspects of dendrite cytoskeleton and synergize to define final arbor shape. Neuron. 56, 963-978 (2007).
- Li, W., Gao, F. B. Actin filament-stabilizing protein tropomyosin regulates the size of dendritic fields. J. Neurosci. 23, 6171-6175 (2003).
- Ye, B. Differential regulation of dendritic and axonal development by the novel Kruppel-like factor Dar1. J. Neurosci. 31, 3309-3319 (2011).
- Parrish, J. Z., Xu, P., Kim, C. C., Jan, L. Y., Jan, Y. N. The microRNA bantam functions in epithelial cells to regulate scaling growth of dendrite arbors in drosophila sensory neurons. Neuron. 63, 788-802 (2009).
- Sugimura, K. Distinct developmental modes and lesion-induced reactions of dendrites of two classes of Drosophila sensory neurons. J. Neurosci. 23, 3752-3760 (2003).
- Budnik, V., Gorczyca, M., Prokop, A. Selected methods for the anatomical study of Drosophila embryonic and larval neuromuscular junctions. Int. Rev. Neurobiol. 75, 323-365 (2006).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila Protocols. , (2000).
- Shimono, K. Multidendritic sensory neurons in the adult Drosophila abdomen: origins, dendritic morphology, and segment- and age-dependent programmed cell death. Neural. Dev. 4, 37-37 (2009).
- Colomb, S., Joly, W., Bonneaud, N., Maschat, F. A concerted action of Engrailed and Gooseberry-Neuro in neuroblast 6-4 is triggering the formation of embryonic posterior commissure bundles. PLoS One. 3, 2197-2197 (2008).
- Dubois, L. Collier transcription in a single Drosophila muscle lineage: the combinatorial control of muscle identity. Development. 134, 4347-4355 (2007).
- Feng, Y., Ueda, A., Wu, C. F. A modified minimal hemolymph-like solution, HL3.1, for physiological recordings at the neuromuscular junctions of normal and mutant Drosophila larvae. J Neurogenet. 18, 377-402 (2004).
- Hummel, T., Krukkert, K., Roos, J., Davis, G., Klambt, C. Drosophila Futsch/22C10 is a MAP1B-like protein required for dendritic and axonal development. Neuron. 26, 357-370 (2000).
- Zipursky, S. L., Venkatesh, T. R., Teplow, D. B., Benzer, S. Neuronal development in the Drosophila retina: monoclonal antibodies as molecular probes. Cell. 36, 15-26 (1984).
- Brent, J., Werner, K., McCabe, B. D. Drosophila Larval NMJ Immunohistochemistry. J. Vis. Exp. (25), e1108-e1108 (2009).
- Karim, M. R., Moore, A. W. Morphological Analysis of Drosophila Larval Peripheral Sensory Neuron Dendrites and Axons Using Genetic Mosaics. J. Vis. Exp. (57), e3111-e3111 (2011).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila Larval NMJ Dissection. J. Vis. Exp. (24), e1107-e1107 (2009).
- Tao, J., Rolls, M. M. Dendrites have a rapid program of injury-induced degeneration that is molecularly distinct from developmental pruning. J. Neurosci. 31, 5398-5405 (2011).
- Yamamoto, M., Ueda, R., Takahashi, K., Saigo, K., Uemura, T. Control of axonal sprouting and dendrite branching by the Nrg-Ank complex at the neuron-glia interface. Curr. Biol. 16, 1678-1683 (2006).
- Mattie, F. J. Directed microtubule growth, +TIPs, and kinesin-2 are required for uniform microtubule polarity in dendrites. Curr. Biol. 20, 2169-2177 (2010).
- Pawson, C., Eaton, B. A., Davis, G. W. Formin-dependent synaptic growth: evidence that Dlar signals via Diaphanous to modulate synaptic actin and dynamic pioneer microtubules. J. Neurosci. 28, 11111-11123 (2008).
- Williams, D. W., Tyrer, M., Shepherd, D. Tau and tau reporters disrupt central projections of sensory neurons in Drosophila. J. Comp. Neurol. 428, 630-640 (2000).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır