A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
תיוג Immunohistological של microtubules ב דנדריטים Neuron חושי, Tracheae, והשרירים של תסיסנית גוף Larva הכותל
In This Article
Summary
כדי להבין כיצד צורות תאים מורכבים, כגון דנדריטים עצביים, מושגות במהלך הפיתוח, חשוב להיות מסוגל הארגון במדויק microtubule assay. כאן אנו מתארים את שיטת תיוג חזקים immunohistological לבחון ארגון microtubule הדנדריטים של נוירון דנדריטים arborization חושית, קנה הנשימה, שריר, ועוד תסיסנית גוף הזחל רקמות קיר.
Abstract
כדי להבין כיצד ההבדלים בצורות התא מורכב מושגות, חשוב לעקוב במדויק ארגון microtubule. הקיר הזחל תסיסנית הגוף מכיל סוגי תאים מספר דגמים ללמוד התא המורפוגנזה רקמות. לדוגמה tracheae משמשים לבחון המורפוגנזה צינור 1, ואת arborization הדנדריטים (DA) עצב סנסורי של הזחל תסיסנית הפכו המערכת העיקרית של הבהרה כללית נוירון ברמה ספציפי מנגנוני 2-5 בידול הדנדריטים וניוון 6 .
צורת הענפים דנדריט יכול להשתנות באופן משמעותי בין מעמדות נוירון, ואפילו בין סניפים שונים של תא עצב בודד 7,8. מחקרים גנטיים מראים כי הנוירונים התובע ארגון cytoskeletal ההפרש יכול ביסוד הבדלים מורפולוגיים בצורת ענף הדנדריטים 4,9-11. אנו מספקים שיטה חזקים תיוג החיסוני לssay בארגון microtubule vivo ב DA דנדריט נוירון חושי סוכת (איורים 1, 2, סרט 1). פרוטוקול זה ממחיש את לנתיחה ו immunostaining של הזחל instar הראשון, השלב שבו פעיל דנדריט נוירון חושי תולדה וארגון הסתעפות מתרחש 12,13.
בנוסף מכתים עצב סנסורי, שיטה זו משיגה תיוג החזקה של ארגון microtubule בשרירים (סרטים 2, 3), קנה הנשימה (איור 3, סרט 3), ועוד קיר רקמות הגוף. זהו ערך עבור חוקרים המבקשים לנתח ארגון microtubule באתרו בקיר הגוף כאשר חוקרים מנגנונים רקמות מלאה צורת התא.
Protocol
1. הכנה של ריאגנטים
הערות לפני ההתחלה: Dissection ו מכתים immunohistochemical מתבצעת בתא מגנטי הזחל הוא מרותקים באמצעות סיכות בצורת חרקים במיוחד. הוראות מפורטות על בניית חדר מגנטי, והכנת סיכות אלו ניתן למצוא אזכורים הקשורים 14,15. בקיצור, חור מרובע 1x1cm הוא חתך לתוך גיליון מגנטי coverslip מודבקת האחורי של הגיליון כדי להפוך חדר קטן. הדפנות של החדר חתומות עם דבק אפוקסי, דבק אחרי זה יש להגדיר את החדר נשטף מספר פעמים עם אתנול 70% לפני השימוש. חרקים סיכות Dissection מוכנים ידי כיפוף לצורה הנדרשת ולאחר מכן מודבק על גבי הכרטיסייה מתכת 14,15. לחילופין ללשונית מתכת, השתמשנו ציור הפוכה ראש שטוח פינים פלדה עם ידית עשוי לחתוך את קצה צהוב. שימוש בהסדר זה קאמרית המגנטי מאפשר לסגור לשלוט over מיצוב סיכה ורקמת מתיחה במהלך לנתיחה.
כדי לנהוג גן ביטוי הכתב תת שונים של נוירונים חוקרים התובע רשאי להשתמש במספר שונה Gal4 קווי (סיכם שימונו על ידי ועמיתיו 16). רבים שורות אלה זמינים ממרכזי מניות לציבור. בפרוטוקול זה נציג, אנחנו לבצע immunostaining קו שבה שני מעמדות מנוגדים של DA נוירון הם שיתוף שכותרתו: הכי פשוט ברמה שאני ורוב מורכבים ברמה IV (P10-Gal4 17,18, כטב"מ-mCD8: Kusabira-Orange (KO)).
- הכן Ca + + ללא HL3.1 מלוחים
- במ"מ: 70 NaCl, KCl 5, 20 MgCl 2, 10 NaHCO 3, 5 HEPES, 115 סוכרוז, ו 5 trehalose; pH 7.2 19. מסנן לעקר ולאחסן ב 4 ° C. הערה: Ca + + ללא פתרון המונע התכווצות שרירים במהלך לנתיחה.
- הכן 2x חיץ PHEM
- מ"מ: 130 צינורות, 60 HEPES, 20 EGTA, 4 MgSO4; 7.0 pH. מסנן לעקר ולאחסן ב 4 ° C.
הערה: חומרים אלה לא מתמוססים עד pH 7.0 הגישות.
- מ"מ: 130 צינורות, 60 HEPES, 20 EGTA, 4 MgSO4; 7.0 pH. מסנן לעקר ולאחסן ב 4 ° C.
- הכן את טרי מקבע מיד לפני קיבעון.
- על מנת להכין פתרון 25ml, paraformaldehyde first 2g לערבב, 100μl NaOH 1M 10 מ"ל מים בצינור פלקון 50 מ"ל.
- Shake מקבע בתוך אמבטיה 55 מעלות צלזיוס מים עם שייקר עד הפתרון הוא ברור. (סה"כ נפח יהיה כ 11.5 מ"ל).
- מקבע מגניב על הקרח.
- הוסף חוצץ 12.5ml 2x PHEM.
- התאם את ה-pH 7.0 עם 1M HCl.
- מלאו את הפתרון עם מים עד נפח הוא 25ml.
- סנן את הפתרון באמצעות נייר Whatman.
2. הזחל לנתיחה
הערה לפני שמתחילים: רשתות Microtubule, ובמיוחד אלה דנדריטים חושית, פירוט יהיה במהירות לאחר תחילתו של דיסקציה. Achieving לנתיחה מהירה תוך פחות מחמש דקות לאחר מכן קיבוע מיידי הם גורמי מפתח להצלחה של פרוטוקול זה.
- שטפו את הזחל במים במהירות להזיז אותם טיפה זה באמצעות לולאה של השיער.
- המזרח בצד הגבי הזחל מעלה את הצד הגחוני על הזכוכית. הערה: אוריינטציה זו היא לבחון את הנוירונים אשכול הגחון. כדי לבחון נוירונים אשכול הגבי, להפוך את הכיוון.
- השתמש במרכז חרקים פינים להצמיד את הקצה הקדמי ליד ווים הפה. מניחים את הסיכה קרוב לסוף לקבלת התוצאות הטובות ביותר.
- מניחים טיפת מלח HL3.1 בחדר דיסקציה.
- חותכים את קצה אחורי מאוד של הזחל את עם microscissors. הערה: צעד זה פותח צוהר בקצה האחורי של הזחל שיאפשר גישה עבור microscissors (שלב 2.7).
- תפוס עם מלקחיים את האזור של הבטן כי הוא עכשיו מציץ מתוך הפתח בקצה האחורי של הזחל. משוך בעדינות את הבטן כולה.
- הנח אתקצה הלהב אחד microscissors דרך הפתח לחתוך לאורך קו האמצע לכיוון הגחון הקדמי.
- באמצעות סיכות פינה, פינים בפינות חינם עכשיו האחורי הראשונה, ואז הקדמי. במקביל למתוח בעדינות לפתוח את פילה הזחל.
3. קיבוע, חסימת, מכתים, ואת הרכבה של פילה הזחל
הערות לפני ההתחלה: כל קיבעון צעדים מכתים מבוצעות בחדר דיסקציה. במהלך תהליך זה, להיזהר לא לדפוק את הפינים חרקים מחזיק את הזחל מכיוון שהדבר עלול לגרום נזק לרקמות. כדי למנוע את הניסוי מהתייבשות, לעשות את כל הצעדים מכתים במיכל פלסטיק קטן מוקף ברקמות לחלח.
- לשאוב + Ca + ללא HL3.1 חיץ באמצעות קצה צהוב. מיד להוסיף את מקבע באמצעות אחר pipetteman.
- פיפטה בעדינות מעלה ומטה כדי לערבב את מקבע עם שאריות של חיץ HL3.1 Ca + + ללאבחדר. מיד לשאוב אותו ולאחר מכן להוסיף מקבע טרי לתוך החדר.
- דגירה בטמפרטורת החדר למשך 20 דקות.
- לשטוף 10mins 6x ב PBST (0.1% טריטון X-100 ב-PBS).
- בלוק עם סרום עיזים 5% PBST במשך 20 דקות ב RT.
- החלף את הפתרון חוסם עם נוגדנים העיקרי בדילול בסרום עיזים 5% PBST. נוגדנים העיקרי בשימוש הם העכבר אנטי-α טובולין (DM1A) לבין חולדה אנטי CD8 (5H10) הן בדילול מלא 1 / 1000.
הערה: החוקר מומלץ תחליף העכבר אנטי-α טובולין (DM1A) עם העכבר אנטי Futsch (22C10) 20,21 בדילול מלא 1 / 1000 בנסיבות מסוימות (ראה דיון).
- דגירה לילה (לפחות 16h) בשעה 4 ° C.
- לשטוף 10mins 6x ב PBST.
- הוסף פתרון נוגדנים משני בדילול בסרום עיזים 5% PBST. נוגדנים הם בשימוש משני אלקסה פלואוריד 488 עיזים אנטי עכבר IgG ו Cy3 חמור נגד חולדה IgG. שמור על מדגם מכוסה כדי למנוע fluorophoreצילום הלבנה 22.
- דגירה או ב RT במשך שעתיים, או לילה ב 4 ° C ואחריו כשעה בטמפרטורת החדר.
- לשטוף 10mins 6x ב PBST.
- מניחים את פילה הזחל בשקופית לציפורן בצד למטה, לעלות ב 80% גליצרול ו לאטום את הצדדים של coverslip עם לק על הר "מהיר".
הערה: ניקוי רקמות משופרת מדגם יציב קבע, הר ב DPX כפי שתואר לעיל 23.
4. נציג תוצאות:
מכתים פלורסנט נבדק תחת מיקרוסקופ confocal. ב איורים 1-2, סניפים שונים בתוך סוכת דנדריט יש ארגון cytoskeletal שונים. איור 1 מציג אזור של סוכת של IV מעמד התובע נוירון על שלב 1 st הזחל instar. סוכת כולו מסומן mCD8: KO ו זוהה באמצעות נוגדן אנטי CD8 ו פלורסנט משני (Cy3). טובולין הוא זוהה באמצעות נוגדן אנטי-α טובולין ו פלואורידescent משנית (אלקסה פלואוריד 488). הענפים העיקריים הם חיוביים טובולין, כמה ענפים דקים מהצד הם טובולין שלילי. סרט 1 היא סדרה של חתכים דרך מכתים דומה אני בכיתה התובע נוירון. איור 2 מראה אזור של סוכת של IV מעמד התובע נוירון מוכתם נוגדנים כנגד Futsch ו CD8 על שלב 1 st הזחל instar. הענפים העיקריים הם Futsch חיובי, כמה ענפים דקים הם Futsch צד שלילי. באיור 3. Tracheae בקיר גוף הזחל להראות ארגון microtubule מורכבים. סרטים 2 ו -3 להראות קטעים הסידורי של מכתים דרך קיר שרירי הגוף ואת הנשימה.
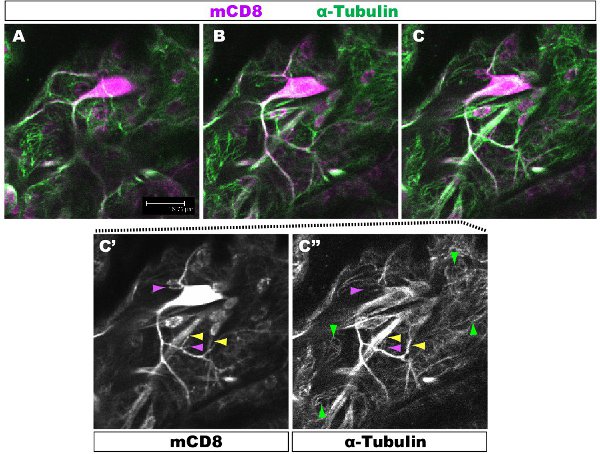
באיור 1. איור. 1 מראה אזור של סוכת של IV מעמד התובע נוירון על שלב 1 st הזחל instar. סוכת כולו מסומן mCD8: KO ו זוהה באמצעות נוגדן אנטי CD8 משני ניאון (Cy3). טובולין מזוהה באמצעות אנטי &-Tubuli n נוגדנים משני ניאון (אלקסה 488). לוחות AC רציפים confocal Z-קטעים (0.5μm), C'-C ", מכתים נוגדן בודד דוגמה ג פאנל של ענפים עם (ראש חץ צהוב) או בלי (חץ סגול) microtubules מודגשים. חצים אדומים להדגיש microtubules בתוך הבסיס תאים אפיתל.
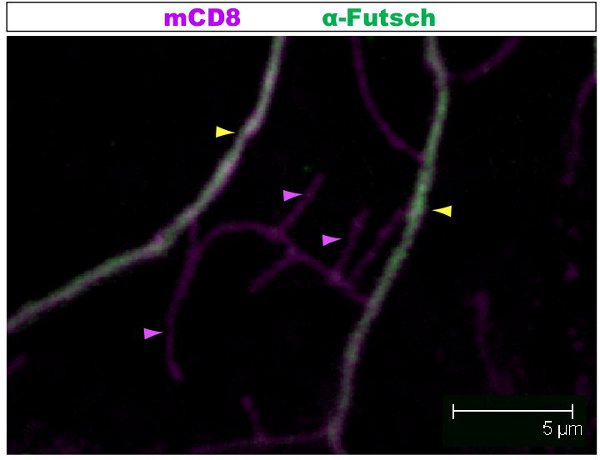
באיור 2. איור. 2 מראה האזור דומה של סוכת של IV בכיתה דה נוירון מוכתם נוגדנים כנגד Futsch ו CD8 על שלב 1 st הזחל instar. סוכת כולו מסומן mCD8: KO ו זוהה באמצעות נוגדן אנטי CD8 משני ניאון (Cy3). Futsch הוא זוהה באמצעות נוגדן אנטי Futsch משני ניאון (אלקסה 488). הענפים העיקריים הם Futsch חיובי, כמה ענפים דקים הם Futsch צד שלילי. דוגמה של ענפים עם (ראש חץ צהוב) או בלי (חץ סגול) Futsch מודגשים.
= "Jove_content"> 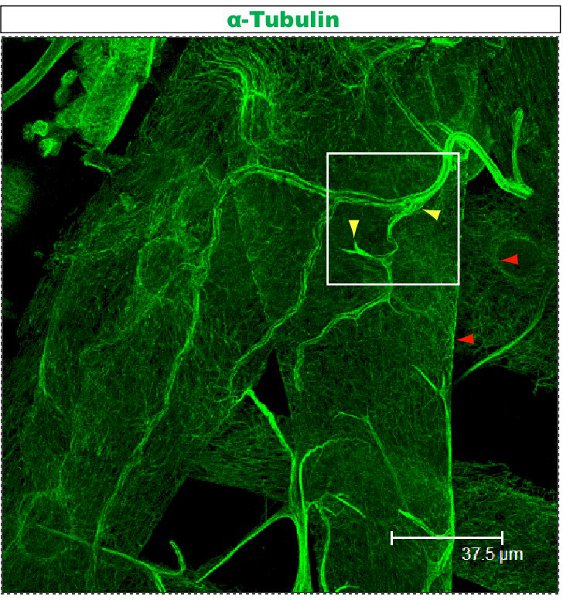
באיור 3. קנה הנשימה מוכתמים באמצעות פרוטוקול טובולין אנטי שתוארו לעיל. הזחל זה instar השלישי גזור כפי שתואר קודם לכן 23,24. Movie 3 מראה קטעים סדרתי מוגדל מתחום מסומן ריבוע.
סרט 1. סעיפים טורי מעקב מכתים טובולין ברחבי סוכת הדנדריטי של מעמד אני נוירון. סוכת כולו מסומן mCD8: KO (מגנטה) ו זוהה באמצעות נוגדן אנטי CD8 ו פלורסנט משני (Cy3). טובולין (ירוק) הוא זוהה באמצעות נוגדן אנטי-α טובולין ו פלורסנט משנית (אלקסה פלואוריד 488). קנה מידה: צד אחד של תמונת וידאו מתאים 46.88μm בסעיף. לחץ כאן כדי להציג את הסרט.
סרט 2. סעיפים טורי מעקב מכתים טובולין ב BODy קיר השרירים של הזחל instar השלישי. טובולין מזוהה באמצעות אנטי טובולין α-נוגדן ו פלורסנט משנית (אלקסה פלואוריד 488). קנה מידה: צד אחד של תמונת וידאו מתאים 46.88μm בסעיף. לחץ כאן כדי להציג את הסרט.
סרט 3. סעיפים טורי מעקב מכתים טובולין בתוך גוף קיר קנה הנשימה של הזחל instar שלישי, המסומנים בכיכר Figure.3. טובולין מזוהה באמצעות אנטי טובולין α-נוגדן ו פלורסנט משנית (אלקסה פלואוריד 488). קנה מידה: צד אחד של תמונת וידאו מתאים 46.88μm בסעיף. לחץ כאן כדי להציג את הסרט.
Discussion
כדי להבין כיצד צורות מורכבות התא מושגות חשוב להיות מסוגל הארגון במדויק microtubule assay. כאן אנו מתארים את שיטת תיוג חזקים immunohistological לארגון assay microtubule הדנדריטים של נוירון דנדריטים arborization חושית. בנוסף עצב סנסורי מכתים, שיטה זו משיגה מכתים immunohistological החזקה של קנה הנשימה, השריר?...
Disclosures
אין לנו שום דבר לגלות.
Acknowledgements
אנו מודים RIKEN למימון. P10-Gal4 הייתה מתנה סוג של אלן וינסנט (אוניברסיטת פול סבטייה, טולוז, צרפת).
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | קטלוג מספר | תגובות (לא חובה) |
|---|---|---|---|
| מצבטים | דומון | 11251-20 | |
| Microscissors | FST | 15000-08 | |
| עכבר אנטי-α טובולין (Clone: DM1A) | סיגמא | T9026 | דילול 1 / 1000 |
| עכבר אנטי Futsch (Clone: 22C10), supernatant | התפתחותי מחקרים Hybridoma בנק | 22C10 | דילול 1 / 1000 |
| עכברוש אנטי CD8 (Clone: 5H10) | Caltag | MCD0800 | דילול 1 / 1000 |
| אלקסה פלואוריד 488 אנטי עכבר IgG | Invitrogen | A-11001 | דילול 1 / 500 |
| Cy3 אנטי עכברוש IgG | ג'קסון Immunoresearch | 712-166-150 | דילול 1 / 200 |
References
- Schottenfeld, J., Song, Y., Ghabrial, A. S. Tube continued: morphogenesis of the Drosophila tracheal system. Curr. Opin. Cell. Biol. 22, 633-639 (2010).
- Gao, F. B., Brenman, J. E., Jan, L. Y., Jan, Y. N. Genes regulating dendritic outgrowth, branching, and routing in Drosophila. Genes Dev. 13, 2549-2561 (1999).
- Corty, M. M., Matthews, B. J., Grueber, W. B. Molecules and mechanisms of dendrite development in Drosophila. Development. 136, 1049-1061 (2009).
- Moore, A. W. Intrinsic mechanisms to define neuron class-specific dendrite arbor morphology. Cell. Adh. Migr. 2, 81-82 (2008).
- Grueber, W. B., Jan, L. Y., Jan, Y. N. Tiling of the Drosophila epidermis by multidendritic sensory neurons. Development. 129, 2867-2878 (2002).
- Nishimura, Y. Selection of Behaviors and Segmental Coordination During Larval Locomotion Is Disrupted by Nuclear Polyglutamine Inclusions in a New Drosophila Huntington's Disease-Like Model. J. Neurogenet. 24, 194-206 (2010).
- Ramon y Cajal, S. . Histology of the nervous system of man and vertebrates, 1995 translation. , (1911).
- London, M., Hausser, M. Dendritic computation. Annu. Rev. Neurosci. 28, 503-532 (2005).
- Jinushi-Nakao, S. Knot/Collier and cut control different aspects of dendrite cytoskeleton and synergize to define final arbor shape. Neuron. 56, 963-978 (2007).
- Li, W., Gao, F. B. Actin filament-stabilizing protein tropomyosin regulates the size of dendritic fields. J. Neurosci. 23, 6171-6175 (2003).
- Ye, B. Differential regulation of dendritic and axonal development by the novel Kruppel-like factor Dar1. J. Neurosci. 31, 3309-3319 (2011).
- Parrish, J. Z., Xu, P., Kim, C. C., Jan, L. Y., Jan, Y. N. The microRNA bantam functions in epithelial cells to regulate scaling growth of dendrite arbors in drosophila sensory neurons. Neuron. 63, 788-802 (2009).
- Sugimura, K. Distinct developmental modes and lesion-induced reactions of dendrites of two classes of Drosophila sensory neurons. J. Neurosci. 23, 3752-3760 (2003).
- Budnik, V., Gorczyca, M., Prokop, A. Selected methods for the anatomical study of Drosophila embryonic and larval neuromuscular junctions. Int. Rev. Neurobiol. 75, 323-365 (2006).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila Protocols. , (2000).
- Shimono, K. Multidendritic sensory neurons in the adult Drosophila abdomen: origins, dendritic morphology, and segment- and age-dependent programmed cell death. Neural. Dev. 4, 37-37 (2009).
- Colomb, S., Joly, W., Bonneaud, N., Maschat, F. A concerted action of Engrailed and Gooseberry-Neuro in neuroblast 6-4 is triggering the formation of embryonic posterior commissure bundles. PLoS One. 3, 2197-2197 (2008).
- Dubois, L. Collier transcription in a single Drosophila muscle lineage: the combinatorial control of muscle identity. Development. 134, 4347-4355 (2007).
- Feng, Y., Ueda, A., Wu, C. F. A modified minimal hemolymph-like solution, HL3.1, for physiological recordings at the neuromuscular junctions of normal and mutant Drosophila larvae. J Neurogenet. 18, 377-402 (2004).
- Hummel, T., Krukkert, K., Roos, J., Davis, G., Klambt, C. Drosophila Futsch/22C10 is a MAP1B-like protein required for dendritic and axonal development. Neuron. 26, 357-370 (2000).
- Zipursky, S. L., Venkatesh, T. R., Teplow, D. B., Benzer, S. Neuronal development in the Drosophila retina: monoclonal antibodies as molecular probes. Cell. 36, 15-26 (1984).
- Brent, J., Werner, K., McCabe, B. D. Drosophila Larval NMJ Immunohistochemistry. J. Vis. Exp. (25), e1108-e1108 (2009).
- Karim, M. R., Moore, A. W. Morphological Analysis of Drosophila Larval Peripheral Sensory Neuron Dendrites and Axons Using Genetic Mosaics. J. Vis. Exp. (57), e3111-e3111 (2011).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila Larval NMJ Dissection. J. Vis. Exp. (24), e1107-e1107 (2009).
- Tao, J., Rolls, M. M. Dendrites have a rapid program of injury-induced degeneration that is molecularly distinct from developmental pruning. J. Neurosci. 31, 5398-5405 (2011).
- Yamamoto, M., Ueda, R., Takahashi, K., Saigo, K., Uemura, T. Control of axonal sprouting and dendrite branching by the Nrg-Ank complex at the neuron-glia interface. Curr. Biol. 16, 1678-1683 (2006).
- Mattie, F. J. Directed microtubule growth, +TIPs, and kinesin-2 are required for uniform microtubule polarity in dendrites. Curr. Biol. 20, 2169-2177 (2010).
- Pawson, C., Eaton, B. A., Davis, G. W. Formin-dependent synaptic growth: evidence that Dlar signals via Diaphanous to modulate synaptic actin and dynamic pioneer microtubules. J. Neurosci. 28, 11111-11123 (2008).
- Williams, D. W., Tyrer, M., Shepherd, D. Tau and tau reporters disrupt central projections of sensory neurons in Drosophila. J. Comp. Neurol. 428, 630-640 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved