このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
免疫組織学的な感覚ニューロンの樹状突起における微小管の標識、気管、との筋肉ショウジョウバエ幼虫の体壁
要約
このようなニューロンの樹状突起のような複雑な細胞の形状は、開発中に達成されるかを理解するために、それは正確にアッセイの微小管の組織にできることが重要です。ここでは、樹状突起分枝のニューロン感覚樹状突起の微小管の組織、気管、筋肉を調べるために堅牢な免疫標識法を説明し、他のショウジョウバエ幼虫の体壁の組織。
要約
複雑なセル形状の違いが達成されるかを理解するために、それは正確に微小管の組織に従うことが重要です。 ショウジョウバエ幼虫の体壁は、細胞や組織の形態形成を研究するモデルであるいくつかの細胞型を含んでいます。例えば、気管はチューブの形態形成1、 ショウジョウバエの幼虫の感覚ニューロンは、一般の解明と樹状突起分化2-5と変性6のニューロンクラス特有のメカニズムを、プライマリシステムとなっている樹状分枝(DA)を調べるために使用されます。 。
樹状突起の枝の形状は、ニューロンのクラス間、そしてさらに、単一ニューロン7,8の異なるブランチ間で著しく異なることがあります。 DAニューロンにおける遺伝学的研究では、差動細胞骨格の組織が 樹枝形状4,9-11の形態学的相違の根底にあることを示唆している。我々は、堅牢な免疫標識法を提供するDA感覚ニューロン樹状突起(図1、2、動画1) の in vivo微小管の組織で SSAY。このプロトコルは、最初の幼虫の解剖と免疫染色、アクティブな感覚ニューロンの樹状突起の伸長と分岐組織は12,13を発生している段階を示しています。
感覚ニューロンを染色することに加えて、この方法では、堅牢な筋肉の微小管の組織のラベリング(作品2本、3)、気管(図3、ムービー3)、およびその他の体壁の組織を実現しています。それは、メカニズムをコントロールする組織および細胞の形状を調査するときに体壁のin situで微小管の組織を分析することを希望する研究者のために貴重です。
プロトコル
1。試薬の調製
開始前の注意:解剖と免疫組織化学的染色は、磁気チャンバー内で実施され、幼虫は、特殊形状の昆虫ピンを使用して釘付けされる。磁気室の建設、及びこれらのピンの準備手順の詳細については、関連する参照14,15に記載されています。簡単に言うと、1x1cmの正方形の穴が磁気シートと小さなチャンバーを作るために、シートの背面に貼付されているカバースリップに切断される。チャンバーの側面は、エポキシ接着剤で密封され、この接着剤は、チャンバが使用前に70%エタノールで数回洗浄している設定された後。解剖の昆虫ピンは、必要な形状に曲げ加工し、金属製のタブ14,15の上に接着することによって調製される。また金属製のタブに、我々は、カットオフ黄色の先端から作られたハンドルとピンを描く反転のフラットヘッド鋼を使用している。この磁気チェンバーの配置の使用は厳密に制御がオベできますRピンの位置と組織は、解剖中にストレッチ。
DAニューロンの研究者の異なるサブセットにレポーター遺伝子の発現を駆動するためには、いくつかの異なるGal4の行を(下野し、同僚16で要約)使用することができます。これらの行の多くは、株式公開センターから入手できます。この代表的なプロトコルでは、我々はDAニューロンの2つの対照的なクラスが共同で標識されている行の免疫染色を行う:最もシンプルなクラスIおよび最も複雑なクラスIV(P10 - Gal4の17,18、UAS - mCD8:: Kusabira -オレンジ(KO))。
- のCa + + -フリーHL3.1生理食塩水を準備
- mMで:70のNaCl、5のKCl、20のMgCl 2、10飽和NaHCO 3、5 HEPES、115スクロース、および5トレハロース、pH 7.2の19。ろ過滅菌し、4℃で保存します。注:CA + + - free溶液は、解剖時の筋収縮を防ぎます。
- 2倍PHEMバッファを準備します
- mMで:130 PIPES、60 HEPES、20 EGTA、4マグネシウム4、pHは7.0。ろ過滅菌し、4℃で保存します。
注:pHが7.0に近づくまで、これらの材料は溶解しません。
- mMで:130 PIPES、60 HEPES、20 EGTA、4マグネシウム4、pHは7.0。ろ過滅菌し、4℃で保存します。
- 固定の直前に新鮮な固定液を準備します。
- 25ミリリットルソリューション、Mixの最初の2グラムのパラホルムアルデヒド、50ミリリットルファルコンチューブに100μlの1M NaOHおよび10mlの水を準備するために。
- 溶液が透明になるまで振とう機で55℃の水浴中で固定して振る。 (総容積は約11.5ミリリットルとなります。)
- 氷上で冷却固定液。
- 12.5ミリリットル2倍PHEMバッファを追加。
- 1M HClでpHを7.0に調整する。
- ボリュームが25ミリリットルになるまで水で解決策を埋める。
- ワットマン濾紙を使用してソリューションをフィルタリングする。
2。幼虫の解剖
解剖の開始後に急速にブレークダウン、微小管ネットワーク、そして特に感覚樹状突起のものになります:開始する前に注意してください 。 AC直接固定に続いて5分足らずで高速の郭清をhievingは、このプロトコルの成功の鍵となる要因です。
- 水中で幼虫を洗うとすぐに髪のループを使用して、このドロップにそれらを移動する。
- オリエント幼虫背側の上とガラス上の腹側。注:この向きは、腹側クラスタのニューロンを調べることです。背側クラスタのニューロンを調べるには、向きを反転。
- 口のフックの近くに前端を固定する中央の虫ピンを使用してください。最良の結果を得るための最後の近くにピンを置きます。
- 解剖室でHL3.1生理食塩水の低下を置きます。
- microscissorsと幼虫の非常に後部先端を切り取ります。注:このステップはmicroscissors(ステップ2.7)へのアクセスを許可する幼虫の後端に開口部を開く。
- 鉗子で今幼虫の後端に開口部から突っついている腸の領域をつかむ。ゆっくりと全体の腸を引き出します。
- 置き前方に向かって腹側正中線に沿って開口部とカットスルーmicroscissorsの一つ刃の先端。
- コーナーピンを使用して、最初に、次に前方後方今すぐ無料のコーナーを、ピン。同時にそっと幼虫フィレットを開くストレッチ。
3。固定、ブロッキング染色、および幼虫のフィレットの取り付け
開始前の注意:すべての固定と染色の手順は、解剖室で実施されています。このプロセスの間、これは組織の損傷につながる可能性があるため、幼虫を保持している虫ピンをノックしないように注意してください。乾燥から実験を防ぐために、湿らせたティッシュに囲まれた小さなタッパーウェアの容器内のすべての染色の手順を実行します。
- 黄色のチップを用いてCa + +のフリーHL3.1バッファーを吸引除去する。すぐに別のpipettemanを使用して固定液を加える。
- ゆっくりとCa + +のフリーHL3.1バッファの残りのトレースで固定液を混合するために上下にピペッティングし、チャンバーインチすぐにそれを吸引し、チャンバー内に新鮮な固定液を加える。
- 20分間室温でインキュベートする。
- PBSTで6倍速10分(0.1%トリトンX - 100 PBSで)を洗う。
- 室温で20分間PBSTで5%ヤギ血清でブロック。
- PBSTで5%ヤギ血清で希釈した一次抗体とブロッキング溶液を交換してください。使用する一次抗体は1 / 1000希釈の両方のマウス抗α-チューブリン(DM1A)及びラット抗CD8(5H10)です。
注:調査員は、マウス抗Futsch(22C10)いくつかの事情で20,21希薄化後1 / 1000(議論を参照)とマウス抗α-チューブリンを(DM1A)置き換えることができます。
- 4℃(少なくとも16時間)一晩インキュベート℃を
- PBSTで6倍の10分を洗ってください。
- PBSTで5%ヤギ血清で希釈した二次抗体溶液を加える。使用される二次抗体はAlexa Fluor 488ヤギ抗マウスIgGおよびCy3ロバ抗ラットIgGです。蛍光団を防ぐためにカバーのサンプルを保持する光退色22。
- 2時間室温でどちらインキュベート、または一晩4℃で、室温で1時間が続く。
- PBSTで6倍の10分を洗ってください。
- スライドダウンキューティクル側での幼虫のフィレットを配置し、80%グリセロールでマウントして、"迅速な"マウント用マニキュアとカバーの両側をシール。
注:改良された組織のクリア、および恒久的な安定したサンプルの場合は、DPXのマウントは、以前に23を説明するように。
4。代表的な結果:
蛍光染色法は、共焦点顕微鏡下で調べた。図では樹状突起内1-2複数のブランチをそれぞれ異なる細胞骨格の組織を持っている。図1は、第1齢幼虫の段階でクラスIV DAニューロンのアーバーの領域を示しています。 KOは、と二次抗CD8抗体と蛍光(Cy3標識)を用いて検出::全体のあずまやがmCD8でマークされます。チューブリン、抗α-チューブリン抗体とフッ素を使用して検出される自己消費の二次(のAlexa Fluor ® 488)。主枝はチューブリン陽性の、いくつかの薄い側の枝は、チューブリン陰性です。ムービー1は、クラスI DAニューロンの同様の染色を通じて、連続切片のセットです。図2は、第1齢幼虫の段階でFutschおよびCD8に対する抗体で染色したクラスIV DAニューロンのアーバーの領域を示しています。主枝がFutsch陽性である、いくつかの薄い側の枝はFutsch陰性です。図3。幼虫体壁の気管は、複雑な微小管の組織を示す。作品2と3は、体壁の筋肉と気管を通して染色の連続切片を示す。
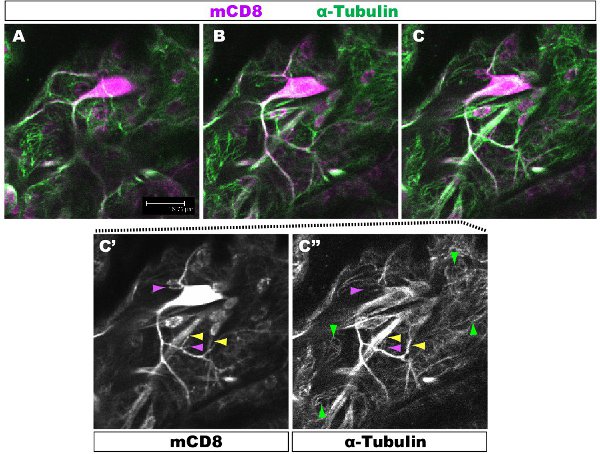
図1。図。 1は第1齢幼虫の段階でクラスIV DAニューロンのアーバーの領域を示しています。 :全体のアーバーはmCD8でマークされています:KOと抗CD8抗体と蛍光二次(Cy3標識)を用いて検出。チューブリン、抗&-細管を用いて検出されるn個の抗体および二次蛍光(アレクサ488)。パネルACシーケンシャル共焦点のz断面(0.5μmの)、C'- C"、と(黄色の矢印)または微小管が強調されています(紫矢印)のない枝のパネルC.の例から、単一の抗体染色では、基本となるの赤矢印のハイライトの微小管上皮細胞。
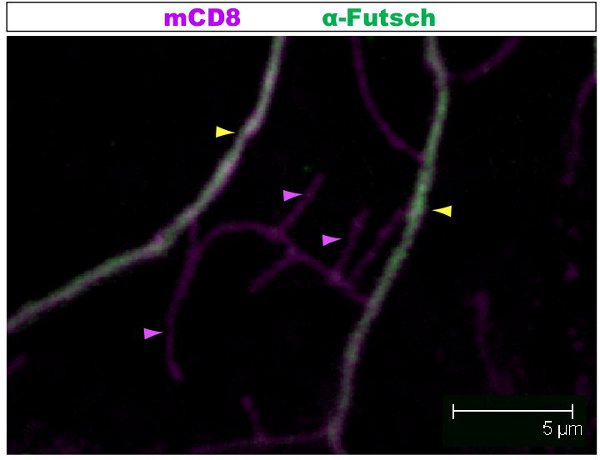
図2。図。 2は、第1齢幼虫の段階でFutschおよびCD8に対する抗体で染色したクラスIV DAニューロンの東屋の類似領域を示しています。 :全体のアーバーはmCD8でマークされています:KOと抗CD8抗体と蛍光二次(Cy3標識)を用いて検出。 Futschは抗Futschの抗体と(アレクサ488)二次蛍光を用いて検出される。主枝がFutsch陽性である、いくつかの薄い側の枝はFutsch陰性です。と(黄色の矢印)または(紫矢印)Futschのない枝の例は、強調表示されます。
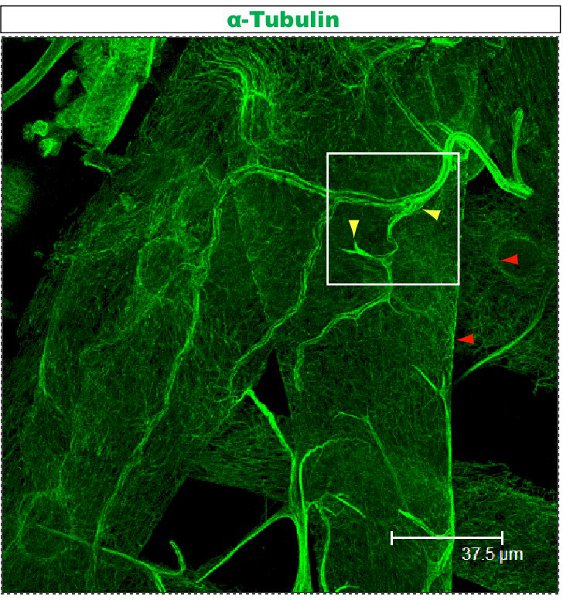
図3。気管は、上述の抗チューブリンのプロトコルを用いて染色。この幼虫は三齢であり、前述した23,24。ムービー3として解剖正方形でマークされたフィールドから拡大した連続切片を示しています。
ムービー1。クラスIニューロンの樹状アーバを通してチューブリン染色をトレースシリアルのセクションでは、。 KO(マゼンタ)と二次抗CD8抗体と蛍光(Cy3標識)を用いて検出::全体のあずまやがmCD8でマークされます。チューブリン(緑)は抗α-チューブリン抗体と(のAlexa Fluor ® 488)の二次蛍光を用いて検出される。スケール:ビデオ画像の片側がセクションで46.88μmに対応する。 ムービーを表示するにはここをクリック。
ムービー2。BODのチューブリン染色をトレースシリアルのセクションでは、三齢幼虫のyの壁の筋肉。チューブリン、抗α-チューブリン抗体と蛍光二次(のAlexa Fluor 488)を使用して検出される。スケール:ビデオ画像の片側がセクションで46.88μmに対応する。 ムービーを表示するにはここをクリック。
動画3。Figure.3の正方形でマークされた3番目の幼虫の体壁気管内チューブリンの染色を、トレースシリアルのセクションでは、。チューブリン、抗α-チューブリン抗体と蛍光二次(のAlexa Fluor 488)を使用して検出される。スケール:ビデオ画像の片側がセクションで46.88μmに対応する。 ムービーを表示するにはここをクリック。
ディスカッション
理解するために複雑な細胞の形状が達成される方法、それは正確にアッセイの微小管の組織にできることが重要です。ここでは、樹状突起分枝のニューロン感覚樹状突起のアッセイの微小管の組織に強固な免疫標識法を説明します。感覚ニューロンを染色に加えて、この方法では気管、筋肉や他の体壁組織の強固な免疫組織染色を実現しています。
我々は、DAニューロン...
開示事項
我々は、開示することは何もない。
謝辞
我々は、資金調達のために理研に感謝。 P10 - Gal4のはアランヴィンセント(大学ポールサバティエ、トゥールーズ、フランス)の一種の贈り物だった。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ 数は | コメント (省略可能) |
|---|---|---|---|
| 鉗子 | デュモン | 11251〜20 | |
| Microscissors | FST | 15000〜08 | |
| マウス抗α-チューブリン(クローン:DM1A) | シグマ | T9026 | 希釈1000分の1 |
| マウス抗Futsch(クローン:22C10)、 上清 | 発達 研究 ハイブリドーマバンク | 22C10 | 希釈1000分の1 |
| ラット抗CD8(クローン:5H10) | Caltag | MCD0800 | 希釈1000分の1 |
| のAlexa Fluor ® 488抗マウスIgG | インビトロジェン | - 11001 | 希釈500分の1 |
| Cy3標識抗ラットIgG | ジャクソンイムノ | 712-166-150 | 希釈200分の1 |
参考文献
- Schottenfeld, J., Song, Y., Ghabrial, A. S. Tube continued: morphogenesis of the Drosophila tracheal system. Curr. Opin. Cell. Biol. 22, 633-639 (2010).
- Gao, F. B., Brenman, J. E., Jan, L. Y., Jan, Y. N. Genes regulating dendritic outgrowth, branching, and routing in Drosophila. Genes Dev. 13, 2549-2561 (1999).
- Corty, M. M., Matthews, B. J., Grueber, W. B. Molecules and mechanisms of dendrite development in Drosophila. Development. 136, 1049-1061 (2009).
- Moore, A. W. Intrinsic mechanisms to define neuron class-specific dendrite arbor morphology. Cell. Adh. Migr. 2, 81-82 (2008).
- Grueber, W. B., Jan, L. Y., Jan, Y. N. Tiling of the Drosophila epidermis by multidendritic sensory neurons. Development. 129, 2867-2878 (2002).
- Nishimura, Y. Selection of Behaviors and Segmental Coordination During Larval Locomotion Is Disrupted by Nuclear Polyglutamine Inclusions in a New Drosophila Huntington's Disease-Like Model. J. Neurogenet. 24, 194-206 (2010).
- Ramon y Cajal, S. . Histology of the nervous system of man and vertebrates, 1995 translation. , (1911).
- London, M., Hausser, M. Dendritic computation. Annu. Rev. Neurosci. 28, 503-532 (2005).
- Jinushi-Nakao, S. Knot/Collier and cut control different aspects of dendrite cytoskeleton and synergize to define final arbor shape. Neuron. 56, 963-978 (2007).
- Li, W., Gao, F. B. Actin filament-stabilizing protein tropomyosin regulates the size of dendritic fields. J. Neurosci. 23, 6171-6175 (2003).
- Ye, B. Differential regulation of dendritic and axonal development by the novel Kruppel-like factor Dar1. J. Neurosci. 31, 3309-3319 (2011).
- Parrish, J. Z., Xu, P., Kim, C. C., Jan, L. Y., Jan, Y. N. The microRNA bantam functions in epithelial cells to regulate scaling growth of dendrite arbors in drosophila sensory neurons. Neuron. 63, 788-802 (2009).
- Sugimura, K. Distinct developmental modes and lesion-induced reactions of dendrites of two classes of Drosophila sensory neurons. J. Neurosci. 23, 3752-3760 (2003).
- Budnik, V., Gorczyca, M., Prokop, A. Selected methods for the anatomical study of Drosophila embryonic and larval neuromuscular junctions. Int. Rev. Neurobiol. 75, 323-365 (2006).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila Protocols. , (2000).
- Shimono, K. Multidendritic sensory neurons in the adult Drosophila abdomen: origins, dendritic morphology, and segment- and age-dependent programmed cell death. Neural. Dev. 4, 37-37 (2009).
- Colomb, S., Joly, W., Bonneaud, N., Maschat, F. A concerted action of Engrailed and Gooseberry-Neuro in neuroblast 6-4 is triggering the formation of embryonic posterior commissure bundles. PLoS One. 3, 2197-2197 (2008).
- Dubois, L. Collier transcription in a single Drosophila muscle lineage: the combinatorial control of muscle identity. Development. 134, 4347-4355 (2007).
- Feng, Y., Ueda, A., Wu, C. F. A modified minimal hemolymph-like solution, HL3.1, for physiological recordings at the neuromuscular junctions of normal and mutant Drosophila larvae. J Neurogenet. 18, 377-402 (2004).
- Hummel, T., Krukkert, K., Roos, J., Davis, G., Klambt, C. Drosophila Futsch/22C10 is a MAP1B-like protein required for dendritic and axonal development. Neuron. 26, 357-370 (2000).
- Zipursky, S. L., Venkatesh, T. R., Teplow, D. B., Benzer, S. Neuronal development in the Drosophila retina: monoclonal antibodies as molecular probes. Cell. 36, 15-26 (1984).
- Brent, J., Werner, K., McCabe, B. D. Drosophila Larval NMJ Immunohistochemistry. J. Vis. Exp. (25), e1108-e1108 (2009).
- Karim, M. R., Moore, A. W. Morphological Analysis of Drosophila Larval Peripheral Sensory Neuron Dendrites and Axons Using Genetic Mosaics. J. Vis. Exp. (57), e3111-e3111 (2011).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila Larval NMJ Dissection. J. Vis. Exp. (24), e1107-e1107 (2009).
- Tao, J., Rolls, M. M. Dendrites have a rapid program of injury-induced degeneration that is molecularly distinct from developmental pruning. J. Neurosci. 31, 5398-5405 (2011).
- Yamamoto, M., Ueda, R., Takahashi, K., Saigo, K., Uemura, T. Control of axonal sprouting and dendrite branching by the Nrg-Ank complex at the neuron-glia interface. Curr. Biol. 16, 1678-1683 (2006).
- Mattie, F. J. Directed microtubule growth, +TIPs, and kinesin-2 are required for uniform microtubule polarity in dendrites. Curr. Biol. 20, 2169-2177 (2010).
- Pawson, C., Eaton, B. A., Davis, G. W. Formin-dependent synaptic growth: evidence that Dlar signals via Diaphanous to modulate synaptic actin and dynamic pioneer microtubules. J. Neurosci. 28, 11111-11123 (2008).
- Williams, D. W., Tyrer, M., Shepherd, D. Tau and tau reporters disrupt central projections of sensory neurons in Drosophila. J. Comp. Neurol. 428, 630-640 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved