Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Étiquetage immunohistologique des microtubules dans dendrites des neurones sensoriels, trachées et les muscles dans la Drosophile Mur Corps Larve
Dans cet article
Résumé
Pour comprendre comment les formes cellulaires complexes, comme les dendrites neuronales, sont atteints au cours du développement, il est important d'être en mesure de précision de dosage organisation des microtubules. Nous décrivons ici une méthode de marquage immunohistochimique robustes afin d'examiner l'organisation des microtubules des cellules dendritiques dendrites des neurones sensoriels arborisation, la trachée, les muscles et les autres Drosophile Tissus du corps larvaire mur.
Résumé
Pour comprendre comment les différences dans les formes cellulaires complexes sont atteints, il est important de suivre avec précision l'organisation des microtubules. Le mur de la drosophile corps des larves contient plusieurs types de cellules qui sont des modèles pour étudier des cellules et la morphogenèse des tissus. Par exemple trachées sont utilisées pour examiner une morphogenèse du tube, et l'arborisation dendritique (DA) des neurones sensoriels de la larve de drosophile sont devenus un système de primaires pour l'élucidation des généraux et des neurones spécifiques à la classe des mécanismes de différenciation dendritiques de 2-5 et une dégénérescence 6 .
La forme des branches des dendrites peut varier considérablement entre les classes de neurones, et même entre les différentes branches d'un seul neurone 7,8. Les études génétiques suggèrent que les neurones DA différentiel de l'organisation du cytosquelette peuvent sous-tendre les différences morphologiques en forme la branche dendritiques 4,9-11. Nous fournissons une méthode immunologique robuste à un étiquetagessay dans l'organisation des microtubules in vivo chez DA sensorielle tonnelle neurone dendrite (figures 1, 2, Film 1). Ce protocole illustre la dissection et immunomarquage du stade larvaire d'abord, un stade où les actifs excroissance sensorielle dendrites des neurones et l'organisation de branchement se produit 12,13.
En plus de coloration des neurones sensoriels, cette méthode permet d'obtenir l'étiquetage robuste de l'organisation des microtubules dans les muscles (Cinéma 2, 3), la trachée (figure 3, Film 3), et d'autres tissus de la paroi du corps. Il est précieux pour les chercheurs souhaitant analyser l'organisation des microtubules in situ dans la paroi du corps où l'étude des mécanismes de contrôle et que le tissu forme des cellules.
Protocole
1. Préparation des réactifs
Remarques avant de commencer: la dissection et la coloration immunohistochimique sont effectués dans une chambre magnétique et la larve est coincé utilisant des broches insectes de forme spéciale. Des instructions détaillées sur la construction d'une chambre magnétique, et la préparation de ces broches peuvent être trouvés dans les références liées 14,15. En bref, un trou carré 1x1cm est coupé dans une feuille magnétique et d'une lamelle apposée à l'arrière de la feuille pour faire une petite chambre. Les côtés de la chambre sont scellés avec de la colle époxy, après cette colle a mis la chambre est lavé plusieurs fois avec de l'éthanol à 70% avant l'utilisation. Dissection broches insectes sont préparés par la flexion de la forme requise et ensuite collés sur un onglet 14,15 métal. Alternativement à une languette métallique, nous avons utilisé une tête plate inversée punaise d'acier avec une poignée faite d'une pointe de coupure jaune. L'utilisation de cet arrangement chambre magnétique permet un contrôle étroit over goupille de positionnement et de tissus d'étirement lors de la dissection.
Pour diriger l'expression du gène rapporteur en différents sous-ensembles de neurones DA enquêteurs peuvent utiliser différents Gal4 lignes (résumé par Shimono et ses collègues 16). Beaucoup de ces lignes sont disponibles auprès des centres d'actions publiques. Dans ce protocole représentatifs, nous effectuons immunomarquage d'une ligne dans laquelle deux classes contrastantes de DA neurone sont co-marqués: le plus simple de classe I et les plus complexes de classe IV (P10-Gal4 17,18, SAMU-mCD8:: Kusabira-Orange (KO)).
- Préparer Ca + + libre HL3.1 salines
- En mm: 70 NaCl, KCl 5, 20 MgCl2, 10 NaHCO 3, HEPES 5, 115 le saccharose, le tréhalose et 5; pH 7,2 19. Filtre-stériliser et conserver à 4 ° C. Note: Ca + solution + libre empêche la contraction des muscles lors de la dissection.
- Préparer 2x tampon PHEM
- En mm: 130 TUBES, 60 HEPES, 20 EGTA, 4 MgSO4; pH 7,0. Filtre-stériliser et conserver à 4 ° C.
Note: Ces matériaux ne se dissoudra pas jusqu'à ce que le pH des approches 7.0.
- En mm: 130 TUBES, 60 HEPES, 20 EGTA, 4 MgSO4; pH 7,0. Filtre-stériliser et conserver à 4 ° C.
- Préparer le fixateur fraîchement immédiatement avant la fixation.
- En vue de préparer une solution de 25ml, d'abord paraformaldéhyde 2g mélanger, 100 ul de NaOH 1 M et de l'eau dans un tube 10ml 50ml Falcon.
- Agiter fixatif dans une 55 ° C avec bain d'eau jusqu'à ce shaker la solution est claire. (Le volume total sera d'environ 11,5 ml).
- Fixatif refroidir sur glace.
- Ajouter 12,5 ml de tampon 2x PHEM.
- Ajuster le pH à 7,0 avec HCl 1M.
- Remplissez la solution avec de l'eau jusqu'à ce que le volume est de 25ml.
- Filtrer la solution en utilisant du papier Whatman.
2. Dissection des larves
Notez avant de commencer: les réseaux de microtubules, et en particulier ceux dans les dendrites sensoriels, se décompose rapidement après l'initiation de la dissection. Achieving dissection rapide en moins de cinq minutes, suivie d'une fixation immédiate sont des facteurs clés dans la réussite de ce protocole.
- Laver la larve dans l'eau et rapidement les déplacer dans cette chute en utilisant une boucle de cheveux.
- Orientez le côté jusqu'à la larve dorsale et la face ventrale sur le verre. Note: Cette orientation est d'examiner les neurones pôle ventral. Pour examiner les neurones pôle dorsale, inverser l'orientation.
- Utilisez le centre d'insectes-broche à broche à l'extrémité antérieure près de la bouche des crochets. Placez la tige près de la fin pour obtenir les meilleurs résultats.
- Déposer une goutte de sérum physiologique HL3.1 dans la chambre de dissection.
- Couper la pointe très postérieure de la larve hors d'microciseaux. Remarque: Cette étape ouvre une ouverture à l'extrémité postérieure de la larve qui va permettre l'accès à l'microciseaux (étape 2.7).
- Grab avec la pince de la région de l'intestin qui est maintenant piquer hors de l'ouverture à l'extrémité postérieure de la larve. Tirez doucement sur le tube digestif tout entier.
- Placez lela pointe d'une pale de l'microciseaux à travers l'ouverture et coupé le long de la ligne médiane ventrale vers la partie antérieure.
- En utilisant les broches angle, broches les coins maintenant libre, postérieure d'abord, puis antérieure. Simultanément étirer doucement le filet ouvert larvaire.
3. Fixation, le blocage, la coloration, et le montage de filets larvaires
Remarques avant de commencer: Toutes les étapes de fixation et de coloration sont effectuées dans la chambre de dissection. Pendant ce processus, faites attention de ne pas heurter les broches insectes tenant la larve, car cela pourrait conduire à des lésions tissulaires. Afin d'éviter l'expérience de se dessécher, faire toutes les étapes de coloration dans un petit récipient Tupperware entourées de tissus humidifiés.
- Aspirer le Ca + + libre HL3.1 tampon en utilisant une pointe de jaune. Ajoutez immédiatement le fixateur en utilisant un autre pipetteman.
- Délicatement la pipette de haut en bas pour mélanger le fixateur avec les traces restantes de Ca + + libre HL3.1 tampondans la chambre. Immédiatement l'aspirer et ensuite ajouter fixateur frais dans la chambre.
- Incuber à température ambiante pendant 20 minutes.
- Lavez 10mins 6x dans le PBST (0,1% de Triton X-100 dans du PBS).
- Bloc avec du sérum de chèvre de 5% en PBST pendant 20 min à température ambiante.
- Remplacer la solution de blocage avec des anticorps primaire dilué dans du sérum de chèvre de 5% en PBST. Les anticorps primaires utilisés sont de souris anti-α-tubuline (DM1A) et de rat anti-CD8 (5h10) à la fois dilué au 1 / 1000.
Remarque: L'investigateur peut souhaiter substitut de souris anti-α-tubuline (DM1A) avec souris anti-Futsch (22C10) 20,21 dilué au 1 / 1000 dans certaines circonstances (voir la discussion).
- Incuber une nuit (au moins 16h) à 4 ° C.
- Lavez 10mins 6x dans le PBST.
- Ajouter une solution d'anticorps secondaire dilué dans du sérum de chèvre de 5% en PBST. Les anticorps secondaires utilisés sont Alexa Fluor 488 de chèvre anti-IgG de souris et Cy3 âne anti-IgG de rat. Conserver l'échantillon couvert pour empêcher fluorophorephoto-décoloration 22.
- Incuber soit à température ambiante pendant deux heures ou une nuit à 4 ° C suivie d'une heure à température ambiante.
- Lavez 10mins 6x dans le PBST.
- Mettez le filet des larves sur la diapositive cuticule vers le bas, montez dans le glycérol 80%, et sceller les bords de la lamelle avec du vernis à ongles pour une «rapide» de montage.
Note: Pour la compensation des tissus améliorés, et un échantillon permanent stable, monter dans DPX 23 comme décrit précédemment.
4. Les résultats représentatifs:
Fluorescent coloration a été examiné sous un microscope confocal. Dans les figures 1-2, les différentes branches au sein d'une tonnelle dendrites ont différentes organisation du cytosquelette. La figure 1 montre une région de la tonnelle d'un neurone de classe IV DA à l'étape 1 er stade larvaire. La tonnelle entière est marquée par mCD8:: KO et détectés à l'aide d'un anticorps anti-CD8 et secondaire fluorescent (Cy3). La tubuline est détectée à l'aide anti-α-tubuline anticorps et Fluorescent secondaire (Alexa Fluor 488). Les branches principales sont positives pour la tubuline, certaines branches latérales minces sont tubuline-négatif. Film 1 est un ensemble de sections de série grâce à une coloration semblable d'un neurone de classe I DA. La figure 2 montre une région de la tonnelle d'un neurone de classe IV DA colorées avec des anticorps contre le Futsch et CD8 au stade 1 er stade larvaire. Les branches principales sont Futsch-positifs, certains branches latérales minces sont Futsch-négatif. Figure 3. Trachées dans la paroi du corps larvaire montrent une organisation des microtubules complexes. Films 2 et 3 montrent des coupes en série de la coloration grâce muscles de la paroi du corps et de la trachée.
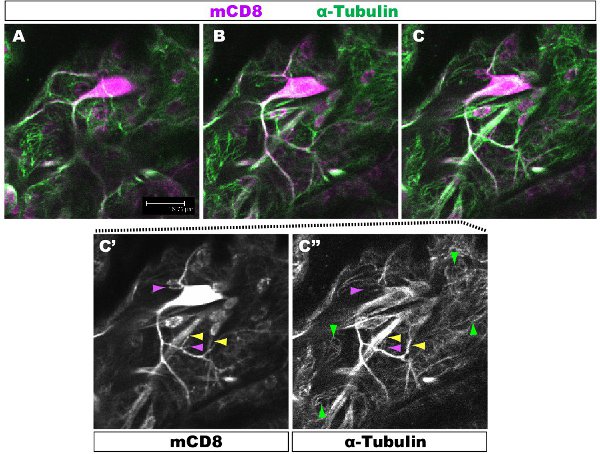
Figure 1. Fig. 1 montre une région de la tonnelle d'un neurone de classe IV DA à l'étape 1 er stade larvaire. La tonnelle entière est marquée par mCD8:: KO et détectés à l'aide d'anticorps anti-CD8 et secondaire fluorescent (Cy3). La tubuline est détecté utilisant des anticorps anti-&-tubulid'anticorps fluorescents n et secondaire (Alexa 488). Panneaux AC séquentielle confocale z-sections (0.5μm), C'-C ", la coloration seul anticorps à partir du panneau C. Exemple de branches avec (flèche jaune) ou sans (violet pointe de flèche) microtubules sont mis en surbrillance. Red microtubules pointes de flèches en évidence dans le sous-jacentes les cellules épithéliales.
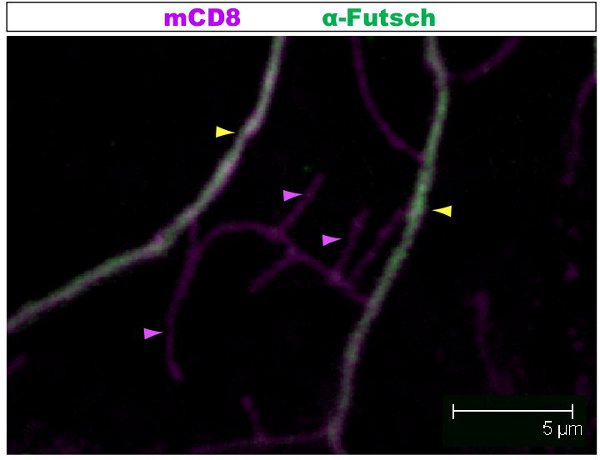
Figure 2. Fig. 2 montre une région similaire de la tonnelle d'un neurone de classe IV da colorées avec des anticorps contre le Futsch et CD8 au stade 1 er stade larvaire. La tonnelle entière est marquée par mCD8:: KO et détectés à l'aide d'anticorps anti-CD8 et secondaire fluorescent (Cy3). Futsch est détecté à l'aide d'anticorps anti-Futsch et secondaire fluorescent (Alexa 488). Les branches principales sont Futsch-positifs, certains branches latérales minces sont Futsch-négatif. Exemple de branches avec (flèche jaune) ou sans (violet pointe de flèche) Futsch sont mis en évidence.
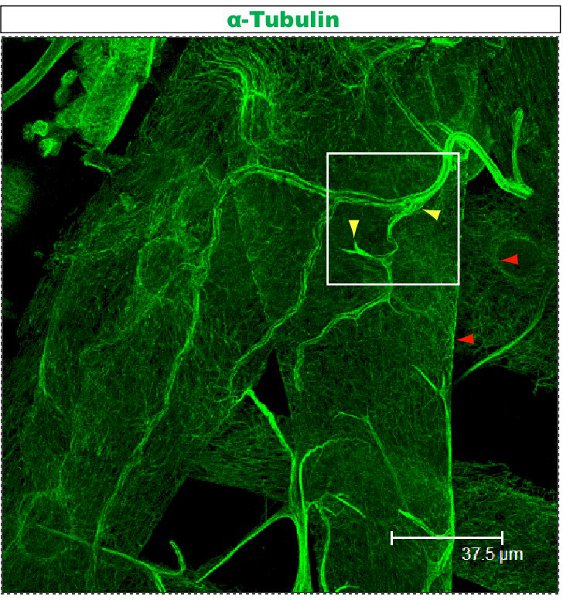
Figure 3. Trachée teinté en utilisant le protocole anti-tubuline décrit ci-dessus. Cette larve est le troisième stade larvaire et disséqués, comme décrit précédemment 23,24. Movie 3 montre élargie des sections en série à partir du champ marqué par un carré.
Sections Film 1. Serial traçage coloration tubuline travers la tonnelle dendritiques d'un neurone de classe I. La tonnelle entière est marquée par mCD8:: KO (Magenta) et détectés à l'aide d'anticorps anti-CD8 et secondaire fluorescent (Cy3). Tubuline (vert) est détecté en utilisant un anticorps anti-α-tubuline et secondaire fluorescent (Alexa Fluor 488). Échelle: d'un côté de l'image vidéo correspond à 46.88μm dans la section. Cliquez ici pour voir le film.
Film 2 sections. Serial traçage coloration tubuline en DBOY muscles de la paroi d'une larve de troisième stade larvaire. La tubuline est détectée à l'aide anti-α-tubuline anticorps et secondaire fluorescent (Alexa Fluor 488). Échelle: d'un côté de l'image vidéo correspond à 46.88μm dans la section. Cliquez ici pour voir le film.
Movie 3. Sections de série traçage coloration tubuline dans un corps mur trachée d'une larve de troisième stade larvaire, marquée d'un carré dans Figure.3. La tubuline est détectée à l'aide anti-α-tubuline anticorps et secondaire fluorescent (Alexa Fluor 488). Échelle: d'un côté de l'image vidéo correspond à 46.88μm dans la section. Cliquez ici pour voir le film.
Discussion
Pour comprendre comment des formes complexes cellulaires sont qu'elle atteint est important d'être en mesure de précision de dosage organisation des microtubules. Nous décrivons ici une méthode de marquage robuste immunohistologiques à l'organisation des microtubules dendritiques dosage des dendrites des neurones sensoriels arborisation. En plus de coloration des neurones sensoriels, cette méthode permet d'obtenir robustes coloration immunohistochimique de la trachée, muscles et autres tissus de l...
Déclarations de divulgation
Nous n'avons rien à révéler.
Remerciements
Nous remercions RIKEN pour le financement. P10-Gal4 a été un cadeau genre d'Alain Vincent (Université Paul Sabatier, Toulouse, France).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Catalogue le numéro de | Commentaires (Optionnel) |
|---|---|---|---|
| Forceps | Dumont | 11251-20 | |
| Microciseaux | TSF | 15000-08 | |
| De souris anti-α-tubuline (Clone: DM1A) | Sigma | T9026 | Dilution 1 / 1000 |
| Souris anti-Futsch (Clone: 22C10), surnageant | Développement Etudes Hybridomes Banque | 22C10 | Dilution 1 / 1000 |
| Rat anti-CD8 (clone: 5h10) | Caltag | MCD0800 | Dilution 1 / 1000 |
| Alexa Fluor 488 IgG anti-souris | Invitrogen | A-11001 | Dilution 1 / 500 |
| Cy3 anti-IgG de rat | Jackson Immunoresearch | 712-166-150 | Dilution 1 / 200 |
Références
- Schottenfeld, J., Song, Y., Ghabrial, A. S. Tube continued: morphogenesis of the Drosophila tracheal system. Curr. Opin. Cell. Biol. 22, 633-639 (2010).
- Gao, F. B., Brenman, J. E., Jan, L. Y., Jan, Y. N. Genes regulating dendritic outgrowth, branching, and routing in Drosophila. Genes Dev. 13, 2549-2561 (1999).
- Corty, M. M., Matthews, B. J., Grueber, W. B. Molecules and mechanisms of dendrite development in Drosophila. Development. 136, 1049-1061 (2009).
- Moore, A. W. Intrinsic mechanisms to define neuron class-specific dendrite arbor morphology. Cell. Adh. Migr. 2, 81-82 (2008).
- Grueber, W. B., Jan, L. Y., Jan, Y. N. Tiling of the Drosophila epidermis by multidendritic sensory neurons. Development. 129, 2867-2878 (2002).
- Nishimura, Y. Selection of Behaviors and Segmental Coordination During Larval Locomotion Is Disrupted by Nuclear Polyglutamine Inclusions in a New Drosophila Huntington's Disease-Like Model. J. Neurogenet. 24, 194-206 (2010).
- Ramon y Cajal, S. . Histology of the nervous system of man and vertebrates, 1995 translation. , (1911).
- London, M., Hausser, M. Dendritic computation. Annu. Rev. Neurosci. 28, 503-532 (2005).
- Jinushi-Nakao, S. Knot/Collier and cut control different aspects of dendrite cytoskeleton and synergize to define final arbor shape. Neuron. 56, 963-978 (2007).
- Li, W., Gao, F. B. Actin filament-stabilizing protein tropomyosin regulates the size of dendritic fields. J. Neurosci. 23, 6171-6175 (2003).
- Ye, B. Differential regulation of dendritic and axonal development by the novel Kruppel-like factor Dar1. J. Neurosci. 31, 3309-3319 (2011).
- Parrish, J. Z., Xu, P., Kim, C. C., Jan, L. Y., Jan, Y. N. The microRNA bantam functions in epithelial cells to regulate scaling growth of dendrite arbors in drosophila sensory neurons. Neuron. 63, 788-802 (2009).
- Sugimura, K. Distinct developmental modes and lesion-induced reactions of dendrites of two classes of Drosophila sensory neurons. J. Neurosci. 23, 3752-3760 (2003).
- Budnik, V., Gorczyca, M., Prokop, A. Selected methods for the anatomical study of Drosophila embryonic and larval neuromuscular junctions. Int. Rev. Neurobiol. 75, 323-365 (2006).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila Protocols. , (2000).
- Shimono, K. Multidendritic sensory neurons in the adult Drosophila abdomen: origins, dendritic morphology, and segment- and age-dependent programmed cell death. Neural. Dev. 4, 37-37 (2009).
- Colomb, S., Joly, W., Bonneaud, N., Maschat, F. A concerted action of Engrailed and Gooseberry-Neuro in neuroblast 6-4 is triggering the formation of embryonic posterior commissure bundles. PLoS One. 3, 2197-2197 (2008).
- Dubois, L. Collier transcription in a single Drosophila muscle lineage: the combinatorial control of muscle identity. Development. 134, 4347-4355 (2007).
- Feng, Y., Ueda, A., Wu, C. F. A modified minimal hemolymph-like solution, HL3.1, for physiological recordings at the neuromuscular junctions of normal and mutant Drosophila larvae. J Neurogenet. 18, 377-402 (2004).
- Hummel, T., Krukkert, K., Roos, J., Davis, G., Klambt, C. Drosophila Futsch/22C10 is a MAP1B-like protein required for dendritic and axonal development. Neuron. 26, 357-370 (2000).
- Zipursky, S. L., Venkatesh, T. R., Teplow, D. B., Benzer, S. Neuronal development in the Drosophila retina: monoclonal antibodies as molecular probes. Cell. 36, 15-26 (1984).
- Brent, J., Werner, K., McCabe, B. D. Drosophila Larval NMJ Immunohistochemistry. J. Vis. Exp. (25), e1108-e1108 (2009).
- Karim, M. R., Moore, A. W. Morphological Analysis of Drosophila Larval Peripheral Sensory Neuron Dendrites and Axons Using Genetic Mosaics. J. Vis. Exp. (57), e3111-e3111 (2011).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila Larval NMJ Dissection. J. Vis. Exp. (24), e1107-e1107 (2009).
- Tao, J., Rolls, M. M. Dendrites have a rapid program of injury-induced degeneration that is molecularly distinct from developmental pruning. J. Neurosci. 31, 5398-5405 (2011).
- Yamamoto, M., Ueda, R., Takahashi, K., Saigo, K., Uemura, T. Control of axonal sprouting and dendrite branching by the Nrg-Ank complex at the neuron-glia interface. Curr. Biol. 16, 1678-1683 (2006).
- Mattie, F. J. Directed microtubule growth, +TIPs, and kinesin-2 are required for uniform microtubule polarity in dendrites. Curr. Biol. 20, 2169-2177 (2010).
- Pawson, C., Eaton, B. A., Davis, G. W. Formin-dependent synaptic growth: evidence that Dlar signals via Diaphanous to modulate synaptic actin and dynamic pioneer microtubules. J. Neurosci. 28, 11111-11123 (2008).
- Williams, D. W., Tyrer, M., Shepherd, D. Tau and tau reporters disrupt central projections of sensory neurons in Drosophila. J. Comp. Neurol. 428, 630-640 (2000).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon