Method Article
Identificación y caracterización de la glicosilación de proteínas específicas de uso de endo-y exoglicosidasas
En este artículo
Resumen
Usando glicosidasas específicas para eliminar los azúcares de las glicoproteínas seguido de SDS-PAGE es un método útil para detectar las modificaciones de glicanos de las muestras de proteínas y es una buena opción para los estudios de glicobiología inicial. Siguientes cambios deglicosilación pueden ser detectados como cambios en la movilidad en gel o por tinción con glicano reactivos sensibles.
Resumen
Glicosilación, la adición de azúcares covalentemente, es una de las principales modificaciones post-traduccionales de proteínas que pueden afectar significativamente a los procesos como la adhesión celular, el tráfico molecular, la limpieza, y la transducción de señales 1.4. En los eucariotas, las modificaciones de la glicosilación más comunes en la vía secretora son adiciones a los residuos de asparagina consenso (N-linked), o en residuos de serina o treonina (O-vinculado) (Figura 1). Iniciación de la síntesis de N-glicanos está altamente conservada en eucariotas, mientras que los productos finales pueden variar mucho entre las diferentes especies, los tejidos o las proteínas. Algunos glicanos quedan sin modificar ("alta manosa N-glicanos") o procesados en el aparato de Golgi ("complejo de N-glicanos"). Mayor diversidad se encuentra a O-glicanos, que comienzan con un común N-acetilgalactosamina (GalNAc) de residuos en las células animales, pero difieren en los organismos inferiores 1. ent "> El análisis detallado de la glicosilación de las proteínas es un campo en sí mismo y requiere muchos recursos y experiencia para ejecutar correctamente. Sin embargo, una variedad de enzimas disponibles que eliminar los azúcares (glicosidasas) hace posible tener una idea general del estado de glicosilación . una proteína en un laboratorio estándar Aquí se ilustra el uso de glicosidasas para el análisis de una glicoproteína de modelo. coriónica humana recombinante beta gonadotropina (hCGβ), que lleva dos N-glicanos y cuatro O-glicanos 5 La técnica requiere sólo simples instrumentación y consumibles típica, y puede ser adaptado fácilmente para el análisis de las muestras de la glicoproteína múltiples.
Varias enzimas se pueden utilizar en paralelo al estudio de una glicoproteína. PNGase F es capaz de eliminar casi todos los tipos de N-glicanos ligados 6,7. De O-glicanos, no hay enzimas disponibles que puede romper un oligosacárido intacto de the esqueleto de la proteína. En cambio, O-glicanos se recortan por exoglicosidasas a un corazón corto, que luego se elimina fácilmente por O-glucosidasa. La mezcla de proteínas contiene deglicosilación PNGase F, O-glucosidasa, la neuraminidasa (sialidasa), galactosidasa β1-4 y β-N-acetilglucosaminidasa. Se utiliza para eliminar simultáneamente N-glicanos y algunos glúcidos O-8. Finalmente, la mezcla deglicosilación se complementó con una mezcla de exoglicosidasas otros (α-N-acetilgalactosaminidasa, α1-2 fucosidasa, α1-3, 6 galactosidasa, y galactosidasa β1-3), que ayudan a eliminar los monosacáridos otra resistencia que podrían estar presentes en ciertas O-glicanos.
SDS-PAGE/Coomasie azul se utiliza para visualizar las diferencias en la migración de las proteínas antes y después del tratamiento glucosidasa. Además, un azúcar específico de método de tinción, ProQ Esmeralda-300, muestra de la señal disminuye a medida que los glicanos son successively eliminado. Este protocolo está diseñado para el análisis de pequeñas cantidades de glicoproteína (0,5 a 2 mg), aunque deglicosilación enzimática puede ser ampliado para dar cabida a grandes cantidades de proteínas, según sea necesario.
Protocolo
1. Deglicosilación enzimática
- Use tubos de PCR para minimizar la pérdida de agua por evaporación. Etiqueta de un conjunto de tubos de 1 a 7.
- Descongele el tampón 10X G7, el buffer de la glicoproteína 10 veces desnaturalización, y el 10% de NP-40 y golpee suavemente los tubos para mezclar el contenido. Mantener a temperatura ambiente.
- Colocar los viales que contienen enzimas en el hielo. Trate de minimizar el deshielo / congelación de los ciclos.
- Disolver el contenido del vial hCGβ (150 mg) en 600 l de dH 2 O y mantener en hielo.
- Prepare 1 ml de 1X buffer del G-7 mediante la dilución de las acciones 10 veces en dH 2 O.
- Diluir 0,5 l de PNGase F en 25 l de amortiguación del G7 1X y mantener en hielo.
- Prepare la mezcla exoglycosidase (mezcla de EG) mediante la combinación de 2 l cada uno de α-N-acetilgalactosaminidasa, fucosidasa α1-2, galactosidasa β1-3, y α1-3, 6 galactosidasa.
- Establecer los tubos de PCR, como se indica:
| Tubo / de la muestra # | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| hCGβ (0.25mg/ml) | 9μl | 9μl | 9μl | 9μl | - | - | - |
| Inhibidores de la glucoproteína 10X Buffer desnaturalización | 1μl | 1μl | 1μl | 1μl | 1μl | 1μl | 1μl |
| dH 2 O | - | - | - | - | 9μl | 9μl | 9μl |
- Tape los tubos, mezclar suavemente y colocar en eltermociclador, cierre la tapa y desnaturalizar las proteínas mediante la incubación de 10 minutos a 94 ° C, seguido de un 4 º C mantener (con tubos de PCR en un termociclador en gran medida evita la evaporación en las muestras de pequeño volumen).
- Retire los tubos del termociclador y se centrifuga para eliminar la condensación visible.
- Añadir los siguientes reactivos como se indica:
| Muestra # | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 10% de NP-40 | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl |
| Buffer 10X G7 | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2,5 y mu; L | 2.5μl |
| PNGase F 1:50 dil. | - | 2μl | - | - | 2μl | - | - |
| Deglicosilación Mix | - | - | 2μl | 2μl | - | 2μl | 2μl |
| Mezcla de EG | - | - | - | 2μl | - | - | 2μl |
| dH 2 O | 10μl | 8μl | 8μl | 6μl | 8μl | 8μl | 6μl |
| Vol total de reacción. | 25 μ l | 25 μ l | 25 μ l | 25 μ l | 25 μ l | 25 μ l | 25 μ l |
- Cerrar los tubos de PCR con tapas nuevas (deseche las que se utilizan, ya que no se ajustan correctamente después de un ciclo de incubación).
- Mezcle los tubos golpeando suavemente 4 veces y luego girar el contenido hacia abajo.
- Colocar los tubos en el termociclador e incubar a 37 ° C durante 4 horas y enfriar las muestras a 4 ° C.
2. SDS-PAGE de las muestras deglicosilada
- Prepare 130 l nuevo 3X tampón de carga SDS reducir mediante la adición de 4 l de 1,25 M de TDT.
- Añadir 12,5 l de la preparada 3X tampón de carga SDS reduciendo a cada muestra.
- Cerrar los tubos con tapones nuevos y golpee suavemente los tubos para mezclar.
- Incubar los tubos en un termociclador a 94 ° C durante 5 minutos y dejar enfriar a 4 ° C.
- Carga de 30 l de cada muestra y de 10 l de la proteína marcadora en un 10-20% de Tris-Glicina gel. Guarde el resto de la muestra de la parte 3.1. Cargar 10μl del marcador ColorPlus proteína prestained.
- La electroforesis en gel a 130 voltios a temperatura ambiente hasta que el frente tinte en la parte inferior del gel.
- Cuando el gel se haya terminado de ejecutarse, quitar el gel de los actores y el lugar en una pequeña caja de plástico con suficiente azul Coomasie mancha para cubrir el gel.
- Manchar el gel durante 1 hora con agitación suave.
- Lavar el gel tres veces durante 30 minutos en 50 ml de solución destain.
- Grabar las imágenes utilizando un transiluminador de luz blanca o un escáner. Por otra parte, el gel se puede secar entre las hojas de papel de celofán en un marco.
3. Pro-Q Esmeralda 300 para la detección de proteínas glicosiladas en geles SDS-PAGE
- En paralelo con el gel de 2.1), carga el resto de las muestras en un 10-20% de Tris-Glicina gel. Carga de 10 y mu; L marcador de proteína ColorPlus prestained.
- Mientras que el gel está ejecutando disolver el reactivo Pro-Q Esmeralda con DMF y preparar la revisión de valores, lavado y oxidantes soluciones para la Esmeralda Pro-Q 300 mancha siguiendo el manual de producto incluida con el kit.
- Cuando la electroforesis, retire el gel de fundición y lo coloca en una caja de plástico.
- Fijar el gel mediante la adición de 100 ml de la solución de Fix y dejarlo toda la noche a temperatura ambiente con agitación suave.
- Lavar el gel con 100 ml de la solución de lavado de 10 a 20 minutos a temperatura ambiente con agitación gentil. Repetir el lavado con solución de lavado fresca.
- Oxidar los hidratos de carbono mediante la incubación del gel con agitación suave durante 30 minutos en 25 ml de solución de oxidantes.
- Lavar el gel como se describe en el paso 3.5.
- Mientras que el gel es el lavado de preparar dulce Pro-Q Esmeralda 300 mancha añadiendo 500 l de la solución Pro-Q Esmeralda 300 reactivo disuelto en el paso 3.2 a 25 ml detinción de amortiguación en el kit.
- Tinción del gel mediante la adición de 25 ml de la mancha preparado en el paso 3.8 e incubar en la oscuridad con agitación suave durante 90 a 120 minutos.
- Repita los dos pasos de lavado descrito en el paso 3.5.
- Grabar las imágenes con un transiluminador UV a 300nm. Use el marcador de 80 kDa, que está marcado con Pro-Q verde esmeralda, a la superposición de la imagen UV a una imagen de luz blanca del gel que muestra la escala prestained.
- Compare las imágenes del gel Coomasie manchado en el paso 2.10 con el gel Pro-Q esmeralda teñidas de paso 3.11.
4. Los resultados representativos
Los cambios en la migración de las proteínas después de deglicosilación enzimática se muestran en la Figura 2. Comparar la muestra de control (panel A, carril 1) con el tratamiento F PNGase (eliminación de N-glicanos, carril 2), y Mix deglicosilación (PNGase F, además de endo-y exoglicosidasas para eliminar O-glicanos, carril 3). Una reducción adicionalen el tamaño se ve después de digestión con glicosidasas adicional (calle 4). Además de un cambio en la masa, las bandas se agudizan como glicanos son removidos. Una banda ejecuta en el marcador de 17 kDa (asterisco) representa la totalidad deglicosilada hCGβ polipéptido (MW: 16 kDa). Otras bandas pudieran derivarse de deglicosilación incompleta o de las proteínas múltiples identificados en la muestra hCGβ (ver carril 1). Calles 5 a 7 (controles) muestran las bandas correspondientes a las glicosidasas.
La tinción de la glicoproteína de verde esmeralda se muestra en el panel B. Este reactivo se oxida y manchas de todos los glicanos presentes en una molécula de proteína. Por lo tanto la intensidad de la señal disminuye a medida que hCGβ es enzimáticamente deglicosilada (calle 1 a calle 4). La señal residual en los carriles 3 y 4 indican la presencia de motivos glicanos, que son resistentes a las enzimas utilizadas. Las glicosidasas adicional que se utiliza en el carril 4 quitar unos pocos residuos adicionales de azúcar: la migración de las proteínas es el mismo, perouna ligera reducción en la intensidad de la tinción se puede ver. Fracciones resistentes al azúcar no estaban presentes en todas las especies de proteínas: algunas bandas no fueron detectados por el verde esmeralda (ausente en la imagen de los rayos UV, entre paréntesis), lo que indica que se deglicosilada ampliamente. Datos adicionales de apoyo a la conclusión de que hCGβ es heterogénea glicosilada. La banda inferior en la pista 2 (flecha) es débil en la imagen verde esmeralda, mientras que la banda superior en la pista 2 es brillante, lo que indica que los grupos de glicanos muchos todavía están presentes. Estos datos apoyan la conclusión de que hCGβ recombinantes expresadas en células de ratón contiene múltiples glicoformas 9. Estos glicoformas diferentes debido a la heterogeneidad inherente de la glicosilación en algunos polipéptidos no reciben un glicano en cada sitio de consenso y / o glicanos algunos se extienden, mientras que otros, incluso en la misma proteína que no lo son.
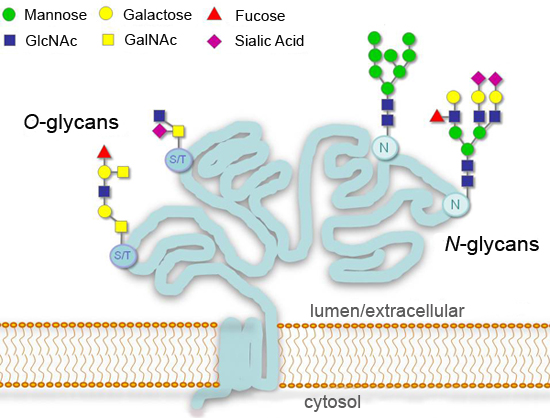
Figura 1.Los patrones típicos de glicosilación de las glicoproteínas secretadas o de la superficie celular.
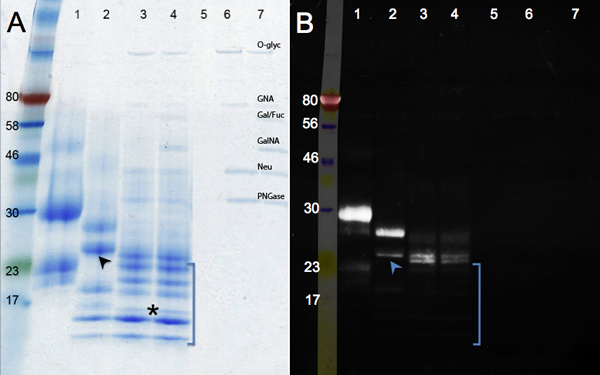
Figura 2. Geles SDS-PAGE mostrando deglicosilación enzimática de hCGβ. El panel A muestra una coloración azul Coomasie mientras que el panel B se muestran los resultados de la Pro-Q Esmeralda 300 para la visualización de las proteínas glicosiladas. Número de la muestra: 1, el control hCGβ, 2, F PNGase digestión; 3, la digestión deglicosilación Mix, 4, Mix deglicosilación más exoglicosidasas digestión, las muestras de 5 a 7 son los controles de reactivos (O-Glyc, O-glucosidasa, GNA, β-N -acetilglucosaminidasa; fucosidasa Gal / FUC, β1-3 galactosidasa, α1-3, galactosidasa 6, y α1-2; GalNA, α-N-Acetylglalactosaminidase, Neu, la neuraminidasa; PNGase; F PNGase)
Discusión
El método descrito aquí usando deglicosilación enzimática y SDS-PAGE puede proporcionar información valiosa sobre el estado de glicosilación de una proteína de interés, mientras que glicano reactivos específicos para facilitar la interpretación de los datos. Este protocolo está pensado para los estudios iniciales de la glicosilación de proteínas y es especialmente adecuado para secretora y las glicoproteínas de membrana de las células de mamíferos: las enzimas elegido en este caso concreto se eliminarán todos los N-glicanos, y N-glicanos o más y los azúcares más comunes la ampliación y que forman el núcleo de O-glicanos. Glicosidasas tienen la ventaja adicional de ser leve, en comparación con los métodos deglicosilación química, preservando la integridad de azúcares y de columna de la proteína.
Para dilucidar la tasa de ocupación (que los aminoácidos son glicosilada), el grado de glicosilación, o para determinar la estructura fina de los glicanos, las técnicas más sofisticadas, tales como mespectrometría de culo, la cromatografía líquida o la RMN son obligatorios.
Debido a su simplicidad, varios pasos en este protocolo se puede ajustar, sustituir y / o combinados para adaptarse a las distintas necesidades experimentales. Sin embargo, con el fin de obtener resultados que puedan interpretarse claramente que es importante para entender sus fortalezas y limitaciones. En primer lugar, la especificidad y la pureza de las glicosidasas son cruciales: sólo las enzimas bien caracterizadas evaluados para estar libres de las proteasas y otras actividades contaminantes deben ser utilizados. Desafortunadamente, no existe una definición estándar para la unidad de enzima glicosidasas, el usuario deberá determinar la sustitución adecuada de acuerdo a las especificaciones del fabricante. En segundo lugar, una cuidadosa selección de detección es necesario: a los reactivos de la proteína) tinción son útiles sólo si los resultados deglicosilación en un cambio significativo de la masa molecular. Como un resultado claro, como se muestra aquí no siempre se consigue. En otros casos, hemos visto mi anormalesintegración después de deglicosilación (lejos del peso molecular predicho, o la migración aún más lento). Este fenómeno no se entiende bien, pero se puede decir que cualquier cambio en la migración es evidencia de que la proteína se ha deglicosilada. B) la detección de azúcar con los anticuerpos presenta desafíos únicos que limitan su aplicabilidad. Ha sido muy difícil generar general anti-glicano anticuerpos, por lo general son planteadas contra un complejo objetivo de glicanos, lo que limita su uso. Por otra parte, varios anticuerpos monoclonales anti-glicanos anticuerpos mostrar reactividad cruzada no deseados 10. C) Las lectinas (proteínas con afinidad intrínseca de azúcar) son muy adecuadas para la detección de azúcar, además de que dan idea de la estructura de glicano. Sin embargo, no todos ellos tienen una especificidad estrecha, y muchos son sólo parcialmente caracterizado (lo que significa que podría tener afinidades desconocido). Como consecuencia, una tinción positiva lectina proporciona una indicación, no una prueba, de la presencia de un giVen azúcar. d) equipos de etiquetado de productos químicos (basado en la oxidación de peryodato de azúcares) son el método de elección para teñir todas las glicoproteínas, y por lo tanto muy adecuado para seguir deglicosilación.
Cuando se procesa una muestra desconocida, es una buena práctica incluir los controles de la glicoproteína. Fetuina es un N disponible - y O-glicoproteína, la gonadotropina coriónica (dos subunidades) es también una buena opción. Albúmina de suero bovino (BSA) se puede utilizar como control negativo. Sin embargo, cabe señalar que algunas proteínas no glicosilada reaccionar ligeramente con la Esmeralda del Pro-Q 300, especialmente cuando se utiliza en altas concentraciones. No glicosilada estándares de peso molecular, tales como el marcador de la proteína prestained utilizados en este protocolo, tienen la ventaja de mostrar bandas nítidas. Sólo por casualidad, es una de estas proteínas (80 kDa) reactiva a Pro-Q Esmeralda 300. Por lo tanto, el usuario podría querer ejecutar una escala estándar de la glicoproteína en su lugar, como el caramelo de la caña de Invitrogen.
Finalmente, simple en gel de detección de las glicoproteínas nucleocytosolic (que se modifican con una sola O-GlcNAc) es posible con el uso de un anticuerpo monoclonal, a lo largo de β-N-acetilglucosaminidasa para el control de especificidad 11. La descripción de esta técnica está más allá de la alcance de este artículo, pero debe ser mencionado como glicosidasas son herramientas útiles para el estudio de muchas otras glicoproteínas y glicoconjugados presentes en las células. Un tratamiento integral de todas las formas conocidas de la glicosilación se puede encontrar en la segunda edición de los "Fundamentos de la Glicobiología", disponible gratuitamente en la biblioteca NCBI (ID estantería: NBK1908; PMID: 20301239) 12.
Divulgaciones
Los autores son empleados de New England Biolabs, que produce muchos de los reactivos utilizados en este artículo.
Agradecimientos
Don Peine
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Β de gonadotropina coriónica humana | Sigma Aldrich | C6572 | |
| Tubos para PCR | VWR | 20170-004 | |
| Termociclador PCR | Applied Biosystems | 4359659 | |
| PNGase F | New England Biolabs | P0704 | Se suministra con tampones |
| Mezclar proteínas deglicosilación | New England Biolabs | P6039 | Se suministra con tampones |
| α-N-Acetylglalactosaminidase | New England Biolabs | P0734 | Se suministra con buffer |
| α1-2 fucosidasa | New England Biolabs | P0724 | Se suministra con buffer |
| α1-3, 6 galactosidasa | New England Biolabs | P0731 | Se suministra con buffer |
| β1-3 galactosidasa | New England Biolabs | P0726 | Se suministra con buffer |
| Buffer 10X G7 (500 mM de fosfato sódico) | New England Biolabs | --- | Se suministra con PNGaseF o Mix Degl |
| Buffer 10X glicoproteína desnaturalización (5% SDS, 400 mM DTT) | New England Biolabs | --- | Se suministra con PNGaseF o Mix Degl |
| 10% de NP-40 | New England Biolabs | --- | Se suministra con PNGaseF o Mix Degl |
| 3X tampón de carga SDS (187,5 mM Tris-HCl pH 6,8, 6% SDS, 30% de glicerol, 0,03% bromophenol azul) | New England Biolabs | B7703 | Se suministra con 1,25 M de TDT |
| ColorPlus prestained marcador de la proteína | New England Biolabs | P7709 | |
| 10-20% de Tris-Glicina Multigel | Cosmo Bio Co. | DCB-414893 | |
| Cassette unidad de electroforesis | Cosmo Bio Co. | DCB-303111 | |
| Electroforesis EPS de alimentación 301 | GE Healthcare | 18-1130-01 | |
| Pro-Q Esmeralda 300 inhibidores de la glucoproteína manchas Kit | Invitrogen | P-21857 | |
| Brilliant Blue R | Sigma Aldrich | B0149 | |
| AlphaImager HP System | Celular Biociencias | 92-13823-00 |
Referencias
- Spiro, R. G. Protein glycosylation: nature, distribution, enzymatic formation, and disease implications of glycopeptide bonds. Glycobiology. 12 (4), 43-56 (2002).
- Ohtsubo, K., Marth, J. D. Glycosylation in Cellular Mechanisms of Health and Disease. Cell. 126, 855-867 (2006).
- Arnold, J. N., Wormald, M. R., Sim, R. B., Rudd, P. M., Dwek, R. A. The impact of glycosylation on the biological function and structure of human immunoglobulins. Annual Review of Immunology. 25, 21-50 (2007).
- Mitra, N., Sinha, S., Ramya, T. N. C., Surolia, A. N-linked oligosaccharides as outfitters for glycoprotein folding, form and function. Trends in Biochemical Sciences. 31, 156-163 (2006).
- Carlsen, R. B., Bahl, O. P., Swaminathan, N. Human chorionic gonadotropin. Linear amino acid sequence of the beta subunit. Journal of Biological Chemistry. 248 (19), 6810-6812 (1973).
- Tarentino, A. L., Plummer, T. H. Deglycosylation of Asparagine-linked Glycans by PNGaseF. Trends in Glycoscience and Glycotechnology. 5 (23), 163-170 (1993).
- Tretter, V., Altmann, F., Marz, L. Peptide-N4-(N-acetyl-β-glucosaminyl)asparagine amidase F cannot release glycans with fucose attached α1-3 to the asparagine-linked N-acetylglucosamine residue. European Journal of Biochemistry. 199, 647-652 (1991).
- Koutsioulis, D., Landry, D., Guthrie, E. P. Novel endo-α-N-acetylgalactosaminidases with broader substrate specificity. Glycobiology. 18 (10), 799-805 (2008).
- Thakur, D. Profiling the glycoforms of the intact alpha subunit of recombinant human chorionic gonadotropin by high-resolution capillary electrophoresis-mass spectrometry. Analytical Chemistry. 81 (2), 8900-8907 (2009).
- Park, S., Lee, M. R., Shin, I. Carbohydrate microarrays as powerful tools in studies of carbohydrate-mediated biological processes. Chemical Communications. 37, 4389-4399 (2008).
- Zachara, N. E., Vosseller, K., Hart, G. W. Detection and analysis of proteins modified by O-linked N-acetylglucosamine. Current Protocols in Molecular Biology. 95, 17-17 (2011).
- Varki, A. . Essentials of Glycobiology. , (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados