Method Article
特定のエンド - およびエキソグリコシダーゼを用いたタンパク質のグリコシル化の同定と特性評価
要約
SDS - PAGEに続く糖タンパク質から糖を削除するには、特定のグリコシダーゼを使用すると、タンパク質サンプルの糖鎖修飾を検出するための貴重な方法ですと、最初の糖鎖生物学の研究に適しています。脱グリコシル化は、次の変更は、ゲル移動度の変化として、あるいは糖鎖に敏感な試薬で染色によって検出することができます。
要約
グリコシル化、共有結合した糖の付加は、大幅にそのような細胞接着、分子の人身売買、クリアランス、およびシグナル伝達1〜4とのプロセスに影響を与える可能性のタンパク質の主要な翻訳後修飾である。またはセリンまたはスレオニン残基での(O結合型)(図1)、真核生物では、分泌経路における最も一般的なグリコシル化の変更は、コンセンサスのアスパラギン残基(N -結合)で追加です。最終製品は、異なる種、組織、またはタンパク質の間で大きく変動する中に、N型糖鎖合成の開始は非常に、真核生物に保存されている。いくつかの糖鎖は、修正されていない("高マンノースN -結合型糖鎖")または、さらにゴルジ("複雑なN -結合型糖鎖")で処理されている残る。多様化は、動物細胞における一般的なN -アセチルガラクトサミン(GalNAcを)残基と開始が下等生物1で異なるO -結合型糖鎖、のために見られる。 ENT">タンパク質のグリコシル化の詳細な分析は、それ自体のフィールドであり、適切に実行するために豊富なリソースと専門知識を必要とする。糖を除去可能な酵素のしかし、様々な(グリコシダーゼ)はのグリコシル化状態の一般的な考え方を持つことが可能に標準的な実験設定におけるタンパク質ここでは、モデル糖タンパク質の分析のためのグリコシダーゼの使用説明:。。二つのN -結合型糖鎖および4個のO -結合型糖鎖5を運ぶ組換えヒト絨毛性ゴナドトロピンβ(hCGβ)、テクニックだけの単純な必要計測機器と代表的な消耗品、そしてそれは容易に複数の糖タンパク質の試料の分析に適応することができます。
いくつかの酵素は糖タンパク質の研究に並行して使用することができます。 PNGase FはN -結合型グリカン6,7のほぼすべてのタイプを削除することができます。 O -結合型糖鎖の場合は、利用可能な酵素は存在しないことを切断するには、目から無傷のオリゴ糖できますEのタンパク質骨格。代わりに、O -グリカンは、簡単にO -グリコシダーゼによって除去される短いコアにエキソグリコシダーゼによってトリミングされています。タンパク質の脱グリコシル化のミックスはPNGase F、O -グリコシダーゼ、ノイラミニダーゼ(シアリダーゼ)、β1- 4ガラクトシダーゼ、およびβ- N -アセチルグルコサミニダーゼが含まれています。それは同時に、N -結合型糖鎖といくつかのO -結合型糖鎖8を削除するために使用されます。最後に、脱グリコシル化のミックスは中に存在することが特に耐熱単糖を取除くのを助ける他のエキソグリコシダーゼの混合物(α- N -アセチルガラク、α1- 2フコシダーゼ、α1- 3、6ガラクトシダーゼ、およびβ1- 3ガラクトシダーゼ)、を添加した特定のO -結合型糖鎖。
SDS-PAGE/Coomasie青はグリコシダーゼ処理前後の蛋白質の移行の違いを視覚化するために使用されます。さらに、砂糖特有の染色法、ProQエメラルド- 300は、糖鎖がsucceなので低下信号を示しています。ssively削除。酵素的脱グリコシル化は、必要に応じて蛋白質のより多くの数量を収容するためにスケールアップすることができますが、このプロトコルは、糖タンパク質(0.5〜2μg)を少量の分析のために設計されています。
プロトコル
1。酵素的脱グリコシル化
- 蒸発による水分の損失を最小限にするためにPCRチューブを使用してください。チューブ1の7のラベルが一組。
- 10X G7バッファ、10X糖タンパク質変性緩衝液、および10%のNP - 40を融解し、穏やかに内容物を混合するためにチューブをタップします。室温で保管してください。
- 氷上で酵素含有バイアルを置きます。融解/凍結サイクルを最小限に抑えるようにしてください。
- のdH 2 O 600μlのhCGβバイアル(150μg)の内容を溶解し、氷上に置きます。
- のdH 2 Oで10倍株式を希釈することにより1X G7バッファー1mlを準備
- 25μlの1X G7バッファにPNGase Fの0.5μlを希釈し、氷上に置きます。
- 2μlのα- N -アセチル、α1- 2フコシダーゼ、β1- 3ガラクトシダーゼ、およびα1- 3、6ガラクトシダーゼのそれぞれを組み合わせることにより、エキソグリコシダーゼのミックスを(EGミックス)の準備。
- 示されるようにPCRチューブを設定します。
| チューブ/サンプル# | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| hCGβ(0.25mg/ml) | 9μl | 9μl | 9μl | 9μl | - | - | - |
| 10X糖タンパク質変性緩衝液 | 1μlの | 1μlの | 1μlの | 1μlの | 1μlの | 1μlの | 1μlの |
| のdH 2 O | - | - | - | - | 9μl | 9μl | 9μl |
- 穏やかに混合しての場所、チューブにキャップをサーモは、蓋を閉じ、94℃で10分インキュベートすることによりタンパク質を変性° 4 ° Cホールドが続くC、(サーモサイクラーにPCRチューブを使用しては非常に少量のサンプルで蒸発を防ぎます)。
- 目に見える結露を除去するサーモサイクラーと遠心機からチューブを外します。
- 示されるように以下の試薬を追加します。
| サンプル# | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 10%のNP - 40 | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl |
| 10X G7バッファ | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5&ムー、L | 2.5μl |
| PNGase F 1:50 DIL。 | - | 2μlの | - | - | 2μlの | - | - |
| 脱グリコシルミックス | - | - | 2μlの | 2μlの | - | 2μlの | 2μlの |
| EGミックス | - | - | - | 2μlの | - | - | 2μlの |
| のdH 2 O | 10μlの | 8μl | 8μl | 6μl | 8μl | 8μl | 6μl |
| 全反応巻。 | 25μlの | 25μlの | 25μlの | 25μlの | 25μlの | 25μlの | 25μlの |
- 新しいキャップを使用してPCRチューブの蓋を閉め(その一インキュベーションサイクル後に適切にフィットしないので、使用されているものを破棄する)。
- 優しく4回タップしてチューブをミックスして、内容をスピンダウン。
- 4時間℃で、その後4℃に試料を冷却37℃サーモサイクラーとインキュベートにチューブを入れ
2。脱グリコシル化のサンプルのSDS - PAGE
- 1.25M DTT、4μlを添加して130μlの新鮮な3X還元SDSローディングバッファーを準備します。
- 各サンプルに準備さ3X還元SDSローディングバッファーの12.5μlを添加します。
- 新しいキャップとチューブの蓋を閉め、穏やかに混合するためにチューブをタップします。
- 94℃サーモサイクラーにチューブをインキュベート° C、4℃まで冷却後、5分間とするための
- 各サンプルの30μlの10〜20%トリス - グリシンゲル上のタンパク質マーカーの10μlをロードします。パート3.1のサンプルの残りを保存します。 ColorPlusプレステタンパク質マーカー10μlをロードします。
- 色素フロントがゲルの底に近くなるまで、室温で130ボルトでゲルを電気泳動させる。
- ゲルの実行が終了すると、キャストからゲルを削除し、十分なCoomasie青ゲルをカバーするために染色、小さなプラスチック製の箱に入れてください。
- 穏やかに攪拌しながら1時間ゲルを染色する。
- 脱色液50ml中で30分間ゲル3回洗浄する。
- 白色光のトランスやスキャナーを使って画像を記録する。また、ゲルは、フレームにセロファンのシートの間に乾燥させることができる。
3。 SDS - PAGEゲルでのグリコシル化タンパク質の検出用Pro - Qエメラルド300
- 2.1のゲル)と並行して、10〜20%トリス - グリシンゲルにサンプルの残りをロードする。負荷10&ムー; ColorPlusプレステタンパク質マーカーlの。
- ゲルは、DMFでのPro - Qエメラルドの試薬を溶解し、株式の修正を準備し実行している間、プロ- Qエメラルド300の洗浄と酸化性ソリューションは、キットに付属の製品マニュアルは、次の染色。
- 電気泳動が完了すると、キャストからゲルを取り出し、プラスチックボックスに入れてください。
- 修正液100 mlを追加し、穏やかに撹拌しながら室温で一晩、それを残すことによってゲルを修正。
- ジェンティーレ撹拌しながら室温で10〜20分間洗浄溶液100mlでゲルを洗浄してください。新鮮な洗浄溶液で洗浄を繰り返します。
- ソリューションを酸化25ml中で30分間穏やかに撹拌しながらゲルをインキュベートすることによって炭水化物を酸化する。
- ステップ3.5で説明したようにゲルを洗浄してください。
- ゲルは、エメラルド300のステップ3.2〜25ミリリットルに溶解したプロ- Qエメラルド300試薬溶液500μlを添加して染色新鮮プロ- Qの準備を洗浄している間キットに含まれているバッファを染色。
- ステップ3.8で作成した染色液の25 mlを加え、90〜120分間穏やかに撹拌しながら、暗所でインキュベートすることにより、ゲルを染色する。
- ステップ3.5で説明する2つの洗浄手順を繰り返します。
- 300nmのでUVトランスイルミネーターで画像を記録します。プレステラダーを示すゲルの白色光の画像にUV画像を重なるようにプロ- Qエメラルドグリーンで標識されている80kDaのマーカーを、使用してください。
- ステップ3.11からプロ- Qエメラルド染色ゲルでステップ2.10でCoomasie染色ゲルの画像を比較。
4。代表的な結果
酵素脱グリコシル化後のタンパク質の移動の変化を図2に示されています。 PNGase Fの治療(N -結合型糖鎖の除去、レーン2)、および脱グリコシル化のミックス(;プラスエンド-およびO -結合型糖鎖を除去するエキソグリコシダーゼ、レーン3 PNGase F)と(パネルA、レーン1)コントロールのサンプルを比較。それ以上の低下なしサイズで追加のグリコシダーゼ(レーン4)で消化した後に見られている。糖鎖が除去される質量の変化に加えて、バンドがシャープになる。 17kDaのマーカー(アスタリスク)の下で実行されているバンドは完全に脱グリコシル化hCGβポリペプチド(:16 kDaのMW)を表します。他のバンドは、不完全な脱グリコシル化またはhCGβ、試料中に存在する複数の未同定タンパク質(レーン1参照)から派生させるかもしれない。レーン5〜7は、(コントロール)グリコシダーゼに対応するバンドを示す。
エメラルドグリーンによる糖タンパク質の染色は、この試薬は、タンパク質の分子中に存在するすべての糖鎖を酸化し、汚れのパネルBに示されています。 hCGβを酵素(レーン4〜レーン1)脱グリコシル化されているため、信号の強度が低下する。レーン3および4における残差信号は、使用する酵素に耐性である糖鎖のモチーフ、の存在を示している。レーン4で使用される追加のグリコシダーゼは、いくつかの余分な糖残基を削除する:蛋白質の移行は同じですが、染色の強度のわずかな減少が見られる。耐糖部分は、すべての種類のタンパク質にも存在しません:いくつかのバンドは、それらが広範囲に脱グリコシル化されたことを示す、エメラルドグリーン(括弧内の、UV画像には存在しない)によって検出されなかった。追加データは、hCGβが不均一にグリコシル化されているという結論を支持。レーン2の上側のバンドは多くの糖鎖のグループがまだ存在していることを示し、明るい間にレーン2(矢印)の下側のバンドは、エメラルドグリーンの画像上で気絶です。これらのデータは、マウスの細胞で発現させた組換えhCGβは、複数のグリコフォーム9を含んでいるという結論をサポートしています。であっても同じタンパク質上にあれば、そうでないもの、これらの異なるグリコフォームはいくつかのポリペプチドは、それぞれのコンセンサス部位および/またはいくつかの糖鎖に糖鎖を受信しないグリコシル化の本質的な異質性に起因するものが拡張されています。
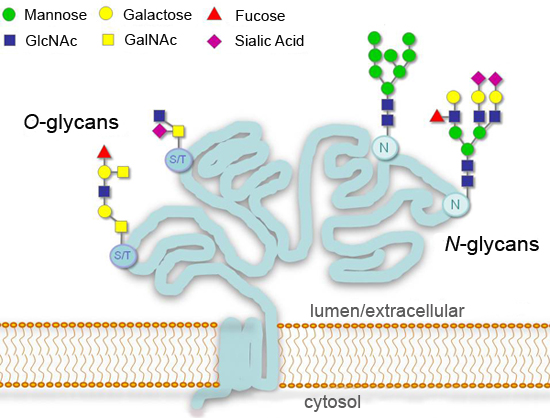
図1。分泌または細胞表面の糖タンパク質の典型的なグリコシル化パターン。
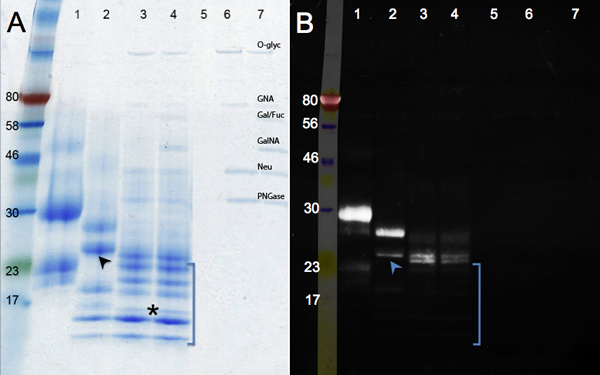
hCGβの酵素的脱グリコシル化を示す図2。SDS - PAGEゲル。パネルBは、グリコシル化タンパク質の可視化のためのPro - Qエメラルド300の結果を示しながら、パネルCoomasieブルー染色を示す。サンプル数:1、hCGβ制御、2、PNGase F消化、3、脱グリコシル化のミックスの消化、4、脱グリコシル化Mix Plusのエキソグリコシダーゼ消化、試料5〜7(O - Glyc、O -グリコシダーゼ試薬のコントロールであり、GNA、β- N -アセチルグルコサミニダーゼ、ギャル/フコース、β1- 3ガラクトシダーゼ、α1- 3、6ガラクトシダーゼ、およびα1- 2フコシダーゼ、GalNA、α- N - Acetylglalactosaminidase、ノイ、ノイラミニダーゼ、PNGase、PNGaseのF)
ディスカッション
糖鎖特異的試薬は、データの解釈を容易にする一方法は、目的のタンパク質のグリコシル化の状態に関する貴重な情報を提供することができる酵素脱グリコシル化とSDS - PAGEを用いてここで説明する。このプロトコルは、タンパク質のグリコシル化の初期の研究のために意図され、それは特に哺乳動物細胞から分泌と膜の糖タンパク質に適しています:この場合、選択された酵素は、特にすべてのN -結合型糖鎖を削除し、またはN -結合型糖鎖に加えて、最も一般的な砂糖になります拡張とO -結合型糖鎖のコアを形成する。グリコシダーゼは、糖とタンパク質骨格の両方の整合性を維持し、化学的脱グリコシル化法と比較して、軽度であることの利点があります。
占有率(アミノ酸がグリコシル化されている)、グリコシル化の程度、または糖鎖の微細構造を決定するために明らかにするために、例えば、Mのような、より高度な技術お尻の分析法、液体クロマトグラフィーやNMRが必要です。
そのシンプルさのため、このプロトコルのいくつかのステップは、調整置き換え、および/または種々の実験ニーズに対応するために組み合わせることができます。しかし、明確に解釈できる結果を得るために、その長所と限界を理解することが重要です。最初に、グリコシダーゼの特異性と純度は非常に重要です:プロテアーゼと他の汚染活動のないようにテストのみ十分に特徴付けられた酵素を使用する必要があります。残念なことに、グリコシダーゼに対する標準的な酵素のユニットの定義はない、ユーザーは、メーカーの仕様に応じて適切な置換を決定する必要があります。第二に、検出の注意深い選択が必要です:)タンパク質染色試薬は、分子量の大幅なシフトで脱グリコシル化の結果場合に便利です。ここに示すようにそのような明確な結果は必ずしも得られていない。他のケースでは、我々は異常なマイルを見てきました脱グリコシル化後にgration(はるかに予測される分子量、または遅くても移行から)。この現象はよくわかっていないですが、それは移行の変化は、タンパク質が脱グリコシル化されている証拠であるといえる。B)抗体と砂糖の検出は、その適用性を制限する独自の課題を提示。それは、一般的な抗糖鎖抗体を生成するためには非常に困難であった、彼らは通常、その使用を制限する複雑な糖鎖のターゲットに対して発生します。また、いくつかのモノクローナル抗糖鎖抗体は、望ましくない交差反応性10を表示。C)レクチンは、(本質的な砂糖の親和性を持つタンパク質)も砂糖の検出に適している、加えて彼らは糖鎖の構造上の洞察を与える。ただし、すべてのそれらの狭い特異性を持っている、と多くの部分的にのみ(彼らは未知の親和性を有することができることを意味します)特徴がある。その結果、正レクチン染色では、GIの存在の指標ではなく、証拠を、提供するようにVEN砂糖。D)化学ラベリングキットは、(糖の過ヨウ素酸酸化に基づいて)すべての糖タンパク質を染色するのに最適な方法であり、そのためよく脱グリコシル化に従うことが適しています。
未知のサンプルを処理するとき、それは糖蛋白質のコントロールを含めることをお勧めします。フェチュインは容易に入手できるNです-とO -糖蛋白質、絨毛性ゴナドトロピンは(両方のサブユニット)にも適しています。ウシ血清アルブミンは(BSA)、ネガティブコントロールとして使用することができます。しかし、それはいくつかの非グリコシル化タンパク質は高濃度で使用する場合は特に、プロ- Qエメラルド300とわずかに反応することに注意してください。そのようなこのプロトコルで使用されているプレステタンパク質マーカーとしての非グリコシル化分子量標準、、シャープなバンドを表示できるという利点を持っている。唯一のチャンスでプロ- Qエメラルド300〜反応これらのタンパク質(80 kDa)の一つです。したがって、ユーザーはそのようなInvitrogeからキャンディケインとして、代わりに糖タンパク質の標準のラダーを実行したい場合がありますnの
最後に、nucleocytosolic糖タンパク質(シングルO - GlcNAcので改変されている)のシンプルで-ゲルの検出は、特異性のコントロール11のβ- N -アセチルグルコサミニダーゼに沿って、モノクローナル抗体の使用が可能です。この手法の説明を超えているこの記事の範囲が、それがグリコシダーゼとして言及されるべきは、細胞内に存在する他の多くの糖タンパク質と複合糖質の研究のための便利なツールです。グリコシル化のすべての既知の形態の包括的な治療は、"糖鎖生物学のエッセンシャル"の第2版では見つけることができます。NCBIの本棚で利用できる無料のオンライン(ブックシェルフID:NBK1908、PMID:20301239)12。
開示事項
著者らは、この記事で使用される試薬の多くを生産するニューイングランドバイオラボで採用されています。
謝辞
ドンのくし
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| ヒト絨毛性ゴナドトロピンβ | シグマアルドリッチ | C6572 | |
| PCRチューブ | VWR | 20170-004 | |
| PCRサーモ | アプライドバイオシステムズ | 4359659 | |
| PNGase F | ニューイングランドバイオラボ | P0704 | バッファーが付属 |
| タンパク質の脱グリコシル化のミックス | ニューイングランドバイオラボ | P6039 | バッファーが付属 |
| α- N - Acetylglalactosaminidase | ニューイングランドバイオラボ | P0734 | バッファーが付属 |
| α1- 2フコシダーゼ | ニューイングランドバイオラボ | P0724 | バッファーが付属 |
| α1- 3、6ガラクトシダーゼ | ニューイングランドバイオラボ | P0731 | バッファーが付属 |
| β1- 3ガラクトシダーゼ | ニューイングランドバイオラボ | P0726 | バッファーが付属 |
| G7 10Xバッファー(500 mMリン酸ナトリウム) | ニューイングランドバイオラボ | --- | PNGaseFまたはDeglミックスで供給 |
| 10X糖タンパク質変性緩衝液(5%SDS、400mMのDTT) | ニューイングランドバイオラボ | --- | PNGaseFまたはDeglミックスで供給 |
| 10%のNP - 40 | ニューイングランドバイオラボ | --- | PNGaseFまたはDeglミックスで供給 |
| 3X SDSローディングバッファー(187.5 mMトリス- HCl pH6.8で、6%SDS、30%グリセロール、0.03%ブロムophenol青) | ニューイングランドバイオラボ | B7703 | 1.25M DTTが付属 |
| ColorPlusプレステタンパク質マーカー | ニューイングランドバイオラボ | P7709 | |
| 10から20パーセントは、トリス - グリシンマルチゲル | コスモバイオ(株) | DCB - 414893 | |
| カセット電気泳動ユニット | コスモバイオ(株) | DCB - 303111 | |
| 電気泳動用電源EPS 301 | GEヘルスケア | 18-1130-01 | |
| プロ- Qエメラルド300糖タンパク質染色キット | インビトロジェン | P - 21857 | |
| ブリリアントブルーR | シグマアルドリッチ | B0149 | |
| AlphaImager HPシステム | セルバイオサイエンス | 92-13823-00 |
参考文献
- Spiro, R. G. Protein glycosylation: nature, distribution, enzymatic formation, and disease implications of glycopeptide bonds. Glycobiology. 12 (4), 43-56 (2002).
- Ohtsubo, K., Marth, J. D. Glycosylation in Cellular Mechanisms of Health and Disease. Cell. 126, 855-867 (2006).
- Arnold, J. N., Wormald, M. R., Sim, R. B., Rudd, P. M., Dwek, R. A. The impact of glycosylation on the biological function and structure of human immunoglobulins. Annual Review of Immunology. 25, 21-50 (2007).
- Mitra, N., Sinha, S., Ramya, T. N. C., Surolia, A. N-linked oligosaccharides as outfitters for glycoprotein folding, form and function. Trends in Biochemical Sciences. 31, 156-163 (2006).
- Carlsen, R. B., Bahl, O. P., Swaminathan, N. Human chorionic gonadotropin. Linear amino acid sequence of the beta subunit. Journal of Biological Chemistry. 248 (19), 6810-6812 (1973).
- Tarentino, A. L., Plummer, T. H. Deglycosylation of Asparagine-linked Glycans by PNGaseF. Trends in Glycoscience and Glycotechnology. 5 (23), 163-170 (1993).
- Tretter, V., Altmann, F., Marz, L. Peptide-N4-(N-acetyl-β-glucosaminyl)asparagine amidase F cannot release glycans with fucose attached α1-3 to the asparagine-linked N-acetylglucosamine residue. European Journal of Biochemistry. 199, 647-652 (1991).
- Koutsioulis, D., Landry, D., Guthrie, E. P. Novel endo-α-N-acetylgalactosaminidases with broader substrate specificity. Glycobiology. 18 (10), 799-805 (2008).
- Thakur, D. Profiling the glycoforms of the intact alpha subunit of recombinant human chorionic gonadotropin by high-resolution capillary electrophoresis-mass spectrometry. Analytical Chemistry. 81 (2), 8900-8907 (2009).
- Park, S., Lee, M. R., Shin, I. Carbohydrate microarrays as powerful tools in studies of carbohydrate-mediated biological processes. Chemical Communications. 37, 4389-4399 (2008).
- Zachara, N. E., Vosseller, K., Hart, G. W. Detection and analysis of proteins modified by O-linked N-acetylglucosamine. Current Protocols in Molecular Biology. 95, 17-17 (2011).
- Varki, A. . Essentials of Glycobiology. , (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved