Method Article
Identificação e caracterização de glicosilação de proteínas específicas usando endo-e exoglycosidases
Neste Artigo
Resumo
Usando glicosidases específicas para remover a partir de açúcares glicoproteínas seguido por SDS-PAGE é um método valioso para detectar modificações glicano em amostras de proteína e é uma boa escolha para estudos glycobiology inicial. Seguintes alterações deglycosylation podem ser detectados como mudanças na mobilidade gel ou através da coloração com glicano reagentes sensíveis.
Resumo
Glicosilação, adição de açúcares ligados covalentemente, é uma modificação pós-translacional de proteínas importantes que podem afetar significativamente processos como adesão celular, o tráfico molecular, depuração e transdução de sinal 1-4. Em eucariotos, as modificações mais comuns de glicosilação na via de excreção são adições em consenso resíduos asparagina (N-linked), ou em serina ou resíduos de treonina (O-linked) (Figura 1). Início do N-glicano síntese é altamente conservada em eucariotos, enquanto o produto final pode variar muito entre diferentes espécies, tecidos ou proteínas. Alguns glicanos não haverá alterações ("alta manose N-glicanos") ou são tratados posteriormente no Golgi ("complexo N-glicanos"). Uma maior diversidade é encontrada para O-glicanas, que começam com um comum N-acetilgalactosamina resíduos (GalNAc) em células animais, mas diferem em organismos inferiores 1. ent "> A análise detalhada da glicosilação de proteínas é um campo em si mesmo e exige muitos recursos e expertise para executar corretamente. No entanto uma variedade de enzimas que removem disponíveis açúcares (glicosidases) torna possível ter uma idéia geral do estado de glicosilação . uma proteína em uma configuração padrão de laboratório Aqui ilustramos o uso de glicosidases para a análise de uma glicoproteína modelo. recombinante gonadotrofina coriônica humana beta (hCGβ), que carrega dois N-glicanos e quatro O-glicanas 5 A técnica requer apenas simples instrumentação e consumíveis típica, e pode ser facilmente adaptado para a análise de amostras glicoproteína múltiplas.
Várias enzimas pode ser usado em paralelo para estudar uma glicoproteína. PNGase F é capaz de remover quase todos os tipos de N-glicanos ligados 6,7. Para O-glicanas, não há enzima disponíveis que podem decompor um oligossacarídeo intacto de thbackbone e proteína. Em vez disso, O-glicanas são aparados por exoglycosidases a um núcleo pequeno, que depois é facilmente removido por O glicosidase. O Mix Deglycosylation Protein contém PNGase F, O glicosidase, Neuraminidase (sialidase), β1-4 Galactosidase e β-N-Acetylglucosaminidase. Ele é usado para remover simultaneamente N-glicanos e alguns glicanos O-8. Finalmente, o Mix Deglycosylation foi suplementada com uma mistura de exoglycosidases outros (α-N-Acetylgalactosaminidase, α1-2 fucosidase, α1-3, 6 Galactosidase e β1-3 Galactosidase), que ajudam a remover monossacarídeos de outra forma resistente, que podem estar presentes em alguns O-glicanas.
SDS-PAGE/Coomasie azul é usado para visualizar diferenças na migração de proteína antes e após o tratamento glicosidase. Além disso, um açúcar específico método de coloração, ProQ Emerald-300, mostra o sinal diminuído como glicanos são successively removido. Este protocolo é projetado para a análise de pequenas quantidades de glicoproteína (0,5 a 2 mg), embora deglycosylation enzimática podem ser ampliados para acomodar grandes quantidades de proteína, conforme necessário.
Protocolo
1. Deglycosylation enzimática
- Use tubos de PCR para minimizar a perda de água devido à evaporação. Um conjunto de etiquetas de tubos de 1-7.
- Descongele o buffer 10X G7, o buffer de glicoproteína 10X de desnaturação, e os 10% NP-40 e bata suavemente os tubos para misturar o conteúdo. Mantenha em temperatura ambiente.
- Coloque os frascos contendo enzima no gelo. Tentar minimizar descongelar / congelar ciclos.
- Dissolva o conteúdo do frasco hCGβ (150 mg) em 600 mL de dH 2 O e manter em gelo.
- Prepare 1 ml de 1X tampão G7 diluindo o estoque de 10X em dH 2 O.
- Diluir 0,5 mL de PNGase F em 25 mL tampão 1X G7 e manter em gelo.
- Prepare a mistura exoglycosidase (mix EG), combinando cada 2 l de α-N-Acetylgalactosaminidase, α1-2 fucosidase, β1-3 Galactosidase e α1-3, 6 Galactosidase.
- Configurar tubos PCR, conforme indicado:
| Tubo / amostra # | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| hCGβ (0.25mg/ml) | 9μl | 9μl | 9μl | 9μl | - | - | - |
| Glicoproteína 10X Tampão de desnaturação | 1μl | 1μl | 1μl | 1μl | 1μl | 1μl | 1μl |
| dH 2 O | - | - | - | - | 9μl | 9μl | 9μl |
- Tapar os tubos, misture delicadamente e coloque notermociclador, feche a tampa e desnaturar as proteínas de incubação de 10 minutos a 94 ° C, seguido de um 4 segure C ° (usando tubos de PCR em um termociclador muito evita a evaporação em amostras de pequeno volume).
- Remover os tubos de termociclador e centrífuga para remover qualquer condensação visível.
- Adicionar os seguintes reagentes conforme indicado:
| Amostra # | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 10% NP-40 | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl |
| Tampão G7 10X | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5 & mu; L | 2.5μl |
| PNGase F 01:50 dil. | - | 2μl | - | - | 2μl | - | - |
| Mix Deglycosylation | - | - | 2μl | 2μl | - | 2μl | 2μl |
| Mix EG | - | - | - | 2μl | - | - | 2μl |
| dH 2 O | 10μl | 8μl | 8μl | 6μl | 8μl | 8μl | 6μl |
| Vol reação total. | 25 l μ | 25 l μ | 25 l μ | 25 l μ | 25 l μ | 25 l μ | 25 l μ |
- Fechar os tubos PCR usando novas tampas (descartar os usados desde que não se encaixam corretamente após um ciclo de incubação).
- Misture os tubos batendo quatro vezes e depois girar o conteúdo para baixo.
- Coloque os tubos no termociclador e incubar a 37 ° C por 4 horas depois esfriar as amostras a 4 ° C.
2. SDS-PAGE de amostras deglycosylated
- Prepare 130 mL de tampão de carregamento fresco 3X reduzindo SDS, adicionando 4 mL de DTT 1.25m.
- Adicionar 12,5 l do tampão de carregamento preparado 3X reduzindo SDS para cada amostra.
- Fechar os tubos com tampas novas e bata suavemente os tubos para misturar.
- Incubar os tubos em um termociclador a 94 ° C por 5 minutos e depois arrefecer a 4 ° C.
- Carga de 30 mL de cada amostra e 10 ml do marcador da proteína em um gel de 10-20% Tris-Glicina. Salvar o restante da amostra para a parte 3.1. 10μl de carga de proteína marcadora ColorPlus Prestained.
- Electroforese do gel em 130 volts à temperatura ambiente até que a frente corante é perto da parte inferior do gel.
- Quando o gel terminar a execução, remover o gel do elenco e colocá-lo em uma pequena caixa de plástico com bastante Coomasie mancha azul para cobrir o gel.
- Manchar o gel por 1 hora com agitação suave.
- Lave o gel três vezes durante 30 minutos em 50 ml de solução destain.
- Gravar as imagens usando um transiluminador de luz branca ou scanner. Alternativamente, o gel pode ser secado entre folhas de papel celofane em um frame.
3. Pro-Q Emerald 300 para detecção de proteínas glicosiladas em géis SDS-PAGE
- Em paralelo com o gel em 2.1), coloque o restante das amostras em um gel de 10-20% Tris-Glicina. Carga 10 e mu; L da proteína marcadora ColorPlus Prestained.
- Enquanto o gel está sendo executado dissolver o Pro-Q reagente Emerald com DMF e preparar o estoque Fix Wash, e oxidantes soluções para o Emerald Pro-Q 300 mancha seguindo o manual do produto fornecido com o kit.
- Quando a eletroforese é concluída, remova o gel de elenco e colocá-lo em uma caixa de plástico.
- Corrigir o gel pela adição de 100 ml da solução de Fix e deixá-lo durante a noite a temperatura ambiente com agitação suave.
- Lavar o gel com 100 ml da solução de lavagem para 10 a 20 minutos em temperatura ambiente com agitação gentios. Repetir a lavagem com solução de lavagem fresca.
- Oxidar os carboidratos, incubando o gel com agitação suave por 30 minutos em 25 ml de solução oxidante.
- Lave o gel como descrito no passo 3.5.
- Enquanto que o gel é lavar preparar fresco Pro-Q Emerald 300 mancha por adição de 500 mL do Pro-Q solução reagente Emerald 300 dissolvido na etapa 3,2-25 ml decoloração buffer fornecido no kit.
- Mancha do gel pela adição de 25 ml da mancha preparada no passo 3.8 e incubar no escuro com agitação suave durante 90 a 120 minutos.
- Repita as duas etapas de lavagem descrito no passo 3.5.
- Gravar as imagens com um transiluminador UV, a 300nm. Use o marcador kDa 80, que é marcado com verde esmeralda Pro-Q, para sobrepor a imagem UV para uma imagem de luz branca do gel mostrando a escada prestained.
- Compare as imagens do gel Coomasie manchada no passo 2,10 com o gel Emerald Pro-Q manchada a partir do passo 3.11.
4. Resultados representativos
As mudanças na migração de proteína após deglycosylation enzimática são mostrados na Figura 2. Compare a amostra controle (painel A, faixa 1) com o tratamento F PNGase (remoção de N-glicanos, pista 2), e Mix Deglycosylation (PNGase F; além de endo e exoglycosidases para remover O-glicanas, pista 3). Sem reduçãoem tamanho é visto depois de digerir com glicosidases adicional (faixa 4). Além de uma mudança em massa, tornam-se mais nítidas bandas como glicanos são removidos. A banda rodando sob o marcador kDa 17 (asterisco) representa o (MW: 16 kDa) totalmente deglycosylated hCGβ polipeptídeo. Outras bandas poderiam derivar de deglycosylation incompleta ou das proteínas não-identificados vários presentes na amostra hCGβ (veja pista 1). Lanes 5-7 (controles) mostram as bandas correspondentes às glicosidases.
A coloração da glicoproteína pelo verde esmeralda é mostrado no painel B. Este reagente oxida e manchas todos os glicanos presentes em uma molécula de proteína. Portanto, a intensidade do sinal diminui à medida que hCGβ é enzimaticamente deglycosylated (pista 1 a pista 4). O sinal residual em faixas 3 e 4 indicam a presença de motivos glicano, que são resistentes às enzimas utilizadas. O glicosidases adicional utilizado na pista quatro remover alguns resíduos de açúcar extra: a migração de proteínas é a mesma, masuma ligeira redução na intensidade de coloração pode ser visto. Metades açúcar resistentes não estavam presentes em todas as espécies de proteína: algumas bandas não foram detectados pelo verde esmeralda (ausente na imagem UV, entre parênteses), indicando que eles foram extensivamente deglycosylated. Dados adicionais de suporte à conclusão de que é heterogeneamente hCGβ glicosilada. A banda inferior na pista 2 (seta) é fraco na imagem verde esmeralda, enquanto a faixa superior na pista 2 é brilhante, indicando que muitos grupos glicanos ainda estão presentes. Esses dados dão suporte à conclusão de que hCGβ recombinante expresso em células de camundongo contém múltiplas glycoforms 9. Estes glycoforms diferentes são devido à heterogeneidade inerente de glicosilação, onde alguns polipeptídeos não receber um glicano em cada local consenso e / ou algum glicanos são estendidos, enquanto outros ainda sobre a mesma proteína não são.
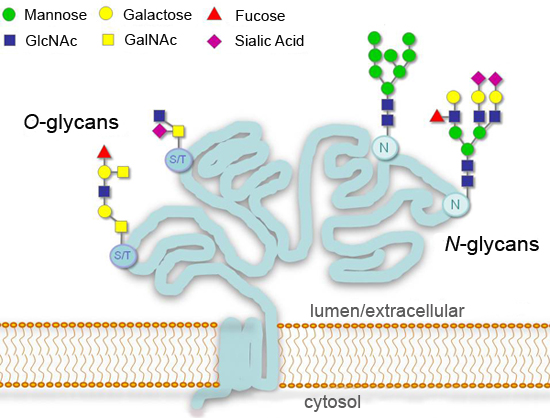
Figura 1.Padrões típicos de glicosilação para secretada ou glicoproteínas da superfície celular.
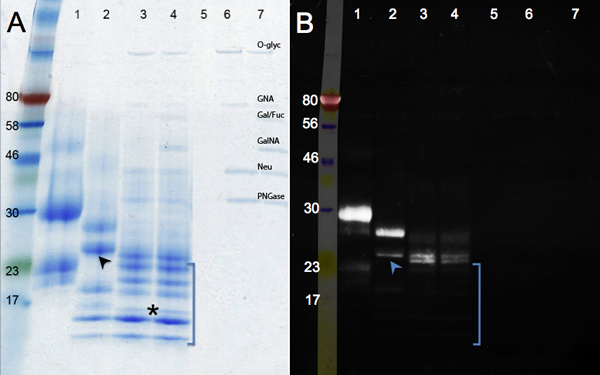
Figura 2. Géis SDS-PAGE mostrando deglycosylation enzimática de hCGβ. Um painel mostra uma coloração azul, enquanto Coomasie Painel B mostra os resultados do Pro-Q Emerald 300 para a visualização de proteínas glicosiladas. Número da amostra: 1, controle hCGβ; 2, PNGase F digestão; 3, digestão Mix Deglycosylation; 4, Mix Deglycosylation mais exoglycosidases digestão, as amostras de 5-7 são os controles de reagentes (O-Glyc, ó glicosidase; GNA, β-N -Acetylglucosaminidase; fucosidase Gal / FUC, β1-3 Galactosidase, α1-3, 6 Galactosidase e α1-2; GalNA, α-N-Acetylglalactosaminidase; Neu, Neuraminidase; PNGase; F PNGase)
Discussão
O método descrito aqui, usando deglycosylation enzimática e SDS-PAGE pode fornecer informações valiosas sobre o estado de glicosilação de uma proteína de interesse, enquanto glicano-reagentes específicos facilitar a interpretação dos dados. Este protocolo destina-se para os estudos iniciais da glicosilação de proteínas e é particularmente adequada para secretoras e glicoproteínas da membrana de células de mamíferos: as enzimas escolhido, neste caso, especificamente remover todas as N-glicanos, e ou N-glicanos mais e os açúcares mais comuns ampliar e formar o núcleo de O-glicanas. Glicosidases têm a vantagem adicional de ser leve, em comparação com métodos químicos deglycosylation, preservando a integridade de ambos os açúcares e proteínas backbone.
Para elucidar a taxa de ocupação (que aminoácidos são glicosilada), extensão de glicosilação, ou para determinar a estrutura fina de glicanos, técnicas mais sofisticadas, como mespectrometria de bunda, cromatografia líquida ou RMN são obrigatórios.
Devido à sua simplicidade, vários passos neste protocolo pode ser ajustado, substituídos e / ou combinados para acomodar várias necessidades experimental. No entanto, a fim de obter resultados que podem ser claramente interpretado é importante para entender seus pontos fortes e limitações. Primeiro, a especificidade e pureza do glicosidases são cruciais: apenas enzimas bem caracterizados testado para ser livre de proteases e outras atividades de contaminação devem ser usados. Infelizmente, não há uma definição unidade padrão enzimático para glicosidases, o usuário deve determinar a substituição apropriada de acordo com as especificações do fabricante. Segundo, uma escolha cuidadosa de detecção é necessário: a) reagentes de coloração de proteínas são úteis somente se os resultados deglycosylation em uma mudança significativa na massa molecular. Um resultado tão claro como mostrado aqui nem sempre é obtida. Em outros casos, vimos mi anormalgração após deglycosylation (longe do peso previsto molecular, ou a migração ainda mais lento). Este fenômeno não é bem compreendida, mas pode-se dizer que qualquer alteração na migração evidências de que a proteína tem sido deglycosylated. B) detecção de anticorpos com Açúcar apresenta desafios únicos limitando a sua aplicabilidade. Tem sido muito difícil gerar geral anti-glicano anticorpos, que são geralmente levantadas contra um alvo glicano complexo, o que restringe seu uso. Além disso, vários monoclonal anti-glicano anticorpos exibir reatividade cruzada indesejada 10. C) As lectinas (proteínas com afinidade intrínseca de açúcar) são adequados para a detecção de açúcar, mais eles dão uma visão sobre a estrutura de glicano. No entanto, nem todos eles têm uma especificidade estreita, e muitos são apenas parcialmente caracterizada (o que significa que eles poderiam ter afinidades desconhecido). Como conseqüência coloração lectina positivo fornece uma indicação, não uma prova da presença de um soldadoven açúcar. d) kits rotulagem química (com base na oxidação periodato de açúcares) são o método de escolha para manchar todas as glicoproteínas, e, portanto, bem adequado a seguir deglycosylation.
Ao processar uma amostra desconhecida, é uma boa prática para incluir controles glicoproteína. Fetuína é um N prontamente disponível - e O-glicoproteína, gonadotrofina coriônica (ambas subunidades) também é uma boa escolha. Albumina de soro bovino (BSA) pode ser usado como controle negativo. No entanto, deve notar-se que algumas proteínas não-glicosiladas reagir um pouco com o Emerald Pro-Q 300, especialmente quando usado em altas concentrações. Não-glicosilada padrões de peso molecular, tais como o marcador de proteína prestained utilizado neste protocolo, têm a vantagem de exibir faixas afiadas. Só por acaso é uma dessas proteínas (80 kDa) reativa para pró-Q Emerald 300. Portanto, o usuário pode querer executar uma escada padrão glicoproteína vez, como Candy Cane-de Invitrogen.
Finalmente, detecção em gel simples de glicoproteínas nucleocytosolic (que são modificados com um único O-GlcNAc) é possível com o uso de um anticorpo monoclonal, junto β-N-Acetylglucosaminidase para o controle de especificidade 11. A descrição desta técnica está além do escopo deste artigo, mas deve ser mencionado como glicosidases são ferramentas úteis para o estudo de muitas outras glicoproteínas e glicoconjugados presentes nas células. Um tratamento abrangente de todas as formas conhecidas de glicosilação pode ser encontrado na segunda edição do "Essentials of Glycobiology"; on-line gratuito, disponível no NCBI Bookshelf (ID Bookshelf: NBK1908; PMID: 20301239) 12.
Divulgações
Os autores são empregados por New England Biolabs, que produz muitos dos reagentes utilizados neste artigo.
Agradecimentos
Comb Don
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Β gonadotrofina coriônica humana | Sigma Aldrich | C6572 | |
| PCR Tubes | VWR | 20170-004 | |
| PCR Termociclador | Applied Biosystems | 4359659 | |
| PNGase F | New England Biolabs | P0704 | Fornecido com buffers |
| Mix Deglycosylation proteína | New England Biolabs | P6039 | Fornecido com buffers |
| α-N-Acetylglalactosaminidase | New England Biolabs | P0734 | Fornecido com tampão |
| α1-2 fucosidase | New England Biolabs | P0724 | Fornecido com tampão |
| α1-3, 6 Galactosidase | New England Biolabs | P0731 | Fornecido com tampão |
| β1-3 Galactosidase | New England Biolabs | P0726 | Fornecido com tampão |
| Tampão 10X G7 (fosfato de sódio 500 mM) | New England Biolabs | --- | Fornecido com PNGaseF ou Mix Degl |
| Tampão de desnaturação Glicoproteína 10X (5% SDS, 400 mM DTT) | New England Biolabs | --- | Fornecido com PNGaseF ou Mix Degl |
| 10% NP-40 | New England Biolabs | --- | Fornecido com PNGaseF ou Mix Degl |
| 3X SDS loading buffer (187,5 mM Tris-HCl pH 6,8, SDS a 6%, glicerol 30%, brom 0,03%azul ophenol) | New England Biolabs | B7703 | Fornecido com 1.25m TDT |
| ColorPlus Prestained marcador Protein | New England Biolabs | P7709 | |
| 10-20% Tris-Glicina Multigel | Cosmo Bio Co. | DCB-414893 | |
| Unidade de Eletroforese cassete | Cosmo Bio Co. | DCB-303111 | |
| Eletroforese EPS Fonte de alimentação 301 | GE Healthcare | 18-1130-01 | |
| Pro-Q Emerald Kit Glicoproteína 300 Stain | Invitrogen | P-21857 | |
| Brilliant Blue R | Sigma Aldrich | B0149 | |
| AlphaImager HP Sistema | Célula de Biociências | 92-13823-00 |
Referências
- Spiro, R. G. Protein glycosylation: nature, distribution, enzymatic formation, and disease implications of glycopeptide bonds. Glycobiology. 12 (4), 43-56 (2002).
- Ohtsubo, K., Marth, J. D. Glycosylation in Cellular Mechanisms of Health and Disease. Cell. 126, 855-867 (2006).
- Arnold, J. N., Wormald, M. R., Sim, R. B., Rudd, P. M., Dwek, R. A. The impact of glycosylation on the biological function and structure of human immunoglobulins. Annual Review of Immunology. 25, 21-50 (2007).
- Mitra, N., Sinha, S., Ramya, T. N. C., Surolia, A. N-linked oligosaccharides as outfitters for glycoprotein folding, form and function. Trends in Biochemical Sciences. 31, 156-163 (2006).
- Carlsen, R. B., Bahl, O. P., Swaminathan, N. Human chorionic gonadotropin. Linear amino acid sequence of the beta subunit. Journal of Biological Chemistry. 248 (19), 6810-6812 (1973).
- Tarentino, A. L., Plummer, T. H. Deglycosylation of Asparagine-linked Glycans by PNGaseF. Trends in Glycoscience and Glycotechnology. 5 (23), 163-170 (1993).
- Tretter, V., Altmann, F., Marz, L. Peptide-N4-(N-acetyl-β-glucosaminyl)asparagine amidase F cannot release glycans with fucose attached α1-3 to the asparagine-linked N-acetylglucosamine residue. European Journal of Biochemistry. 199, 647-652 (1991).
- Koutsioulis, D., Landry, D., Guthrie, E. P. Novel endo-α-N-acetylgalactosaminidases with broader substrate specificity. Glycobiology. 18 (10), 799-805 (2008).
- Thakur, D. Profiling the glycoforms of the intact alpha subunit of recombinant human chorionic gonadotropin by high-resolution capillary electrophoresis-mass spectrometry. Analytical Chemistry. 81 (2), 8900-8907 (2009).
- Park, S., Lee, M. R., Shin, I. Carbohydrate microarrays as powerful tools in studies of carbohydrate-mediated biological processes. Chemical Communications. 37, 4389-4399 (2008).
- Zachara, N. E., Vosseller, K., Hart, G. W. Detection and analysis of proteins modified by O-linked N-acetylglucosamine. Current Protocols in Molecular Biology. 95, 17-17 (2011).
- Varki, A. . Essentials of Glycobiology. , (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados