Method Article
Identifizierung und Charakterisierung von Protein-Glykosylierung mit speziellen Endo-und Exoglycosidasen
In diesem Artikel
Zusammenfassung
Mit Hilfe spezifischer Glycosidasen um Zucker aus Glykoproteinen, die durch SDS-PAGE gefolgt zu entfernen, ist eine wertvolle Methode, um glycan Modifikationen am Protein-Proben erkannt und ist eine gute Wahl für die erste Glykobiologie Studien. Veränderungen nach Deglykosylierung kann als Verschiebungen in Gel-Mobilität oder durch Färbung mit glycan empfindliche Reagenzien nachgewiesen werden.
Zusammenfassung
Glykosylierung, die Zugabe von kovalent gebundene Zucker, ist ein wichtiger post-translationale Modifikation von Proteinen, die wesentlich beeinflussen können Prozesse wie Zelladhäsion, molekulare Handels-, Abstands-und Signaltransduktion 1-4. In Eukaryoten sind die häufigsten Glykosylierung Änderungen in den sekretorischen Weg Ergänzungen um einen Konsens Asparaginresten (N-linked), oder an Serin oder Threonin-Reste (O-linked) (Abbildung 1). Initiation von N-Glycan Synthese ist sehr in Eukaryoten konserviert, während die Endprodukte stark variieren kann zwischen verschiedenen Spezies, Geweben oder Proteine. Einige Glykane unverändert bleiben ("high Mannose N-Glykane") oder werden in den Golgi ("komplexen N-Glykane") verarbeitet. Größere Vielfalt ist für O-Glykane, die mit einem gemeinsamen N-Acetylgalactosamin (GalNAc)-Rest in tierischen Zellen beginnen, unterscheiden sich aber in niederen Organismen 1 gefunden. ENT "> Die detaillierte Analyse der Glykosylierung von Proteinen ist ein Feld, in sich selbst und erfordert umfangreiche Ressourcen und Expertise, um korrekt ausgeführt. Doch eine Vielzahl der verfügbaren Enzyme, die Zucker zu entfernen (Glycosidasen) möglich macht, eine allgemeine Vorstellung von der Glykosylierung Status haben . ein Protein in einem Standard-Laborbedingungen Hier zeigen die Verwendung von Glycosidasen für die Analyse eines Modells Glykoprotein:. rekombinantes humanes Chorion-Gonadotropin Beta (hCGβ), die zwei N-Glykane und vier O-Glykane 5 trägt die Technik erfordert nur einfache Instrumentierung und typische Verschleißteile, und es kann ohne weiteres auf die Analyse von mehreren Proben Glykoprotein angepasst werden.
Mehrere Enzyme können parallel verwendet werden, um ein Glykoprotein, zu studieren. PNGase F ist in der Lage nahezu alle Arten von N-Glycane 6,7 zu entfernen. Für O-Glykane, gibt es keine verfügbaren Enzym, das spalten kann eine intakte Oligosaccharid von the-Protein-Rückgrat. Stattdessen werden O-Glykane von Exoglycosidasen eine kurze Kern, die dann leicht durch O-Glycosidase entfernt getrimmt. Das Protein Deglycosylierung Mix enthält PNGase F, O-Glycosidase, Neuraminidase (Sialidase), β1-4 Galactosidase und β-N-Acetylglucosaminidase. Es wird verwendet, um gleichzeitig zu entfernen N-Glykane und einige O-Glykane 8. Schließlich wurde die Deglycosylierung Mix mit einer Mischung aus anderen Exoglycosidasen (α-N-Acetylgalactosaminidase, α1-2 Fucosidase, α1-3, 6 Galactosidase und β1-3 Galactosidase), die zu entfernen sonst resistenten Monosaccharide, die vorhanden sein in könnte dazu beitragen, ergänzt bestimmte O-Glykane.
SDS-PAGE/Coomasie blau wird verwendet, um Unterschiede in der Protein-Migration vor und nach Glycosidase Behandlung visualisieren. Darüber hinaus zeigt eine Zucker-spezifischen Färbemethode, Proq Smaragd-300, verminderte Signal als Glykane succe sindssively entfernt. Dieses Protokoll wird für die Analyse von kleinen Mengen an Glykoprotein (0,5 bis 2 ug) entwickelt, obwohl enzymatische Deglykosylierung hochskaliert werden kann, um größere Mengen an Protein bei Bedarf anzupassen.
Protokoll
1. Enzymatische Deglykosylierung
- Verwenden PCR-Röhrchen, um den Wasserverlust durch Verdunstung zu minimieren. Beschriften Sie ein Set von Röhren 1 bis 7.
- Auftauen 10X G7-Puffer, der 10X-Glykoprotein denaturierenden Puffer, und die 10% NP-40 und klopfen Sie leicht die Rohre, um den Inhalt zu mischen. Halten Sie bei Raumtemperatur.
- Legen Sie die enzymhaltigen Fläschchen auf dem Eis. Versuchen Sie zum Auftauen / Einfrieren-Zyklen zu minimieren.
- Lösen Sie den Inhalt des hCGβ Fläschchen (150 ug) in 600 ul dH 2 O und halten auf dem Eis.
- Bereiten Sie 1 ml 1X G7-Puffer durch Verdünnen des 10fach in dH 2 O.
- Verdünnen 0,5 ul PNGase F in 25 ul 1X G7-Puffer und halten auf dem Eis.
- Bereiten Sie die exoglycosidase Mix (EG-Mix) durch die Kombination von 2 ul jedem α-N-Acetylgalactosaminidase, α1-2 Fucosidase, β1-3 Galactosidase und α1-3, 6 Galactosidase.
- Set up PCR-Röhrchen wie angegeben:
| Tube / Probe # | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| hCGβ (0.25mg/ml) | 9μl | 9μl | 9μl | 9μl | - | - | - |
| 10X Glycoprotein Denaturierungspuffer | 1μl | 1μl | 1μl | 1μl | 1μl | 1μl | 1μl |
| dH 2 O | - | - | - | - | 9μl | 9μl | 9μl |
- Verschließen Sie die Röhrchen, vorsichtig mischen und in dieThermocycler, schließen Sie den Deckel und Denaturierung der Proteine durch Inkubation 10 Minuten bei 94 ° C, mit einem 4 ° C zu halten, gefolgt (mit PCR-Röhrchen in einem Thermocycler stark verhindert die Verdunstung in kleinen Proben).
- Entfernen Sie die Schläuche aus Thermocycler und Zentrifuge zu keiner sichtbaren Kondensation zu entfernen.
- Fügen Sie die folgenden Reagenzien wie angegeben:
| Sample # | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 10% NP-40 | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl |
| 10X G7 Buffer | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5 & mu; L | 2.5μl |
| PNGase F 01.50 dil. | - | 2μl | - | - | 2μl | - | - |
| Deglykosylierung Mix | - | - | 2μl | 2μl | - | 2μl | 2μl |
| EG-Mix | - | - | - | 2μl | - | - | 2μl |
| dH 2 O | 10 &mgr; l | 8μl | 8μl | 6μl | 8μl | 8μl | 6μl |
| Insgesamt Reaktion vol. | 25 μ l | 25 μ l | 25 μ l | 25 μ l | 25 μ l | 25 μ l | 25 μ l |
- Schließen Sie die PCR-Röhrchen mit neuen Kappen (verwerfen die benutzten, da sie nicht richtig passen nach einer Inkubationszeit Zyklus).
- Mischen Sie die Röhrchen durch leichtes Antippen 4 mal und dann drehen Sie den Inhalt nach unten.
- Die Röhrchen in den Thermocycler und bei 37 ° C für 4 Stunden, dann kühlen die Proben auf 4 ° C.
2. SDS-PAGE von Proben deglykosylierter
- Bereiten Sie 130 ul frisch 3X reduzierenden SDS-Ladepuffer durch Zugabe von 4 pl 1,25 M DTT.
- Add 12,5 ul der vorbereiteten 3X reduzierenden SDS-Ladepuffer zu jeder Probe.
- Schließen Sie die Rohre mit neuen Kappen und klopfen Sie leicht die Rohre zu mischen.
- Die Röhrchen in einem Thermocycler bei 94 ° C für 5 Minuten und dann abkühlen auf 4 ° C.
- Legen Sie 30 ul jeder Probe und 10 ul der Protein-Marker auf einem 10-20% Tris-Glycin-Gel. Save the Rest der Probe für einen Teil 3.1. Legen Sie 10 &mgr; l der ColorPlus Markers.
- Elektrophorese des Gels bei 130 Volt bei Raumtemperatur bis der Farbstoff Front ist nahe der Unterseite des Gels.
- Wenn das Gel beendet ist, entfernen Sie das Gel von der Besetzung und legen Sie sie in eine kleine Plastikbox mit genug Coomasie Bläue, um das Gel zu decken.
- Stain das Gel für 1 Stunde unter leichtem Schütteln.
- Wash Gel dreimal für 30 Minuten in 50 ml entfärben Lösung.
- Notieren Sie sich die Bilder mit einer Weißlicht-Transilluminator oder Scanner. Alternativ kann das Gel zwischen den Blättern der Zellophan in einem Rahmen getrocknet werden.
3. Pro-Q Smaragd 300 für Erkennung von glykosylierten Proteinen in SDS-PAGE-Gelen
- Parallel mit dem Gel in 2,1), laden den Rest der Proben auf einem 10-20% Tris-Glycin-Gel. Laden 10 & mu; L ColorPlus Markers.
- Während das Gel läuft lösen die Pro-Q Smaragd Reagenz mit DMF und bereiten die Lager Fix, Wash-und Oxidationsmittel-Lösungen für die Pro-Q Smaragd 300 nach dem Produkt-Handbuch mit dem Kit mitgeliefert Fleck.
- Wenn die Elektrophorese beendet ist, entfernen Sie das Gel gegossen und legen Sie sie in einer Kunststoff-Box.
- Fix das Gel durch Zugabe von 100 ml der Fix-Lösung und lassen es über Nacht bei Raumtemperatur unter leichtem Schütteln.
- Wash das Gel mit 100 ml der Waschlösung für 10 bis 20 Minuten bei Raumtemperatur mit gentile Agitation. Wiederholen Sie die Wäsche mit frischer Waschlösung.
- Oxidieren die Kohlenhydrate durch Inkubation des Gels mit leichtem Schütteln für 30 Minuten in 25 ml oxidierende Lösung.
- Wash Gel wie in Schritt 3.5 beschrieben.
- Während das Gel Waschen vorbereiten frischen Pro-Q Smaragd 300 Flecken durch Zugabe von 500 ul des Pro-Q Smaragd 300 Reagenzlösung in Schritt 3,2 bis 25 ml des gelöstenFärbepuffer im Kit enthalten.
- Stain das Gel durch Zugabe von 25 ml des Flecks in Schritt 3,8 vorbereitet und Inkubation im Dunkeln unter leichtem Schütteln für 90 bis 120 Minuten.
- Wiederholen Sie die beiden Waschschritte in Schritt 3.5 beschrieben.
- Notieren Sie sich die Bilder mit einem UV-Transilluminator bei 300 nm. Verwenden Sie das 80 kDa-Marker, die mit Pro-Q Emerald Green gekennzeichnet ist, die UV-Bild auf ein weißes Licht Bild des Gels zeigt die prestained Leiter überlappen.
- Vergleichen Sie die Bilder der Coomasie gefärbten Gel in Schritt 2.10 In der Pro-Q Smaragd gefärbtes Gel aus Schritt 3.11.
4. Repräsentative Ergebnisse
Die Änderungen im Protein Migration nach enzymatischer Deglykosylierung sind in Abbildung 2 dargestellt. Vergleichen Sie die Kontrollprobe (Panel A, Spur 1) mit dem PNGase F Behandlung (Entfernung der N-Glykane, Spur 2) und Deglycosylierung Mix (PNGase F; sowie Endo-und Exoglycosidasen zu O-Glykane zu entfernen, Spur 3). Keine weitere Reduktionin der Größe wird nach Verdauung mit zusätzlichen Glycosidasen (Bahn 4) zu sehen. Neben einer Veränderung in der Masse, werden Bänder schärfer als Glykane entfernt werden. Eine Band, die unter dem 17 kDa-Marker (Stern) steht für die vollständig deglykosylierter hCGβ Polypeptid (MW: 16 kDa). Andere Bands können von unvollständigen Deglykosylierung oder aus dem mehrere nicht identifizierte Proteine in der hCGβ Probe (siehe Spur 1) ableiten. Lanes 5 bis 7 (Kontrollen) zeigen die Banden auf, die Glycosidasen.
Das Glykoprotein-Färbung von Emerald Green ist in Feld B gezeigt Dieses Reagenz oxidiert und Flecken aller Glykane in ein Eiweißmolekül. Daher ist die Intensität des Signals nimmt mit hCGβ enzymatisch deglykosylierter ist (Spur 1 bis Spur 4). Das Restsignal in Bahnen 3 und 4 zeigen das Vorhandensein von Glykan Motive, die resistent gegen die eingesetzten Enzyme werden. Die zusätzlichen Glycosidasen in Spur 4 verwendet entfernen ein paar zusätzliche Zuckerreste: das Protein Migration ist die gleiche, abereinen leichten Rückgang in der Intensität der Färbung zu erkennen. Beständig Zuckereinheiten wurden nicht in allen Protein-Spezies: einige Bands wurden von Emerald Green (abwesend in die UV-Bild, in Klammern) nachgewiesen, was auf sie ausgiebig waren deglykosylierter. Zusätzliche Daten unterstützen die Schlussfolgerung, dass hCGβ heterogen glykosyliert ist. Die untere Bande auf Bahn 2 (Pfeil) ist schwach auf der Emerald Green Bild, während das obere Band auf Spur 2 ist hell, was darauf hinweist, dass viele Glykane Gruppen noch vorhanden sind. Diese Daten unterstützen die Schlussfolgerung, dass rekombinante hCGβ in Maus-Zellen exprimiert mehrere glycoforms enthält 9. Diese unterschiedlichen glycoforms sind aufgrund der inhärenten Heterogenität der Glykosylierung, wo einige Polypeptide nicht erhalten, ein Glykan in jedem Konsens vor Ort und / oder einige Glykane sind erweitert, während andere sogar auf das gleiche Protein nicht.
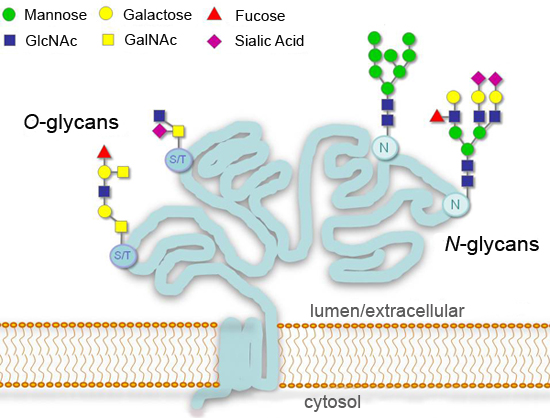
Abbildung 1.Typische Glykosylierungsmustern für sezernierte oder Zelloberflächen-Glykoproteine.
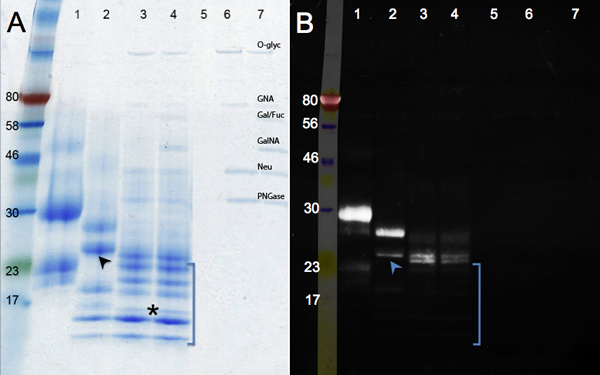
Abbildung 2. SDS-PAGE-Gele zeigen enzymatische Deglykosylierung hCGβ. Panel A zeigt ein Coomassie-Blau-Färbung, während Panel B zeigt die Ergebnisse der Pro-Q Smaragd 300 für Visualisierung von glykosylierten Proteinen. Beispiel: 1, hCGβ Kontrolle; 2, PNGase F Verdauung; 3, Deglycosylierung Mix Verdauung; 4, Deglycosylierung Mix plus Exoglycosidasen Verdauung, Proben 5 bis 7 sind die Reagenzien Kontrollen (O-Glyc, O-Glycosidase, GNA, β-N -Acetylglucosaminidase; Gal / Fuc, β1-3 Galactosidase, α1-3, 6 Galactosidase und α1-2 Fucosidase; GalNA, α-N-Acetylglalactosaminidase; Neu, Neuraminidase; PNGase; PNGase F)
Diskussion
Die hier beschriebene Methode mit Hilfe enzymatischer Deglykosylierung und SDS-PAGE können wertvolle Informationen über die Glykosylierung eines Proteins von Interesse zu erbringen, während Glykan-spezifische Reagenzien die Interpretation der Daten erleichtern. Dieses Protokoll wird für die ersten Untersuchungen der Protein-Glykosylierung bestimmt, und es ist besonders für sekretorische und Membranglykoproteine aus Säugerzellen geeignet: die Enzyme in diesem Fall gewählt wird speziell entfernen Sie alle N-Glykane und oder N-Glykane plus und die häufigste Zucker Erweiterung und bilden den Kern der O-Glykane. Glycosidasen haben den zusätzlichen Vorteil, dass sie mild, im Vergleich mit chemischen Deglykosylierung Methoden, die Wahrung der Integrität der beiden Zucker-und Protein-Rückgrat.
Um die Rate der Belegung (die Aminosäuren glykosyliert sind), das Ausmaß der Glykosylierung oder die Feinstruktur der Glykane, anspruchsvollere Techniken wie m bestimmen Aufklärungass-Spektrometrie, Flüssigchromatographie oder NMR erforderlich sind.
Wegen seiner Einfachheit kann in mehreren Schritten in diesem Protokoll angepasst, ersetzt werden, und / oder kombiniert werden, um verschiedene experimentelle Bedürfnisse anzupassen. Um jedoch die Ergebnisse, die eindeutig interpretiert werden können, erhalten, ist es wichtig, seine Stärken und Schwächen zu verstehen. Erstens sind die Spezifität und Reinheit der Glycosidasen entscheidend: nur gut charakterisierten Enzyme getestet, frei zu sein von Proteasen und anderen verunreinigenden Tätigkeit verwendet werden soll. Leider gibt es keine Standard-Enzym-Einheit Definition für Glycosidasen, sollte der Benutzer die entsprechende Substitution nach den Angaben des Herstellers zu bestimmen. Zweitens ist eine sorgfältige Auswahl der Nachweis erforderlich: a) Protein Färbereagenzien sind nur sinnvoll, wenn Deglykosylierung führt zu einer deutlichen Verschiebung in der molekularen Masse. Solch ein eindeutiges Ergebnis wie hier gezeigt, ist nicht immer erhalten. In anderen Fällen haben wir abnormal mi gesehengration nach Deglykosylierung (weit entfernt von dem vorhergesagten Molekulargewicht, oder sogar langsamer Migration). Dieses Phänomen ist nicht gut verstanden, aber es kann gesagt werden, dass jede Änderung in der Migration Beweise dafür, dass das Protein wurde deglykosylierter ist. B) Zucker-Detektion mit Antikörpern einzigartige Herausforderungen Begrenzung ihrer Anwendbarkeit präsentiert werden. Es war sehr schwierig, allgemeine Anti-Glycan Antikörper zu erzeugen, sie sind in der Regel gegen ein komplexes Glycan Ziel, was ihren Einsatz einschränkt angehoben. Darüber hinaus zeigen verschiedene monoklonale anti-Glycan Antikörper unerwünschte Kreuzreaktivität 10. C) Lektine (Proteine mit intrinsischer Zucker Affinität) sind gut für Zucker-Erkennung geeignet, plus sie geben Einblick in Glykanstruktur. Allerdings haben nicht alle von ihnen eine enge Spezifität, und viele sind nur teilweise charakterisiert (das heißt, sie könnten nicht bekannt Affinitäten haben). Als Folge positive Lektin Färbung bietet Indikation, kein Beweis, der die Anwesenheit eines given Zucker. d) Chemische Labeling Kits (basierend auf Perjodat Oxidation von Zuckern) sind die Methode der Wahl für alle Glykoproteine Fleck, und somit gut geeignet, um Deglykosylierung folgen.
Bei der Verarbeitung von einer unbekannten Probe, ist es eine gute Übung, Glykoprotein Kontrollen beinhalten. Fetuin ist ein leicht verfügbares N - und O-Glykoprotein, Chorion-Gonadotropin (beide Untereinheiten) ist ebenfalls eine gute Wahl. Rinderserumalbumin (BSA) können als negative Kontrolle verwendet werden. Es sollte jedoch angemerkt, dass einige nicht-glykosylierte Proteine leicht reagieren mit dem Pro-Q Smaragd 300, besonders wenn sie in hohen Konzentrationen eingesetzt werden. Nicht-glykosylierte Molekulargewicht-Standards, wie z. B. die Markers in diesem Protokoll verwendet werden, haben den Vorteil, dass die Anzeige scharfe Banden. Nur durch Zufall ist eines dieser Proteine (80 kDa) reaktiv auf Pro-Q Smaragd 300. Daher könnte der Benutzer wollen ein Glykoprotein Standard Leiter laufen, anstatt wie Candy-Cane aus Invitrogen.
Schließlich ist einfach in-Gel-Detektion von nucleocytosolic Glykoproteine (die mit einem einzigen O-GlcNAc modifiziert) mit der Verwendung eines monoklonalen Antikörpers möglich, entlang β-N-Acetylglucosaminidase Spezifität Steuerung 11. Die Beschreibung dieser Technik ist, über die Rahmen dieses Artikels sprengen, aber es sollte erwähnt werden, wie Glycosidasen nützliche Werkzeuge für das Studium der vielen anderen Glykoproteinen und Glycokonjugate in Zellen sind. 12:;: online frei verfügbar auf der NCBI Bookshelf (NBK1908 PMID 20301239 Bookshelf ID;) Eine umfassende Behandlung aller bekannten Formen der Glykosylierung in der zweiten Auflage der "Essentials of Glycobiology" gefunden werden.
Offenlegungen
Die Autoren sind von New England Biolabs, die viele der Reagenzien in diesem Artikel verwendeten produziert beschäftigt.
Danksagungen
Don Comb
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Humanes Choriongonadotropin β | Sigma Aldrich | C6572 | |
| PCR Tubes | VWR | 20170-004 | |
| PCR Thermocycler | Applied Biosystems | 4359659 | |
| PNGase F | New England Biolabs | P0704 | Ausgestattet mit Puffer |
| Protein Deglycosylierung Mix | New England Biolabs | P6039 | Ausgestattet mit Puffer |
| α-N-Acetylglalactosaminidase | New England Biolabs | P0734 | Ausgestattet mit Puffer |
| α1-2 Fucosidase | New England Biolabs | P0724 | Ausgestattet mit Puffer |
| α1-3, 6 Galactosidase | New England Biolabs | P0731 | Ausgestattet mit Puffer |
| β1-3 Galactosidase | New England Biolabs | P0726 | Ausgestattet mit Puffer |
| 10X Buffer G7 (500 mM Natriumphosphat) | New England Biolabs | --- | Ausgestattet mit PNGaseF oder Degl Mix |
| 10X Glycoprotein Denaturierungspuffer (5% SDS, 400 mM DTT) | New England Biolabs | --- | Ausgestattet mit PNGaseF oder Degl Mix |
| 10% NP-40 | New England Biolabs | --- | Ausgestattet mit PNGaseF oder Degl Mix |
| 3X SDS-Ladepuffer (187,5 mM Tris-HCl pH 6,8, 6% SDS, 30% Glycerin, 0,03% bromophenol blau) | New England Biolabs | B7703 | Geliefert mit 1,25 M DTT |
| ColorPlus Markers | New England Biolabs | P7709 | |
| 10-20% Tris-Glycin-Multigel | Cosmo Bio Co. | DCB-414893 | |
| Cassette Elektrophoresekammer | Cosmo Bio Co. | DCB-303111 | |
| Elektrophorese Power Supply EPS 301 | GE Healthcare | 18-1130-01 | |
| Pro-Q Smaragd 300 Glykoprotein Stain Kit | Invitrogen | P-21857 | |
| Brilliant Blue R | Sigma Aldrich | B0149 | |
| AlphaImager HP System | Zell Biosciences | 92-13823-00 |
Referenzen
- Spiro, R. G. Protein glycosylation: nature, distribution, enzymatic formation, and disease implications of glycopeptide bonds. Glycobiology. 12 (4), 43-56 (2002).
- Ohtsubo, K., Marth, J. D. Glycosylation in Cellular Mechanisms of Health and Disease. Cell. 126, 855-867 (2006).
- Arnold, J. N., Wormald, M. R., Sim, R. B., Rudd, P. M., Dwek, R. A. The impact of glycosylation on the biological function and structure of human immunoglobulins. Annual Review of Immunology. 25, 21-50 (2007).
- Mitra, N., Sinha, S., Ramya, T. N. C., Surolia, A. N-linked oligosaccharides as outfitters for glycoprotein folding, form and function. Trends in Biochemical Sciences. 31, 156-163 (2006).
- Carlsen, R. B., Bahl, O. P., Swaminathan, N. Human chorionic gonadotropin. Linear amino acid sequence of the beta subunit. Journal of Biological Chemistry. 248 (19), 6810-6812 (1973).
- Tarentino, A. L., Plummer, T. H. Deglycosylation of Asparagine-linked Glycans by PNGaseF. Trends in Glycoscience and Glycotechnology. 5 (23), 163-170 (1993).
- Tretter, V., Altmann, F., Marz, L. Peptide-N4-(N-acetyl-β-glucosaminyl)asparagine amidase F cannot release glycans with fucose attached α1-3 to the asparagine-linked N-acetylglucosamine residue. European Journal of Biochemistry. 199, 647-652 (1991).
- Koutsioulis, D., Landry, D., Guthrie, E. P. Novel endo-α-N-acetylgalactosaminidases with broader substrate specificity. Glycobiology. 18 (10), 799-805 (2008).
- Thakur, D. Profiling the glycoforms of the intact alpha subunit of recombinant human chorionic gonadotropin by high-resolution capillary electrophoresis-mass spectrometry. Analytical Chemistry. 81 (2), 8900-8907 (2009).
- Park, S., Lee, M. R., Shin, I. Carbohydrate microarrays as powerful tools in studies of carbohydrate-mediated biological processes. Chemical Communications. 37, 4389-4399 (2008).
- Zachara, N. E., Vosseller, K., Hart, G. W. Detection and analysis of proteins modified by O-linked N-acetylglucosamine. Current Protocols in Molecular Biology. 95, 17-17 (2011).
- Varki, A. . Essentials of Glycobiology. , (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten