Method Article
Идентификация и характеристика гликозилирования белков с использованием конкретных эндо-и exoglycosidases
В этой статье
Резюме
Использование специфических гликозидазы удалить сахара из гликопротеинов следуют SDS-PAGE является ценным методом для обнаружения гликана модификаций на белок образцов и является хорошим выбором для первоначального исследования гликобиологии. Изменения, произошедшие в Дегликозилирование могут быть обнаружены как сдвиги в геле подвижность или окрашиванием гликана чувствительных реагентов.
Аннотация
Glycosylation, the addition of covalently linked sugars, is a major post-translational modification of proteins that can significantly affect processes such as cell adhesion, molecular trafficking, clearance, and signal transduction1-4. In eukaryotes, the most common glycosylation modifications in the secretory pathway are additions at consensus asparagine residues (N-linked); or at serine or threonine residues (O-linked) (Figure 1). Initiation of N-glycan synthesis is highly conserved in eukaryotes, while the end products can vary greatly among different species, tissues, or proteins. Some glycans remain unmodified ("high mannose N-glycans") or are further processed in the Golgi ("complex N-glycans"). Greater diversity is found for O-glycans, which start with a common N-Acetylgalactosamine (GalNAc) residue in animal cells but differ in lower organisms1.
The detailed analysis of the glycosylation of proteins is a field unto itself and requires extensive resources and expertise to execute properly. However a variety of available enzymes that remove sugars (glycosidases) makes possible to have a general idea of the glycosylation status of a protein in a standard laboratory setting. Here we illustrate the use of glycosidases for the analysis of a model glycoprotein: recombinant human chorionic gonadotropin beta (hCGβ), which carries two N-glycans and four O-glycans 5. The technique requires only simple instrumentation and typical consumables, and it can be readily adapted to the analysis of multiple glycoprotein samples.
Several enzymes can be used in parallel to study a glycoprotein. PNGase F is able to remove almost all types of N-linked glycans6,7. For O-glycans, there is no available enzyme that can cleave an intact oligosaccharide from the protein backbone. Instead, O-glycans are trimmed by exoglycosidases to a short core, which is then easily removed by O-Glycosidase. The Protein Deglycosylation Mix contains PNGase F, O-Glycosidase, Neuraminidase (sialidase), β1-4 Galactosidase, and β-N-Acetylglucosaminidase. It is used to simultaneously remove N-glycans and some O-glycans8 . Finally, the Deglycosylation Mix was supplemented with a mixture of other exoglycosidases (α-N-Acetylgalactosaminidase, α1-2 Fucosidase, α1-3,6 Galactosidase, and β1-3 Galactosidase ), which help remove otherwise resistant monosaccharides that could be present in certain O-glycans.
SDS-PAGE/Coomasie blue is used to visualize differences in protein migration before and after glycosidase treatment. In addition, a sugar-specific staining method, ProQ Emerald-300, shows diminished signal as glycans are successively removed. This protocol is designed for the analysis of small amounts of glycoprotein (0.5 to 2 μg), although enzymatic deglycosylation can be scaled up to accommodate larger quantities of protein as needed.
протокол
1. Ферментативный Дегликозилирование
- Использование ПЦР для минимизации потерь воды за счет испарения. Этикетка одного комплекта труб от 1 до 7.
- Оттепель 10X G7 буфера, 10X гликопротеин денатурирующих буфера, а 10% NP-40 и мягко нажмите на трубах для перемешивания содержимого. Хранить при комнатной температуре.
- Место фермент-содержащие флаконах по льду. Постарайтесь свести к минимуму оттепели / заморозки циклов.
- Растворить содержимое флакона hCGβ (150 мкг) в 600 мкл дН 2 O и держать на льду.
- Подготовка 1 мл 1X G7 буфера путем разбавления 10X акций дН 2 O.
- Развести 0,5 мкл PNGase F в 25 мкл 1X G7 буфера и держать на льду.
- Подготовка exoglycosidase смеси (Е. Г. смеси) путем объединения 2 мкл каждого из α-N-Acetylgalactosaminidase, α1-2 Fucosidase, β1-3 галактозидазы и α1-3, 6 галактозидазы.
- Настройка пробирки для ПЦР, которые указаны:
| Труба / образец # | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| hCGβ (0.25mg/ml) | 9μl | 9μl | 9μl | 9μl | - | - | - |
| 10X гликопротеина денатурирующих буфера | 1 мкл | 1 мкл | 1 мкл | 1 мкл | 1 мкл | 1 мкл | 1 мкл |
| дН 2 O | - | - | - | - | 9μl | 9μl | 9μl |
- Cap трубы, аккуратно перемешать и поместить вамплификаторе, закройте крышкой и денатурации белков путем инкубации 10 мин при 94 ° С с последующим 4 ° С места (с использованием ПЦР труб в амплификаторе значительно предотвращает испарение в малых выборках объема).
- Удалить труб из амплификаторе и центрифугу для удаления видимых конденсации.
- Добавить следующие реагенты, которые указаны:
| Пример # | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 10% NP-40 | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl |
| 10X G7 буфера | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2,5 и мю; Л | 2.5μl |
| PNGase F 1:50 дил. | - | 2μl | - | - | 2μl | - | - |
| Дегликозилирование Mix | - | - | 2μl | 2μl | - | 2μl | 2μl |
| Е. смеси | - | - | - | 2μl | - | - | 2μl |
| дН 2 O | 10 мкл | 8μl | 8μl | 6μl | 8μl | 8μl | 6μl |
| Всего т. реакции. | 25 μ л | 25 μ л | 25 μ л | 25 л μ | 25 μ л | 25 μ л | 25 μ л |
- Закрыть пробирки для ПЦР с использованием новых колпачков (отказаться использовать, т.к. они не соответствуют должным образом после инкубации один цикл).
- Смешайте труб аккуратным постукиванием в 4 раза, а затем спина содержимое вниз.
- Место труб в амплификаторе и инкубировать при температуре 37 ° С в течение 4 часов, затем охладить образцы до 4 ° C.
2. SDS-электрофорез deglycosylated образцы
- Подготовка 130 мкл свежей 3X сокращение SDS загрузки буфера путем добавления 4 мкл 1,25 DTT.
- Добавить 12,5 мкл подготовленных 3X снижения загрузки буфера SDS для каждого образца.
- Закрыть труб с новой шапки и мягко нажмите на трубы, чтобы смешаться.
- Инкубируйте труб в амплификаторе при 94 ° С в течение 5 минут, а затем охладить до 4 ° С.
- Нагрузка 30 мкл каждого образца и 10 мкл белок маркером на 10-20% Трис-Глицин геля. Сохранить оставшуюся часть образца на части 3.1. Нагрузка 10 мкл из ColorPlus Prestained маркерный белок.
- Electrophorese геля при 130 вольт при комнатной температуре до красителя фронт в нижней части геля.
- Когда гель завершения работы, удалить гель из литого и поместить его в небольшую пластиковую коробку с достаточно Coomasie синевы, чтобы покрыть гелем.
- Пятно геля в течение 1 часа с нежным агитации.
- Вымойте гель три раза в течение 30 минут в 50 мл destain решение.
- Запись изображений с использованием белого света transilluminator или сканера. Кроме того, гель можно сушить между листами целлофана в кадре.
3. Pro-Q Изумрудный 300 для обнаружения гликозилированного белков в SDS-PAGE гелей
- Параллельно с гелем в 2,1), загрузить оставшуюся часть образцов на 10-20% Трис-Глицин геля. Нагрузка 10-му; Л ColorPlus Prestained маркерный белок.
- В то время как гель работает растворяются Pro-Q Изумрудный реагента с DMF и подготовить запас Fix, вымыть и Окисляющие решения для Pro-Q 300 Изумрудный пятно следующим руководством по продукции обеспечен комплектом.
- При электрофорезе завершено, удалить гель из литого и поместить его в пластиковой коробке.
- Fix гель, добавив 100 мл Fix решение и оставить его на ночь при комнатной температуре при легком помешивании.
- Вымойте гель 100 мл Промывочный раствор от 10 до 20 минут при комнатной температуре с языческими агитации. Повторите промыть свежим раствором промыть.
- Окислять углеводы путем инкубации гель с нежным агитации в течение 30 минут в 25 мл Окисляющие решение.
- Вымойте гель, как описано в пункте 3.5.
- В то время как гель стиральной подготовить свежие Pro-Q Изумрудный 300 пятно, добавив 500 мкл Pro-Q Изумрудный 300 раствора реагента, растворенного в шаге от 3,2 до 25 млокрашивание буфер, предоставленный в комплекте.
- Пятно гель, добавив 25 мл пятно подготовлен в шаге 3.8 и инкубации в темноте с легком помешивании в течение 90 до 120 минут.
- Повторите два промывания, описанных в пункте 3.5.
- Запись изображений с УФ transilluminator при 300 нм. Используйте 80 кДа маркер, который помечен Pro-Q изумрудно-зеленый, перекрывать УФ изображение белое изображение свете геля показывает prestained лестнице.
- Сравните образы Coomasie окрашенных гель в шаге 2,10 с Pro-Q Изумрудный окрашенных гель, начиная с шага 3.11.
4. Представитель результаты
Изменения в белок миграции после ферментативной Дегликозилирование показаны на рисунке 2. Сравнить контрольной пробы (панель, полоса 1) с лечением PNGase F (удаление N-гликанов, переулок 2), и Дегликозилирование Mix (PNGase F; плюс эндо-и exoglycosidases удалить О-гликанов, дорожка 3). Нет дальнейшее снижениев размере видно после переваривания с дополнительными гликозидазы (дорожка 4). Кроме изменения массы, группы обостряются как гликанов удаляются. Группа под управлением 17 кДа маркер (звездочка) представляет собой полностью deglycosylated hCGβ полипептид (МВт: 16 кДа). Другие группы могут извлекать из неполных Дегликозилирование или с несколькими неизвестными белки, присутствующие в hCGβ образца (см. дорожка 1). Дорожки от 5 до 7 (контроля) показывают полосы, соответствующие гликозидазы.
Гликопротеин окрашивания изумрудно-зеленый показан на панели B. Этот реагент окисляется и пятна все гликанов присутствует в молекуле белка. Поэтому интенсивность сигнала уменьшается hCGβ ферментативно deglycosylated (полоса 1 до переулок 4). Остаточный сигнал в полосы 3 и 4 указывают на наличие гликана мотивы, которые устойчивы к ферменты используются. Дополнительные гликозидазы используются в полосе 4 удалить несколько лишних остатков сахара: белка миграция то же самое, нонебольшое снижение интенсивности окрашивания можно увидеть. Устойчива фрагменты сахара не присутствовали во всех белков видов: некоторые группы не были обнаружены на изумрудно-зеленый (отсутствует в УФ-изображения, в скобках), что указывает на их широко deglycosylated. Дополнительные данные подтверждают вывод о том, что hCGβ является гетерогенно гликозилированного. Нижняя полоса на полосу 2 (стрелка) на слабое изображение изумрудно-зеленый, в то время как верхняя полоса на переулок, 2 ярко, указывая, что многие группы гликанов все еще существуют. Эти данные подтверждают вывод, что рекомбинантный hCGβ выражается в мышиных клеток содержит несколько гликоформ 9. Эти различные гликоформ обусловлены присущими неоднородность гликозилирования, где некоторые полипептиды не получают гликана на каждом сайте консенсуса и / или какой-либо гликанов распространяются, а другие даже на тот же белок нет.
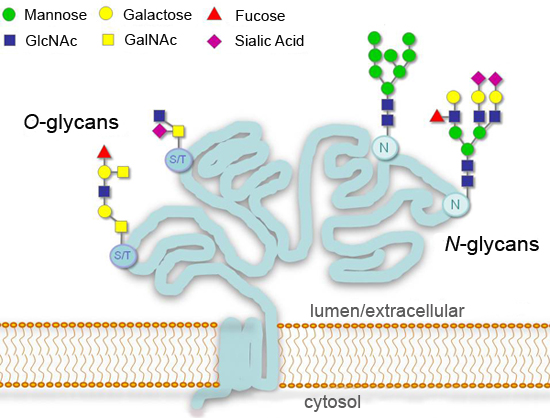
Рисунок 1.Типичные модели гликозилирования для выделяется или клеточных поверхностных гликопротеинов.
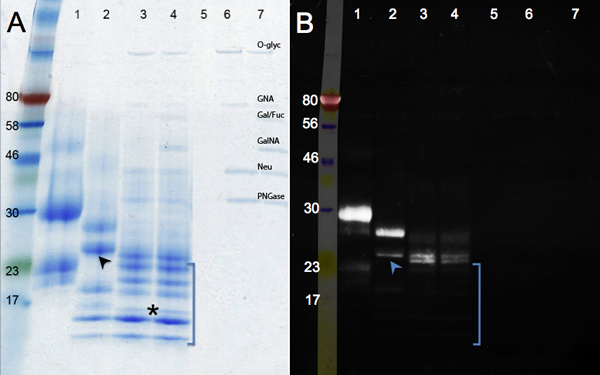
Рисунок 2. SDS-PAGE гелей показывает ферментативную Дегликозилирование hCGβ. Группа показывает Coomasie синего окрашивания в то время как группа B показаны результаты Pro-Q Изумрудный 300 для визуализации гликозилированного белков. Пример номер: 1, hCGβ контроля; 2, PNGase F пищеварения, 3, пищеварение Дегликозилирование Mix, 4, Mix Дегликозилирование плюс exoglycosidases пищеварения, образцы 5 до 7 реагента управления (O-Glyc, O-гликозидазы, ГНА, β-N -Acetylglucosaminidase; Гал / Фук, β1-3 галактозидазы, α1-3, 6 галактозидазы и α1-2 Fucosidase; GalNA, α-N-Acetylglalactosaminidase; Neu, нейраминидазы; PNGase; PNGase F)
Обсуждение
Описанный здесь метод использования ферментативных Дегликозилирование и SDS-PAGE может дать ценную информацию о состоянии гликозилирования белков представляет интерес, в то время как гликана-специфических реагентов облегчить интерпретацию данных. Этот протокол предназначен для первоначальных исследований гликозилирования белков, и это особенно хорошо подходит для секреторной и мембранные гликопротеины из клеток млекопитающих: ферменты выбрали в этом случае будет специально удалить все N-гликанов, и или N-гликанов плюс и самый распространенный сахар расширение и формирование ядра О-гликанов. Гликозидазы имеют дополнительное преимущество мягкий, по сравнению с химическими методами Дегликозилирование, сохранения целостности обоих сахаров и белков позвоночника.
Для выяснения показатель заполненности (что аминокислоты гликозилированного), степень гликозилирования, или для определения тонкой структуры гликанов, более сложные методы, такие как мзад-спектрометрии, жидкостной хроматографии и ЯМР обязательны для заполнения.
Из-за своей простоты, несколько шагов в этом протоколе можно отрегулировать, заменить и / или в комбинации для размещения различных экспериментальных потребностей. Однако, для того, чтобы получить результаты, которые могут быть четко интерпретировать важно понимать свои сильные стороны и ограничения. Во-первых, специфичность и чистоту гликозидазы имеют решающее значение: только хорошо известных ферментов, проходят проверку на отсутствие протеаз и других загрязняющих деятельности должны быть использованы. К сожалению, не существует стандартного определения единицы фермент для гликозидазы, пользователь должен определить соответствующие замены в соответствии со спецификацией производителя. Во-вторых, тщательный выбор обнаружения необходимо: а) реагентов белка окрашивания полезны, только если Дегликозилирование приводит к значительному сдвигу в молекулярной массой. Такой четкий результат, как показано здесь, не всегда получается. В других случаях мы видели ненормальных мильgration после Дегликозилирование (далеко не предсказал молекулярный вес, или еще медленнее, миграция). Это явление не очень хорошо понимал, но можно сказать, что любые изменения в миграционной доказательства того, что белок deglycosylated. Б) Сахар обнаружения с антителами представляет уникальные задачи, что ограничивает их применение. Это было очень трудно произвести общий анти-гликана антител; они, как правило, выдвигаемые против комплексной целевой гликана, что ограничивает их использование. Кроме того, несколько моноклональных анти-гликана антител дисплей нежелательных перекрестной реактивности 10. В) лектинов (белки с внутренней близости сахара) хорошо подходят для обнаружения сахара, плюс они дают представление о структуре гликана. Однако, не все из них имеют узкую специфику, и многие из них лишь частично охарактеризованы (это означает, что они, возможно, неизвестные сродство). Как следствие положительное окрашивание лектин обеспечивает индикацию, а не доказательства, о присутствии гиВен сахара. г) Химическая маркировка комплектов (на основе периодатом окисление сахаров) методом выбора для окрашивания всех гликопротеинов, и таким образом хорошо подходит следовать Дегликозилирование.
При обработке неизвестного образца, это хорошая практика, чтобы включить гликопротеин управления. Fetuin является доступной N - и О-гликопротеин, хорионический гонадотропин (оба подразделения) также является хорошим выбором. Бычий сывороточный альбумин (BSA), могут быть использованы в качестве отрицательного контроля. Однако следует отметить, что некоторые негликозилированные белки реагируют слегка Pro-Q Изумрудный 300, особенно при использовании в высоких концентрациях. Негликозилированные молекулярного веса стандартов, таких как prestained маркерный белок, используемые в настоящем протоколе, имеют то преимущество, отображающий резкие полосы. Лишь по случайности один из этих белков (80 кДа) реагирует на Pro-Q Изумрудный 300. Таким образом, пользователь может понадобиться запустить лестнице гликопротеин стандартных, а не, например, конфеты-Кане от Invitrogen.
Наконец, просто в-гель обнаружения nucleocytosolic гликопротеины (которые изменяются с одним О-GlcNAc) возможно с использованием моноклональных антител, а также β-N-Acetylglucosaminidase за специфики управления 11. Описание этой техники находится за пределами рамки данной статьи, но она должна быть упомянутым в качестве гликозидазы являются полезным инструментом для изучения многих других гликопротеинов и гликоконъюгатов присутствуют в клетках. Комплексное лечение всех известных форм гликозилирования могут быть найдены в второе издание "Основы гликобиологии" и доступен бесплатно онлайн на книжной полке NCBI (Книжная полка ID: NBK1908; PMID: 20301239) 12.
Раскрытие информации
Авторы являются сотрудниками Новой Англии Биолабс, который производит многие из реагентов, используемых в этой статье.
Благодарности
Расческа Дону
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Человека хорионический гонадотропин β | Sigma Aldrich | C6572 | |
| ПЦР трубы | VWR | 20170-004 | |
| ПЦР Термоциклер | Applied Biosystems | 4359659 | |
| PNGase F | New England Biolabs | P0704 | Поставляется с буферами |
| Смешать белки Дегликозилирование | New England Biolabs | P6039 | Поставляется с буферами |
| α-N-Acetylglalactosaminidase | New England Biolabs | P0734 | Поставляется с буфером |
| α1-2 Fucosidase | New England Biolabs | P0724 | Поставляется с буфером |
| α1-3, 6 галактозидазы | New England Biolabs | P0731 | Поставляется с буфером |
| β1-3 галактозидазы | New England Biolabs | P0726 | Поставляется с буфером |
| 10X Буфер G7 (500 мМ фосфат натрия) | New England Biolabs | --- | Поставляется с PNGaseF или Degl Mix |
| 10X гликопротеина денатурирующих буфера (5% SDS, 400 мМ DTT) | New England Biolabs | --- | Поставляется с PNGaseF или Degl Mix |
| 10% NP-40 | New England Biolabs | --- | Поставляется с PNGaseF или Degl Mix |
| 3X SDS загрузки буфера (187.5 мМ Трис-HCl, рН 6.8, 6 SDS%, 30% глицерина, 0.03% бромophenol синий) | New England Biolabs | B7703 | Поставляется с 1,25 DTT |
| ColorPlus Prestained белка Маркера | New England Biolabs | P7709 | |
| 10-20% Трис-Глицин Multigel | Cosmo Bio Ко | DCB-414 893 | |
| Кассетный Электрофорез | Cosmo Bio Ко | DCB-303 111 | |
| Электрофорез питания EPS 301 | GE Healthcare | 18-1130-01 | |
| Pro-Q Изумрудный 300 гликопротеина пятна Kit | Invitrogen | P-21857 | |
| Brilliant Blue R | Sigma Aldrich | B0149 | |
| AlphaImager HP System | Сотовые Biosciences | 92-13823-00 |
Ссылки
- Spiro, R. G. Protein glycosylation: nature, distribution, enzymatic formation, and disease implications of glycopeptide bonds. Glycobiology. 12 (4), 43-56 (2002).
- Ohtsubo, K., Marth, J. D. Glycosylation in Cellular Mechanisms of Health and Disease. Cell. 126, 855-867 (2006).
- Arnold, J. N., Wormald, M. R., Sim, R. B., Rudd, P. M., Dwek, R. A. The impact of glycosylation on the biological function and structure of human immunoglobulins. Annual Review of Immunology. 25, 21-50 (2007).
- Mitra, N., Sinha, S., Ramya, T. N. C., Surolia, A. N-linked oligosaccharides as outfitters for glycoprotein folding, form and function. Trends in Biochemical Sciences. 31, 156-163 (2006).
- Carlsen, R. B., Bahl, O. P., Swaminathan, N. Human chorionic gonadotropin. Linear amino acid sequence of the beta subunit. Journal of Biological Chemistry. 248 (19), 6810-6812 (1973).
- Tarentino, A. L., Plummer, T. H. Deglycosylation of Asparagine-linked Glycans by PNGaseF. Trends in Glycoscience and Glycotechnology. 5 (23), 163-170 (1993).
- Tretter, V., Altmann, F., Marz, L. Peptide-N4-(N-acetyl-β-glucosaminyl)asparagine amidase F cannot release glycans with fucose attached α1-3 to the asparagine-linked N-acetylglucosamine residue. European Journal of Biochemistry. 199, 647-652 (1991).
- Koutsioulis, D., Landry, D., Guthrie, E. P. Novel endo-α-N-acetylgalactosaminidases with broader substrate specificity. Glycobiology. 18 (10), 799-805 (2008).
- Thakur, D. Profiling the glycoforms of the intact alpha subunit of recombinant human chorionic gonadotropin by high-resolution capillary electrophoresis-mass spectrometry. Analytical Chemistry. 81 (2), 8900-8907 (2009).
- Park, S., Lee, M. R., Shin, I. Carbohydrate microarrays as powerful tools in studies of carbohydrate-mediated biological processes. Chemical Communications. 37, 4389-4399 (2008).
- Zachara, N. E., Vosseller, K., Hart, G. W. Detection and analysis of proteins modified by O-linked N-acetylglucosamine. Current Protocols in Molecular Biology. 95, 17-17 (2011).
- Varki, A. . Essentials of Glycobiology. , (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены