Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Protocolos de tinción de islotes pancreáticos humanos
En este artículo
Resumen
Este vídeo muestra los procedimientos para la caracterización de los islotes pancreáticos humanos con hematoxilina y eosina (H & E) e inmunohistoquímica (IHC). Secciones de páncreas de la cabeza, el cuerpo y las regiones de la cola se tiñen tanto por H & E y de IHC para determinar la composición endocrina islote (insulina, glucagón y polipéptido pancreático), la replicación celular (Ki 67), e infiltrado inflamatorio (H & E, CD3). La región se localiza uncinado con IHC para el polipéptido pancreático.
Resumen
Las estimaciones de área islote y los números y la composición células endocrinas en el páncreas humano adulto variar desde varios cientos de miles a varios millones de rangos de masa y beta de 500 a 1500 mg de 1-3. Con esta conocida heterogeneidad, un tratamiento estándar y el procedimiento de tinción fue desarrollado para que las regiones del páncreas estaban claramente definidos e islotes caracterizado utilizando rigurosos exámenes de histopatología y de inmunolocalización.
Los procedimientos estandarizados para el procesamiento de páncreas humano recuperado de donantes de órganos se describen en la parte 1 de esta serie. El páncreas se transforma en 3 regiones principales (cabeza, cuerpo, cola), seguidos de las secciones transversales. Las secciones transversales de la cabeza del páncreas se dividen, como se indica en función del tamaño, y numerados en orden alfabético para referirse a las subsecciones. Esta normalización permite un análisis completo de la sección transversal de la región de la cabeza que incluye la región uncinado que contiene islotes compuestosprincipalmente de células pancreáticas polipéptido a la región de la cola.
El presente informe comprende la parte 2 de esta serie y se describen los procedimientos utilizados para la sección de serie y la morfología de las secciones pancreáticas de parafina con un énfasis en las células endocrinas de los islotes, replicación, y los infiltrados de células T. Patología de las secciones de páncreas se destina a caracterizar tanto exocrino, ductular, y los componentes endocrinos. El compartimiento exocrina se evalúa para determinar la presencia de la pancreatitis (activo o crónica), atrofia, fibrosis y grasa, así como el sistema de conductos, particularmente en relación a la presencia de neoplasia pancreática intraductal 4. Los islotes son evaluados por la morfología, tamaño y densidad, las células endocrinas, la inflamación, la fibrosis, el amiloide, y la presencia de células apoptóticas o replicar con H & E y las manchas de IHC.
El componente final se describe en la parte 2 es la disposición de la muestra teñidas, como imágenes digitalizadas conjunto de diapositivas. Las diapositivas digitalizadas son organizadas por el caso y la región de páncreas en una base de datos virtual de patología de la creación de un biobanco. El acceso a esta colección en línea es actualmente a más de 200 médicos y científicos que participan en la investigación de la diabetes tipo 1. La base de datos en línea proporciona un medio para el intercambio de datos rápida y completa, y para los investigadores para seleccionar los bloques de parafina o congelados secciones seriadas.
Protocolo
1. Microtomía para las secciones sin teñir
- Establecer baño de agua y microtomo de parafina como para microtomía estándar. Utilizar portaobjetos cargados positivamente y pre-etiqueta con número de caso, la región páncreas (muestra) y número de diapositiva. Colocar bloque de parafina en el mandril microtomo con la etiqueta del cassette en el lado izquierdo.
- Siga los procedimientos normales microtomía, la sección en el bloque hasta que el tejido se encontró de manera uniforme. Producir una cinta de secciones seriadas (4 micras de espesor, 3-6 dependiendo del número de manchas iniciales requeridos (Vea el Formulario Presentación de caso, el Apéndice 1)). En diferentes apartados de la cinta, recoge cada uno en orden, y el lugar en las diapositivas con el orden numerado con lápiz. Denota si una parte es utilizada por la numeración de las secciones en el orden exacto. Mantener la misma orientación en la diapositiva como se encuentra en el cartucho con la etiqueta de diapositivas orientada hacia la izquierda. Secar la noche a temperatura ambiente ya continuación proceder a la tinción o distribución a los investigadores.
- Res.eal superficie de bloque de parafina con capa delgada de parafina para preservar tejido y archivo a temperatura ambiente o -20 ° C.
- Para microtomía posterior, mantener numeración de serie de secciones en cada nivel como anteriormente. Obtener un carro adicional y las manchas por el tobogán de H & E para cada nivel de ~ 100 mM dentro de cada bloque.
2. H & E tinción
- Colocar la primera serie de diapositivas en sección de cada bloque en una rejilla deslizante entonces en la primera bandeja en el Autostainer.
- Seleccione el estándar de H & E programa de la mancha y proceder como de costumbre.
- Cuando haya terminado manchas, retire las diapositivas de Autostainer y el lugar en el capó para cubreobjetos.
- Cubreobjetos utilizando la técnica estándar. Seque bien y la etiqueta con una etiqueta impresa (ver sección 12).
3. IHC Set-up
- Seleccione el programa de Dako para las manchas de dobles y los números de entrada de las diapositivas. Preparar tampones TBST y citrato, anticuerpos y otros Reagpadres de acuerdo a los volúmenes especificados (Tabla 1). Cargue la bandeja de reactivos y las diapositivas. La rotación de limpia y las líneas de desecho se programan de acuerdo con las recomendaciones del fabricante.
- Si la realización de estas pruebas de forma manual, preparar a los volúmenes estimados. Incubar los portaobjetos en una cámara húmeda para evitar el secado de las diapositivas en cualquier paso. Siga el mismo procedimiento para cada uno de los reactivos como cuando se utiliza para el Autostainer.
4. IHC desparafinización y recuperación de antígeno
- Colocar los portaobjetos en xileno durante 5 minutos. Repetir una vez. No permita que los portaobjetos se sequen a cabo en cualquier momento posterior hasta que se indica como esto dará lugar a fondo excesivo y la tinción de los pobres.
- Transferir diapositivas a 100% de etanol durante 2 minutos. Repetir una vez.
- Coloque los portaobjetos en recién preparada 3% de H 2 O 2 en metanol durante 10 minutos.
- Sumerja los portaobjetos en etanol al 90% y coloque en el 90% de etanol durante 3 minutos.
- Transferencia se desliza hacia70% de etanol durante 1 minuto.
- Enjuague los portaobjetos en agua desionizada.
- Precaliente el vapor y el tampón citrato en vapor durante 5 minutos.
- Agregar diapositivas con citrato de búfer en el vapor y el vapor durante 30 minutos.
- Transferir inmediatamente las diapositivas con el agua y mantenga hasta que se desliza enfriar a temperatura ambiente (~ 20 minutos).
- Transferencia de diapositivas para los bastidores Dako Autostainer de acuerdo a las manchas de secuencia (Figura 1) y ejecutar el programa de doble tinción. Los pasos principales del programa Autostainer se enumeran de forma que los procedimientos manuales puede duplicar.
5. Primero anticuerpos primarios (Ki-67, CD3, polipéptido pancreático)
- Bloque portaobjetos con solución Francotirador durante 15 minutos. Lavar dos veces con TBST.
- Incubar los portaobjetos en el anticuerpo primario durante 30 minutos. Lavar dos veces con TBST.
- Incubar con Mach2 de cabra anti-ratón (Ki-67) o anti-conejo (CD3, polipéptido pancreático) peroxidasa de rábano picante (HRP) de polímero de 30 minutos. Lavar dos veces con TBST.
- Aplicar 3,3-diaminobenzidina (DAB) a las diapositivas de 4 minutos. Lavar dos veces con agua.
- Las diapositivas incubadas con el polipéptido pancreático se llevan a cabo en el Dako cuando se ensayó simultáneamente y TBST utilizado para todos los pasos subsiguientes mientras que las diapositivas restantes se incubaron con el segundo conjunto de anticuerpos primarios. Por otra parte, para los ensayos manuales, vaya a la sección 6.
6. En segundo lugar Anticuerpos primarios (insulina, glucagón)
- Incubar los portaobjetos en DEEB durante 20 minutos. Lavar dos veces con TBST.
- Bloque con suero de cabra normal al 10% en bloqueador avidina 20% en TBST (insulina) o Francotirador (glucagón) en TBST durante 20 minutos. Lavar dos veces con TBST.
- Incubar con insulina o glucagón anticuerpo primario durante 15 minutos. Lavar dos veces con TBST.
- Insulina: diapositivas Incubar en biotina de cabra anti-cobaya en la dilución 1:300 durante 30 minutos. Lavar dos veces con TBST. Incubar con ve normalctor ABC-AP reactivo durante 30 minutos. Lavar dos veces con TBST.
- El glucagón: diapositivas Incubar en tampón durante durante 30 minutos seguido por cabra anti-ratón de fosfatasa alcalina (AP) polímero durante 30 minutos. Lavar dos veces con TBST.
- Mientras que los portaobjetos se incubaron en conjugados, calentar el tampón LPR a temperatura ambiente. Añadir 1 gota de líquido de color rojo permanente (LPR) por 3 ml de tampón de inmediato antes de su uso y el lugar en el rack de reactivos de Dako. Incubar los portaobjetos en LPC durante 4 minutos. Lavar dos veces con agua.
- Incubar los portaobjetos en hematoxilina durante 1 minuto. Lavar dos veces con agua.
- Incubar los portaobjetos en TBS pH 7,6 durante 1 minuto. Lavar dos veces con agua.
- Descargar las diapositivas de Dako Autostainer.
- Inmediatamente deshidratación de tinción para el polipéptido pancreático. Para todos los portas teñidos dobles y seco durante al menos 1 hora y luego se deshidrata.
7. La deshidratación
- Colocar desliza en etanol al 80% durante 1 minuto.
- Sumergir los portaobjetos en etanol al 95%.
- Mantener portaobjetos en etanol al 95% durante 30 segundos.
- Transferencia de diapositivas al 100% de etanol y mantener un minuto. Repita.
- Sumerja los portaobjetos en xileno.
- Mantener portaobjetos en xileno durante 1 minuto. Repita.
- Inmediatamente montar cubreobjetos sobre portaobjetos utilizando Cytoseal.
8. Slide etiquetado
- Introduzca la información de la identificación de casos, incluyendo el número de órganos y el bloque, manchas, y la fecha y de impresión. Número de la sección de serie es opcional para las manchas de la primera diapositiva de cada bloque. Los niveles posteriores se indican con numeración.
- Coloque las etiquetas en las diapositivas.
9. Escaneo de diapositivas
- Coloque en la bandeja portaobjetos con tinción escáner y análisis de acuerdo a la instrumentación.
- Organizar las diapositivas por el tipo de donante y los tejidos (cabeza del páncreas, cuerpo, cola, el bazo).
- Diapositivas Archivo teñidas a temperatura ambiente y que las diapositivas no teñidas restantes a -20 ° C hasta su utilización.
10. RepreseResultados ntative
Estos procedimientos de tinción se han desarrollado para la Red de la JDRF de donantes de órganos de páncreas con diabetes (nPOD) para ofrecer una caracterización de referencia de la parafina y frescas bloques congelados. Cada donante tiene una caracterización inicial realizada compuesto por manchar a 2 cuadras de cada región del páncreas (cabeza, cuerpo y cola) y el bazo (Figura 1, véase también el formulario de presentación de caso, Anexo 1). La tinción H & E se lleva a cabo mediante un Autostainer programado como para una instalación clínica con grado clínico soluciones que se utilizan en todas partes. Como los bloques adicionales de los donantes son seccionados, cada uno tiene una muestra tomada para H & E para mostrar la morfología del tejido. Cuando los bloques son seccionadas de nuevo, como para su distribución a los investigadores, los niveles más profundos también tendrá diapositivas tomadas para representante de H & E diapositivas para documentar la morfología todo el bloque de tejido, así como la numeración de serie de secciones en cada nivel. Los cortes teñidos se etiquetan conla identificación de casos, la región del páncreas, el número de bloque, las manchas y la fecha (Figura 2) y escaneados en el sistema en línea de la patología de gestión de la información. Imágenes representativas de un donante de control se muestran en la Figura 3 en ambos aumentos de alta y baja para mostrar los resultados esperados después de este procedimiento. El manchado de diapositivas con el polipéptido pancreático (D, H) se ensayó en un día diferente con el ensayo realizado manualmente y muestra la intensidad de la tinción de la reducción de contraste hematoxilina. Las diferencias en la intensidad de la tinción de anticuerpos primarios o contratinción entre los ensayos se debe evitar especialmente si se utiliza el análisis de imagen de lo contrario se desliza con requerir la corrección de color individual para alcanzar las áreas celulares mismos o recuentos.
Cada laboratorio debe esperar para optimizar las concentraciones de anticuerpos como de lote a lote variación y otros reactivos y las condiciones pueden afectar la intensidad de la tinción y la especificidad. Con la adquisición de nuevas razonescaballeros, los procedimientos de tinción se validan con muestras de control conocidas positivas y negativas para lograr el mismo grado de intensidad de la mancha con los reactivos anteriores. Anticuerpos adicionales optimizados en el núcleo nPOD patología se proporcionan en la Tabla 2 como una fuente de referencia y se han utilizado para los ensayos de inmunofluorescencia para multilabeling microscopía confocal.
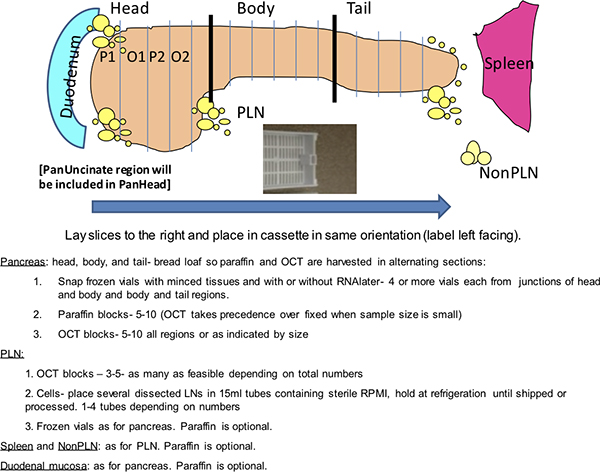
Figura 1. Red de Dako manchas. Este esquema representa un análisis de rutina del páncreas de un donante nPOD a cabo en un Dako Autostainer. Los donantes nPOD están codificados con un número de identificación de 4 dígitos. Dos bandejas de diapositivas se muestran con diapositivas organizadas por la mancha. Configuraciones alternativas de diapositivas se espera dependiendo del número de diapositivas donantes. Los controles positivos son la inclusión de un donante conocido positivo para las dos manchas de dobles y el bazo de los donantes para Ki-67 y CD3. Los controles negativos son dobles e incluyen dos tarjetas gráficas SLIdes de un bloque de páncreas de donantes incubaron con inmunoglobulina (Ig) de la especie huésped de los anticuerpos primarios y dos toboganes de bazo donante para la insulina y glucagon.
Figura 2. Representante de doble cara manchada. Una diapositiva final típico se muestra con los parámetros de etiquetado de diapositivas y la colocación de tejido antes de escaneo digital se lleva a cabo.
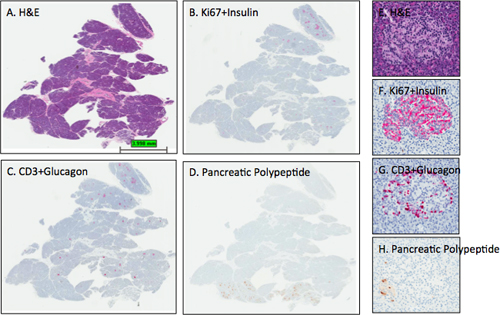
Figura 3. Representante de H & E y las manchas de inmunohistoquímica en secciones de páncreas. Las secciones del páncreas de un donante de órganos de mujeres adultas (6096 a 04 de cabeza redonda) estaban manchadas y exploraciones digitales realizadas tal como se describe en el protocolo. Las imágenes se obtuvieron usando el programa ImageScope la visualización de toda la sección (AD) y de un islote (EH). Las intensidades de los islotes esperados mancha de insulina, glucagón y polipéptido pancreático sonobservado para las secciones BD como sección delinea D que este bloque de cabeza de páncreas contiene una pequeña porción de la región uncinado o lóbulo pancreático ventral como todos los islotes pancreáticos contienen principalmente polipéptido de células positivas. Tenga en cuenta que la contratinción de hematoxilina en el panel D es demasiado clara, mientras que la hematoxilina contratinción intensidades en B y C son óptimas. Los paneles EH muestran un islote en el lóbulo dorsal con la distribución prevista de las células beta y las células α. A las células pancreáticas polipeptídicas pocos se encuentran en la parte inferior izquierda de la isleta (H). A, E-H &E; B, F-Ki67 + insulina; C, G-CD3 + glucagón; D, H-polipéptido pancreático. AD, 0.2x, EH-12.8x.
Discusión
La estandarización de los procedimientos de IHC es fundamental para el análisis de imágenes, especialmente cuando se utilizan algoritmos basados en equipo a través de un gran número de diapositivas a través del tiempo. El procedimiento de tinción inmunohistoquímica se describe en este informe permitirá el análisis de lotes de muestras de un donante determinado utilizando un Autostainer dentro de una jornada laboral de 8 horas y se modifican a partir de un informe anterior 5. Imágenes digitali...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores agradecen a las familias de los donantes y las organizaciones de obtención de órganos involucrados en esta investigación, y Montgomery Emily, Pietras Robert, Ann-fu, Agarwal Mitali, y Agarwal Roshan por su ayuda de expertos. Este trabajo fue financiado por la Juvenile Diabetes Research Foundation (MC-T.) en apoyo de la Red de Donantes de Órganos de páncreas con diabetes.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| 30% de peróxido de hidrógeno (H 2 O 2) | FisherScientific | H325-500 | El bloqueo de la peroxidasa endógena |
| ABC-fosfatasa alcalina (AP) | Vector | AK-5000 | AP conjugado |
| Diluyente de anticuerpos | Invitrogen | 003218 | Anticuerpo primario |
| Avidina bloqueador | Vector | SP-2001 | Bloque biotina endógena |
| Biotina de cabra anti-cobaya | Vector | BA-7000 | Anticuerpo secundario |
| Reactivo de coloración azul | FisherScientific | 7301 | Leica autostainer |
| Tampón citrato, pH 6,0 | BioGenex | HK086-9K | Antígeno de recuperación |
| Clarificador 1 | FisherScientific | 7401 | Leica Autostainer |
| Cytoseal XYL | FisherScientific | 8312-4 | Cubreobjetos medio de montaje |
| DAB | Vector | SK-4100 | HRP cromógeno |
| DEEB | Dako | S2003 | AP endógena reactivo de bloqueo |
| Eosina alcohólica Y | FisherScientific | 71204 | Leica Autostainer |
| Etanoles-100%, 95%, 90%, 70% | FisherScientific | Varios | Desparafinización y cubreobjetos |
| Hematoxilina | Dako | S3301 | Dako Autostainer |
| Hematoxilina 7211 | FisherScientific | 7211 | Leica Autostainer |
| IgG (todas las especies de acogida para los anticuerpos primarios) | Varios | Varios | Los controles negativos para las primarias |
| Líquido Rojo Permanente (LPR) | Dako | K0640 | AP cromógeno |
| Mach2 AP | Biocare Médica | MALP521L | Cabra anti-ratón conjugado AP |
| Mach2 HRP | Biocare Médica | MHRP520L | Cabra anti-ratón conjugado con HRP |
| Mach2 HRP | Biocare Médica | RHRP520L | Cabra anti-ratón conjugado con HRP |
| El metanol | FisherScientific | Varios | H 2 O 2 diluyente |
| Suero de cabra normal | Vector | S-1000 | IHC reactivo de bloqueo |
| Francotirador | Biocare Médica | BS966M | IHC reactivo de bloqueo |
| TBST 20X | ThermoScientific | TA-999-TT | IHC tampón |
| Triology 20x | Marque la célula | 920P-06 | Antígeno de recuperación |
| Xileno | FisherScientific | Varios | Desparafinización y cubreobjetos |
Tabla 1. Reactivos específicos.
| Anticuerpo primario | Las especies de acogida | Vendedor | Cat. # | Comentarios y recuperación del antígeno |
| Parafina | ||||
| Amilasa | Ratón | Santa Cruz | SC-46657 | Citrato |
| La amilina | Ratón | Serotec | MCA11267 | Citrato |
| La anhidrasa carbónica 19,9 | Ratón | Abcam | ab15146 | |
| Caspasa-3, se escindió | Conejo | Señalización Celular | 9961 | Citrato o Trilogy |
| CD20 | Ratón | Dako | M0755 | Citrato o Trilogy |
| CD3 | Conejo | Dako | A0452 | Citrato |
| CD34 | Ratón | Señalización Celular | 3569 | Citrato |
| CD4 | Ratón | Dako | M7310 | Citrato |
| CD45 | Ratón | Dako | M0754 | Citrato |
| CD68 | Ratón | Dako | M0876 | Citrato |
| CD8 | Ratón | Dako | M7103 | Citrato |
| Cromogranina A | Conejo | Dako | A0430 | Citrato |
| CK17 | Ratón | Dako | M7046 | Citrato |
| CK19 | Ratón | Dako | M0772 | Citrato |
| CK7 | Ratón | Dako | M7018 | Citrato |
| El péptido C | Conejo | Señalización Celular | 4593 | Citrato |
| Foxp3 | Rata | e Bioscience | 14-4776-80 | Citrato |
| La grelina | Cabra | Santa Cruz | SC-10386 | |
| La grelina | Conejo | Abcam | ab85104 | |
| El glucagón | Conejo | Dako | A0565 | |
| El glucagón | Ratón | Abcam | ab10988 | Citrato |
| El glucagón | Conejillo de Indias | Bachem | T-5037 | Citrato |
| Glut-1 | Ratón | Abcam | ab40084 | Trilogía |
| Glut-2 | Conejo | Santa Cruz | SC-9117 | No se expresa en los islotes |
| Insulina | Conejillo de Indias | Dako | A0564 | |
| Ki-67 | Ratón | Dako | M7240 | Citrato |
| Mafa | Conejo | Novus Biológica | NB400-137A | Trilogía |
| El polipéptido pancreático | Conejo | Invitrogen | 18-0043 | Citrato |
| PDX-1 | Conejillo de Indias | Abcam | ab47308 | Citrato o Trilogy |
| La proinsulina | Ratón | Novocastra | NCL-PROIN-1G4 | |
| La proinsulina | Ratón | Desarrollo hibridoma Estudios del Banco | GS-9A8 | Citrato |
| Secretagogin | Conejo | Sigma | HPA 006641 | Citrato |
| Actina de músculo liso | Conejo | Abcam | ab5694 | |
| La somatostatina | Conejo | Dako | A0566 | |
| Sinaptofisina | Ratón | Dako | M0776 | Citrato |
| Fresco, congelado | Las especies de acogida | Vendedor | Cat. # | Comentarios |
| CD11b | Rata | Abcam | ab6332 | Fijar con el 4% PF |
| CD11c | Conejo | Serotec | AHP1226 | |
| CD25 | Ratón | Novus Biológica | Nota: 600-564 | Utilice una noche de incubación de los cortes de parafina |
| CD94 | Ratón | Abcam | ab61874 | Fijar con acetona |
| GAD65 | Ratón | Santa Cruz | SC-130569 | Fijar con el 4% PF |
| HLA-ABC | Ratón | Dako | M0736 | Fijar con acetona o el 4% PF |
Tabla 2. Los anticuerpos primarios.
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Aperio Scanscope CS | Aperio | Escáner de diapositivas digital | |
| Dako Autostainer Plus | Dako | IHC manchas | |
| Matriz de impresión de etiquetas de software | Biocarta | LM7UP57 | Deslice el software de la etiqueta |
| Leica Autostainer XL | Leica | H & E manchas | |
| Prima cubreobjetos | FisherScientific | 12-548-5J | Cubreobjetos |
| Espectro Information Manager | Aperio | Escáner de software | |
| Superfrost Plus diapositivas | FisherScientific | 12-550-15 | Portaobjetos cargados positivamente |
| Verduras vapor | Negro y Decker | Varios | Antígeno de recuperación |
| Zebra TLP 3742 | CDWG | TLP3742 | Deslice la impresora de etiquetas |
Tabla 3. Suministros y equipos específicos.
Referencias
- In't Veld, P., Marichal, M. Microscopic anatomy of the human islet of Langerhans. Adv. Exp. Med. Biol. 654, 1-19 (2010).
- Matveyenko, A. V., Butler, P. C. Relationship between beta-cell mass and diabetes onset. Diabetes Obes. Metab. 10, 23-31 (2008).
- Saisho, Y. Pancreas volumes in humans from birth to age one hundred taking into account sex, obesity, and presence of type-2 diabetes. Clin. Anat. 20, 933-942 (2007).
- Hruban, R. H. Pancreatic intraepithelial neoplasia: a new nomenclature and classification system for pancreatic duct lesions. Am. J. Surg. Pathol. 25, 579-586 (2001).
- Campbell-Thompson, M. Pancreatic adenocarcinoma patients with localised chronic severe pancreatitis show an increased number of single beta cells, without alterations in fractional insulin area. Diabetologia. 52, 262-270 (2009).
- Meier, J. Beta-cell replication is the primary mechanism subserving the postnatal expansion of beta-cell mass in humans. Diabetes. 57, 1584-1594 (2008).
- Rowe, P. A., Campbell-Thompson, M. L., Schatz, D. A., Atkinson, M. A. The pancreas in human type 1 diabetes. Semin. Immunopathol. 33, 29-43 (2011).
- Veld, I. n. '. t., P, . Insulitis in human type 1 diabetes: The quest for an elusive lesion. Islets. 3, 131-138 (2011).
- van Belle, T. L., Coppieters, K. T., von Herrath, M. G. Type 1 diabetes: etiology, immunology, and therapeutic strategies. Physiol Rev. 91, 79-118 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados