Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İnsan Pankreas Adacıklar için boyama Protokoller
Bu Makalede
Özet
Bu video hematoksilen ve eosin (H & E) ve immunohistokimyasal (İHK) kullanarak insan pankreas adacık karakterizasyonu için prosedürleri göstermektedir. Baş, gövde ve kuyruk bölgelerinden Pankreas bölümleri adacık endokrin kompozisyon (insülin, glukagon ve pankreatik polipeptit), hücre çoğaltma (Ki67) ve inflamatuar infiltrasyon (H & E, CD3) belirlemek için H & E ve İHK her ikisi tarafından boyanmış. Unsinat bölge pankreatik polipeptid için İHK kullanarak yerelleştirilmiştir.
Özet
Adacık alanı ve numaraları ve yetişkin insan pankreas endokrin hücre kompozisyon tahminleri birkaç yüz bin 500 ile 1500 mg 1-3 birkaç milyon ve beta kitle aralıkları değişir. Bu bilinen heterojenite ile, bir standart işleme ve boyama işlemi pankreas bölgelerinde açıkça tanımlanmış ve adacıklar titiz histopatoloji ve immunolocalization muayene kullanılarak karakterize edilmiştir böylece geliştirilmiştir.
Organ bağışında kurtarıldı insan pankreas işlenmesi için standart bir prosedür bu serinin ikinci bölümünde 1 de açıklanmıştır. Pankreas enine kesitler izledi 3 ana bölgede (baş, gövde, kuyruk) içine işlenir. Pankreas başından transversal kesitler daha ayrılır gibi büyüklüğüne göre belirtilen ve alt belirtmek için alfabetik sayılı. Bu standardizasyon oluşan adacıklar içerir unsinat bölgesi içeren kafa bölgesinde tam bir kesit analizi için olanakesas olarak kuyruğa bölgeye pankreatik polipeptid hücre.
Mevcut rapor, bu serinin parçası 2 oluşur ve adacık endokrin hücreleri, çoğaltma ve T-hücre infiltrasyonlar bir vurgu ile pankreas parafin kesitlerin seri kesit ve histopatolojik karakterizasyonu için kullanılan prosedürler açıklanmaktadır. Pankreatik bölümlerinin her iki patolojinin ekzokrin, ductular, ve endokrin bileşenleri karakterize etmek için tasarlanmıştır. Ekzokrin bölmesi özellikle pankreas intraduktal neoplasia 4 varlığı ile ilişkili olarak, pankreatit varlığında (aktif veya kronik), atrofi, fibroz, ve yağ gibi kanalı sistemi için değerlendirilir. Adacıklar morfolojisi, boyutu ve yoğunluğu, endokrin hücreleri, inflamasyon, fibrozis, amiloid, ve H & E ve İHK lekeleri kullanarak çoğaltan veya apoptotik hücrelerin varlığı açısından değerlendirilmiştir.
2. bölümünde tarif edilen nihai komponent lekeli sürgünün temin edilmesidirsayısallaştırılmış Tüm slayt görüntüleri olarak s. Sayısallaştırılmış slaytlar sanal bir biobank oluştururken bir online patoloji veritabanında durumunda pankreas ve bölgeye göre düzenlenir. Bu online toplama Erişim henüz tip 1 diyabet araştırmaya katılan 200'den fazla klinisyen ve bilim adamlarına verilmektedir. Online veritabanı parafin veya dondurulmuş seri bölümleri için blok seçmek için hızlı ve eksiksiz veri paylaşımı ve araştırmacılar için bir yol sağlar.
Protokol
1. Boyanmamış Bölümler için Microtomy
- Standart parafin microtomy için su banyosu ve mikrotom ayarlayın. Vaka sayısı, pankreas bölgesi (örnek) ve slayt numarası ile pozitif yüklü slaytlar ve ön etiketi kullanın. Sol tarafta kaset etiketi ile mikrotom ayna yerleştirin parafin blok.
- Doku eşit rastlayana kadar blok içine Normal microtomy prosedürleri, bölüm izleyin. Seri bölümler (4 mikron kalınlığında, ilk gerekli lekeler sayısına bağlı olarak 3-6 (Olgu Teslim Formu, Ek 1'e bakınız)) bir şerit üretmek. Şerit ayrı bölümler, kalemle sayılı emri ile slaytlar üzerinde sırayla her pick up ve yer. Bir bölüm tam sırası bölümleri numaralandırma kullanılmayan olup olmadığını gösterelim. Sola yönelik slayt etiketi ile kaset bulunan gibi slaytta aynı yönde koruyun. Gece boyunca oda sıcaklığında kurumaya sonra araştırmacılara boyama veya dağıtımı ile devam edin.
- Resoda sıcaklığında veya -20 ° C'de doku ve arşiv korumak için parafin ince bir tabaka ile parafin blok eal yüzey
- Sonraki microtomy için, yukarıdaki gibi her seviyede seri bölümler için numaralandırma korumak. 1 ek slayt edinin ve her blok içinde her ~ 100 uM düzeyi için H & E slayt tarafından leke.
2. H & E Boyama
- Autostainer ilk tepside sonra slayt rafa her bloğunun ilk seri kesitler slayt yerleştirin.
- Standart H & E boyama programı seçin ve her zamanki gibi devam edin.
- Boyama bittiğinde coverslipping için kaputu Autostainer ve yerden slaytları çıkarın.
- Standart tekniğini kullanarak Coverslip. Basılı bir etiket (bölüm 12) ile iyice ve etiket kurulayın.
3. IHC Set-up
- Çift lekeleri ve slaytların giriş numaraları için Dako programı seçin. TBST ve sitrat tampon, antikorlar, ve diğer Reag hazırlamakbelirtilen hacimleri (Tablo 1) 'e göre Ent. Reaktif tepsisi ve slaytlar yükleyin. Temiz ve atık hatları Dönme üretici tavsiyelerine göre programlanır.
- Elle bu testlerin yapılması halinde, tahmini hacimleri hazırlamak. Herhangi bir adım dışarı kurutma slaytlar önlemek için nemlendirilmiş bir odasında slaytlar inkübe edin. Autostainer için kullanıldığında her reaktifler için aynı işlemi uygulayın.
4. IHC Deparaffinization ve Antigen Alma
- 5 dakika ksilen slaytlar koyun. Kez tekrarlayın. Bu aşırı arka plan ve zayıf boyanma neden olacak gibi gösterene kadar slaytlar sonraki herhangi bir noktada kurumasına izin vermeyin.
- 2 dakika süreyle% 100 etanol slaytlar aktarın. Kez tekrarlayın.
- 10 dakika boyunca metanol içinde taze hazırlanmış% 3 H 2 O 2 slaytların koydu.
- % 90 Etanol ve sonra Dip slaytlar 3 dakika boyunca% 90 Etanol yerleştirmek.
- Transfer slaytlar1 dakika boyunca% 70 Etanol.
- De-iyonize su kaydırağı durulayın.
- Onceden vapur ve 5 dakika buharlı sitrat tamponu.
- 30 dakika buharlı ve buhar tampon sitrat için slayt ekleyin.
- Derhal su kaydırağı aktarmak ve oda sıcaklığında (~ 20 dakika) için serin çıkana kadar basılı tutun.
- Dizisi (Şekil 1) leke göre Dako Autostainer raflara slaytlar aktarın ve ikili boyama programı çalıştırın. Autostainer programın temel aşamalar elle çalıştırılır çoğaltmak böylece listelenmiştir.
5.. İlk Primer Antikorlar (Ki-67, CD3, Pankreatik Polipeptid)
- 15 dakika boyunca Sniper çözeltisi ile slaytlar bloke eder. TBST ile iki kez yıkayın.
- 30 dakika için primer antikor slaytlar inkübe. TBST ile iki kez yıkayın.
- 30 m için Mach2 keçi anti-fare (Ki-67) ya da anti-tavşan (CD3, pankreatik polipeptid) turbu peroksidaz (HRP) polimer ile inkübeinutes. TBST ile iki kez yıkayın.
- 4 dakika slaytların 3,3-diaminobenzidin tetrahydrochloride (DAB) uygulayın. Su ile iki kez yıkayın.
- Pankreatik polipeptid ile inkübe Slaytlar eşzamanlı olarak tahlil edilen Dako üzerinde tutulur ve geriye kalan slaytlar Primer antikor ikinci küme ile inkübe edilir ise tüm sonraki adım için kullanılan TBST. Alternatif olarak, manuel deneyleri için, bölüm 6 geçin.
6. İkinci Primer Antikorlar (İnsülin, Glukagon)
- 20 dakika Deeb slaytlar inkübe edin. TBST ile iki kez yıkayın.
- 20 dakika TBST (insülin) veya TBST içinde Sniper (glukagon)% 20 avidin engelleyici% 10 normal keçi serumu ile Blok. TBST ile iki kez yıkayın.
- 15 dakika için insülin veya glukagon Primer antikor ile inkübe edilir. TBST ile iki kez yıkayın.
- İnsülin: 30 dakika 1:300 titrede biotinlenmiş goat anti-kobay olarak inkübe slaytlar. TBST ile iki kez yıkayın. Standart ve ile inkübe30 dakika boyunca ctor ABC-AP reaktifi. TBST ile iki kez yıkayın.
- Glukagon: 30 dakika boyunca keçi anti-fare alkalin fosfataz (AP) polimer takiben 30 dakika süreyle inkübe sırasında tampon içinde kayar. TBST ile iki kez yıkayın.
- Slaytlar konjugatları inkübe edilir ise, oda sıcaklığına kadar ısınmaya LPR tamponu. Dako reaktif rafa kullanımı ve yer öncesi acil 3 mL tampon başına sıvı kalıcı kırmızı 1 damla (LPR) ekleyin. 4 dakika LPC slaytlar inkübe edin. Su ile iki kez yıkayın.
- 1 dakika hematoksilen slaytlar inkübe edin. Su ile iki kere durulanır.
- 1 dakika TBS pH 7.6 slaytlar inkübe edin. Su ile iki kere durulanır.
- DAKO Autostainer slaytları Unload.
- Hemen pankreatik polipeptid için boyandı slaytları kurutmak. Tüm çift boyalı kesitler için, en az 1 saat süreyle kuru sonra kurutmak.
7. Kurutma
- Yeri 1 dakika boyunca% 80 etanol içinde kayar.
- % 95 etanol içinde slaytlar eğimlidir.
- 30 saniye boyunca% 95 etanol slaytlar tutun.
- % 100 etanol slaytlar aktarın ve 1 dakika tutun. Tekrarlayın.
- Ksilen Dip slaytlar.
- 1 dakika ksilen slaytlar tutun. Tekrarlayın.
- Hemen cytoseal kullanarak slaytlara lamelleri monte edin.
8. Slayt Etiketleme
- Organ ve blok numarası, leke ve tarih ve yazdırma dahil durumda tanımlama bilgilerini girin. Seri numarası bölümüne her bloğun ilk slayt lekeler için isteğe bağlıdır. Sonraki seviyeleri numaralandırma ile gösterilir.
- Slaytlarda etiketler yerleştirin.
9. Slayt Tarama
- Tarayıcı tepsiye lekeli slaytlar yerleştirin ve enstrümantasyon göre tarayın.
- Donör ve doku tipi (pankreas baş, gövde, kuyruk, dalak) tarafından slaytlar düzenleyin.
- -20 ° C'de, oda sıcaklığında ve kalan boyanmamış slaytlar azından Arşiv boyalı kesitler kullanılmıştır kadar.
10. Hukntative Sonuçlar
Bu boyama işlemleri parafin ve taze donmuş blok temel karakterizasyonu sağlamak için Diyabet (nPOD) ile Pankreas Organ bağış için JDRF Ağı için geliştirilmiştir. Her verici bir temel karakterizasyon sahip 2 adet pankreas bölgeden blokları (baş, gövde ve kuyruk) ve dalak (Şekil 1, ayrıca vaka başvuru formu, Ek 1), leke oluşur yapıldı. H & E boyama boyunca kullanılan klinik dereceli çözümleri ile klinik bir tesis için de programlanmış bir Autostainer kullanılarak yapılır. Ek bağış bloklar kesitli olduğundan, her doku morfolojisini göstermek için H & E için alınan bir slayt vardır. Bloklar tekrar kesitli olduğunda, araştırmacılar dağıtım gibi, derin düzeyleri de hem de her düzeyde seri kesitler numaralandırma olarak tüm bloğun doku morfolojisi belgelemek temsilcisi H & E slaytlar için alınan slaytlar olacaktır. Vitray slaytlar etiketlidurumda, tanımlama, pankreas bölge, blok numarası, leke ve tarih (Şekil 2) ve çevrimiçi patoloji bilgi yönetim sistemi taranır. Bir kontrol donörden temsili görüntü Bu prosedür izlenerek beklenen sonuçlar göstermek için düşük ve yüksek büyütmelerde hem de Şekil 3 'de gösterilmiştir. Tahlil elle yapıldı ve hematoksilen counterstain azaltılmış lekelenme yoğunluğunu göstermektedir ile pankreatik polipeptid (D, H) ile slayt lekeli farklı bir günde ölçüldü. Primer antikor yoğunluğu boyama farklılıklar veya testler arasında counterstain özellikle bireysel renk düzeltme aynı hücre alanları veya sayıları elde etmek için gerekli olan görüntü analizi kullanılarak aksi slaytlar halinde kaçınılmalıdır.
Her laboratuvar sürü-için-pek çok varyasyon ve diğer reaktifler ve koşulları boyanma yoğunluğu ve özgüllük etkileyebilir olarak antikor konsantrasyonları optimize bekleyebilirsiniz. Yeni rea edinimi ilebeyler, boyama işlemleri eski reaktifleri gibi leke yoğunluğu aynı derecede ulaşmak için bilinen pozitif ve negatif kontrol örnekleri ile doğrulanır. NPOD patolojisi optimize çekirdekte Ek antikorlar bir referans kaynağı olarak Tablo 2'de verilmektedir ve konfokal mikroskopi için imünoflüoresan deneylerinde multilabeling için kullanılmıştır.
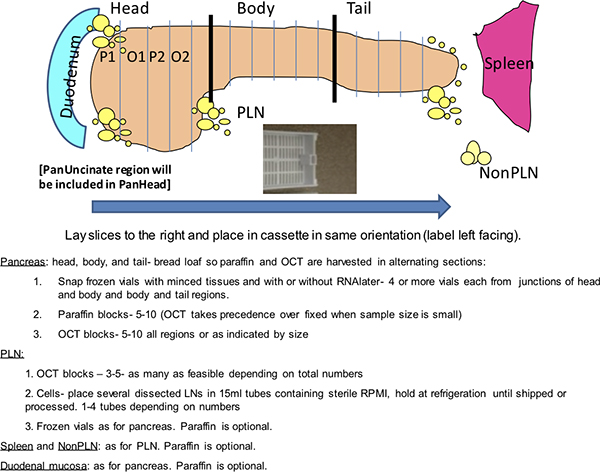
Şekil 1.. Dako boyama ızgara. Bu şematik bir Dako Autostainer üzerinde yapılan bir nPOD Donör pankreasın bir rutin analizler gösteriyor. NPOD donörler 4 haneli bir kimlik numarası ile kodlanır. İki slayt tepsiler leke tarafından düzenlenen slaytlar gösterilir. Alternatif slayt yapılandırmaları donör slaytların numaraları bağlı olarak beklenmektedir. Pozitif kontroller iki çift lekeleri ve Ki-67 ve CD3 için donör dalak için bilinen bir pozitif verici dahil edilmesi yer alıyor. Negatif kontroller iki yönlüdür ve iki SLI dahildes insülin ve glukagon için donör dalak primer antikorlar ve iki slaytların ana türlerden immünglobulin (Ig) ile inkübe bir donör pankreas blok.
Şekil 2. Dijital tarama yapılmadan önce Temsilcisi çift lekeli slayt. Tipik bitmiş slayt slayt etiketleme parametreleri ve doku yerleştirme ile gösterilir.
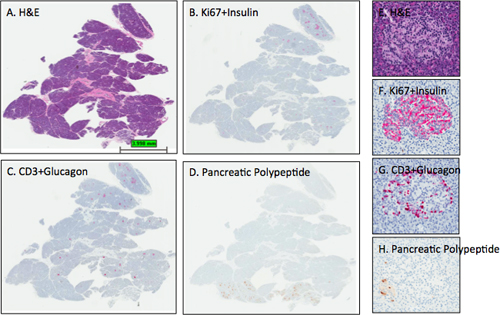
Şekil 3. Temsilcisi H & E ve pankreas bölümlerde IHC lekeler. Yetişkin bir dişi organ donör (6096-04 PanHead) ve pankreas Kesitler ve gibi, protokolü açıklanan yapılan dijital taramaları idi. Görüntüler tüm bölümü (AD) ve bir adacık (EH) den ImageScope görüntüleme programı kullanılarak elde edilmiştir. Insülin, glukagon, ve pankreatik polipeptid için tahmin adacık leke yoğunlukları olanBu pankreas kafa bloğu bütün adacıkları esas pankreatik polipeptit-pozitif hücreler içeren olarak unsinat bölge veya ventral pankreas lob küçük bir kısmını içerdiğini D bölümü çizer gibi bölümler BD gözlenmiştir. Hematoksilen B ve C şiddetlerde optimal counterstain iken paneli D hematoksilen counterstain çok açık olduğunu unutmayın. EH paneller β-hücreleri ve α-hücrelerinin beklenen dağılımına sahip dorsal lob bir adacık göstermektedir. Birkaç pankreatik polipeptid hücreleri adacık (H) sol alt kısmı bulunmaktadır. A, E-H izleme ve değerlendirme; B, F-Ki67 + İnsülin, C, G-CD3 + Glukagon D, H-Pankreatik polipeptid. AD, 0.2x, EH-12.8x.
Tartışmalar
Zamanla slaytlar sayıda genelinde bilgisayar tabanlı algoritmaları kullanarak özellikle IHC prosedürlerin standartlaştırılması, görüntü analizi için önemlidir. Bu raporda açıklanan İHK boyama işlemi 8 saatlik bir iş günü içinde bir Autostainer kullanarak belirli bir donörün numunelerin toplu analizi sağlayacak ve bir önceki raporda 5 değiştirilir. Her lekeli slayt Sayısallaştırılmış Tüm slayt görüntüleri web tabanlı online patoloji sistemi üzerinden nPOD-bağlı müfett...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Yazarlar, donörlerin aileleri ve uzman yardımı için bu araştırma ve Emily Montgomery, Robert Pietras, Ann Fu, Mitali Agarwal ve Roshan Agarwal yer Organ İhale Organizasyonlar teşekkür ederim. Bu çalışma Diyabet ile Pankreas Organ Bağış için Ağ destek Juvenil Diyabet Araştırma Vakfı (MC-T.) tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar |
| % 30'luk hidrojen peroksit (H2O 2) | FisherScientific | H325-500 | Endojen peroksidaz engelleme |
| ABC-Alkalen Fosfataz (AP) | Vektör | AK-5000 | AP konjugat |
| Antikor Dilüent | Invitrogen | 003218 | Primer antikor |
| Avidin bloker | Vektör | SP-2001 | Endojen biotin Blok |
| Tinile Keçi anti-kobay | Vektör | BA-7000 | Sekonder antikor |
| Reaktif mavileştirme | FisherScientific | 7301 | Leica autostainer |
| Sitrat tampon, pH 6.0 | BioGenex | HK086-9K | Antijen alma |
| Clarifier 1 | FisherScientific | 7401 | Leica Autostainer |
| Cytoseal XYL | FisherScientific | 8312-4 | Coverslip mountant |
| DAB | Vektör | SK-4100 | HRP kromojen |
| Deeb | DAKO | S2003 | Endojen AP reaktif engelleme |
| Alkollü Eosin Y | FisherScientific | 71204 | Leica Autostainer |
| Ethanols-100,% 95,% 90,% 70% | FisherScientific | Çeşitli | Deparaffinization ve coverslipping |
| Hematoksilen | DAKO | S3301 | Dako Autostainer |
| Hematoksilen 7211 | FisherScientific | 7211 | Leica Autostainer |
| IgG (primer antikorlar için tüm ana tür) | Çeşitli | Çeşitli | Primerleri için negatif kontroller |
| Sıvı Daimi Kırmızı (LPR) | DAKO | K0640 | AP kromojen |
| Mach2 AP | Biocare Tıp | MALP521L | Keçi anti-fare AP konjugat |
| Mach2 HRP | Biocare Tıp | MHRP520L | Keçi anti-Fare HRP konjugatı |
| Mach2 HRP | Biocare Tıp | RHRP520L | Keçi anti-Fare HRP konjugatı |
| Metanol | FisherScientific | Çeşitli | H 2 O 2 seyreltici |
| Normal keçi serumu | Vektör | S-1000 | IHC engelleme reaktif |
| Keskin Nişancı | Biocare Tıp | BS966M | IHC engelleme reaktif |
| TBST 20X | ThermoScientific | TA-999-TT | IHC tampon |
| Triology 20x | Hücre Marque | 920P-06 | Antijen Alma |
| Ksilen | FisherScientific | Çeşitli | Deparaffinization ve coverslipping |
Tablo 1. Özel reaktifler.
| Primer antikor | Ana türler | Satıcı | Cat. # | Yorum ve Antigen Alma |
| Parafin | ||||
| Amilaz | Fare | Santa Cruz | SC-46657 | Sitrat |
| Amilin | Fare | Serotec | MCA11267 | Sitrat |
| Karbonik anhidraz 19.9 | Fare | Abcam | ab15146 | |
| Kaspaz-3, parçalanabilen | Tavşan | Hücre Sinyali | 9961 | Sitrat veya Trilogy |
| CD20 | Fare | DAKO | M0755 | Sitrat veya Trilogy |
| CD3 | Tavşan | DAKO | A0452 | Sitrat |
| CD34 | Fare | Hücre Sinyali | 3569 | Sitrat |
| CD4 | Fare | DAKO | M7310 | Sitrat |
| CD45 | Fare | DAKO | M0754 | Sitrat |
| CD68 | Fare | DAKO | M0876 | Sitrat |
| CD8 | Fare | DAKO | M7103 | Sitrat |
| Bir kromogranin | Tavşan | DAKO | A0430 | Sitrat |
| CK17 | Fare | DAKO | M7046 | Sitrat |
| CK19 | Fare | DAKO | M0772 | Sitrat |
| CK7 | Fare | DAKO | M7018 | Sitrat |
| C-peptid | Tavşan | Hücre Sinyali | 4593 | Sitrat |
| Foxp3 | Sıçan | e Bioscience | 14-4776-80 | Sitrat |
| Ghrelin | Keçi | Santa Cruz | SC-10386 | |
| Ghrelin | Tavşan | Abcam | ab85104 | |
| Glukagon | Tavşan | DAKO | A0565 | |
| Glukagon | Fare | Abcam | ab10988 | Sitrat |
| Glukagon | Guinea Pig | Bachem | T-5037 | Sitrat |
| Glut-1 | Fare | Abcam | ab40084 | Trilogy |
| Glut-2 | Tavşan | Santa Cruz | SC-9117 | Insan adacıklar olarak ifade değil |
| Ensülin | Guinea Pig | DAKO | A0564 | |
| Ki-67 | Fare | DAKO | M7240 | Sitrat |
| Mafa | Tavşan | Novus Biyolojik | NB400-137A | Trilogy |
| Pankreatik polipeptid | Tavşan | Invitrogen | 18-0043 | Sitrat |
| Pdx-1 | Guinea Pig | Abcam | ab47308 | Sitrat veya Trilogy |
| Proinsülin | Fare | Novocastra | NCL-proin-1G4 | |
| Proinsülin | Fare | Gelişim Çalışmaları Hibridoma Bankası | GS-9A8 | Sitrat |
| Secretagogin | Tavşan | Sigma | HPA 006.641 | Sitrat |
| Düz kas aktini | Tavşan | Abcam | ab5694 | |
| Somatostatin | Tavşan | DAKO | A0566 | |
| Sinaptofizin | Fare | DAKO | M0776 | Sitrat |
| Dondurulmuş Taze | Ana türler | Satıcı | Cat. # | Yorumlar |
| CD11b | Sıçan | Abcam | ab6332 | % 4 PF ile Fix |
| CD11c | Tavşan | Serotec | AHP1226 | |
| CD25 | Fare | Novus Biyolojik | NB 600-564 | Parafin bölümler için gece inkübasyon kullanın |
| CD94 | Fare | Abcam | ab61874 | Aseton ile Fix |
| GAD65 | Fare | Santa Cruz | SC-130569 | % 4 PF ile Fix |
| HLA-ABC | Fare | DAKO | M0736 | Aseton veya% 4 PF ile Fix |
Tablo 2. İlköğretim antikorlar.
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar |
| Aperio Scanscope CS | Aperio | Dijital slayt tarayıcı | |
| DAKO Autostainer Plus | DAKO | IHC lekeleri | |
| Etiket Matrix yazdırma yazılımı | BioCarta | LM7UP57 | Slayt etiket yazılımı |
| Leica XL Autostainer | Leica | H & E lekeleri | |
| Premium Coverglass | FisherScientific | 12-548-5J | Coverslip |
| Spektrum Bilgi Yöneticisi | Aperio | Tarayıcı yazılımı | |
| SuperFrost Plus slaytlar | FisherScientific | 12-550-15 | Pozitif yüklü slaytlar |
| Sebze vapur | Black & Decker | Çeşitli | Antijen alma |
| Zebra TLP 3742 | CDWG | TLP3742 | Slayt etiket yazıcısı |
Tablo 3. Özel malzeme ve teçhizat.
Referanslar
- In't Veld, P., Marichal, M. Microscopic anatomy of the human islet of Langerhans. Adv. Exp. Med. Biol. 654, 1-19 (2010).
- Matveyenko, A. V., Butler, P. C. Relationship between beta-cell mass and diabetes onset. Diabetes Obes. Metab. 10, 23-31 (2008).
- Saisho, Y. Pancreas volumes in humans from birth to age one hundred taking into account sex, obesity, and presence of type-2 diabetes. Clin. Anat. 20, 933-942 (2007).
- Hruban, R. H. Pancreatic intraepithelial neoplasia: a new nomenclature and classification system for pancreatic duct lesions. Am. J. Surg. Pathol. 25, 579-586 (2001).
- Campbell-Thompson, M. Pancreatic adenocarcinoma patients with localised chronic severe pancreatitis show an increased number of single beta cells, without alterations in fractional insulin area. Diabetologia. 52, 262-270 (2009).
- Meier, J. Beta-cell replication is the primary mechanism subserving the postnatal expansion of beta-cell mass in humans. Diabetes. 57, 1584-1594 (2008).
- Rowe, P. A., Campbell-Thompson, M. L., Schatz, D. A., Atkinson, M. A. The pancreas in human type 1 diabetes. Semin. Immunopathol. 33, 29-43 (2011).
- Veld, I. n. '. t., P, . Insulitis in human type 1 diabetes: The quest for an elusive lesion. Islets. 3, 131-138 (2011).
- van Belle, T. L., Coppieters, K. T., von Herrath, M. G. Type 1 diabetes: etiology, immunology, and therapeutic strategies. Physiol Rev. 91, 79-118 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır