É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Protocolos de coloração de ilhotas pancreáticas humanas
Neste Artigo
Resumo
Este vídeo demonstra os procedimentos para caracterização de ilhotas pancreáticas humanas com hematoxilina e eosina (H & E) e imuno-histoquímica (IHQ). Seções pancreáticas de cabeça, corpo e regiões da cauda estão manchadas por tanto H & E e IHC para determinar a composição endócrino ilhéu (insulina, glucagon e polipeptídeo pancreático), a replicação celular (Ki67), e infiltrado inflamatório (H & E, CD3). A região uncinado está localizado usando IHC para polipeptídeo pancreático.
Resumo
As estimativas de área de ilhotas e os números e composição endócrino célula no pâncreas humano adulto variar de várias centenas de milhar a gamas de massa vários milhões e beta de 500 a 1500 mg 1-3. Com essa heterogeneidade conhecido, um tratamento padrão e procedimento de coloração foi desenvolvido para que as regiões pancreáticas foram claramente definidos e ilhotas caracterizados por histopatologia rigorosa e exames imunolocalização.
Procedimentos padronizados para o processamento de pâncreas humano recuperado de doadores de órgãos são descritos na parte 1 desta série. O pâncreas é processado em 3 regiões principais (cabeça, corpo, cauda), seguido de cortes transversais. Secções transversais da cabeça do pâncreas são ainda divididas, tal como indicado com base no tamanho, e numerados em ordem alfabética para denotar subsecções. Esta normalização permite uma análise completa transversal em corte da região da cabeça, incluindo a região que contém uncinado ilhotas compostosprincipalmente de células pancreáticas polipéptido para a região da cauda.
O presente relatório compreende parte 2 desta série e descreve os procedimentos utilizados para cortes seriados e caracterização histopatológica das seções pancreáticas de parafina com ênfase em células endócrinas das ilhotas, replicação e de células T infiltrados. Patologia de secções pancreáticas destina-se a caracterizar tanto exócrino, ductular, e componentes endócrinos. O compartimento exócrino é avaliada quanto à presença de pancreatite (activo ou crónica), atrofia, fibrose, e gordura, bem como o sistema de condutas, particularmente em relação à presença de neoplasia pancreática intraductal 4. Ilhotas são avaliadas para a morfologia, tamanho e densidade, células endócrinas, inflamação, fibrose, amilóide, bem como a presença de células replicantes ou apoptótico utilizando H e E e as manchas de IHC.
O componente final descrito na parte 2 é o fornecimento da lâmina coradas como digitalizados imagens de diapositivos inteiras. Os slides digitalizados são organizados por caso e região do pâncreas em um banco de dados on-line patologia criar um biobanco virtual. O acesso a esta coleção on-line está actualmente previsto para mais de 200 médicos e cientistas envolvidos na pesquisa do diabetes tipo 1. O banco de dados on-line fornece um meio para a rápida e completa partilha de dados e para os investigadores para selecionar blocos de parafina ou congelados cortes seriados.
Protocolo
1. Microtomia para as secções não coradas
- Configure o banho de água e micrótomo de parafina para microtomia como padrão. Use slides carregados positivamente e pré-label com o número de caso, região do pâncreas (amostra) eo número de slide. Colocar o bloco de parafina no mandril micrótomo com o rótulo da cassete no lado esquerdo.
- Siga os procedimentos normais, microtomia secção em bloco até que o tecido é uniformemente encontrada. Produzir uma fita de cortes seriados (4 mm de espessura, 3-6 dependendo do número de manchas iniciais necessários (ver Formulário Caso Submission, Apêndice 1)). Seções separadas na fita, pegue cada um em ordem, e local em lâminas com ordem numérica com o lápis. Denote se uma seção não é utilizada pela numeração seções na ordem exata. Manter a mesma orientação sobre a lâmina como encontrado no cassete com a etiqueta lâmina orientada para a esquerda. Secar durante a noite à temperatura ambiente, em seguida, prosseguir com a coloração ou de distribuição para os investigadores.
- Ressuperfície eal de bloco de parafina com fina camada de parafina para preservar o tecido e arquivar à temperatura ambiente ou -20 ° C.
- Para microtomia subseqüente, manter a numeração de secções seriadas a cada nível acima. Obter 1 slide adicional e mancha por slide H & E para cada nível mM ~ 100 dentro de cada bloco.
2. H & E Coloração
- Colocar a lâmina de série primeiro seccionados a partir de cada bloco em um porta-lâminas em seguida, na primeira bandeja na Autostainer.
- Selecione o programa H & E padrão de manchas e proceder como de costume.
- Quando terminar coloração, retire os slides de Autostainer e lugar na capa de lamínulas.
- Lamela utilizando a técnica padrão. Seque bem e rótulo com uma etiqueta impressa (ver secção 12).
3. IHC Set-up
- Selecione o programa Dako para manchas de casal e os números de entrada de slides. Preparar TBST e citrato de buffers, anticorpos, e Reag outroentos de acordo com volumes indicados (Tabela 1). Carregar o tabuleiro de reagente e as lâminas. A rotação do limpa e linhas de resíduos são programados de acordo com as recomendações do fabricante.
- Se a realização destes ensaios manualmente, preparar volumes estimados. Incubar as lâminas em câmara úmida para evitar lâminas secarem em qualquer etapa. Siga o mesmo procedimento para cada reagentes como quando usado para o Autostainer.
4. IHC desparafinização e recuperação de antígenos
- Colocar as lâminas em xileno durante 5 minutos. Repetir uma vez. Não permita que as lâminas para secar a qualquer momento subseqüente, até indicado como isso irá resultar em fundo excessivo e coloração pobres.
- Transferir as lâminas etanol a 100% durante 2 minutos. Repetir uma vez.
- Colocar as lâminas em recém-preparada de 3% de H2O 2 em metanol durante 10 minutos.
- Dip lâminas em etanol a 90% e, em seguida, colocar em etanol a 90% durante 3 minutos.
- Transferência desliza paraEtanol a 70% durante 1 minuto.
- Lavar as lâminas em água desionizada.
- Pré-aqueça o vapor e tampão de citrato em vapor durante 5 minutos.
- Adicionar as lâminas tampão citrato no vapor e de vapor durante 30 minutos.
- Transferir imediatamente as lâminas de água e segure até que desliza arrefecer à temperatura ambiente (~ 20 minutos).
- Transferir as lâminas para as prateleiras Dako Autostainer de acordo com mancha seqüência (Figura 1) e executar o programa de dupla marcação. As principais etapas do programa Autostainer são listados para que corridas manuais pode duplicar.
5. Primeiros anticorpos primários (Ki-67, CD3, pâncreas polipéptido)
- Bloquear as lâminas com solução Sniper durante 15 minutos. Lavar duas vezes com TBST.
- Incubar as lâminas em anticorpo primário durante 30 minutos. Lavar duas vezes com TBST.
- Incubar com Mach2 de cabra anti-rato (Ki-67) ou anti-coelho (CD3, polipéptido pancreático) de rábano (HRP) polímero para 30 minutos. Lavar duas vezes com TBST.
- Aplicar 3,3 diaminobenzidina-tetrahidrocloreto (DAB) a slides durante 4 minutos. Lavar duas vezes com água.
- As lâminas incubadas com polipéptido pancreático são mantidas no Dako quando está a ser ensaiada concorrentemente e TBST utilizado para todos os passos subsequentes ao passo que os restantes lâminas são incubadas com o segundo conjunto de anticorpos primários. Alternativamente, para ensaios manuais, avance para a secção 6.
6. Segundo Anticorpos Primários (insulina, glucagon)
- Incubar as lâminas em Deeb por 20 minutos. Lavar duas vezes com TBST.
- Bloco com soro de cabra normal a 10% em bloqueador avidina de 20% em TBST (insulina) ou Sniper (glucagon) em TBST durante 20 minutos. Lavar duas vezes com TBST.
- Incubar com insulina ou anticorpo primário glucagon durante 15 minutos. Lavar duas vezes com TBST.
- Insulina: incubar em biotinilado cabra, porco anti-guiné na diluição 1:300 por 30 minutos. Lavar duas vezes com TBST. Incubar com ve padrãoctor reagente ABC-AP por 30 minutos. Lavar duas vezes com TBST.
- O glucagon: incubar em tampão durante durante 30 minutos, seguido por anticorpo de cabra anti-rato de fosfatase alcalina (AP) de polímero durante 30 minutos. Lavar duas vezes com TBST.
- Enquanto as lâminas são incubadas em conjugados, aquecer o tampão de LPR à temperatura ambiente. Adicione 1 gota de líquido vermelho permanente (LPR) por 3 mL de tampão antes do uso imediato e coloque no Dako rack de reagente. Incubar as lâminas em LPC por 4 minutos. Lavar duas vezes com água.
- Incubar as lâminas em hematoxilina por 1 minuto. Lavar duas vezes com água.
- Incubar as lâminas em TBS pH 7,6 por 1 minuto. Lavar duas vezes com água.
- Descarregar slides da DAKO Autostainer.
- Imediatamente desidratar lâminas coradas para polipeptídeo pancreático. Para todas as lâminas coradas duplas, seco durante pelo menos 1 hora, em seguida, desidratar.
7. Desidratação
- Desliza lugar em etanol a 80% durante 1 minuto.
- Mergulhar as lâminas em etanol a 95%.
- Segurar as lâminas em etanol a 95% durante 30 segundos.
- Transferir as lâminas em etanol 100% e segure 1 minuto. Repita.
- Dip slides em xileno.
- Mantenha as lâminas em xilol durante 1 minuto. Repita.
- Imediatamente montar lamínulas em lâminas com cytoseal.
8. Rotulagem de slides
- Digite as informações de identificação do caso incluindo órgão e número do bloco, mancha, data e impressão. Número da seção Serial é opcional para as manchas de slides primeiros de cada bloco. Os níveis subseqüentes são indicados por numeração.
- Coloque etiquetas em slides.
9. Digitalização de slides
- Coloque lâminas coradas na bandeja do scanner e digitalizar de acordo com a instrumentação.
- Organize os slides por doador e tecido tipo (cabeça do pâncreas, o corpo, cauda, baço).
- Lâminas coradas Arquivo à temperatura ambiente e quaisquer lâminas restantes não coradas a -20 ° C até ser utilizado.
10. RepreseResultados ntative
Estes procedimentos de coloração foram desenvolvidas para a Rede JDRF para os doadores de órgãos do pâncreas com Diabetes (nPOD) apresentar a caracterização de base de parafina e frescos blocos congelados. Cada doador tem uma caracterização inicial realizada composta de manchar a 2 quarteirões de cada região do pâncreas (cabeça, corpo e cauda) e do baço (Figura 1, ver também ficha de inscrição caso, Anexo 1). A coloração H & E é conduzida usando um Autostainer programado como para uma instalação clínica com clínico-grade soluções utilizadas por toda parte. Como blocos adicionais dos doadores são seccionadas, cada um tem um slide tomadas para a H & E para mostrar morfologia do tecido. Quando os blocos são seccionados de novo, como para distribuição aos investigadores, os níveis mais profundos também terá lâminas colhidas para representante H e E lâminas para documentar a morfologia todo o bloco de tecido, bem como a numeração secções seriadas em cada nível. Lâminas coradas são rotulados comidentificação caso, a região do pâncreas, número do bloco, mancha e data (Figura 2) e digitalizado para o sistema de gestão de informação em linha patologia. Imagens representativas de um dador de controlo são apresentados na Figura 3 em ambas as ampliações de baixa e alta para mostrar os resultados esperados seguindo este procedimento. A lâmina com manchado polipéptido pancreático (D, H) foi ensaiada em um dia diferente com o ensaio realizado manualmente e mostra reduzida intensidade de coloração do contracorante hematoxilina. As diferenças na intensidade de coloração de anticorpos primários ou contracoloração entre os ensaios é para ser evitado particularmente se usando análise de imagem de outro modo desliza com requerer correcção de cor individual para atingir as áreas mesma célula ou contagens.
Cada laboratório deve esperar para otimizar as concentrações de anticorpos como o lote para lote variação e outros reagentes e condições podem afetar a intensidade da coloração e especificidade. Com a aquisição de novas reagents, procedimentos de coloração são validados com conhecidos amostras de controlo positivo e negativo para atingir o mesmo grau de intensidade de manchas como com os reagentes anteriores. Anticorpos adicionais optimizados no núcleo patologia nPOD são fornecidos na Tabela 2, tal como uma fonte de referência e têm sido utilizados para multilabeling imunofluorescência para microscopia confocal.
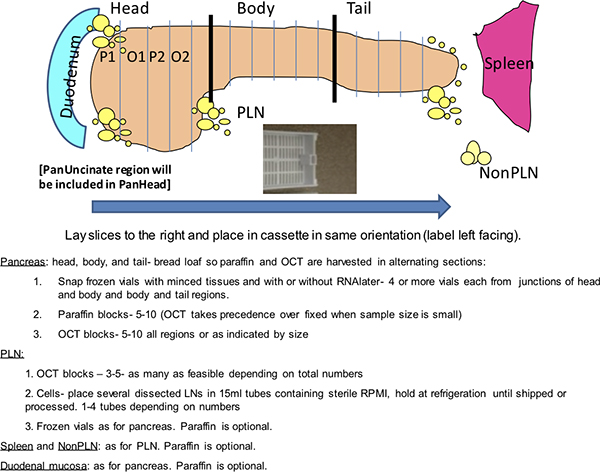
Figura 1. Dako grade de coloração. Este esquemática descreve uma análise de rotina a partir de um dador pâncreas nPOD realizada num Autostainer Dako. Os doadores de nPOD são codificados com um número de identificação de 4 dígitos. Duas bandejas de slides são apresentados com slides organizados pela mancha. Configurações de deslizamento alternados são esperados dependendo do número de lâminas de doadores. Os controlos positivos incluem inclusão de um dador positivo conhecido para os dois manchas duplas e baço doador para o Ki-67 e CD3. Os controlos negativos são duplas e incluem duas slides de um bloco de pâncreas doador incubadas com imunoglobulina (Ig) a partir das espécies hospedeiras dos anticorpos primários e duas lâminas de baço dador para a insulina e glucagon.
Figura 2. Lâmina dupla representante manchado. Um slide acabado típico é mostrado com os parâmetros de slides de rotulagem e colocação de tecido antes de escaneamento digital é realizada.
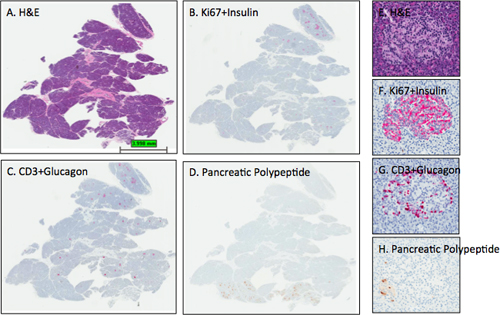
Figura 3. Representante H & E e manchas IHC em seções pancreáticas. Seções do pâncreas de um doador de órgãos da fêmea adulta (6096-04 Panhead) foram coradas e scans digitais realizados conforme descrito no protocolo. As imagens foram obtidas usando o programa ImageScope visualização de toda a secção (AD) e de um ilhéu (EH). As intensidades das ilhotas esperados mancha para a insulina, glucagon e polipéptido pancreático sãoobservado para as secções BD como delineia secção D que este bloco cabeça do pâncreas contém uma pequena porção da região uncinado ou lóbulo ventral do pâncreas como todos os ilhéus pancreáticos contêm principalmente polipéptido células positivas. Note-se que a contracoloração de hematoxilina no painel D é muito leve, enquanto a contracoloração de hematoxilina intensidades em B e C são ideais. Painéis EH mostram um ilhéu do lóbulo dorsal com a distribuição esperada de células beta e α-células. A poucas células pancreáticas polipeptídicas são encontrados na porção inferior esquerdo da ilhota (H). A, E-H &E; B, F-Ki67 insulina +; C, G-CD3 + glucagon; D, H pâncreas-polipéptido. AD, 0.2x, EH-12.8x.
Discussão
Padronização da IHC procedimentos é crítica para a análise de imagem, especialmente quando se utiliza algoritmos baseados em computador através de um grande número de lâminas ao longo do tempo. O processo de coloração IHQ descritos neste relatório permitirá a análise do lote de amostras de um doador dado, utilizando um Autostainer dentro de um dia de trabalho de 8 horas e são modificadas a partir de um relatório anterior 5. Digitalizadas imagens de slides inteiros de cada slide manchado disponi...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores agradecem as famílias dos doadores e as Organizações de Procura de Órgãos envolvidos na pesquisa e Montgomery Emily, Pietras Robert, Fu Ann, Agarwal Mitali, e Agarwal Roshan para a sua assistência especializada. Este trabalho foi financiado pela Juvenile Diabetes Research Foundation (MC-T.) em apoio da Rede de Doadores de Órgãos do pâncreas com Diabetes.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Peróxido de hidrogénio a 30% (H 2 O 2) | FisherScientific | H325-500 | A peroxidase endógena de bloqueio |
| ABC-fosfatase alcalina (AP) | Vetor | AK-5000 | AP conjugado |
| Diluente anticorpo | Invitrogen | 003218 | O anticorpo primário |
| Avidina bloqueador | Vetor | SP-2001 | Bloquear biotina endógena |
| Biotinilado de cabra anti-porco da guiné | Vetor | BA-7000 | Anticorpo secundário |
| Bluing Reagente | FisherScientific | 7301 | Leica autostainer |
| Tampão citrato, pH 6,0 | Biogenex | HK086-9K | Recuperação antigênica |
| Clarificador 1 | FisherScientific | 7401 | Leica Autostainer |
| Cytoseal XYL | FisherScientific | 8312-4 | Lamela de montagem |
| DAB | Vetor | SK-4100 | HRP cromógeno |
| Deeb | DAKO | S2003 | AP endógena bloqueando reagente |
| Eosina Y alcoólica | FisherScientific | 71204 | Leica Autostainer |
| Etanóis-100%, 95%, 90%, 70% | FisherScientific | Vário | Desparafinização e lamínulas |
| Hematoxilina | DAKO | S3301 | Dako Autostainer |
| Hematoxilina 7211 | FisherScientific | 7211 | Leica Autostainer |
| IgG (todas as espécies de hospedeiros para os anticorpos primários) | Vário | Vário | Os controlos negativos para primárias |
| Líquido vermelho permanente (LPR) | DAKO | K0640 | AP cromógeno |
| Mach2 AP | Biocare Medical | MALP521L | Cabra anti-rato conjugado AP |
| Mach2 HRP | Biocare Medical | MHRP520L | Cabra anti-ratinho HRP |
| Mach2 HRP | Biocare Medical | RHRP520L | Cabra anti-ratinho HRP |
| Metanol | FisherScientific | Vário | H 2 O 2 diluente |
| Soro de cabra normal | Vetor | S-1000 | IHC reagente bloqueador |
| Sniper | Biocare Medical | BS966M | IHC reagente bloqueador |
| TBST 20X | ThermoScientific | TA-999-TT | IHC tampão |
| Trilogia 20x | Marque celular | 920p-06 | Recuperação antigênica |
| Xileno | FisherScientific | Vário | Desparafinização e lamínulas |
Tabela 1. Reagentes específicos.
| O anticorpo primário | Espécies hospedeiras | Vendedor | Cat. # | Comentários e recuperação de antígenos |
| Parafina | ||||
| Amilase | Mouse | Santa Cruz | SC-46657 | Citrato |
| Amylin | Mouse | Serotec | MCA11267 | Citrato |
| A anidrase carbónica 19,9 | Mouse | Abcam | ab15146 | |
| Caspase-3, clivado | Coelho | Sinalização celular | 9961 | Citrato ou Trilogy |
| CD20 | Mouse | DAKO | M0755 | Citrato ou Trilogy |
| CD3 | Coelho | DAKO | A0452 | Citrato |
| CD34 | Mouse | Sinalização celular | 3569 | Citrato |
| CD4 | Mouse | DAKO | M7310 | Citrato |
| CD45 | Mouse | DAKO | M0754 | Citrato |
| CD68 | Mouse | DAKO | M0876 | Citrato |
| CD8 | Mouse | DAKO | M7103 | Citrato |
| Cromogranina A | Coelho | DAKO | A0430 | Citrato |
| CK17 | Mouse | DAKO | M7046 | Citrato |
| CK19 | Mouse | DAKO | M0772 | Citrato |
| CK7 | Mouse | DAKO | M7018 | Citrato |
| C-péptido | Coelho | Sinalização celular | 4593 | Citrato |
| Foxp3 | Rato | e Bioscience | 14-4776-80 | Citrato |
| A grelina | Cabra | Santa Cruz | SC-10386 | |
| A grelina | Coelho | Abcam | ab85104 | |
| Glucagon | Coelho | DAKO | A0565 | |
| Glucagon | Mouse | Abcam | ab10988 | Citrato |
| Glucagon | Cobaia | Bachem | T-5037 | Citrato |
| Glut-1 | Mouse | Abcam | ab40084 | Trilogia |
| Glut-2 | Coelho | Santa Cruz | SC-9117 | Não expressa em ilhotas humanas |
| Insulina | Cobaia | DAKO | A0564 | |
| Ki-67 | Mouse | DAKO | M7240 | Citrato |
| Mafa | Coelho | Novus Biológica | NB400-137A | Trilogia |
| Polipeptídeo pancreático | Coelho | Invitrogen | 18-0043 | Citrato |
| PDX-1 | Cobaia | Abcam | ab47308 | Citrato ou Trilogy |
| Proinsulina | Mouse | Novocastra | NCL-Proin-1G4 | |
| Proinsulina | Mouse | Desenvolvimento de Estudos Hybridoma Banco | GS-9A8 | Citrato |
| Secretagogin | Coelho | Sigma | HPA 006641 | Citrato |
| Actina de músculo liso | Coelho | Abcam | ab5694 | |
| Somatostatina | Coelho | DAKO | A0566 | |
| Sinaptofisina | Mouse | DAKO | M0776 | Citrato |
| Fresco Congelado | Espécies hospedeiras | Vendedor | Cat. # | Comentários |
| CD11b | Rato | Abcam | ab6332 | Fixe com PF 4% |
| CD11c | Coelho | Serotec | AHP1226 | |
| CD25 | Mouse | Novus Biológica | NB 600-564 | Use incubação durante a noite para parafina |
| CD94 | Mouse | Abcam | ab61874 | Fixar-se com acetona |
| GAD65 | Mouse | Santa Cruz | SC-130.569 | Fixe com PF 4% |
| HLA-ABC | Mouse | DAKO | M0736 | Fixar-se com acetona ou PF 4% |
Tabela 2. Anticorpos primários.
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Aperio Scanscope CS | Aperio | Scanner de slides Digital | |
| Além disso DAKO Autostainer | DAKO | Manchas IHC | |
| Etiqueta software de impressão Matrix | BioCarta | LM7UP57 | Software de etiqueta de slides |
| Leica XL Autostainer | Leica | H & E manchas | |
| Prêmio lamela | FisherScientific | 12-548-5J | Lamela |
| Information Manager Spectrum | Aperio | Software do scanner | |
| Além disso Superfrost desliza | FisherScientific | 12-550-15 | Lâminas carregadas positivamente |
| Vapor vegetal | Black e Decker | Vário | Recuperação antigênica |
| Zebra TLP 3742 | CDWG | TLP3742 | Impressora de etiquetas de slides |
Tabela 3. Suprimentos e equipamentos específicos.
Referências
- In't Veld, P., Marichal, M. Microscopic anatomy of the human islet of Langerhans. Adv. Exp. Med. Biol. 654, 1-19 (2010).
- Matveyenko, A. V., Butler, P. C. Relationship between beta-cell mass and diabetes onset. Diabetes Obes. Metab. 10, 23-31 (2008).
- Saisho, Y. Pancreas volumes in humans from birth to age one hundred taking into account sex, obesity, and presence of type-2 diabetes. Clin. Anat. 20, 933-942 (2007).
- Hruban, R. H. Pancreatic intraepithelial neoplasia: a new nomenclature and classification system for pancreatic duct lesions. Am. J. Surg. Pathol. 25, 579-586 (2001).
- Campbell-Thompson, M. Pancreatic adenocarcinoma patients with localised chronic severe pancreatitis show an increased number of single beta cells, without alterations in fractional insulin area. Diabetologia. 52, 262-270 (2009).
- Meier, J. Beta-cell replication is the primary mechanism subserving the postnatal expansion of beta-cell mass in humans. Diabetes. 57, 1584-1594 (2008).
- Rowe, P. A., Campbell-Thompson, M. L., Schatz, D. A., Atkinson, M. A. The pancreas in human type 1 diabetes. Semin. Immunopathol. 33, 29-43 (2011).
- Veld, I. n. '. t., P, . Insulitis in human type 1 diabetes: The quest for an elusive lesion. Islets. 3, 131-138 (2011).
- van Belle, T. L., Coppieters, K. T., von Herrath, M. G. Type 1 diabetes: etiology, immunology, and therapeutic strategies. Physiol Rev. 91, 79-118 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados