Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Färbeprotokollen for Human Pankreasinseln
In diesem Artikel
Zusammenfassung
Dieses Video zeigt Verfahren zur Charakterisierung von humanen Langerhans-Inseln mit Hämatoxylin und Eosin (H & E) und Immunhistochemie (IHC). Pankreas-Abschnitten von Kopf, Körper und Schwanz Regionen werden sowohl von H & E und IHC gefärbt, um Inselzellen endokrinen Zusammensetzung (Insulin, Glukagon und pankreatische Polypeptid), Zell-Replikation (Ki67) und entzündlichen Infiltraten (H & E, CD3) zu bestimmen. Die uncinatus Region lokalisiert ist mit IHC für pankreatische Polypeptid.
Zusammenfassung
Die Schätzungen der Insel Bereich und Zahlen und endokrine Zelle Zusammensetzung im erwachsenen menschlichen Bauchspeicheldrüse variieren von mehreren hunderttausend bis zu mehreren Millionen und Beta Masse reicht von 500 bis 1500 mg 1-3. Mit dieser bekannten Heterogenität wurde ein Standard-Verarbeitung und Färbeverfahren entwickelt, so dass der Bauchspeicheldrüse Regionen klar definiert waren und Inselchen gekennzeichnet mit rigorosen Histopathologie und Immunolokalisation Untersuchungen.
Standardisierte Verfahren für die Verarbeitung von menschlichen Bauchspeicheldrüse von Organspendern gewonnen werden, in Teil 1 dieser Serie beschrieben. Die Bauchspeicheldrüse ist in 3 Regionen (Kopf, Körper, Schwanz) von Querschnitten gefolgt verarbeitet. Querschnitte aus der Bauchspeicheldrüse Kopf weiter unterteilt sind, wie angegeben basierend auf Größe, alphabetisch und nummeriert, um Unterabschnitte bezeichnen. Diese Standardisierung ermöglicht einen kompletten Querschnitt Analyse der Kopfbereich einschließlich der uncinatus Region, die Inselchen enthältin erster Linie aus Pankreas-Polypeptid Zellen Schwanzbereich.
Der vorliegende Bericht umfasst Teil 2 dieser Serie und beschreibt die Verfahren für die serielle Schnitt-und histopathologischen Charakterisierung der Bauchspeicheldrüse Paraffinschnitten mit einem Schwerpunkt auf Inselchen endokrinen Zellen, Replikation und T-Zell-Infiltrate verwendet. Pathologie des Pankreas Sektionen soll sowohl exokrinen, ductularen und endokrinen Komponenten zu charakterisieren. Das exokrine Kammer wird auf das Vorhandensein von Pankreatitis (aktiv oder chronisch), Atrophie, Fibrose und Fett sowie der Leitung ausgewertet, insbesondere in Beziehung auf das Vorhandensein von Pankreas intraduktalen Neoplasie 4. Inseln sind für Morphologie, Größe und Dichte, endokrine Zellen, Entzündung, Fibrose, Amyloid, und die Anwesenheit von replizierenden oder apoptotischen Zellen mit H & E und IHC Flecken ausgewertet.
Die letzte Komponente in Teil 2 beschrieben ist die Bereitstellung der gefärbten Objektträgers als digitalisierte Bilder gesamte Folie. Die digitalisierten Dias werden von Fall und Bauchspeicheldrüse Region in einer Online-Datenbank Pathologie Erstellung eines virtuellen Biobank organisiert. Der Zugang zu dieser Online-Sammlung ist derzeit auf über 200 Kliniker und Wissenschaftler beim Typ 1 Diabetes Forschung beteiligt sind. Die Online-Datenbank stellt ein Mittel für eine rasche und vollständige gemeinsame Nutzung von Daten und für die Ermittler, um Blöcke für Paraffin oder gefrorenen Schnittserien wählen.
Protokoll
1. Mikrotomie für ungefärbte Schnitte
- Richten Sie Wasserbad und Mikrotom für Standard-Paraffin Mikrotomie. Verwenden Sie positiv geladene Objektträger und Pre-Etikett mit der Nummer, des Pankreas Region (Probe) und Foliennummer. Ort Paraffinblock im Mikrotom Spannfutter mit der Kassette Etikett auf der linken Seite.
- Folgen Sie den normalen Mikrotomie Verfahren, Abschnitt in den Block, bis Gewebe einheitlich auftritt. Produzieren Sie ein Band von Serienschnitten (4 um dick, 3-6 je nach Anzahl der erforderlichen anfänglichen Flecken (Vgl. Urteil Kontaktformular, Anhang 1)). Separate Abschnitte in der Band, nehmen Sie jeweils in Ordnung, und auf Objektträger mit um mit Bleistift nummeriert. Bezeichnen, wenn ein Abschnitt ungenutzt durch Nummerierung Abschnitte in genau dieser Reihenfolge. Pflegen Sie die gleiche Orientierung auf der Folie, wie in der Kassette mit dem Schlitten Label orientiert sich an der linken Seite gefunden. Trocknen über Nacht bei Raumtemperatur dann mit färbenden oder Verteilung der Ermittler gehen.
- Res.EAL Oberfläche des Paraffin-Block mit dünnen Schicht aus Paraffin, um Gewebe-und Archiv bei Raumtemperatur oder bei -20 ° C zu erhalten
- Für die anschließende Mikrotomie, pflegen Nummerierung für serielle werden auf jeder Ebene wie oben. Besorgen Sie ein zusätzliches Dia-und färben von H & E-Rutsche für jeden ~ 100 pM Ebene in jedem Block.
2. H & E Färbung
- Platzieren Sie die erste serielle geschnittene Folie aus jedem Block in einer Objektträgergestell dann in dem ersten Fach auf der automatischen Färbevorrichtung.
- Wählen Sie den Standard H & E Färbung Programm und wie gewohnt fortfahren.
- Wenn Sie fertig Färbung, entfernen Sie die Folien aus Autostainer und Ort in der Kapuze für Eindecken.
- Deckglas mit Standard-Technik. Gründlich abtrocknen und Etikett mit einem bedruckten Etikett (siehe Abschnitt 12).
3. IHC Set-up
- Wählen Sie den Dako-Programm für Doppel-Flecken und Eingabe von Zahlen von Dias. Planen TBST und Citrat-Puffer, Antikörper und andere REAGEltern nach vorgegebenen Volumina (Tabelle 1). Laden Sie das Reagenzträgers und Dias. Die Drehung des sauberen und Entsorgungsleitungen werden nach den Empfehlungen des Herstellers programmiert.
- Wenn die Durchführung dieser Tests manuell, bereiten geschätzten Volumina. Die Objektträger in einer befeuchteten Kammer zu Folien Trocknung bei jedem Schritt zu vermeiden. Folgen Sie dem gleichen Vorgang für jede Reagenzien als wenn für den Autostainer verwendet.
4. IHC Entparaffinierung und Antigen-Retrieval
- Legen Sie Dias in Xylol für 5 Minuten. Wiederholen Sie einmal. Lassen Sie die Dias zum Austrocknen zu einem späteren Zeitpunkt, bis angezeigt, da dies zu einer übermäßigen Hintergrund und schlechte Färbung führt.
- Die Objektträger bis 100% Ethanol für 2 Minuten. Wiederholen Sie einmal.
- Legen Sie Folien in frisch zubereitete 3% H 2 O 2 in Methanol für 10 Minuten.
- Dip Slides in 90% Ethanol und dann in 90% Ethanol Platz für 3 Minuten.
- Die Objektträger zu70% Ethanol für 1 Minute.
- Die Objektträger in entionisiertem Wasser.
- Combidämpfer und Citratpuffer in Dampfer für 5 Minuten.
- Hinzufügen von Folien auf Puffer, in dem Dampfer und Dampf für 30 Minuten Citrat.
- Sofortüberweisung Dias zu Wasser und zu halten, bis gleitet auf Zimmertemperatur abkühlen lassen (~ 20 Minuten).
- Die Objektträger mit den Dako Autostainer Racks nach Sequenz (Abbildung 1) und führen Sie den Fleck Doppelfärbung Programm. Die wichtigsten Schritte des automatischen Färbevorrichtung Programm so dass die manuelle läuft nachvollziehen können aufgeführt.
5. Erste primäre Antikörper (Ki-67, CD3, Pankreaspolypeptid)
- Blockieren Sie Dias mit Sniper-Lösung für 15 Minuten. Waschen zweimal mit TBST.
- Die Objektträger in primärem Antikörper für 30 Minuten. Waschen zweimal mit TBST.
- Inkubieren mit Mach2 Ziege anti-Maus (Ki-67) oder Anti-Kaninchen-(CD3-, Pankreas-Polypeptid) Meerrettichperoxidase (HRP)-Polymer für 30 minuten. Waschen zweimal mit TBST.
- Bewerben 3,3-Diaminobenzidin (DAB) zu Folien für 4 Minuten. Zweimal mit Wasser waschen.
- Folien mit Pankreas-Polypeptid inkubiert werden, wenn der Dako, die gleichzeitig getestet gehalten und für alle nachfolgenden Schritte verwendet TBST während die übrigen Dias mit dem zweiten Satz von primären Antikörpern inkubiert werden. Alternativ zur manuellen Tests, § 6 fortfahren.
6. Zweite primäre Antikörper (Insulin, Glukagon)
- Die Objektträger in Deeb für 20 Minuten. Waschen zweimal mit TBST.
- Block mit 10% normalem Ziegenserum in 20% Avidin-Blocker in TBST (Insulin) oder Sniper (Glucagon) in TBST für 20 Minuten. Waschen zweimal mit TBST.
- Inkubation mit Insulin oder Glucagon primären Antikörper für 15 Minuten. Waschen zweimal mit TBST.
- Insulin: inkubieren in biotinylierter Ziege-Anti-Meerschweinchen bei 1:300-Verdünnung für 30 Minuten. Waschen zweimal mit TBST. Inkubieren mit Standard-vector ABC-AP Reagenz für 30 Minuten. Waschen zweimal mit TBST.
- Glucagon: inkubieren im Puffer während 30 Minuten, gefolgt von Ziegen Anti-Maus-alkalische Phosphatase (AP) Polymer für 30 Minuten. Waschen zweimal mit TBST.
- Während die Folien in der Konjugate inkubiert werden, wärmen die LPR-Puffer auf Raumtemperatur. 1 Tropfen der Flüssigkeit permanent rot (LPR) pro 3 mL Puffer sofort vor dem Gebrauch und in Dako Reagenzhalter. Die Objektträger in LPC für 4 Minuten. Zweimal mit Wasser waschen.
- Die Objektträger in Hämatoxylin für 1 Minute. Spülen Sie zweimal mit Wasser.
- Die Objektträger in TBS pH 7,6 für 1 Minute. Spülen Sie zweimal mit Wasser.
- Entladen von Folien aus Dako Autostainer.
- Unmittelbar dehydrieren Folien für pankreatische Polypeptid gefärbt. Für alle doppelt gefärbten Schnitten, trocken für mindestens 1 Stunde dann dehydrieren.
7. Austrocknung
- Die Objektträger in 80% igem Ethanol für 1 Minute.
- Dip Slides in 95% Ethanol.
- Halten Sie Folien in 95% Ethanol für 30 Sekunden.
- Übertragen Dias zu 100% Ethanol und halten Sie 1 Minute. Wiederholen.
- Dip Slides in Xylol.
- Halten Sie Folien in Xylol für 1 Minute. Wiederholen.
- Unmittelbar montieren Deckgläser auf Objektträger mit Cytoseal.
8. Slide Labeling
- Geben Sie den Fall Identifikationsinformationen einschließlich Organ-und Blocknummer, Fleck, und das Datum und Print. Serielle Schnitt-Nummer ist für die erste Folie Flecken von jedem Block optional. Nachfolgenden Ebenen werden durch Nummerierung bezeichnet.
- Legen Sie Etiketten auf Folien.
9. Slide-Scanning
- Platzieren Sie gefärbten Schnitten in Scanner und scannen Tablett nach Instrumentierung.
- Organisieren Sie Dias von Geber-und Gewebe-Typ (Pankreas Kopf, Körper, Schwanz, Milz).
- Archiv gefärbten Objektträger bei Raumtemperatur und alle verbleibenden ungefärbten Objektträger bei -20 ° C bis zur Verwendung.
10. Representative Ergebnisse
Diese Färbung Verfahren wurden für die JDRF Netzwerk für Bauchspeicheldrüsenkrebs Organspendern mit Diabetes (nPOD) zum Ausgangswert Charakterisierung von Paraffin und frisch gefrorene Blöcke liefern entwickelt. Jeder Spender hat einen Ausgangswert Charakterisierung durchgeführt umfasste der Färbung 2 Blocks von jeder Region der Bauchspeicheldrüse (Kopf, Körper und Schwanz) und die Milz (Abbildung 1, siehe auch Fall Formular, Anhang 1). Die H & E Färbung wird unter Verwendung einer Autostainer als für eine klinische Einrichtung mit klinisch-Grade-Lösungen verwendet, während programmiert. Als zusätzliche Spender Blöcke geschnitten sind, hat jeder eine Folie für H & E getroffen werden, um Gewebe-Morphologie zeigen. Wenn Blöcke geschnitten sind sie wieder, als zur Ausschüttung an Forscher, werden tiefere Ebenen haben auch Folien für repräsentative H & E Dias unternommen, um den gesamten Block der Gewebemorphologie sowie Nummerierung Seriennummer werden auf jeder Ebene zu dokumentieren. Eindecken werden die Objektträger mit markiertenBei Identifizierung, Bauchspeicheldrüse Region, Blocknummer, Fleck und Datum (Abbildung 2) und gescannt in den Online-Pathologie Information-Management-System. Repräsentative Bilder von einem Kontrollraum Spender sind in Abbildung 3 bei niedrigen und hohen Vergrößerungen gezeigt, dass die erwarteten Ergebnisse nach diesem Verfahren zeigen. Der Schlitten gebeizt mit Pankreas-Polypeptid (D, H) wurde an einem anderen Tag getestet mit dem Assay manuell durchgeführt und zeigt, reduziert Färbeintensität des Hämatoxylin Gegenfärbung. Unterschiede in der Färbeintensität der primäre Antikörper oder Gegenfärbung zwischen Assays ist die Insbesondere, wenn mittels Bildanalyse sonst gleitet mit individuellen Farbkorrektur zu der gleichen Zelle oder zählt Bereichen zu erreichen müssen vermieden werden.
Jedes Labor sollte erwarten, dass Antikörper-Konzentrationen als viel-zu-viel Variation und andere Reagenzien und Bedingungen können Färbeintensität und Spezifität Wirkung zu optimieren. Mit Erwerb der neuen REAHerren, sind Färbeverfahren mit bekannten positiven und negativen Kontrollproben, den gleichen Grad der Färbeintensität als mit dem ehemaligen Reagenzien zu erreichen validiert. Weitere Antikörper in der Pathologie nPOD Kern optimiert sind in Tabelle 2 als Referenz bereitgestellt und sind für multilabeling Immunfluoreszenz für konfokale Mikroskopie verwendet.
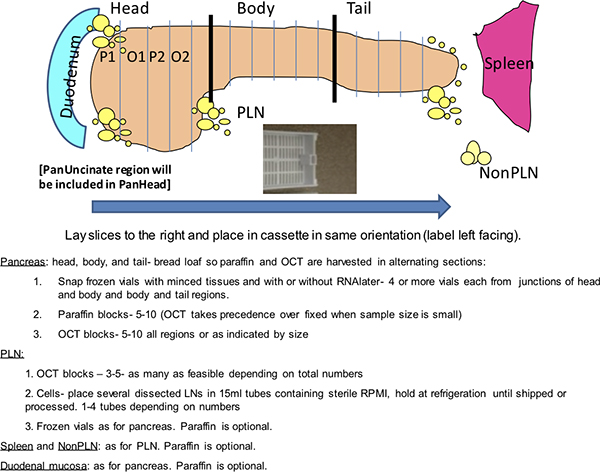
Abbildung 1. Dako Färbung Gitter. Dieses Schema zeigt eine Routine-Analyse von einem Spender nPOD Bauchspeicheldrüse auf einem Dako Autostainer durchgeführt. Die nPOD Spender werden mit einem 4-stelligen Identifikationsnummer codiert. Zwei-Magazine sind mit Dias von Fleck organisiert dargestellt. Alternate Dia-Konfigurationen werden voraussichtlich je nach Zahl der Spender Dias. Positive Kontrollen umfassen die Aufnahme eines bekannten positiven Spender für die beiden Doppel-Flecken und Milz Spender für Ki-67 und CD3. Negative Kontrollen sind zweifach und beinhalten zwei SLIdes von einem Spender Pankreas-Block mit Immunglobulin (Ig) aus den Host-Spezies des primären Antikörper und zwei Schlitten vom Spender Milz für Insulin und Glukagon inkubiert.
Abbildung 2. Vertreter doppelt gefärbten Folie. Eine typische fertige Folie wird mit Folie Kennzeichnung Parameter und Gewebe Platzierung gezeigt, bevor digitale Abtastung erfolgt.
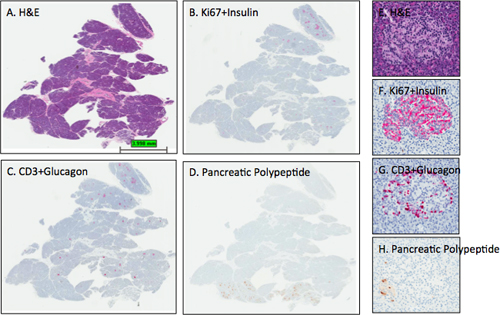
Abbildung 3. Vertreter von H & E und IHC Flecken in der Bauchspeicheldrüse Abschnitten. Abschnitte aus der Bauchspeicheldrüse von einer erwachsenen Frau Organspender (6096-04 Panhead) waren fleckig und digitale Scans durchgeführt, wie im Protokoll beschrieben. Bilder wurden mit dem Programm ImageScope Betrachtung des gesamten Abschnitt (AD) und von einer kleinen Insel (EH). Die zu erwartenden Inselchen Fleck Intensitäten für Insulin, Glukagon und Pankreaspolypeptid sindbeobachtet Abschnitte BD als Abschnitt D skizziert, dass diese Pankreas Kopfblock einen kleinen Teil des hakenförmigen Region oder ventralen Pankreas Lappen da alle Inseln vor allem Polypeptid aus der Bauchspeicheldrüse-positive Zellen enthalten enthält. Beachten Sie, dass die Hämatoxylin-Gegenfärbung in D Panel zu hell ist, während der Hämatoxylin Gegenfärbung Intensitäten in B und C sind optimal. EH Panels zeigen eine kleine Insel aus dem dorsalen Lappen mit der erwarteten Verteilung der β-Zellen und α-Zellen. Einige Polypeptid aus der Bauchspeicheldrüse Zellen werden in der linken unteren Teil der Insel (H) vorhanden. A, E-H &E; B, F-Ki67 + Insulin, C, G-CD3 + Glucagon, D, H-Pankreas-Polypeptid. AD, 0.2x, EH-12,8 X.
Diskussion
Die Standardisierung der immunhistochemischen Verfahren ist von entscheidender Bedeutung für die Bildanalyse, insbesondere bei Verwendung von Computer-basierten Algorithmen über eine große Anzahl von Dias über die Zeit. Der IHC-Färbung Verfahren in diesem Bericht beschrieben wird es Batch-Analyse einer gegebenen Spenders Proben mit einem Autostainer innerhalb einer 8-stündigen Arbeitstag und werden von einem früheren Bericht 5 modifiziert. Digitalisierte Bilder gesamten Objektträger eines jeden gefär...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren danken den Spendern die Familien und die Orgel Beschaffung Organisationen in diesem Forschungs-und Emily Montgomery, Robert Pietras, Ann Fu, Mitali Agarwal, und Roshan Agarwal für ihre fachkundige Unterstützung beteiligt. Diese Arbeit wurde von der Juvenile Diabetes Research Foundation (MC-T.) zur Unterstützung des Network for Organ Donors mit Pankreas-Diabetes gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| 30% igem Wasserstoffperoxid (H 2 O 2) | FisherScientific | H325-500 | Endogene Peroxidase Blocking |
| ABC-alkalische Phosphatase (AP) | Vektor | AK-5000 | AP-Konjugat |
| Antibody Diluent | Invitrogen | 003218 | Der primäre Antikörper |
| Avidin-Blocker | Vektor | SP-2001 | Blockieren Sie endogenes Biotin |
| Biotinylierten Ziegen-anti-Meerschweinchen | Vektor | BA-7000 | Sekundärer Antikörper |
| Bläuungsreagenz | FisherScientific | 7301 | Leica autostainer |
| Citratpuffer, pH 6,0 | BioGenex | HK086-9K | Antigen-Retrieval |
| Clarifier 1 | FisherScientific | 7401 | Leica Autostainer |
| Cytoseal XYL | FisherScientific | 8312-4 | Coverslip Deckfluessigkeit |
| DAB | Vektor | SK-4100 | HRP Chromogen |
| Deeb | DAKO | S2003 | Endogene AP Blockierungsreagenz |
| Eosin Y Alkoholische | FisherScientific | 71204 | Leica Autostainer |
| Ethanole-100%, 95%, 90%, 70% | FisherScientific | Verschiedene | Entparaffinierung und Eindecken |
| Hämatoxylin | DAKO | S3301 | Dako Autostainer |
| Hämatoxylin 7211 | FisherScientific | 7211 | Leica Autostainer |
| IgG (alle Wirtsarten für Primär-Antikörper) | Verschiedene | Verschiedene | Negative Kontrollen für Vorwahlen |
| Flüssige Permanent Red (LPR) | DAKO | K0640 | AP Chromogen |
| Mach2 AP | Biocare Medical | MALP521L | Ziege anti-Maus AP-Konjugat |
| Mach2 HRP | Biocare Medical | MHRP520L | Ziege anti-Maus-HRP-Konjugat |
| Mach2 HRP | Biocare Medical | RHRP520L | Ziege anti-Maus-HRP-Konjugat |
| Methanol | FisherScientific | Verschiedene | H 2 O 2 Verdünnungsmittel |
| Normalem Ziegenserum | Vektor | S-1000 | IHC Blockierungsreagenz |
| Heckenschütze | Biocare Medical | BS966M | IHC Blockierungsreagenz |
| TBST 20X | ThermoScientific | TA-999-TT | IHC-Puffer |
| Triology 20x | Cell Marque | 920P-06 | Antigen-Retrieval |
| Xylol | FisherScientific | Verschiedene | Entparaffinierung und Eindecken |
Tabelle 1. Spezifische Reagenzien.
| Primärer Antikörper | Wirtsarten | Verkäufer | Cat. # | Kommentare und Antigen-Retrieval |
| Paraffin | ||||
| Amylase | Maus | Santa Cruz | SC-46657 | Zitrat |
| Amylin | Maus | Serotec | MCA11267 | Zitrat |
| Carboanhydrase 19,9 | Maus | Abcam | ab15146 | |
| Caspase-3, gespalten | Kaninchen | Cell Signaling | 9961 | Citrat oder Trilogy |
| CD20 | Maus | DAKO | M0755 | Citrat oder Trilogy |
| CD3 | Kaninchen | DAKO | A0452 | Zitrat |
| CD34 | Maus | Cell Signaling | 3569 | Zitrat |
| CD4 | Maus | DAKO | M7310 | Zitrat |
| CD45 | Maus | DAKO | M0754 | Zitrat |
| CD68 | Maus | DAKO | M0876 | Zitrat |
| CD8 | Maus | DAKO | M7103 | Zitrat |
| Chromogranin A | Kaninchen | DAKO | A0430 | Zitrat |
| CK17 | Maus | DAKO | M7046 | Zitrat |
| CK19 | Maus | DAKO | M0772 | Zitrat |
| CK7 | Maus | DAKO | M7018 | Zitrat |
| C-Peptid | Kaninchen | Cell Signaling | 4593 | Zitrat |
| Foxp3 | Ratte | e Bioscience | 14-4776-80 | Zitrat |
| Ghrelin | Ziege | Santa Cruz | SC-10.386 | |
| Ghrelin | Kaninchen | Abcam | ab85104 | |
| Glucagon | Kaninchen | DAKO | A0565 | |
| Glucagon | Maus | Abcam | ab10988 | Zitrat |
| Glucagon | Guinea Pig | Bachem | T-5037 | Zitrat |
| Glut-1 | Maus | Abcam | ab40084 | Trilogie |
| Glut-2 | Kaninchen | Santa Cruz | SC-9117 | Nicht in menschlichen Inseln ausgedrückt |
| Insulin | Guinea Pig | DAKO | A0564 | |
| Ki-67 | Maus | DAKO | M7240 | Zitrat |
| Mafa | Kaninchen | Novus Biologische | NB400-137A | Trilogie |
| Pankreaspolypeptid | Kaninchen | Invitrogen | 18-0043 | Zitrat |
| PDX-1 | Guinea Pig | Abcam | ab47308 | Citrat oder Trilogy |
| Proinsulin | Maus | Novocastra | NCL-Proin-1G4 | |
| Proinsulin | Maus | Developmental Studies Hybridoma der Bank | GS-9A8 | Zitrat |
| Secretagogin | Kaninchen | Sigma | HPA 006641 | Zitrat |
| Glattmuskelaktin | Kaninchen | Abcam | ab5694 | |
| Somatostatin | Kaninchen | DAKO | A0566 | |
| Synaptophysin | Maus | DAKO | M0776 | Zitrat |
| Fresh Frozen | Wirtsarten | Verkäufer | Cat. # | Kommentare |
| CD11b | Ratte | Abcam | ab6332 | Fix mit 4% PF |
| CD11c | Kaninchen | Serotec | AHP1226 | |
| CD25 | Maus | Novus Biologische | NB 600-564 | Verwenden Sie Inkubation über Nacht für Paraffinschnitte |
| CD94 | Maus | Abcam | ab61874 | Fix mit Aceton |
| GAD65 | Maus | Santa Cruz | SC-130.569 | Fix mit 4% PF |
| HLA-ABC | Maus | DAKO | M0736 | Fix mit Aceton oder 4% PF |
Tabelle 2. Primäre Antikörper.
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Aperio ScanScope CS | Aperio | Digitale Dia-Scanner | |
| DAKO Autostainer Plus | DAKO | IHC Flecken | |
| Label Matrix-Druck-Software | BioCarta | LM7UP57 | Slide-Label-Software |
| Leica Autostainer XL | Leica | H & E Flecken | |
| Premium-Deckglas | FisherScientific | 12 bis 548-5J | Coverslip |
| Spectrum Information Manager | Aperio | Scanner-Software | |
| Superfrost Plus Objektträger | FisherScientific | 12-550-15 | Positiv geladene Objektträger |
| Gemüsedämpfer | Black und Decker | Verschiedene | Antigen-Retrieval |
| Zebra TLP 3742 | CDWG | TLP3742 | Slide-Etikettendrucker |
Tabelle 3. Spezifische Versorgungsgüter und Ausrüstungsgegenstände.
Referenzen
- In't Veld, P., Marichal, M. Microscopic anatomy of the human islet of Langerhans. Adv. Exp. Med. Biol. 654, 1-19 (2010).
- Matveyenko, A. V., Butler, P. C. Relationship between beta-cell mass and diabetes onset. Diabetes Obes. Metab. 10, 23-31 (2008).
- Saisho, Y. Pancreas volumes in humans from birth to age one hundred taking into account sex, obesity, and presence of type-2 diabetes. Clin. Anat. 20, 933-942 (2007).
- Hruban, R. H. Pancreatic intraepithelial neoplasia: a new nomenclature and classification system for pancreatic duct lesions. Am. J. Surg. Pathol. 25, 579-586 (2001).
- Campbell-Thompson, M. Pancreatic adenocarcinoma patients with localised chronic severe pancreatitis show an increased number of single beta cells, without alterations in fractional insulin area. Diabetologia. 52, 262-270 (2009).
- Meier, J. Beta-cell replication is the primary mechanism subserving the postnatal expansion of beta-cell mass in humans. Diabetes. 57, 1584-1594 (2008).
- Rowe, P. A., Campbell-Thompson, M. L., Schatz, D. A., Atkinson, M. A. The pancreas in human type 1 diabetes. Semin. Immunopathol. 33, 29-43 (2011).
- Veld, I. n. '. t., P, . Insulitis in human type 1 diabetes: The quest for an elusive lesion. Islets. 3, 131-138 (2011).
- van Belle, T. L., Coppieters, K. T., von Herrath, M. G. Type 1 diabetes: etiology, immunology, and therapeutic strategies. Physiol Rev. 91, 79-118 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten