Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Protocoles de coloration pour des îlots pancréatiques humains
Dans cet article
Résumé
Cette vidéo montre des procédures pour la caractérisation des îlots pancréatiques humains en utilisant l'hématoxyline et l'éosine (H & E) et l'immunohistochimie (IHC). Sections du pancréas, de la tête, le corps et les régions de la queue sont colorées à la fois par H & E et IHC pour déterminer la composition du système endocrinien îlot (insuline, le glucagon, et le polypeptide pancréatique), la réplication des cellules (Ki67), et des infiltrats inflammatoires (H & E, CD3). La région est localisée à l'aide unciforme IHC pour le polypeptide pancréatique.
Résumé
Estimations de la superficie des îlots et les numéros et la composition des cellules endocrines dans le pancréas humain adulte varie de plusieurs centaines de milliers à plusieurs millions de gammes de masse et bêta à partir de 500 à 1500 1-3 mg. Avec cette hétérogénéité connue, un traitement standard et procédure de coloration a été développé afin que les régions du pancréas ont été clairement définis et îlots caractérisés par l'histopathologie et rigoureuse des examens immunolocalisation.
Des procédures normalisées pour le traitement de pancréas humain récupéré à partir de donneurs d'organes sont décrites dans la partie 1 de cette série. Le pancréas est transformé en 3 grandes régions (tête, corps, queue), suivis par les sections transversales. Des coupes transversales de la tête du pancréas sont encore divisés, comme indiqué sur la base de la taille, et numérotées par ordre alphabétique pour désigner paragraphes. Cette standardisation permet une analyse complète de la section transversale de la région de la tête, y compris la région unciforme qui contient des îlots composésprincipalement de cellules pancréatiques polypeptidiques à la région de la queue.
Le présent rapport comprend une partie 2 de cette série et décrit les procédures utilisées pour les coupes sériées et la caractérisation histopathologique des coupes en paraffine pancréatiques en mettant l'accent sur les cellules endocrines des îlots de Langerhans, la réplication et de cellules T des infiltrats. Pathologie des sections du pancréas est destiné à caractériser à la fois exocrine, ductulaire, et composants du système endocrinien. Le compartiment exocrine est évalué pour détecter la présence de la pancréatite (actif ou chronique), l'atrophie, la fibrose, et la graisse, ainsi que le système de conduits, en particulier en relation avec la présence d'une néoplasie pancréatique intracanalaire 4. Les îlots sont évalués pour la morphologie, la taille et la densité, les cellules endocrines, l'inflammation, la fibrose, l'amyloïde, et la présence de cellules en réplication ou apoptotiques en utilisant H & E et les taches IHC.
Le dernier élément décrit dans la partie 2 est la disposition de la lame colorées comme images numérisées de diapositives entières. Les diapositives numérisées sont organisées au cas par cas et dans la région du pancréas dans une base de données en ligne la création d'une pathologie virtuelle biobanque. L'accès à cette collection en ligne est actuellement fourni à plus de 200 cliniciens et les scientifiques impliqués dans la recherche du diabète de type 1. La base de données en ligne fournit un moyen de partage des données rapide et complète et pour les enquêteurs de sélectionner des blocs de paraffine ou congelés pour des coupes sériées.
Protocole
1. Microtomie pour les sections non colorées
- Mettre en place bain d'eau et microtome que pour microtomie paraffine standard. Utilisez des lames chargées positivement et pré-étiquette avec le numéro de dossier, la région du pancréas (l'échantillon) et le numéro de diapositive. Bloc de paraffine place dans le mandrin microtome avec l'étiquette de cassette sur le côté gauche.
- Suivre les procédures normales, Microtomie section dans le bloc jusqu'à ce que le tissu est uniformément rencontrés. Produire un ruban de coupes sériées (4 m d'épaisseur, 3-6 selon le nombre de taches initiales requises (voir formulaire de soumission de cas, l'annexe 1)). Des sections distinctes dans le ruban, ramasser chacun dans l'ordre, et le lieu sur des lames à l'ordre numéroté au crayon. Notons si une section est utilisé par la numérotation des sections dans l'ordre exact. Maintenir la même orientation sur la diapositive que l'on trouve dans la cassette avec le label diapositive orienté vers la gauche. Sécher toute la nuit à température ambiante puis procéder à la coloration ou la distribution aux enquêteurs.
- Ressurface eal de bloc de paraffine d'une fine couche de paraffine à préserver les tissus et d'archivage à la température ambiante ou à -20 ° C.
- Pour microtomie ultérieure, de maintenir de numérotation pour les coupes en série à chaque niveau comme ci-dessus. Obtenez 1 chariot supplémentaire et tacher par diapositive H & E pour chaque niveau de ~ 100 pM au sein de chaque bloc.
2. H & E coloration
- Placer le premier coulisseau série une coupe de chaque bloc dans une grille coulissante puis dans le premier plateau sur la coloration automatique.
- Sélectionnez la norme H & E du programme tache et procéder comme d'habitude.
- Lorsque vous avez terminé la coloration, retirez les lames de coloration automatique et le lieu dans la hotte pour lamelles.
- Lamelle en utilisant la technique standard. Séchez soigneusement et l'étiquette avec une étiquette imprimée (voir section 12).
3. IHC Set-up
- Sélectionnez le programme de Dako pour les taches et les numéros doubles d'entrée de diapositives. Préparation des tampons TBST et le citrate, des anticorps, et d'autres Reagents en fonction des volumes spécifiés (tableau 1). Chargez le plateau des réactifs et des diapositives. Rotation des lignes propres et des déchets sont programmés selon les recommandations du fabricant.
- Si l'exécution de ces tests manuellement, préparer les volumes estimés. Incuber les lames dans une chambre humide pour éviter le dessèchement des diapositives à n'importe quelle étape. Suivez la même procédure pour chaque réactifs que lorsqu'il est utilisé pour la coloration automatique.
4. Déparaffinage IHC et de restauration des antigènes
- Mettre les lames dans le xylène pendant 5 minutes. Répéter une fois. Ne pas laisser les lames sécher à tout moment ultérieur jusqu'à ce que a indiqué que cela se traduira par de fond excessif et coloration pauvres.
- Transfert diapositives à l'éthanol à 100% pendant 2 minutes. Répéter une fois.
- Mettre les lames dans fraîchement préparée 3% H 2 O 2 dans le méthanol pendant 10 minutes.
- Tremper les lames dans l'éthanol 90% puis placez-le dans l'éthanol 90% pendant 3 minutes.
- Transfert de glisseL'éthanol à 70% pendant 1 minute.
- Rincer les lames dans de l'eau déminéralisée.
- Préchauffer le paquebot et un tampon de citrate dans une marguerite pendant 5 minutes.
- Ajouter des diapositives avec du citrate de mémoire tampon dans le bateau à vapeur et de la vapeur pendant 30 minutes.
- Immédiatement le transfert des diapositives à l'eau et tenir jusqu'à glisse refroidir à température ambiante (~ 20 minutes).
- Transfert diapositives à des racks Dako Autostainer selon la tache séquence (Figure 1) et exécutez le programme double coloration. Les principales étapes du programme Autostainer sont répertoriés afin que les points fixes manuelles pouvez dupliquer.
5. Premières Anticorps primaires (Ki-67, CD3, le polypeptide pancréatique)
- Bloc glisse avec une solution Sniper pendant 15 minutes. Laver deux fois avec TBST.
- Incuber les lames dans l'anticorps primaire pendant 30 minutes. Laver deux fois avec TBST.
- Incuber avec Mach2 chèvre anti-souris (Ki-67) ou anti-lapin (CD3, le polypeptide pancréatique) cheval peroxydase de raifort (HRP) polymère pour 30 minutes. Laver deux fois avec TBST.
- Appliquer 3,3-diaminobenzidine tétrahydrochlorure (DAB) à des diapositives pendant 4 minutes. Laver deux fois avec de l'eau.
- Lames incubées avec le polypeptide pancréatique sont maintenus sur le Dako lorsque étant dosée et en même temps TBST utilisé pour tous les étapes suivantes pendant que les lames restantes sont incubées avec le second ensemble d'anticorps primaires. Sinon, pour les dosages manuels, passez à la section 6.
6. Deuxièmement Anticorps primaires (insuline, glucagon)
- Incuber les lames dans DEEB pendant 20 minutes. Laver deux fois avec TBST.
- Bloquer avec du sérum de chèvre normal à 10% en bloquant l'avidine 20% dans TBST (insuline) ou Sniper (glucagon) dans TBST pendant 20 minutes. Laver deux fois avec TBST.
- Incuber avec de l'insuline ou de l'anticorps primaire glucagon pendant 15 minutes. Laver deux fois avec TBST.
- Insuline: Incuber les lames dans de chèvre anti-Guinée porc biotinylé à 1:300 de dilution pendant 30 minutes. Laver deux fois avec TBST. Incuber avec ve normector ABC-AP réactif pendant 30 minutes. Laver deux fois avec TBST.
- Glucagon: Incuber les lames dans un tampon pendant 30 minutes, suivie par de chèvre anti-souris phosphatase alcaline (AP) polymère pendant 30 minutes. Laver deux fois avec TBST.
- Tandis lames sont incubées dans des conjugués, chauffer le tampon LPR à la température ambiante. Ajouter 1 goutte de rouge permanente de liquide (LPR) par 3 ml de tampon immédiate avant l'utilisation et le lieu dans le rack réactif Dako. Incuber les lames dans LPC pendant 4 minutes. Laver deux fois avec de l'eau.
- Incuber les lames dans l'hématoxyline pendant 1 minute. Rincer deux fois avec de l'eau.
- Incuber les lames dans du TBS pH 7,6 pendant 1 minute. Rincer deux fois avec de l'eau.
- Décharger les lames de DAKO Autostainer.
- Immédiatement Déshydrater les lames colorées pour le polypeptide pancréatique. Pour toutes les diapositives doubles colorées, sec pendant au moins 1 heure, puis déshydrater.
7. La déshydratation
- Lieu glisse dans l'éthanol 80% pendant 1 minute.
- Plonger les lames dans l'éthanol à 95%.
- Maintenez les lames dans l'éthanol à 95% pendant 30 secondes.
- Transfert diapositives à l'éthanol 100% et maintenez 1 minute. Répéter.
- Tremper les lames dans du xylène.
- Tenez diapositives dans le xylène pendant 1 minute. Répéter.
- Immédiatement monter des lamelles sur des lames en utilisant cytoseal.
8. Étiquetage diapositives
- Entrez les informations d'identification cas y compris le nombre d'organes et de bloc, de la teinture, la date et l'impression. Numéro de la section de série est facultative pour les taches première diapositive de chaque bloc. Les niveaux suivants sont désignés par numérotation.
- Placez les étiquettes sur les diapositives.
9. Numérisation diapositives
- Placez les lames colorées dans le bac du scanner et de numériser en fonction de l'instrumentation.
- Organisez vos diapositives par type donneur et les tissus (tête du pancréas, du corps, la queue, de la rate).
- Diapositives Archives colorées à la température ambiante et toutes les diapositives restantes non colorées à -20 ° C jusqu'à leur utilisation.
10. RepreseRésultats ntative
Ces procédures de coloration ont été développés pour le réseau de la FRDJ de donneurs d'organes pancréatiques avec diabète (nPOD) pour fournir la caractérisation de base de paraffine et de frais blocs congelés. Chaque donateur a une caractérisation de base réalisée composé de coloration 2 blocs de chaque région du pancréas (tête, corps, et la queue) et de la rate (Figure 1, voir aussi formulaire de soumission cas, Annexe 1). La coloration H & E est effectuée en utilisant un Autostainer programmé que pour une installation clinique de qualité clinique solutions utilisées tout au long. Comme blocs donneurs supplémentaires sont sectionnés, chacun a une diapositive prise pour H & E pour montrer la morphologie des tissus. Lorsque les blocs sont sectionnés à nouveau, comme pour la distribution aux enquêteurs, des niveaux plus profonds devront également des diapositives prises pour le représentant de H & E diapositives afin de documenter la morphologie des tissus tout le bloc, ainsi que la numérotation des coupes sériées à chaque niveau. Lames colorées sont étiquetés avecl'identification des cas, la région du pancréas, le numéro de bloc, tache et la date (figure 2) et numérisés dans le système en ligne d'information de gestion pathologie. Des images représentatives provenant d'un donneur de contrôle sont présentés dans la figure 3, à deux grossissements haute et basse pour montrer les résultats escomptés à la suite de cette procédure. Les vitraux diapositive avec le polypeptide pancréatique (D, H) a été testée sur un autre jour avec le test effectué manuellement et montre réduit l'intensité de la coloration de la contre-coloration hématoxyline. Les différences dans l'intensité de la coloration des anticorps primaires ou du contre entre les dosages doit être évitée, en particulier si vous utilisez l'analyse d'image glisse autrement exiger la correction des couleurs individuel pour atteindre les zones de cellules mêmes chefs d'accusation.
Chaque laboratoire doit s'attendre à optimiser les concentrations d'anticorps comme étant le lot à lot de variation et d'autres réactifs et les conditions peuvent avoir une incidence intensité de la coloration et la spécificité. Avec l'acquisition de nouvelles raisonsmessieurs, les procédures de coloration sont validés avec des échantillons connus de contrôle positifs et négatifs pour atteindre le même degré d'intensité tache comme réactifs anciens. Anticorps supplémentaires optimisées dans le noyau nPOD pathologie sont fournis dans le tableau 2 comme source de référence et ont été utilisés pour multilabeling immunofluorescence pour la microscopie confocale.
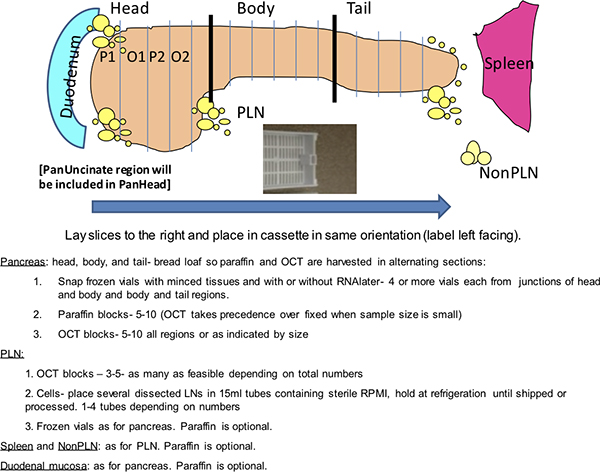
Figure 1. Grille de coloration Dako. Ce schéma représente une analyse de routine à partir d'un pancréas de donneur nPOD effectuée sur un Dako Autostainer. Les bailleurs de fonds nPOD sont codés avec un numéro d'identification à 4 chiffres. Deux plateaux coulissants sont présentés avec des diapositives organisées par tache. Configurations de diapositives Autres sont attendus en fonction du nombre de diapositives donateurs. Les contrôles positifs, notamment l'intégration d'un donneur connu positif pour les deux taches doubles et de la rate des donateurs pour le Ki-67 et CD3. Les contrôles négatifs sont doubles et comprennent deux slides d'un bloc de pancréas de donneur incubées avec de l'immunoglobuline (Ig) de l'espèce hôte des anticorps primaires et deux diapositives à partir de la rate des donateurs pour l'insuline et le glucagon.
Figure 2. Représentant double glissière teinté. Une diapositive fini typique est montré avec des paramètres en matière d'étiquetage des diapositives et de placement des tissus avant la numérisation numérique est effectuée.
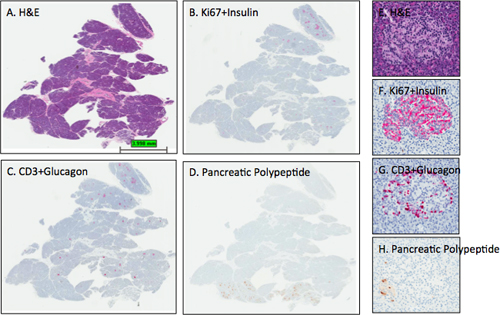
Figure 3. Représentant H & E et les taches IHC dans les sections du pancréas. Les articles du pancréas d'un donneur d'organe femelle adulte (6096-04 Panhead) étaient tachés et analyses numériques effectuées telles que décrites dans le protocole. Les images ont été obtenues en utilisant le programme ImageScope la visualisation de toute la section (AD) et d'un îlot (EH). Les intensités des îlots attendus détachants pour l'insuline, le glucagon, et le polypeptide pancréatique sontobservée pour les sections BD comme délimite D section que ce bloc de tête du pancréas contient une petite portion de la région unciforme ou lobe pancréatique ventrale que tous les îlots pancréatiques contiennent principalement polypeptide cellules positives. Notez que la contre-coloration hématoxyline dans le panneau D est trop léger alors que le hématoxyline recolorer intensités dans B et C sont optimales. Panneaux EH montrer un îlot du lobe dorsal avec la distribution attendue des cellules ß et α-cellules. A quelques cellules pancréatiques polypeptidiques se trouvent dans la partie inférieure gauche de l'îlot (H). A, E-H & E, B, F-Ki67 + insuline; C, G-CD3 + Glucagon; D, H-polypeptide pancréatique. AD, 0.2x, EH-12.8x.
Discussion
Normalisation des procédures IHC est critique pour l'analyse d'image, en particulier lors de l'utilisation des algorithmes informatiques, à travers un grand nombre de diapositives au fil du temps. La procédure de coloration IHC décrit dans le présent rapport permettront d'analyser des échantillons de lots d'un donateur donné de l'aide d'un Autostainer au sein d'une journée de travail de 8 heures et sont modifiées à partir d'un précédent rapport 5. Images numéri...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Les auteurs tiennent à remercier les familles des donneurs et des d'approvisionnement en organes impliqués dans cette recherche et Emily Montgomery, Robert Pietras, Ann Fu, Mitali Agarwal, Agarwal et Roshan pour leur aide d'experts. Ce travail a été financé par la Juvenile Diabetes Research Foundation (MC-T.) à l'appui du Réseau des donneurs d'organes atteints de diabète pancréatique.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| Peroxyde d'hydrogène 30% (H 2 O 2) | FisherScientific | H325-500 | Peroxydase endogène de blocage |
| ABC-phosphatase alcaline (AP) | Vecteur | AK-5000 | AP conjugué |
| Antibody Diluent | Invitrogen | 003218 | L'anticorps primaire |
| Avidine bloquant | Vecteur | SP-2001 | Bloquer la biotine endogène |
| Biotinylé de chèvre anti-Guinée cochon | Vecteur | BA-7000 | Anticorps secondaire |
| Réactif bleuissant | FisherScientific | 7301 | Leica autostainer |
| Tampon citrate, pH 6,0 | BioGenex | HK086-9K | De restauration des antigènes |
| Clarificateur 1 | FisherScientific | 7401 | Leica Autostainer |
| Cytoseal XYL | FisherScientific | 8312-4 | Lamelle milieu de montage |
| DAB | Vecteur | SK-4100 | HRP chromogène |
| DEEB | DAKO | S2003 | Endogène AP réactif de blocage |
| Éosine alcoolique Y | FisherScientific | 71204 | Leica Autostainer |
| Éthanols-100%, 95%, 90%, 70% | FisherScientific | Divers | Déparaffinage et de lamelles de protection |
| Hématoxyline | DAKO | S3301 | Dako Autostainer |
| Hématoxyline 7211 | FisherScientific | 7211 | Leica Autostainer |
| IgG (toutes les espèces d'accueil pour les anticorps primaires) | Divers | Divers | Les contrôles négatifs pour les primaires |
| Liquid Permanent Red (LPR) | DAKO | K0640 | AP chromogène |
| Mach2 AP | Biocare médicale | MALP521L | Chèvre anti-souris conjugué AP |
| Mach2 HRP | Biocare médicale | MHRP520L | Chèvre anti-souris conjugué HRP |
| Mach2 HRP | Biocare médicale | RHRP520L | Chèvre anti-souris conjugué HRP |
| Le méthanol | FisherScientific | Divers | H 2 O 2 diluant |
| Du sérum de chèvre normal | Vecteur | S-1000 | IHC réactif de blocage |
| Tireur isolé | Biocare médicale | BS966M | IHC réactif de blocage |
| TBST 20X | ThermoScientific | TA-999-TT | IHC tampon |
| Trilogie 20x | Marque cellulaire | 920P-06 | Récupération d'antigène |
| Xylène | FisherScientific | Divers | Déparaffinage et de lamelles de protection |
Tableau 1. Réactifs spécifiques.
| Anticorps primaire | Espèces hôtes | Vendeur | Cat. # | Commentaires et récupération d'antigène |
| Paraffine | ||||
| Amylase | Souris | Santa Cruz | SC-46657 | Citrate |
| Amylin | Souris | Serotec | MCA11267 | Citrate |
| L'anhydrase carbonique 19,9 | Souris | Abcam | ab15146 | |
| Caspase-3, clivé | Lapin | Signalisation cellulaire | 9961 | Citrate ou Trilogie |
| CD20 | Souris | DAKO | M0755 | Citrate ou Trilogie |
| CD3 | Lapin | DAKO | A0452 | Citrate |
| CD34 | Souris | Signalisation cellulaire | 3569 | Citrate |
| CD4 | Souris | DAKO | M7310 | Citrate |
| CD45 | Souris | DAKO | M0754 | Citrate |
| CD68 | Souris | DAKO | M0876 | Citrate |
| CD8 | Souris | DAKO | M7103 | Citrate |
| Chromogranine A | Lapin | DAKO | A0430 | Citrate |
| CK17 | Souris | DAKO | M7046 | Citrate |
| CK19 | Souris | DAKO | M0772 | Citrate |
| CK7 | Souris | DAKO | M7018 | Citrate |
| C-peptide | Lapin | Signalisation cellulaire | 4593 | Citrate |
| Foxp3 | Rat | e Bioscience | 14-4776-80 | Citrate |
| La ghréline | Chèvre | Santa Cruz | SC-10386 | |
| La ghréline | Lapin | Abcam | ab85104 | |
| Glucagon | Lapin | DAKO | A0565 | |
| Glucagon | Souris | Abcam | ab10988 | Citrate |
| Glucagon | Guinée Pig | Bachem | T-5037 | Citrate |
| Glut-1 | Souris | Abcam | ab40084 | Trilogie |
| Glut-2 | Lapin | Santa Cruz | SC-9117 | Pas exprimé dans les îlots humains |
| Insuline | Guinée Pig | DAKO | A0564 | |
| Ki-67 | Souris | DAKO | M7240 | Citrate |
| Mafa | Lapin | Novus biologique | NB400-137A | Trilogie |
| Polypeptide pancréatique | Lapin | Invitrogen | 18-0043 | Citrate |
| PDX-1 | Guinée Pig | Abcam | ab47308 | Citrate ou Trilogie |
| Proinsuline | Souris | Novocastra | NCL-PROIN-1G4 | |
| Proinsuline | Souris | Developmental Studies Hybridoma Banque | GS-9A8 | Citrate |
| Secretagogin | Lapin | Sigma | HPA 006641 | Citrate |
| L'actine musculaire lisse | Lapin | Abcam | ab5694 | |
| La somatostatine | Lapin | DAKO | A0566 | |
| Synaptophysin | Souris | DAKO | M0776 | Citrate |
| Frais congelé | Espèces hôtes | Vendeur | Cat. # | Commentaires |
| CD11b | Rat | Abcam | ab6332 | Fixer avec PF 4% |
| CD11c | Lapin | Serotec | AHP1226 | |
| CD25 | Souris | Novus biologique | NB 600-564 | Utilisez une nuit d'incubation pour les coupes en paraffine |
| CD94 | Souris | Abcam | ab61874 | Fixer avec de l'acétone |
| GAD65 | Souris | Santa Cruz | SC-130569 | Fixer avec PF 4% |
| HLA-ABC | Souris | DAKO | M0736 | Fixer avec de l'acétone ou PF 4% |
Tableau 2. Anticorps primaires.
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| Aperio ScanScope CS | Aperio | Scanner de diapositives numérique | |
| DAKO Autostainer Plus | DAKO | Taches IHC | |
| Logiciel d'impression d'étiquettes Matrice | BioCarta | LM7UP57 | Logiciel de étiquette de la diapositive |
| Leica Autostainer XL | Leica | H & E taches | |
| Prime lamelle couvre-objet | FisherScientific | 12-548-5J | Lamelle |
| Gestionnaire de l'information du spectre | Aperio | Logiciel du scanner | |
| Superfrost Plus glisse | FisherScientific | 12-550-15 | Des lames chargées positivement |
| Vapeur de légumes | Black & Decker | Divers | De restauration des antigènes |
| Zebra TLP 3742 | CDWG | TLP3742 | Imprimante d'étiquettes Diapositive |
Tableau 3. Fournitures et équipements spécifiques.
Références
- In't Veld, P., Marichal, M. Microscopic anatomy of the human islet of Langerhans. Adv. Exp. Med. Biol. 654, 1-19 (2010).
- Matveyenko, A. V., Butler, P. C. Relationship between beta-cell mass and diabetes onset. Diabetes Obes. Metab. 10, 23-31 (2008).
- Saisho, Y. Pancreas volumes in humans from birth to age one hundred taking into account sex, obesity, and presence of type-2 diabetes. Clin. Anat. 20, 933-942 (2007).
- Hruban, R. H. Pancreatic intraepithelial neoplasia: a new nomenclature and classification system for pancreatic duct lesions. Am. J. Surg. Pathol. 25, 579-586 (2001).
- Campbell-Thompson, M. Pancreatic adenocarcinoma patients with localised chronic severe pancreatitis show an increased number of single beta cells, without alterations in fractional insulin area. Diabetologia. 52, 262-270 (2009).
- Meier, J. Beta-cell replication is the primary mechanism subserving the postnatal expansion of beta-cell mass in humans. Diabetes. 57, 1584-1594 (2008).
- Rowe, P. A., Campbell-Thompson, M. L., Schatz, D. A., Atkinson, M. A. The pancreas in human type 1 diabetes. Semin. Immunopathol. 33, 29-43 (2011).
- Veld, I. n. '. t., P, . Insulitis in human type 1 diabetes: The quest for an elusive lesion. Islets. 3, 131-138 (2011).
- van Belle, T. L., Coppieters, K. T., von Herrath, M. G. Type 1 diabetes: etiology, immunology, and therapeutic strategies. Physiol Rev. 91, 79-118 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon