Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La cirugía estereotáxica para la lesión excitotóxica de áreas específicas del cerebro en la rata adulta
En este artículo
Resumen
La ablación selectiva de la región específica del cerebro (s) mediante la infusión de una excitotoxina utilizando las coordenadas estereotáxicas se describe. Esta técnica también se podría adaptar para la infusión de otros productos químicos en el cerebro de rata.
Resumen
Muchas de las funciones de comportamiento en los mamíferos, incluyendo roedores y seres humanos, están mediadas principalmente por las regiones cerebrales discretas. Un método común para discernir la función de diversas regiones del cerebro de comportamiento u otros resultados experimentales es la implementación de una ablación localizada de la función. En los seres humanos, las poblaciones de pacientes con lesiones cerebrales localizadas se estudian a menudo los déficits, con la esperanza de revelar la función subyacente de la zona dañada. En los roedores, uno experimental puede provocar lesiones de regiones específicas del cerebro.
Lesión se puede lograr de varias maneras. Lesiones electrolíticas pueden causar daños localizados pero dañará una variedad de tipos de células, así como fibras que atraviesan de otras regiones del cerebro que pasan a estar cerca del sitio de la lesión. Inducible utilizando técnicas de genética de células de tipo promotores específicos también puede permitir que el sitio específico de la orientación. Estas técnicas son complejas y no siempre prácticos, dependiendo del área cerebral de destino. Excitotlesión óxico usando cirugía estereotáxica, por el contrario, es uno de los métodos más fiables y prácticos de lesioning neuronas excitadoras sin dañar las células gliales locales o atravesando las fibras.
Aquí, se presenta un protocolo para la infusión estereotáxica de la excitotoxina, N-metil-D-aspartato (NMDA), en el complejo basolateral amígdala. Utilizando indicaciones anatómicas, aplicamos las coordenadas estereotáxicas para determinar la ubicación de nuestra región del cerebro de destino y bajar una aguja de inyección en el lugar justo encima de la meta. A continuación, infundir nuestro excitotoxina en el cerebro, resultando en la muerte excitotóxica de neuronas cercanas. Si bien nuestro sujeto experimental de elección es una rata, los mismos métodos se pueden aplicar a otros mamíferos, con los ajustes apropiados en el equipo y las coordenadas.
Este método se puede utilizar en una variedad de regiones del cerebro, incluyendo la amígdala basolateral 1-6, otro núcleos amígdala 6, 7, 8 hipocampo, entorhinal 9 y la corteza prefrontal 10. También se puede utilizar para infundir compuestos biológicos tales como vectores virales 1, 11. La técnica estereotáxica básico podría adaptarse también para la implantación de más bombas osmóticas permanentes, permitiendo la exposición más prolongada a un compuesto de interés.
Protocolo
Anestesia y analgesia: Treinta minutos antes de la anestesia, inyectar a la rata con 0,05 mg de buprenorfina / kg por vía subcutánea para la analgesia. Iniciar la anestesia con 30-40 mg / kg de sodio pentobarbital intraperitoneal. En este punto, también se inyecta atropina para prevenir la insuficiencia respiratoria (0,4 mg / kg, por vía subcutánea) y meloxicam como analgésico adicional (2 mg / kg por vía subcutánea). Si después de 5 minutos, la rata es todavía móvil o sensible a pellizco dedo del pie, administrar dosis posteriores de pentobarbital sódico a 5 mg / kg (intraperitoneal) hasta que la rata es insensible al dolor. Antes de realizar la incisión primero, inyectar lidocaína (5 mg / kg, intradérmica) en el sitio de la incisión para la anestesia local. Seis a ocho horas después de la inyección inicial, inyectar la rata con 0,05 mg de buprenorfina / kg por vía subcutánea para analgesia. La buprenorfina se puede inyectar a partir de entonces cada 6-8 horas si es necesario, aunque esto no suele ser necesario.
Es importante señalar que otras formas de anestesia cun interferir con lesiones excitotóxicos. Por ejemplo, aunque la ketamina es una forma comúnmente utilizada de la anestesia en roedores, puede interferir con las lesiones inducidas con NMDA debido a que es un antagonista del receptor NMDA. Es importante seleccionar un método de anestesia que induce que no reduce tamaño de la lesión. Si la anestesia de gas que se desea, la mayoría de dispositivos estereotáxicas, incluyendo los descritos aquí pueden adaptarse a los adaptadores de la careta antigás.
Nota: Los materiales se describen con más detalle en la Tabla de los reactivos específicos y equipos de abajo.
1. Preparación de la bomba y Stereotax
- Llene una jeringa de 10 l Hamilton con agua estéril y montarlo en el carro de una bomba de jeringa de 6 programable. Fijar el extremo del émbolo de la jeringa en el soporte fijada en la bomba.
- Prellenado de gas esterilizada PE20 tubo con agua estéril con una aguja y una jeringa de 1 ml. Deslice el extremo abierto del tubo a la jeringa Hamilton, siendo la atenciónútil para evitar la creación de burbujas de aire en el tubo.
- Sujetar la 30ga, plano de corte, el extremo infusión aguja 1 pulgada de la tubería en el brazo de un dispositivo estereotáxico utilizando un manipulador electrodo barril de estilo. Insertar la aguja de infusión entre la abrazadera y el barril acanalado. Fijar la abrazadera sobre un trozo de tubo que contiene la aguja de metal dentro de ella para evitar el aplanamiento de la tubería y restringir el flujo de fluido.
- Ajustar la velocidad de la bomba de> 5 l / min y encienda la bomba. Una gota de agua debe aparecer en la punta de la aguja de infusión. Compruebe la longitud de la tubería y sus juntas para asegurarse de que no haya fugas.
- Limpie el agua de perlas con un hisopo estéril y ajuste la bomba a retirarse. Retirar una burbuja de aire 2 l. La parte superior de la burbuja debe ser visible en el tubo.
- Sumergir la punta de la aguja de infusión en una disolución de 20 mg / ml de NMDA en estéril 0,1 M PBS y retirar l 4-5. Una burbuja de aire debe ser visible entre el agua estéril y la solución de NMDAen la punta. Es importante señalar que NMDA es una neurotoxina potente y se debe tener cuidado en la preparación y manipulación de esta solución. Los guantes y protección para los ojos se les aconseja en todo momento.
2. Montar la Rata en el dispositivo de estereotaxia
- La Figura 1 muestra las partes básicas del dispositivo estereotáxico. Después de afeitarse la cabeza de la rata de la línea de los ojos a las orejas, cargue dientes de las ratas en la barra de bocado, con el cuerpo de la rata que descansa sobre una almohadilla térmica en el medio. La lengua debe pasar por debajo de la barra de mordida, con la mandíbula inferior. Si es posible, una retroalimentación de temperatura almohadilla eléctrica sería preferible. Control de la temperatura rectal también sería ideal.
- Sosteniendo el cuello de la rata con el pulgar y el dedo índice, mueva el canal de la oreja derecha de la barra horizontal en la oreja derecha. La barra debe sentir que está descansando en un lugar sólido, no como ahora que se hunde en la cabeza. Manteniendo el lado derecho de la cabeza firme, deslizar la oreja izquierdabar en el canal de la oreja izquierda horizontal de la rata. Se debe sentir como si estuviera descansando en un lugar sólido. El pabellón auricular debería ser simétrica y que parecen estar apoyados en las barras de los oídos. Hacia arriba la quema de pinnas indica la colocación inadecuada de las barras de los oídos. La cabeza no debe oscilar en respuesta a la presión en el cuello.
- Atornillar la barra de la nariz. Sé amable. Los huesos de la nariz es delicado y la barra de la nariz no tiene por qué ser apretado. Compruebe que la rata aún está anestesiado antes de proceder.
3. Preparación de la Rata de Cirugía
- El uso de un hisopo estéril, coloque suavemente una pequeña cantidad de ungüento oftálmico veterinario lubricante en cada uno de los ojos de las ratas para protegerlos de la desecación y los escombros.
- Concéntricamente desde el sitio de la incisión prevista para el borde de la región afeitado, limpie el cuero cabelludo de la rata con una solución de clorhexidina al 2% seguido de etanol al 70% tres veces. Matorrales clorhexidina también puede ser utilizado si desinfectante más eficaz que se desea.Para terminar, limpiar con una solución de povidona yodada al 10%. El cuero cabelludo está ahora preparado estéril y sólo se debe tocar con los materiales estériles.
- Don guantes estériles para que continúe, porque lo próximo en hacer frente a la zona quirúrgica preparada.
- Colocar un campo estéril de manera que la fenestración expone el sitio quirúrgico.
4. Creación de la ventana quirúrgica
- Utilizando una cuchilla # 10 escalpelo, hacer una incisión (aproximadamente 2 cm de longitud) a lo largo de la línea media longitudinal del cuero cabelludo. La incisión debe comenzar por detrás de la línea de los ojos. Con el pulgar y el dedo índice de la mano no dominante, sostenga el cuero cabelludo en la tracción perpendicular a la dirección de la incisión.
- Tirar de la fascia que recubre la superficie del cráneo a los bordes de la zona quirúrgica utilizando estériles de algodón puntas. Tomará un poco de fuerza para despejar el cráneo, por lo que se puede ver.
- Utilice cuatro pinzas hemostáticas curvas, estériles para crear una ventana quirúrgica. Fascia abrazadera (no la piel) en EACH lado de las caras anterior y posterior de la incisión y luego poner las abrazaderas junto al animal, con lo que tirando de la incisión abierta y totalmente exponiendo el cráneo.
5. Nivelación de la Calavera y crear el agujero piloto
- Localizar bregma, el punto anterior donde las tres placas principales del cráneo se encuentran, como se ilustra en la Figura 2. Mueva la aguja de infusión por lo que la punta de la aguja apenas toque el cráneo en el bregma. Tenga en cuenta el dorsal-ventral de coordenadas. La Figura 3 muestra cómo leer las coordenadas en un dispositivo estereotáxico Stoelting. Nota, en este punto, los guantes ya no son estériles y no debe tocar el área de cirugía estéril directamente. Nota: Después de tocar el dispositivo estereotáxico no estéril, el cirujano ya no es estéril y no debe tocar el sitio de la cirugía o las partes del equipo que va a tocar el sitio quirúrgico.
- Busque lambda, el punto posterior, donde los tres platos principales del cráneo se encuentran, como depicted en la Figura 2. Levante la aguja de infusión y moverlo ligeramente hacia atrás a lambda. Baje la aguja hasta que toque el cráneo, en lambda. Leer la coordenada dorsal-ventral. Si el cráneo es nivel, será dentro de 0,1 mm de la lectura bregma. Si es más lejos que esto, mover la aguja hacia arriba (fuera del camino), afloje la barra de la nariz, ya sea subir o bajar la plataforma de barra de bocado, dependiendo de la final de la cabeza es demasiado alto, y luego volver a medir.
- Mueva la aguja de infusión en bregma y registrar las coordenadas antero-posterior y medial-lateral. Calcular donde la aguja debe ser movido sobre la base de las coordenadas del área cerebral de interés de acuerdo con un atlas cerebral 12. Para el BLA, restar 2,8 mm a partir de la coordenada antero-posterior y, o bien sumar o restar 5,1 mm a / desde la coordenada medio-lateral en función de si desea orientar la campaña a la izquierda oa la derecha. Mueva la aguja de infusión a la posición calculada.
- Gire la needle fuera del camino, teniendo cuidado de no perder de vista donde se encontraba y luego perfore un agujero de aproximadamente 2 mm de diámetro en ese lugar con una moto-herramienta de Dremel con una broca dental estéril adjunta. Taladre cuidadosamente como cuando la perforación se rompe a través del cráneo, se tienden a tirar hacia abajo, dañando posiblemente la duramadre y el tejido cerebral por debajo. Escariar el agujero para verla en grande.
- Absorber la sangre con un hisopo de algodón estéril.
6. La infusión de la neurotoxina
- Gire la aguja de nuevo en su posición. Baje la aguja hasta que toque la superficie del cerebro. Graba la coordenada dorsal-ventral. Este es el nivel de la duramadre. Reste el valor apropiado para llegar a la región del cerebro de su interés. Para la amígdala basolateral, restar 6,7 mm.
- Baje la aguja de infusión para el nivel calculado lentamente. Luego se levantaría nuevamente, muy por encima del cráneo. Utilizar una jeringa Hamilton de alambre de limpieza para desatascar la punta de la aguja de infusión, teniendo cuidado de no touch el extremo del alambre que entra en contacto con la aguja de infusión con guantes no estériles.
- Haga funcionar la bomba a> 5 ml / min y asegúrese de ver una gota de líquido sale de la aguja de infusión. Si no es así, destapar con el cable y vuelva a intentarlo.
- Baje la aguja de perfusión a la que desee dorsal / ventral nivel lentamente.
- Establezca la velocidad de la bomba de infusión a 0,1 l / min y iniciar la infusión. Infundir durante 2 min.
- Una vez que la infusión se ha iniciado, marcar los dos extremos de la burbuja de aire en el tubo con un marcador negro. Si ambos extremos no se mueven, que la aguja está obstruido. Detener la infusión, levantar la aguja, destapar con el cable, verifique que el flujo con un caudal alto, volver a bajar la aguja y vuelva a intentarlo.
- Una vez que la infusión es completo, detenga la bomba y esperar 5 minutos para el NMDA para difundir lejos de la punta de la aguja.
- Levante la aguja de 0,5 mm, e infundir de nuevo durante 1 min. Esperar 2,5 min para el NMDA a difundirse fuera de la punta de aguja. Esta infusión extra queLPS asegurar todo el BLA está cubierto por la infusión. Si esto es necesario para otras regiones del cerebro debe determinarse experimentalmente.
- Elevar la aguja fuera del cerebro lentamente y gire el brazo estereotáxica fuera del camino.
7. Cierre de la incisión
- Don nuevos guantes estériles para cerrar la incisión.
- Limpie cualquier exceso de sangre en el cráneo con las puntas de algodón estériles y quitar las abrazaderas de la fascia.
- Con unas pinzas de Londres, empujar a los dos lados de la incisión juntos. Los bordes interiores de la piel debe cumplir y el borde exterior de la piel no se debe permitir que se enroscan en la incisión. Mientras presiona se cierra la incisión, se aplican los clips de la herida para cerrar la protuberancia con firmeza. Continuar para empujar la piel juntos y grapas a lo largo de la longitud de la incisión. Esto generalmente toma 3-5 clips de la herida.
- Después de colocar todos los clips de la herida, utilice las pinzas para apretar las grapas de nuevo, asegurándose de que son seguros. El t más seguroque los clips, es menos probable que una rata se los saque antes de que la herida ha sanado.
- Limpie la incisión con grapas con una solución de povidona yodada al 10% y volver a la rata a su jaula y el monitor hasta que se restablezca la movilidad (generalmente 1-2 horas después de la anestesia, el tiempo quirúrgico total de la inducción al cierre de estar 30-45 minutos). En este punto, la rata puede ser devuelto a la sala de colonia. Después de una semana, quite las grapas con una herramienta removedor de grapas bajo anestesia con isoflurano.
- Use un esterilizador de cuentas en caliente para esterilizar las superficies de punta de todos los instrumentos antes de su uso en la rata que viene. Los instrumentos deben ser sumergidos en las cuentas por no más de 15 segundos, o pueden llegar a ser demasiado caliente para manejar. Los instrumentos deben ser completamente fría antes de utilizarse en otro animal.
8. Recuperación
- Es posible que las ratas se muestran actividad de ataques en los días posteriores a la lesión. Dependiendo de la región del cerebro comportamientos dañados, tales como el consumo de alimentos o GROoming puede verse afectada. Es importante que los animales ser controlados sobre una base diaria para asegurar que permanezcan sanos durante la recuperación. La atención de apoyo, tales como alimentos líquidos, alimentos ricos en calorías, o analgesia adicional puede ser requerida. La mortalidad debida a la anestesia se produce en un bajo porcentaje de ratas, por lo general menos de 5%. La mortalidad debida a otras causas (infección, hemorragia) es extremadamente rara. Todos los signos de sufrimiento después de la recuperación de la anestesia puede ser causa de exclusión de los estudios futuros, pero son extremadamente raros. La figura 4 muestra la pérdida de peso durante los primeros días después de la cirugía, ya que se debe esperar. El peso corporal debe recuperarse dentro de 1 semana.
9. Los resultados representativos
Una semana o más después de la infusión de NMDA, la lesión puede ser visualizado usando un colorante de contraste cresil violeta y microscopía de campo claro. Los cerebros se perfundieron con hielo frío paraformaldehído al 4%, equilibrada en 30% de sacarosa 0,1 M en PBS y Frozen. A continuación, debe ser cortado en lonchas en 30-60 micras, en una serie de 1:6 a 1:12 y están montados en portaobjetos de vidrio recubiertos con gelatina antes de someterse a un estándar de contraste violeta de cresilo. La lesión debe corresponder a una "calva" o un área de color violeta disminución de cresilo manchas debido a la muerte celular tras la lesión. Figuras 5A y B muestran una lesión representante de la BLA y CEA. Esta imagen fue obtenida usando un escáner de superficie plana con una alta resolución de escaneo (1200 dpi). Para visualizar la lesión, que ayuda a contratinción una serie de secciones a través de la mayor parte del tejido que rodea el área de destino para una lesión fuera de lugar puede ser localizado.

Figura 1. Configuración estereotáxica. Esta figura muestra el estereotáxica en ratas con las partes pertinentes etiquetados.

Figura 2. Bregma y lambda en el SKU de ratall. Esta ilustración muestra las localizaciones de bregma y lambda. Todas las coordenadas se miden en relación a bregma. Lambda se utiliza para asegurar que el cráneo está nivelada.
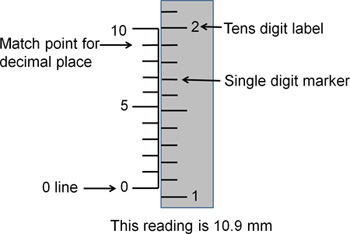
Figura 3. Lectura de las coordenadas estereotáxicas. Este dibujo representa una lectura estereotáxica estándar. Para obtener los dígitos a la izquierda del punto decimal, utilizar los marcadores en el lado derecho. El dígito de la etiqueta se corresponde con el lugar de las decenas (por ejemplo, 1 = 10, 2 = 20). Las marcas de control entre los dígitos marcados corresponden a las unidades individuales (1-9). La línea de cero indica a que el número entero stereotax se establece. Aquí, la línea de cero es entre el 10 y 11 marcadores, lo que indica que el valor está entre 10 y 11. Para determinar los números a la derecha de la coma decimal, utilice los marcadores en el lado izquierdo. Las marcas de control de la izquierda están numerados del 0 al 10, con cada uno de hash sin etiqueta que representa una diferencia de unidad deaquellos junto a él. Cualquiera de las marcas de control en las líneas de la izquierda mejor hasta con las marcas de control de la derecha indica el primer decimal de la lectura de coordenadas. En este caso, la marca de hash en el izquierdo correspondiente al número 9 líneas arriba con la mejor de las marcas de control del lado derecho por lo que la cifra decimal es 9. La lectura final es de 10,9 mm.

Figura 4. El cambio de peso después de la cirugía. Este gráfico muestra la media (± SEM) de peso de las ratas que se sometieron a la cirugía estereotáxica (n = 17) o no someterse a cirugía (n = 6). El día 0 es el día de la cirugía. Después de la cirugía, el peso de las ratas disminuyó durante 2-3 días después de la cirugía y luego se incrementó alrededor de 5-6 días.
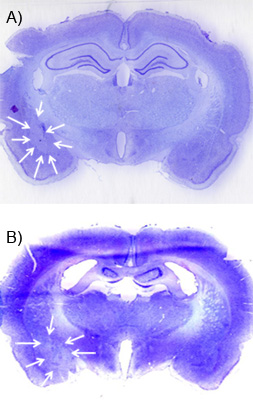
Figura 5. Ejemplo de lesión excitotóxica. A) Esta imagen muestra una violeta de cresilo contratinción sobre una rebanada 30 m coronal con el calvo "in situ "de la lesión de NMDA de la amígdala basolateral. Las flechas blancas delinear la lesión. Se puede comparar con el lado contralateral de la corte de cerebro que no tiene ninguna lesión. B) Una lesión similar de la central de la amígdala núcleo.
Discusión
El método que aquí se presenta estereotáxica permite la lesión excitotóxica de áreas específicas del cerebro a través de la infusión de NMDA. Los métodos estereotáxicas básicos pueden ser adaptados para infundir una variedad de agentes farmacológicos y biológicos de una manera específica del sitio. También puede ser adaptado para apuntar a una variedad de áreas del cerebro, que se define por sus coordenadas estereotáxicas en un atlas cerebral 12. La adaptación a otras especies tales como ra...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado ya CIRM beca predoctoral (EDK), Premio Joven Investigador NARSAD (DK) y el premio NIMH CEREBROS (R01MH087495) (DK).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| N-metil-D-aspártico Acido 98% | Fisher Scientific | AC32919-0500 | |
| Doble estándar de laboratorio estereotáxica w/45 grados. Bares del oído | Stoelting | 51653 | Alternativa proveedor: Kopf * nota de precaución: asegurar la compatibilidad de los accesorios estereotáxicas si la compra de varios proveedores |
| 10ul SYR ESPECIAL (* / * / *) | Hamilton | 701SN | |
| Dremel Moto-Tool | Stoelting | 58600 | Alternativa proveedor: Kopf |
| Fresas de metal duro, pieza de mano de HP, tamaño 2 | Schein Dental | 2284578 | |
| Stoelting 6 Programa de JeringaLa bomba programable | Stoelting | 53140 | Alternativa proveedor: Kopf |
| Tubos de acero inoxidable 316 hipodérmica pared regular calibre 30 .0123 "OD x .00625" x 0.003 "de la pared (aguja de infusión) | Piezas pequeñas | HTXX-30R-06-05 | |
| Intramedic PE 20 tubos (tubo de infusión) | VWR | 63019-025 | |
| Clips Reflex, 9 mm, no estéril | Kent Scientific Corp. | INS500346 | Alternativa proveedor: Herramientas de Bellas Ciencia |
| Aplicador de clips Reflex para los clips de 9mm | Kent Scientific Corp. | 12031-09 | Alternativa proveedor: Herramientas de Bellas Ciencia |
| Curva pinza hemostática Hartman | Herramientas de Bellas Ciencia | 13003-10 | |
| Londres pinza | Herramientas de Bellas Sceince | 11080-02 | |
| 2% de clorhexidina solución | Allivet | 30159 | Alternativa proveedor: PetSolutions |
| 10% de povidona solución de yodo | CVS | SKU # 739575 | |
| Hot cordón esterilizador | Aparato de Harvard | 610183 |
Tabla 1. Tabla de reactivos y equipos específicos.
Referencias
- Kirby, E. D. Basolateral amygdala regulation of adult hippocampal neurogenesis and fear-related activation of newborn neurons. Mol. Psychiatry. , (2011).
- Goosens, K. A., Maren, S. Contextual and auditory fear conditioning are mediated by the lateral, basal, and central amygdaloid nuclei in rats. Learn Mem. 8, 148-155 (2001).
- Korz, V., Frey, J. U. Bidirectional modulation of hippocampal long-term potentiation under stress and no-stress conditions in basolateral amygdala-lesioned and intact rats. J. Neurosci. 25, 7393-7400 (2005).
- Bhatnagar, S., Vining, C., Denski, K. Regulation of chronic stress-induced changes in hypothalamic-pituitary-adrenal activity by basolateral amygdala. Ann. N.Y. Acad. Sci. 1032, 315-319 (2004).
- Ikegaya, Y., Saito, H., Abe, K. Attenuated hippocampal long-term potentiation in basolateral amygdala-lesioned rats. Brain Res. 656, 157-164 (1994).
- Ikegaya, Y., Saito, H., Abe, K. The basomedial and basolateral amygdaloid nuclei contribute to the induction of long-term potentiation in the dentate gyrus in vivo. Eur. J. Neurosci. 8, 1833-1839 (1996).
- Carter, R. N., Pinnock, S. B., Herbert, J. Does the amygdala modulate adaptation to repeated stress. Neurosciene. 126, 9-19 (2004).
- Roozendaal, B., McGaugh, J. L. Basolateral amygdala lesions block the memory-enhancing effects of glucocorticoid administration in the dorsal hippocampus of rats. Eur. J. Neurosci. 9, 76-83 (1997).
- Roesler, R., Roozendaal, B., McGaugh, J. L. Basolateral amgdala lesions block the memory-enhancing effect of 8-Br-cAMP infused into the entorhinal cortex of rats after training. Eur. J. Neurosci. 15, 905-910 (2002).
- Roozendaal, B. Glucocorticoid effects on memory consolidation depend on functional interactions between the medial prefrontal cortex and basolateral amygdala. J. Neurosci. 29, 14299-14308 (2009).
- Kaufer, D. Restructuring the neuronal stress response with anti-glucocorticoid gene delivery. Nat. Neurosci. 7, 947-953 (2004).
- Paxinos, G., Watson, C. . The rat brain: in stereotaxic coordinates-the new coronal set. , (2004).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable Stereotaxic Surgery in Rodents. J. Vis. Exp. (20), e880 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados