Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Chirurgie stéréotaxique pour lésion excitotoxique des zones spécifiques du cerveau chez le rat adulte
Dans cet article
Résumé
L'ablation ciblée de la région spécifique du cerveau (s) par perfusion d'une excitotoxine en utilisant les coordonnées stéréotaxique est décrite. Cette technique pourrait également être adapté pour perfusion d'autres produits chimiques dans le cerveau de rat.
Résumé
De nombreuses fonctions de comportement chez les mammifères, y compris les rongeurs et les humains, sont médiés principalement par les régions discrètes du cerveau. Une méthode courante pour discerner la fonction de diverses régions du cerveau pour le comportement ou d'autres résultats expérimentaux est de mettre en œuvre une ablation localisée de la fonction. Chez les humains, les populations de patients atteints de lésions cérébrales localisées sont souvent étudiés pour les déficits, dans l'espoir de révéler la fonction sous-jacente de la zone endommagée. Chez les rongeurs, on peut induire expérimentalement des lésions de régions spécifiques du cerveau.
Lésion peut être accompli de plusieurs façons. Lésions électrolytiques peuvent provoquer des dommages localisés, mais peuvent endommager une variété de types cellulaires ainsi que les fibres qui traversent des autres régions du cerveau qui se trouvent près de la site de la lésion. Inductibles techniques génétiques à l'aide de cellules de type promoteurs spécifiques peuvent également permettre un ciblage spécifique au site. Ces techniques sont complexes et pas toujours pratique en fonction de la zone du cerveau cible. Excitotlésion oxique utilisant la chirurgie stéréotaxique, en revanche, est l'une des méthodes les plus fiables et pratiques de lesioning neurones excitateurs, sans endommager les cellules gliales locales ou traversant des fibres.
Ici, nous présentons un protocole pour perfusion stéréotaxique du excitotoxine, N-méthyl-D-aspartate (NMDA), dans le complexe basolatéral amygdale. En utilisant les indications anatomiques, nous appliquons les coordonnées stéréotaxiques pour déterminer l'emplacement de notre région du cerveau cible et abaisser une aiguille d'injection en place juste au-dessus de la cible. Nous avons ensuite infuser notre excitotoxine dans le cerveau, entraînant la mort excitotoxique des neurones voisins. Bien que notre sujet expérimental de choix est un rat, les mêmes méthodes peuvent être appliquées à d'autres mammifères, avec les ajustements appropriés dans les équipements et les coordonnées.
Cette méthode peut être utilisée sur une variété de régions du cerveau, y compris l'amygdale basolatérale 1-6, d'autres noyaux amygdale 6, 7, 8 hippocampe, entorhinal cortex 9 et du cortex préfrontal 10. Il peut également être utilisé pour infuser composés biologiques tels que des vecteurs viraux, 11 1. La technique de base stéréotaxique pourrait également être adapté pour l'implantation de plus de permanents pompes osmotiques, ce qui permet une exposition plus prolongée à un composé d'intérêt.
Protocole
Anesthésie et l'analgésie: Trente minutes avant l'anesthésie, injecter le rat avec 0,05 mg de buprénorphine / kg sous-cutanée pour l'analgésie. Initier une anesthésie avec 30-40 mg / kg par voie intrapéritonéale de sodium pentobarbital. À ce stade, aussi injecter de l'atropine pour éviter une insuffisance respiratoire (0,4 mg / kg, sous-cutanée) et le méloxicam comme analgésique supplémentaire (2 mg / kg sous-cutanée). Si après 5 minutes, le rat est encore mobile ou sensible à pincement de l'orteil, administrer les doses suivantes de pentobarbital de sodium à 5 mg / kg (par voie intrapéritonéale) jusqu'à ce que le rat ne répond pas à la douleur. Avant d'effectuer la première incision, injecter de lidocaïne (5 mg / kg, par voie intradermique) à l'endroit de l'incision pour l'anesthésie locale. Six à huit heures après l'injection initiale, injecter le rat avec 0,05 mg de buprénorphine / kg sous-cutanée pour l'analgésie. La buprénorphine peut être injecté tous les 6-8 heures qui suivent, si nécessaire, si ce n'est généralement pas nécessaire.
Il est important de noter que d'autres formes de c l'anesthésieune interférer avec lésions excitotoxiques. Par exemple, bien que la kétamine est une forme couramment utilisé de l'anesthésie chez les rongeurs, il peut interférer avec des lésions induites par le NMDA, car il est un antagoniste du récepteur NMDA. Il est important de choisir une méthode d'induction de l'anesthésie qui ne réduit pas la taille des lésions. Si l'anesthésie au gaz est souhaitée, la plupart des appareils stéréotaxiques, y compris celles qui sont décrites ici peuvent accueillir des adaptateurs de masques à gaz.
Remarque: Les matériaux sont décrits plus loin dans le tableau des réactifs spécifiques et des équipements ci-dessous.
1. Préparation de la pompe et Stereotax
- Remplissez un seringue de 10 ul Hamilton à l'eau stérile et le monter dans le chariot d'une pompe 6 seringue programmable. Fixer l'extrémité du piston de seringue dans le support fixé à la pompe.
- Prefill gaz stérilisée PE20 tube avec de l'eau stérile à l'aide d'une aiguille et seringue de 1 ml. Coulisser l'extrémité ouverte du tube à la seringue Hamilton, étant soinsutile pour éviter de créer des bulles d'air dans le tube.
- Serrer le Calibre 30, plate-coupe, une extrémité de pouce aiguille de perfusion de la tubulure sur le bras d'un dispositif stéréotaxique utilisant un manipulateur d'électrode barillet de style. Insérer l'aiguille de perfusion entre le collier et le canon rainurée. Fixer la pince sur une pièce de la tubulure aiguille métallique contenant en son sein afin d'éviter l'aplatissement du tube et en limitant l'écoulement de fluide.
- Réglez le débit de la pompe à> 5 pi / min et tourner sur la pompe. Un cordon de l'eau doit apparaître à la pointe de l'aiguille de perfusion. Vérifiez la longueur de la tubulure et de ses articulations pour s'assurer qu'il n'y ait pas de fuites.
- Essuyez l'eau perle avec un écouvillon stérile et régler la pompe à se retirer. Retirer une bulle d'air 2 pl. Le sommet de la bulle devrait être visible dans le tube.
- Immerger la pointe de l'aiguille de perfusion dans une solution à 20 mg / ml de NMDA dans stérile 0,1 M PBS et retirer ul 4-5. Une bulle d'air ne devrait être visible entre l'eau stérile et la solution NMDAdans la pointe. Il est important de noter que NMDA est une puissante neurotoxine et la prudence doit être utilisé dans la préparation et la manipulation de cette solution. Gants et lunettes de protection est conseillé à tout moment.
2. Montez le Rat dans l'appareil stéréotaxique
- La figure 1 illustre les éléments de base de l'appareil de stéréotaxie. Après le rasage de tête du rat à partir de la ligne des yeux aux oreilles, de charger les dents de devant du rat sur la barre de morsure, avec le corps du rat reposant sur un coussin chauffant à feu moyen. La langue doit pendre en dessous de la barre de morsure, avec la mâchoire inférieure. Si disponible, un coussin chauffant la température retour serait préférable. Surveillance de la température rectale serait également idéal.
- Tenir le cou du rat avec le pouce et l'index, déplacez le canal de l'oreille droite sur la barre horizontale oreille droite. La barre devrait se sentir comme elle est posée sur une place solide, pas comme il s'enfonce loin dans la tête. En tenant le côté droit de la tête droite, faites glisser à l'oreille gauchebarre dans la gauche du rat canal horizontal. Il devrait se sentir comme elle est posée sur une place solide. Les pennes devrait ressembler symétrique et devrait apparaître à plat sur les barres d'oreilles. La hausse du torchage de pennes indique un mauvais positionnement des barres d'oreilles. La tête ne doit pas vaciller en réponse à la pression au niveau du cou.
- Visser la barre le nez. Soyez doux. Les os dans le nez est délicat et la barre de nez n'a pas besoin d'être serré. Vérifiez que le rat est encore anesthésié avant de procéder.
3. Préparation du Rat pour la chirurgie
- Avec un écouvillon stérile, placez doucement une petite quantité de pommade ophtalmique lubrifiante vétérinaire dans chacun des yeux du rat pour les protéger du dessèchement et de débris.
- Concentrique à partir du site d'incision planifiée à l'arête de la région rasé, essuyer le cuir chevelu du rat avec une solution de chlorhexidine 2% à 70% d'éthanol suivie trois fois. Gommage chlorhexidine peut également être utilisé si désinfectant plus efficace est souhaitée.Terminer en essuyant avec une solution de povidone iodée à 10%. Le cuir chevelu est maintenant préparé stérile et ne doit être touché avec des matériaux stériles.
- Enfiler des gants stériles pour des mesures supplémentaires parce que vous allez faire face à la prochaine sur le site préparé chirurgicale.
- Placez un champ stérile de sorte que la fenestration expose le site chirurgical.
4. Création de la fenêtre chirurgicale
- Utilisation d'une lame de scalpel # 10, faire une incision (environ 2 cm de longueur) le long de la ligne médiane longitudinale du cuir chevelu. L'incision doit commencer postérieure à la ligne des yeux. Avec le pouce et l'index de la main non-dominante, maintenir le cuir chevelu dans traction perpendiculaire à la direction de l'incision.
- Tirez sur le fascia recouvrant la surface du crâne sur les bords du site chirurgical à l'aide de coton stériles conseils. Il faudra une certaine force pour effacer le crâne afin qu'il puisse être vu.
- Utilisez les quatre courbes, hémostatiques stériles pour créer une fenêtre chirurgicale. Fascia Clamp (PAS la peau) sur l'évaluation environnementaleCH côté des faces antérieure et postérieure de l'incision et ensuite fixer les colliers aux côtés de l'animal, tirant ainsi l'incision ouverte et complètement exposer le crâne.
5. Mise à niveau du crâne et Création le trou
- Localisez bregma, le point antérieur, où les trois principales plaques du crâne de répondre, comme le montre la figure 2. Déplacer l'aiguille de perfusion de sorte que la pointe de l'aiguille touche juste le crâne au bregma. Notez le dorso-ventral de coordonnées. Figure 3 montre comment lire les coordonnées sur un dispositif Stoelting stéréotaxique. Remarque, à ce stade, des gants ne sont plus stériles et ne doit pas toucher le site de la chirurgie stérile directement. Remarque: Après avoir touché l'appareil stéréotaxique non stérile, le chirurgien n'est plus stérile et ne doit pas toucher le site opératoire, ni les pièces d'équipement qui va toucher le site opératoire.
- Localisez lambda, la pointe postérieure, où les trois principales plaques du crâne de répondre, comme depicted sur la figure 2. Soulevez légèrement l'aiguille de perfusion et de le déplacer vers l'arrière à la lambda. Abaissez l'aiguille jusqu'à ce qu'elle touche le crâne à lambda. Lire la coordonnée dorso-ventral. Si le crâne est de niveau, il sera à moins de 0,1 mm de la lecture bregma. Si elle est plus loin que cela, déplacer l'aiguille vers le haut (hors de la voie), desserrer la barre nez, augmenter ou d'abaisser la plate-forme barre de morsure, selon le extrémité de la tête est trop élevé, et puis re-mesure.
- Déplacer l'aiguille de perfusion au cours bregma et enregistrer les coordonnées antéro-postérieur et médio-latérale. Calculer où l'aiguille doit être déplacé sur la base de coordonnées de la région du cerveau d'intérêt selon un cerveau atlas 12. Pour la BLA, soustraire 2,8 mm de la coordonnée antéro-postérieure et soit ajouter ou de soustraire 5,1 mm vers / à partir de la coordonnée médio-latérale en fonction de si vous souhaitez cibler la gauche ou la droite. Déplacer l'aiguille de perfusion à la position calculée.
- Balancez le necDLE de la route, en prenant soin de garder une trace de l'endroit où il a été établi et, ensuite percer un trou d'environ 2 mm de diamètre à cet endroit en utilisant un outil de Dremel moto-avec une mèche dentaire stérile attaché. Percer soigneusement que lorsque le foret perce le crâne, il aura tendance à tirer vers le bas, qui risque d'endommager la dure-mère et le tissu cérébral en dessous. Equarrissez le trou pour l'agrandir.
- Absorber le sang avec un coton-tige stérile.
6. La perfusion de neurotoxine
- Balancez le dos aiguille dans la position. Abaisser l'aiguille jusqu'à ce qu'il touche la surface du cerveau. Notez les coordonnées dorso-ventral. Il s'agit du niveau de la dure-mère. Soustraire la valeur appropriée pour atteindre la région du cerveau d'intérêt. Pour l'amygdale basolatérale, soustraire 6,7 mm.
- Abaissez l'aiguille de perfusion pour le niveau calculé lentement. Puis le soulever back up, bien au-dessus du crâne. Utilisez un fil Hamilton nettoyage seringue pour débloquer la pointe de l'aiguille de perfusion, en faisant attention de ne pas touch l'extrémité du fil qui vient en contact avec l'aiguille de perfusion non stérile avec des gants.
- Faire fonctionner la pompe à> 5 pi / min et assurez-vous voir un cordon de liquide sortir de l'aiguille de perfusion. Si ce n'est pas, déboucher avec le fil et essayez à nouveau.
- Abaissez l'aiguille de perfusion à l'souhaitée dorsale / ventrale niveau lentement.
- Réglez le taux de la pompe à perfusion à 0,1 ul / min et commencer la perfusion. Laisser infuser pendant 2 min.
- Une fois la perfusion a commencé, marquer les deux extrémités de la bulle d'air dans le tube avec un marqueur noir. Si les deux extrémités ne se déplacent pas, votre aiguille est bouchée. Arrêter la perfusion, relever l 'aiguille, déboucher avec le fil, contrôler le débit avec un débit élevé, ne rabaissez pas l'aiguille et essayez à nouveau.
- Une fois la perfusion est terminée, arrêter la pompe et attendre 5 min pour le NMDA de diffuser loin de la pointe de l'aiguille.
- Relevez l'aiguille de 0,5 mm, et laisser infuser pendant 1 min. Attendre 2,5 min pour le NMDA à diffuser hors de l'aiguille à pointe. Cette infusion supplémentaire, ilLPS sorte que toutes les BLA est couvert par la perfusion. Que cela est nécessaire pour d'autres régions cérébrales doit déterminer expérimentalement.
- Relevez l'aiguille sur le cerveau lentement et balancer le bras stéréotaxique de la route.
7. Fermeture de l'incision
- Don de nouveaux gants stériles à fermer l'incision.
- Essuyer tout excès de sang sur le crâne avec de coton stériles conseils et enlever les pinces de l'aponévrose.
- En utilisant des pinces de Londres, poussez les deux côtés de l'incision ensemble. Les bords intérieurs de la peau devrait se réunir et le bord externe de la peau ne devrait pas être autorisé à se recourber dans l'incision. Tout en appuyant sur l'incision fermée, s'appliquent clips plaie pour fermer la saillie fermement. Continuer à pousser la peau ensemble et discontinues sur la longueur de l'incision. Cela prend habituellement 3-5 clips de la plaie.
- Après avoir placé tous les clips de la plaie, utilisez la pince pour pincer les agrafes à nouveau, en s'assurant qu'ils sont en sécurité. Le t plus sûril clips, moins il est probable qu'un rat de les sortir avant l'incision est guérie.
- Swab l'incision agrafé avec une solution de povidone iodée à 10% et de retourner chez le rat dans sa cage la maison et moniteur jusqu'à ce que la mobilité est rétablie (habituellement 1-2 heures après l'anesthésie, la chirurgie du temps total de l'induction à la fermeture étant 30-45 min). À ce stade, le rat peut être retourné à la salle de la colonie. Après une semaine, enlever les agrafes avec un outil Dégrafeuse sous anesthésie à l'isoflurane.
- Utilisez un stérilisateur à chaud talon pour stériliser les surfaces d'embout de tous les instruments avant de l'utiliser sur le rat prochaine. Les instruments doivent être immergés dans les perles pour plus de 15 secondes, ou bien ils peuvent devenir trop chaud pour manipuler. Les instruments doivent être complètement refroidi avant d'être utilisé sur un autre animal.
8. Récupération
- Il est possible que les rats présentent une activité de saisie dans les jours qui suivent la lésion. Selon la région du cerveau endommagées, d'autres comportements comme la consommation d'aliments ou de grooming peut être affectée. Il est important que les animaux soient surveillés sur une base quotidienne afin de s'assurer qu'ils restent en bonne santé lors de la récupération. Les soins de soutien, tels que la nourriture liquide, à haute teneur en calories des aliments, ou d'une analgésie supplémentaire peut être nécessaire. La mortalité due à l'anesthésie survient dans un faible pourcentage de rats, habituellement de moins de 5%. La mortalité due à d'autres causes (infection, saignement) est extrêmement rare. Tout signe de détresse après la récupération de l'anesthésie peut être cause d'exclusion de futures études, mais sont extrêmement rares. La figure 4 illustre la perte de poids pendant les premiers jours qui suivent la chirurgie comme il devrait être prévu. Le poids corporel devrait rebondir dans 1 semaine.
9. Les résultats représentatifs
Une semaine ou plus après la perfusion NMDA, la lésion peut être visualisée en utilisant un contre-coloration crésyl-violet et microscopie en fond clair. Brains devrait être perfusé avec de la glace du paraformaldéhyde à 4% à froid, équilibrée dans saccharose à 30% dans 0,1 M PBS et frozfr. Ils devraient ensuite être tranché à 30-60 um, dans une série de 1:06-1:12 et montés sur des lames de verre recouvertes de gélatine avant de subir un contre violette norme de crésyl. La lésion doit correspondre à un "calvitie" ou une zone de violet de crésyl diminué en raison tache à la mort cellulaire suite d'une lésion. Les figures 5A et B montrent une lésion représentant de la BLA et le CEA. Cette image a été obtenue en utilisant un scanner à plat avec un scan à haute résolution (1200 dpi). Pour visualiser la lésion, il contribue à recolorer une série de sections dans une grande partie du tissu qui entoure la zone cible afin d'une lésion mal placée peut être situé.

Figure 1. Configuration stéréotaxique. Cette figure montre la stéréotaxique chez le rat avec les parties concernées étiquetés.

Figure 2. Bregma et lambda sur le sku ratll. Cette illustration montre les emplacements des bregma et lambda. Toutes les coordonnées sont mesurées par rapport à bregma. Lambda est utilisé pour faire en sorte que le crâne est de niveau.
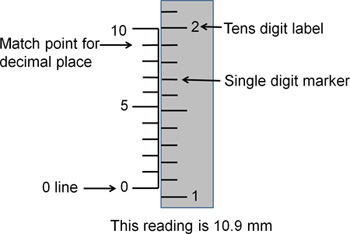
Figure 3. Lecture des coordonnées stéréotaxiques. Ce dessin représente une lecture standard stéréotaxique. Pour obtenir les chiffres à la gauche de la décimale, utilisez les marqueurs sur le côté droit. Le chiffre marqué correspond à l'endroit des dizaines (c.-à-1 = 10, 2 = 20). Les marques de hachage entre les chiffres marqués correspondent à des unités simples (1-9). La ligne de zéro indique à quel nombre entier l'stereotax est réglé. Ici, la ligne zéro est compris entre 10 et 11 de la marqueurs, indiquant que la température est comprise entre 10 et 11. Pour déterminer les chiffres à la droite de la virgule décimale, utilisez les marqueurs sur le côté gauche. Les marques de hachage sur la gauche sont numérotés de 0 à 10, avec chaque hachage non marqué qui représente une différence de l'unitéceux côté. Quelle que soit la marque de hachage sur les lignes à gauche le mieux avec les marques de hachage sur la droite indique la première décimale de la lecture de coordonnées. Ici, la marque de hachage sur la gauche correspondant au numéro 9 lignes mieux avec les marques du côté droit de hachage de sorte que la décimale est de 9. La lecture finale est de 10,9 mm.

Figure 4. Le changement de poids après la chirurgie. Ce graphique montre la moyenne (± SEM) de poids des rats ayant subi une chirurgie stéréotaxique (n = 17) ou n'avaient pas été opérés (n = 6). Jour 0 est le jour de la chirurgie. Après la chirurgie, le poids des rats a diminué pendant 2-3 jours après la chirurgie et a ensuite augmenté la journée autour de 5-6.
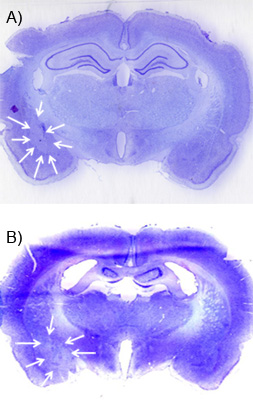
Figure 5. Par exemple une lésion excitotoxique. A) Cette image montre un violet de crésyl recolorer sur une tranche 30 um coronale avec le chauve "spot »de la lésion de l'amygdale NMDA basolatérale. Les flèches blanches donnent un aperçu de la lésion. Il peut être comparé au côté opposé de la tranche du cerveau qui n'a pas de lésion. B) Une lésion similaire de la centrale amygdale noyau.
Discussion
La méthode présentée ici permet stéréotaxique pour une lésion excitotoxique des zones spécifiques du cerveau par l'intermédiaire d'infusion de NMDA. Les méthodes de base stéréotaxiques peut être adapté pour infuser une variété d'agents pharmacologiques et biologiques d'une manière spécifique au site. Il peut également être adaptée pour cibler une variété de régions du cerveau, définis par leurs coordonnées stéréotaxiques du cerveau dans un atlas 12. Adaptation à d&#...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été soutenu ya CIRM bourse pré-doctorale (CDIP), le Prix du jeune chercheur NARSAD (DK) et le prix NIMH CERVEAUX (R01MH087495) (NSP).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| N-méthyl-D-aspartique acide 98% | Fisher Scientific | AC32919-0500 | |
| Double standard Lab stéréotaxique W/45 °. Barres d'oreilles | Stoelting | 51653 | Fournisseur alternatif: Kopf * note de prudence: assurer la compatibilité des accessoires stéréotaxiques si l'achat auprès de fournisseurs multiples |
| 10 ul SYR SPECIAL (* / * / *) | Hamilton | 701SN | |
| Dremel Moto-outil | Stoelting | 58600 | Fournisseur alternatif: Kopf |
| Fraises au carbure, la pièce à main HP, taille 2 | Schein | 2284578 | |
| Stoelting 6 Programme seringuePompe programmable | Stoelting | 53140 | Fournisseur alternatif: Kopf |
| Acier inoxydable 316 hypodermique paroi du tube régulier de calibre 30 0.0123 "OD x 0,00625" ID x .003 "mur (aiguille de perfusion) | Petites pièces | HTXX-30R-06-05 | |
| Intramedic PE 20 tubes (tubulure de perfusion) | VWR | 63019-025 | |
| Clips Reflex, 9mm, non stérile | Kent Scientific Corp | INS500346 | Fournisseur alternatif: Outils belle science |
| Applicateur de clips Reflex pour les clips 9mm | Kent Scientific Corp | 12031-09 | Fournisseur alternatif: Outils belle science |
| Courbé hémostatique Hartman | Outils belle science | 13003-10 | |
| Londres pince | Outils Sceince Beaux- | 11080-02 | |
| Une solution de chlorhexidine à 2% | Allivet | 30159 | Fournisseur alternatif: PetSolutions |
| 10% de solution d'iode povidone | CVS | SKU # 739575 | |
| Hot stérilisateur à billes | Harvard Apparatus | 610183 |
Tableau 1. Table des réactifs spécifiques et des équipements.
Références
- Kirby, E. D. Basolateral amygdala regulation of adult hippocampal neurogenesis and fear-related activation of newborn neurons. Mol. Psychiatry. , (2011).
- Goosens, K. A., Maren, S. Contextual and auditory fear conditioning are mediated by the lateral, basal, and central amygdaloid nuclei in rats. Learn Mem. 8, 148-155 (2001).
- Korz, V., Frey, J. U. Bidirectional modulation of hippocampal long-term potentiation under stress and no-stress conditions in basolateral amygdala-lesioned and intact rats. J. Neurosci. 25, 7393-7400 (2005).
- Bhatnagar, S., Vining, C., Denski, K. Regulation of chronic stress-induced changes in hypothalamic-pituitary-adrenal activity by basolateral amygdala. Ann. N.Y. Acad. Sci. 1032, 315-319 (2004).
- Ikegaya, Y., Saito, H., Abe, K. Attenuated hippocampal long-term potentiation in basolateral amygdala-lesioned rats. Brain Res. 656, 157-164 (1994).
- Ikegaya, Y., Saito, H., Abe, K. The basomedial and basolateral amygdaloid nuclei contribute to the induction of long-term potentiation in the dentate gyrus in vivo. Eur. J. Neurosci. 8, 1833-1839 (1996).
- Carter, R. N., Pinnock, S. B., Herbert, J. Does the amygdala modulate adaptation to repeated stress. Neurosciene. 126, 9-19 (2004).
- Roozendaal, B., McGaugh, J. L. Basolateral amygdala lesions block the memory-enhancing effects of glucocorticoid administration in the dorsal hippocampus of rats. Eur. J. Neurosci. 9, 76-83 (1997).
- Roesler, R., Roozendaal, B., McGaugh, J. L. Basolateral amgdala lesions block the memory-enhancing effect of 8-Br-cAMP infused into the entorhinal cortex of rats after training. Eur. J. Neurosci. 15, 905-910 (2002).
- Roozendaal, B. Glucocorticoid effects on memory consolidation depend on functional interactions between the medial prefrontal cortex and basolateral amygdala. J. Neurosci. 29, 14299-14308 (2009).
- Kaufer, D. Restructuring the neuronal stress response with anti-glucocorticoid gene delivery. Nat. Neurosci. 7, 947-953 (2004).
- Paxinos, G., Watson, C. . The rat brain: in stereotaxic coordinates-the new coronal set. , (2004).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable Stereotaxic Surgery in Rodents. J. Vis. Exp. (20), e880 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon