É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Cirurgia estereotáxica para lesão excitotóxica de áreas específicas do cérebro do rato adulto
Neste Artigo
Resumo
Ablação alvo de região específica do cérebro (s) por infusão de uma excitotoxina utilizando coordenadas estereotáxico é descrito. Esta técnica pode também ser adaptado para infusão de outros produtos químicos para o cérebro de rato.
Resumo
Muitas funções comportamentais em mamíferos, incluindo roedores e humanos, são mediados principalmente pelos regiões do cérebro discretos. Um método comum para a função o discernimento de várias regiões do cérebro para o comportamento ou outros resultados experimentais é implementar uma ablação localizada da função. Em humanos, as populações de pacientes com lesões cerebrais localizadas são frequentemente estudadas para os défices, na esperança de revelar a função subjacente da área danificada. Em roedores, pode-se induzir experimentalmente lesões de regiões específicas do cérebro.
Lesão pode ser realizado de várias maneiras. Lesões electrolíticas pode causar danos localizados mas irá prejudicar uma variedade de tipos de células, bem como fibras que atravessam a partir de outras regiões do cérebro que acontecem para ser próximo do local da lesão. Induzível técnicas genéticas utilizando células tipo promotores específicos pode também ativar site-specific segmentação. Estas técnicas são complexos e nem sempre é prático, dependendo da área do cérebro alvo. Excitotóxico lesão através de cirurgia estereotáxica, pelo contrário, é um dos métodos mais confiáveis e práticos da lesioning neurônios excitatórios sem danificar locais células gliais ou atravessando fibras.
Aqui, nós apresentamos um protocolo para infusão estereotáxico do excitotoxina, N-metil-D-aspartato (NMDA), no complexo amígdala basolateral. Usando indicações anatômicas, aplicamos coordenadas estereotáxicas para determinar a localização da nossa região do cérebro alvo e baixar uma agulha de injeção no local um pouco acima do alvo. Em seguida, infundir nosso excitotoxina no cérebro, resultando em morte excitotóxica de neurônios próximos. Embora o nosso sujeito experimental de escolha é um rato, os mesmos métodos podem ser aplicados a outros mamíferos, com os ajustes apropriados em equipamentos e coordenadas.
Este método pode ser usado em uma variedade de regiões do cérebro, incluindo a amígdala basolateral 1-6, os núcleos amígdala outro 6, 7, 8 hipocampo, entorhinal córtex 9 e córtex pré-frontal 10. Também pode ser utilizado para infundir compostos biológicos, tais como vectores virais 1, 11. A técnica básica estereotáxico poderia também ser adaptado para a implantação de mais permanentes bombas osmóticas, permitindo a exposição mais prolongada a um composto de interesse.
Protocolo
Anestesia e analgesia: Trinta minutos antes da anestesia, injectar no rato com 0,05 mg / kg por via subcutânea a buprenorfina para analgesia. Inicie a anestesia com sódio mg / kg 30-40 intraperitoneal de pentobarbital. Neste ponto, também injectar atropina para evitar a insuficiência respiratória (0,4 mg / kg, subcutânea) e meloxicam como analgésico mais (2 mg / kg por via subcutânea). Se depois de 5 minutos, o rato é ainda móvel ou responsiva à pitada dedo do pé, dar as doses subsequentes de pentobarbital de sódio a 5 mg / kg (via intraperitoneal), até que o rato é insensível à dor. Antes de realizar a primeira incisão, injectar lidocaína (5 mg / kg, intradérmica) no local da incisão para anestesia local. Seis a oito horas após a injecção inicial, injectar no rato com 0,05 mg / kg por via subcutânea a buprenorfina para analgesia. A buprenorfina pode ser injetado a cada 6-8 horas depois, se necessário, embora este geralmente não é necessário.
É importante notar que as outras formas de c anestesiaum interferir com lesões excitotóxicas. Por exemplo, embora a cetamina é uma forma geralmente usado de anestesia em roedores, pode interferir com lesões induzidas com NMDA, porque é um antagonista do receptor de NMDA. É importante seleccionar um método de indução de anestesia que não reduz o tamanho da lesão. Se a anestesia de gás for desejado, a maioria dos dispositivos estereotáxicas, incluindo os descritos aqui podem acomodar placas de máscara de gás.
Nota: Os materiais são descritos mais na Tabela de reagentes específicos e equipamentos abaixo.
1. Preparação da bomba e Stereotax
- Encher uma seringa de Hamilton 10 ul com água estéril e montá-lo para o transportador de uma bomba de seringa 6 programável. Fixar a extremidade do êmbolo da seringa no suporte fixada na bomba.
- Prefill gás-esterilizado PE20 tubagem com água estéril usando uma agulha e seringa 1 ml. Deslizar a extremidade aberta do tubo para a seringa de Hamilton, sendo o cuidadoful para evitar a criação de quaisquer bolhas de ar no tubo.
- Prender a 30ga, plana de corte, ponta de agulha 1 polegada de infusão da tubagem para o braço de um dispositivo estereotáxico utilizando um manipulador eléctrodo barril de estilo. Inserir a agulha de infusão entre a braçadeira eo cano estriado. Coloque a braçadeira ao longo de um pedaço de tubo contendo agulha de metal no seu interior, para evitar o achatamento da tubagem e restringindo o fluxo de fluido.
- Ajustar a taxa de bomba para> 5 ul / min e ligar a bomba. Uma gota de água deve aparecer na ponta da agulha de infusão. Verifique o comprimento da tubulação e suas articulações para se certificar de que não há vazamentos.
- Limpe a água do cordão, com um cotonete estéril e definir a bomba para retirar. Retirar a 2 bolha de ar ul. A parte superior da bolha deve ser visível na tubagem.
- Mergulha-se o ponta da agulha de perfusão em uma solução de 20 mg / ml de NMDA no estéril 0,1 M PBS e retirar uL 4-5. Uma bolha de ar deve ser visível entre a água estéril ea solução NMDAna ponta. É importante notar que NMDA é um potente neurotoxina e cuidado deve ser usado na preparação e manuseamento desta solução. Luvas e proteção para os olhos são aconselhados em todos os momentos.
2. Monte o rato no dispositivo Estereotáxica
- A Figura 1 mostra as partes básicas do dispositivo estereotáxico. Depois de raspar a cabeça do rato a partir da linha dos olhos para as orelhas, coloque os dentes da frente do rato sobre a barra de mordida, com o corpo do rato repousa sobre uma almofada de aquecimento definida em médio prazo. A língua deve ficar abaixo da barra de mordida, com o maxilar inferior. Se disponível, uma temperatura almofada de aquecimento gabarito seria preferível. Monitorar a temperatura retal também seria ideal.
- Segurando o pescoço do rato com o polegar eo indicador, mova o canal do ouvido direito sobre a barra horizontal orelha direita. A barra deve sentir como ele está descansando em um lugar sólido, não como ele afunda muito na cabeça. Segurando o lado direito da cabeça constante, deslize da orelha esquerdabarrar no canal do rato orelha esquerda horizontal. Deve sentir como ele está descansando em um lugar sólido. O orelhas deve olhar simétrico e deve aparecer para deitar-se as barras de ouvido. Upward queima de orelhas indica um posicionamento inadequado das barras de ouvido. A cabeça não deve oscilar em resposta à pressão no pescoço.
- Aparafuse a barra de nariz. Seja gentil. Os ossos do nariz são delicadas e barra de nariz não precisa ser apertado. Verifique se o rato é ainda anestesiado antes de prosseguir.
3. Preparando o Rato para a cirurgia
- Usando uma zaragatoa estéril, suavemente colocar uma pequena quantidade de pomada oftálmica veterinária lubrificante em cada um dos olhos do rato para protegê-los a partir de secagem e detritos.
- Concentricamente a partir do local da incisão planeada para a borda da região raspada, limpe couro cabeludo do rato com uma solução de clorexidina 2%, seguido de etanol a 70%, três vezes. Esfrega clorexidina pode também ser utilizados se desinfectante mais eficaz for desejado.Termine limpando com solução a 10% iodopovidona. O couro cabeludo é preparada agora estéril e só deve ser tocado com materiais estéreis.
- Luvas estéreis para Don novas medidas porque você vai lidar com o próximo local preparado cirúrgico.
- Colocar uma cortina estéril de modo que a fenestração expõe o local cirúrgico.
4. Criando a janela cirúrgica
- Usando uma lâmina de bisturi # 10, fazer uma incisão (aproximadamente 2 cm de comprimento) ao longo da linha mediana longitudinal do couro cabeludo. A incisão deve começar posterior em relação à linha dos olhos. Com o polegar eo dedo indicador da mão não-dominante, segurar o couro cabeludo em perpendicular à direcção da tensão da incisão.
- Puxar o fáscia que recobre a superfície do crânio para as bordas do local cirúrgico utilizando estéreis de algodão-dicas. Vai levar um pouco de força para limpar o crânio para que ele possa ser visualizado.
- Use quatro curvas, hemostats estéreis para criar uma janela cirúrgica. Fáscia braçadeira (não de pele) em EAch lado dos aspectos anteriores e posteriores da incisão e, em seguida colocar os grampos ao lado do animal, fazendo assim avançar o incisão aberta e inteiramente expondo o crânio.
5. Nivelamento da Caveira e Criando o orifício piloto
- Localizar bregma, o ponto anterior em que as três placas principais do crânio se encontram, como representado na Figura 2. Mova a agulha da infusão para a ponta da agulha só toca o crânio, bregma. Observe o dorso-ventral Figura coordenadas. 3 demonstra como ler coordenadas em um dispositivo Stoelting estereotáxica. Nota, neste ponto, as luvas são já não estéril e não deve tocar no local da cirurgia estéril directamente. Nota: Depois de tocar o dispositivo não estéril estereotáxico, o cirurgião não é mais estéril e não deve tocar no local cirúrgico, nem partes do equipamento que irá tocar o local cirúrgico.
- Localizar lambda, o ponto posterior onde os três placas principais do crânio se encontram, como depicted na Figura 2. Levante a agulha da infusão ligeiramente e movê-lo para trás para lambda. Baixe a agulha até que toque o crânio em lambda. Leia a coordenada dorso-ventral. Se o crânio é nível, será de 0,1 mm da leitura bregma. Se for mais longe do que isso, mover a agulha para cima (fora do caminho), solte a barra de nariz, aumentar ou reduzir tanto a plataforma barra de mordida, dependendo do final da cabeça é muito alto, e então re-medida.
- Mova a agulha da infusão sobre bregma e gravar as coordenadas ântero-posterior e medial-lateral. Calcular onde a agulha deve ser movido com base nas coordenadas de a área do cérebro de interesse de acordo com um cérebro atlas 12. Para o BLA, subtraia 2,8 milímetros a partir da coordenada ântero-posterior e adicionar ou subtrair 5,1 mm a / a partir da coordenada medial-lateral, dependendo se você deseja atingir a esquerda ou direita. Mover a agulha de infusão para a posição calculada.
- Balance o needle fora do caminho, tomando cuidado para manter o controle de onde foi localizado e, em seguida, faça um furo de aproximadamente 2 mm de diâmetro em que local usando uma Dremel moto-ferramenta com uma broca dental estéril anexado. Fure com cuidado, quando a broca rompe o crânio, ele tenderá a puxar para baixo, podendo danificar o tecido cerebral e dura por baixo. Resma do buraco para ampliá-la.
- Absorver todo o sangue com um cotonete estéril.
6. A infusão de neurotoxina
- Balance a agulha de volta para a posição. Baixe a agulha até tocar a superfície do cérebro. Registre a coordenada dorso-ventral. Este é o nível de dura. Subtrair o valor apropriado para alcançar a região do cérebro de seu interesse. Para a amígdala basolateral, subtrair 6,7 mm.
- Baixar a agulha de perfusão para o nível calculado lentamente. Em seguida, levantar-lo de volta, bem acima do crânio. Use um fio de Hamilton limpeza seringa para desobstruir a ponta da agulha de infusão, tomando cuidado para não tai a extremidade do fio que entra em contacto com a agulha de perfusão com não-estéreis luvas.
- Executar a bomba em> 5 uL / min e certifique-se ver uma gota de líquido sair da agulha da infusão. Se não, desentupir com o fio e tente novamente.
- Abaixe a agulha da infusão para o nível desejado dorsal / ventral lentamente.
- Definir a taxa sobre a bomba de infusão a 0,1 ul / min e iniciar a infusão. Infundir durante 2 min.
- Uma vez que a infusão foi iniciado, marcar as duas extremidades da bolha de ar na tubagem com um marcador preto. Se ambas as extremidades não se movem, a agulha está obstruída. Parar a infusão, levantar a agulha, desentupir com o fio, para verificar fluxo com uma taxa de fluxo elevado, re-diminuir a agulha e tentar de novo.
- Uma vez que a infusão está completa, parar a bomba e esperar 5 min para o NMDA para difundir para longe da ponta da agulha.
- Levantar a agulha de 0,5 mm, e infundir novamente durante 1 min. Espere 2,5 min para o NMDA para difundir para longe da ponta da agulha. Esta infusão extra que eleLPS assegurar todo o BLA é coberta pela infusão. Se isto é necessário para outras regiões do cérebro deve determinada experimentalmente.
- Levante a agulha para fora do cérebro lenta e balançar o braço estereotáxico para fora do caminho.
7. Fechamento da incisão
- Don novas luvas estéreis para fechar a incisão.
- Limpe qualquer excesso de sangue no crânio com algodão estéril de dicas e remover os grampos da fáscia.
- Utilizando uma pinça de Londres, empurrar os dois lados da incisão em conjunto. As arestas interiores da pele deve satisfazer ea borda exterior da pele não deve ser permitido para enrolar na incisão. Enquanto pressiona a incisão fechada, aplicar grampos de sutura para fechar a protrusão firmemente. Continuar a empurrar a pele em conjunto e grampo ao longo do comprimento da incisão. Isso normalmente leva 3-5 grampos de sutura.
- Depois de colocar todos os clipes da ferida, use a pinça para prender os grampos novamente, certificando-se que eles são seguros. O t mais seguroele clips, menor a probabilidade de um rato vai retirá-los antes da incisão tenha cicatrizado.
- Swab a incisão grampeada com solução a 10% iodopovidona e retornar o rato para sua gaiola e monitor até que a mobilidade é restaurada (normalmente 1-2 horas após a anestesia, tempo total de cirurgia de indução ao fechamento sendo 30-45 min). Neste ponto, o rato pode ser retornada para a sala de colónia. Após uma semana, remover grampos com uma ferramenta de removedor de grampos, sob anestesia com isoflurano.
- Use um esterilizador quente talão para esterilizar as superfícies da ponta de todos os instrumentos antes da utilização no rato seguinte. Os instrumentos devem ser imersos nas pérolas para não mais do que 15 segundos, ou podem tornar-se demasiado quente para manipular. Os instrumentos devem ser totalmente resfriado antes usada em outro animal.
8. Recuperação
- É possível que os ratos serão exibem actividade convulsiva, nos dias após a lesão. Dependendo da região do cérebro danificadas, outros comportamentos, tais como consumo de alimentos ou grooming pode ser afetada. É importante que os animais ser monitorizado numa base diária para assegurar que eles permanecem saudáveis durante a recuperação. O tratamento de suporte, tais como alimentos líquidos, de alto teor calórico dos alimentos, ou analgesia adicional pode ser necessária. A mortalidade por anestesia ocorre em uma baixa percentagem de ratos, geralmente inferior a 5%. A mortalidade por outras causas (infecções, hemorragias) é extremamente raro. Quaisquer sinais de angústia após a recuperação da anestesia pode ser motivo de exclusão a partir de estudos futuros, mas são extremamente raros. Figura 4 mostra a perda de peso durante os primeiros dias após a cirurgia como deveria ser esperado. O peso corporal deve se recuperar dentro de 1 semana.
9. Os resultados representativos
Uma semana ou mais após a infusão de NMDA, a lesão pode ser visualizada usando um contracorante cresilo-violeta e microscopia de campo claro. Cérebros deve ser perfundidos com paraformaldeído gelada 4%, equilibrada em sacarose a 30% em 0,1 M de PBS e frozen. Eles devem, então, ser cortado em 30-60 mM, de uma série de 01:06 - 1:12 e montada em lâminas de gelatina revestidos de vidro antes de sofrer uma contracorante violeta de cresilo padrão. A lesão deve corresponder a uma "careca", ou uma área de diminuição cresil violeta mancha devido à morte celular após lesão. Figuras 5A e B mostram uma lesão representante da AML e CeA. Esta imagem foi obtida utilizando um scanner de mesa com uma varredura de alta resolução (1200 dpi). Para visualizar a lesão, ele ajuda a contracoloração uma série de seções com grande parte do tecido que circunda a área alvo para uma lesão mal colocada pode ser localizado.

Figura 1. Configuração estereotáxica. Esta figura mostra a estereotáxica rato com as partes pertinentes rotulados.

Figura 2. Bregma e lambda na sku ratoll. Esta ilustração mostra os locais de bregma e lambda. Todas as coordenadas são medidas em relação à bregma. Lambda é usado para assegurar que o crânio é nível.
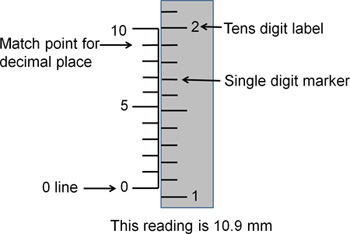
Figura 3. Lendo coordenadas estereotáxicas. Este desenho representa uma leitura padrão estereotáxica. Para obter os dígitos para a esquerda da casa decimal, utilizar os marcadores do lado direito. O dígito rotulado corresponde ao local dezenas (isto é, 1 = 10, 2 = 20). As marcas de hash entre os dígitos marcados correspondem às unidades individuais (1-9). A linha zero indica o que o inteiro stereotax está definido. Aqui, a linha de zero é entre os 10 e 11 marcadores, indicando que a leitura está entre 10 e 11. Para determinar os números para a direita da casa decimal, utilizar os marcadores do lado esquerdo. As marcas de hash à esquerda são numerados de 0 a 10, com cada hash não marcado que representa uma diferença unidade deaqueles ao lado dele. Qualquer que seja o das marcas de hash sobre as linhas de esquerda melhor até com as marcas de hash à direita indica a primeira casa decimal da leitura de coordenadas. Aqui, a marca hash na esquerda correspondente ao número 9 linhas até melhor com as marcas do lado direito de hash para a casa decimal é 9. A leitura final é de 10,9 mm.

Figura 4. Alteração de peso após a cirurgia. Este gráfico mostra o peso (± SEM) média de ratos submetidos a cirurgia estereotáxico (n = 17) ou não ter a cirurgia (n = 6). Dia 0 é o dia da cirurgia. Após a cirurgia, o peso de ratos diminuiu durante 2-3 dias após a cirurgia e, em seguida, aumentou cerca de 5-6 dias.
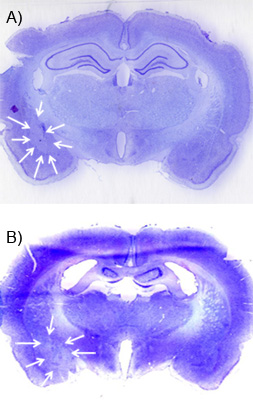
Figura 5. Exemplo lesão excitotóxica. A) Esta imagem mostra uma violeta cresil contracoloração em uma fatia 30 um coronal com o careca "mancha "de lesão de NMDA da amígdala basolateral. As setas brancas delinear a lesão. Ele pode ser comparado com o lado contralateral da fatia do cérebro que não tem nenhuma lesão. B) Uma lesão semelhante do núcleo central da amígdala.
Access restricted. Please log in or start a trial to view this content.
Discussão
O método aqui apresentado estereotáxico permite lesão excitotóxica de áreas específicas do cérebro através de infusão de NMDA. Os métodos básicos estereotáxicas pode ser adaptado para infundir uma variedade de agentes farmacológicos e biológicos de um modo específico do local. Ele também pode ser adaptado para orientar uma variedade de áreas do cérebro, definida pelas suas coordenadas estereotáxicas no cérebro atlas 12. Adaptação a outras espécies tais como ratos pode ser feita com um e...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi apoiado ya CIRM comunhão predoctoral (EDK), NARSAD Young Investigator Award (DK) e do NIMH prêmio CÉREBROS (R01MH087495) (DK).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| N-Metil-D-aspártico Ácido 98% | Fisher Scientific | AC32919-0500 | |
| Dupla Laboratório Padrão Estereotáxica w/45 graus. Barras de ouvido | Stoelting | 51653 | Fornecedor alternativo: Kopf * nota de cautela: garantir a compatibilidade de acessórios estereotáxicas se comprar de vários fornecedores |
| 10 ul SYR ESPECIAL (* / * / *) | Hamilton | 701SN | |
| Dremel Moto-Ferramenta | Stoelting | 58600 | Fornecedor alternativo: Kopf |
| Carbide brocas, peça de mão HP, tamanho 2 | Schein Dental | 2284578 | |
| Stoelting 6 Programa SeringaBomba programável | Stoelting | 53140 | Fornecedor alternativo: Kopf |
| Aço Inoxidável Hypodermic 316 Tubulação parede regular calibre 30 0,0123 "OD x 0,00625" ID x .003 "Wall (agulha de infusão) | Peças pequenas | HTXX-30R-06-05 | |
| Intramedic PE 20 tubagem (tubo de infusão) | VWR | 63019-025 | |
| Clipes Reflex, 9mm, não-estéril | Kent Scientific Corp | INS500346 | Vendedor Alternativa: Ferramentas de Ciência Belas |
| Aplicador Clipe Reflex para clipes de 9mm | Kent Scientific Corp | 12031-09 | Vendedor Alternativa: Ferramentas de Ciência Belas |
| Hemostat Hartman Curvo | Belas Ferramentas Ciência | 13003-10 | |
| Londres fórceps | Belas Ferramentas sceince | 11080-02 | |
| Solução de clorexidina a 2% | Allivet | 30159 | Fornecedor alternativo: PetSolutions |
| Solução de iodo de 10% povidona | CVS | SKU # 739575 | |
| Hot talão esterilizador | Harvard Apparatus | 610183 |
Tabela 1. Tabela de reagentes específicos e equipamentos.
Referências
- Kirby, E. D. Basolateral amygdala regulation of adult hippocampal neurogenesis and fear-related activation of newborn neurons. Mol. Psychiatry. , Forthcoming (2011).
- Goosens, K. A., Maren, S. Contextual and auditory fear conditioning are mediated by the lateral, basal, and central amygdaloid nuclei in rats. Learn Mem. 8, 148-155 (2001).
- Korz, V., Frey, J. U. Bidirectional modulation of hippocampal long-term potentiation under stress and no-stress conditions in basolateral amygdala-lesioned and intact rats. J. Neurosci. 25, 7393-7400 (2005).
- Bhatnagar, S., Vining, C., Denski, K. Regulation of chronic stress-induced changes in hypothalamic-pituitary-adrenal activity by basolateral amygdala. Ann. N.Y. Acad. Sci. 1032, 315-319 (2004).
- Ikegaya, Y., Saito, H., Abe, K. Attenuated hippocampal long-term potentiation in basolateral amygdala-lesioned rats. Brain Res. 656, 157-164 (1994).
- Ikegaya, Y., Saito, H., Abe, K. The basomedial and basolateral amygdaloid nuclei contribute to the induction of long-term potentiation in the dentate gyrus in vivo. Eur. J. Neurosci. 8, 1833-1839 (1996).
- Carter, R. N., Pinnock, S. B., Herbert, J. Does the amygdala modulate adaptation to repeated stress. Neurosciene. 126, 9-19 (2004).
- Roozendaal, B., McGaugh, J. L. Basolateral amygdala lesions block the memory-enhancing effects of glucocorticoid administration in the dorsal hippocampus of rats. Eur. J. Neurosci. 9, 76-83 (1997).
- Roesler, R., Roozendaal, B., McGaugh, J. L. Basolateral amgdala lesions block the memory-enhancing effect of 8-Br-cAMP infused into the entorhinal cortex of rats after training. Eur. J. Neurosci. 15, 905-910 (2002).
- Roozendaal, B. Glucocorticoid effects on memory consolidation depend on functional interactions between the medial prefrontal cortex and basolateral amygdala. J. Neurosci. 29, 14299-14308 (2009).
- Kaufer, D. Restructuring the neuronal stress response with anti-glucocorticoid gene delivery. Nat. Neurosci. 7, 947-953 (2004).
- Paxinos, G., Watson, C. The rat brain: in stereotaxic coordinates-the new coronal set. , Elsevier Academic Press. Burlington, MA. (2004).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable Stereotaxic Surgery in Rodents. J. Vis. Exp. (20), e880(2008).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados