È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
La chirurgia stereotassica della lesione eccitotossico di specifiche aree cerebrali nel ratto adulto
In questo articolo
Riepilogo
Ablazione mirata della regione specifica del cervello (s) mediante infusione di uno eccitotossina utilizzando le coordinate stereotassico descritto. Questa tecnica può anche essere adattato per l'infusione di altre sostanze chimiche nel cervello di ratto.
Abstract
Molte funzioni comportamentali nei mammiferi, compresi roditori ed esseri umani, sono mediate principalmente da regioni cerebrali distinte. Un metodo comune per discernere la funzione di regioni cerebrali diverse per comportamenti o altri risultati sperimentali è quello di attuare una ablazione localizzata di funzione. Negli esseri umani, popolazioni di pazienti con lesioni cerebrali localizzate sono spesso studiati per deficit, nella speranza di rivelare la funzione di base della zona danneggiata. Nei roditori, si può indurre sperimentalmente lesioni di regioni specifiche del cervello.
Lesione può essere realizzato in diversi modi. Lesioni elettrolitiche possono causare danni localizzati, ma per evitare di danneggiare una varietà di tipi di cellule così come attraversano le fibre provenienti da altre regioni del cervello che capita di essere vicino al sito della lesione. Inducibile tecniche genetiche utilizzando promotori specifici delle cellule di tipo può anche consentire site-specific targeting. Queste tecniche sono complessi e non sempre pratici a seconda della zona bersaglio del cervello. Excitotlesione ossico utilizzando chirurgia stereotassica, invece, è uno dei metodi più affidabili e pratici di neuroni eccitatori la lesione senza danneggiare locali cellule gliali o movimento fibre.
Qui, presentiamo un protocollo per infusione stereotassico del eccitotossina, N-metil-D-aspartato (NMDA), nel complesso basolaterale amigdala. Utilizzando le indicazioni anatomiche, si applica coordinate stereotassiche per determinare la posizione della nostra regione di destinazione cervello e abbassare un ago per iniezioni sul posto appena sopra il bersaglio. Abbiamo poi infondere alla nostra eccitotossina nel cervello, con conseguente morte delle neuroni vicini. Mentre il nostro soggetto sperimentale di scelta è un topo, gli stessi metodi possono essere applicati ad altri mammiferi, con gli opportuni adattamenti in attrezzature e coordinate.
Questo metodo può essere utilizzato in una varietà di regioni del cervello, compreso il basolaterale amigdala 1-6, altri nuclei amigdala 6, 7, 8 ippocampo, entorhinal corteccia prefrontale della corteccia 9 e 10. Può anche essere usate per somministrare composti biologici come vettori virali 1, 11. La tecnica di base stereotassico potrebbe anche essere adattato per l'impianto di più pompe osmotiche permanenti, consentendo più prolungata esposizione ad un composto di interesse.
Protocollo
Anestesia e analgesia: Trenta minuti prima dell'anestesia, iniettare il topo con 0,05 mg / kg per via sottocutanea buprenorfina per l'analgesia. Iniziato anestesia con 30-40 mg / kg intraperitoneale di sodio pentobarbital. A questo punto, anche iniettare atropina per prevenire insufficienza respiratoria (0,4 mg / kg, sottocutanea) e meloxicam come analgesico ulteriormente (2 mg / kg per via sottocutanea). Se dopo 5 minuti, il ratto è ancora mobile o sensibile al pinch punta, somministrare successive dosi di sodio pentobarbital a 5 mg / kg (intraperitoneale) finché il ratto è insensibile al dolore. Prima di eseguire la prima incisione, iniettare lidocaina (5 mg / kg, intradermica) presso il sito di incisione per l'anestesia locale. Da sei a otto ore dopo l'iniezione iniziale, iniettare il ratto con 0,05 mg / kg per via sottocutanea buprenorfina per l'analgesia. La buprenorfina può essere iniettata ogni 6-8 ore successive, se necessario, anche se questo genere non è necessario.
È importante notare che altre forme di c anestesiauno interferire con lesioni eccitotossiche. Ad esempio, sebbene ketamina è una forma comunemente usata di anestesia nei roditori, può interferire con lesioni indotte con NMDA perché è un antagonista del recettore NMDA. È importante selezionare un metodo di indurre anestesia che non ridurre la dimensione della lesione. Se l'anestesia gas si desidera, dispositivi più stereotassiche comprese quelle descritte qui in grado di ospitare schede di maschera antigas.
Nota: I materiali sono descritti più approfonditamente nella tabella di reagenti e attrezzature specifiche di seguito.
1. Preparazione della pompa e Stereotax
- Riempire una siringa da 10 microlitri Hamilton con acqua sterile e montarlo nel caddy di una pompa siringa 6 programmabile. Fissare la estremità dello stantuffo della siringa nel supporto fissato sulla pompa.
- Prefill gas-sterilizzato PE20 tubi con acqua sterile usando un ago e la siringa da 1 ml. Inserire l'estremità aperta del tubo al siringa Hamilton, essendo curautile per evitare di creare eventuali bolle d'aria nel tubo.
- Fissare la 30ga, piatta-cut, 1 pollice estremità dell'ago infusione del tubo al braccio di un dispositivo stereotassico utilizzando un barile stile manipolatore elettrodo. Inserire l'ago di infusione tra il morsetto e la canna rigata. Fissare la pinza su un pezzo di tubo contenente ago metallico al suo interno per evitare l'appiattimento del tubo e limitando il flusso di fluido.
- Regolare la velocità della pompa di> 5 microlitri / min e accendere la pompa. Una goccia d'acqua dovrebbe apparire sulla punta dell'ago infusione. Controllare la lunghezza del tubo e delle sue articolazioni per assicurarsi che non vi siano perdite.
- Eliminare l'acqua tallone con un tampone sterile e impostare la pompa a ritirarsi. Aspirare a 2 microlitri bolla d'aria. La parte superiore della bolla deve essere visibile nel tubo.
- Immergere la punta dell'ago in infusione a 20 mg / ml soluzione di NMDA in 0,1 M PBS sterile e ritirare ul 4-5. Una bolla d'aria deve essere visibile tra l'acqua sterile e la soluzione NMDAnella punta. È importante notare che NMDA è un potente neurotossina e cautela devono essere usati nella preparazione e all'uso di questa soluzione. Guanti e protezioni per gli occhi si consiglia in ogni momento.
2. Montare il Rat nel dispositivo stereotassico
- La Figura 1 illustra le parti fondamentali del dispositivo stereotassico. Dopo rasatura testa del ratto dalla linea degli occhi per le orecchie, caricare denti frontali del topo sulla barra morso, con il corpo del ratto che poggia su una piastra elettrica impostato su terreno. La lingua dovrebbe appendere sotto la barra del morso, con la mascella inferiore. Se disponibile, un feedback pad temperatura di riscaldamento sarebbe preferibile. Monitoraggio della temperatura rettale sarebbe anche l'ideale.
- Tenendo il collo del ratto con il pollice e l'indice, spostare il canale orecchio destro sulla barra orizzontale orecchio destro. La barra dovrebbe sentire come si poggia su una solida, non come affonda molto nella testa. Tenendo il lato destro della testa ferma, far scorrere l'orecchio sinistrobar nel canale sinistro del ratto orecchio in posizione orizzontale. Si deve sentire come si poggia su una solida. La pinna dovrebbe essere simmetrica e dovrebbe comparire a sdraiarsi sulle barre di auricolari. Svasatura verso l'alto dei padiglioni auricolari indica la distribuzione impropria delle barre di auricolari. La testa non deve oscillare in risposta alla pressione a livello del collo.
- Avvitare la barra naso. Sii gentile. Le ossa del naso sono delicati e la barra naso non deve essere stretto. Controllare che il ratto è ancora anestetizzato prima di procedere.
3. Preparazione del Rat di Chirurgia
- Utilizzando un tampone sterile, delicatamente mettere una piccola quantità di pomata oftalmica lubrificante veterinaria in ogni degli occhi del topo di proteggerli da essiccazione e detriti.
- Concentricamente dal sito incisione prevista al bordo della regione rasata, pulire cuoio capelluto del ratto con soluzione di clorexidina 2% seguita etanolo al 70% tre volte. Scrub clorexidina può anche essere utilizzato se disinfettante più efficace si desidera.Termina pulendo con una soluzione di iodio povidone al 10%. Il cuoio capelluto è ora preparato sterile e deve essere toccato con materiali sterili.
- Don guanti sterili per ulteriori passi, perché vi verrà ora affrontare il sito preparato chirurgico.
- Posizionare un telino sterile in modo che la fenestrazione espone il sito chirurgico.
4. Creare il Window chirurgico
- Utilizzando una lama di bisturi # 10, effettuare un'incisione (circa 2 cm di lunghezza) lungo la linea mediana longitudinale del cuoio capelluto. L'incisione dovrebbe iniziare posteriore alla linea degli occhi. Con il pollice e l'indice della mano non dominante, tenere il cuoio capelluto in tensione perpendicolare alla direzione della incisione.
- Tirare la fascia sovrastante la superficie del cranio ai bordi del sito chirurgico sterili utilizzando cotone punte. Ci vorrà una certa forza per cancellare il cranio in modo che possa essere visualizzato.
- Utilizzare quattro curve, hemostats sterili per creare una finestra chirurgica. Morsetto fascia (NON pelle) su EAch lato delle superfici anteriore e posteriore della incisione e poi fissare i morsetti a fianco l'animale, così tirando l'incisione aperta e completamente esporre il cranio.
5. Livellamento della Skull and Creazione del foro pilota
- Individuare bregma, il punto anteriore in cui le tre piastre principali del cranio incontrano, come illustrato in Figura 2. Spostare l'ago di infusione in modo che la punta dell'ago a contatto con il cranio al bregma. Si noti il dorso-ventrale coordinate. Figura 3 viene illustrato come leggere le coordinate su un dispositivo Stoelting stereotassico. Si noti, a questo punto, guanti non sono più sterile e non toccare il sito chirurgico sterile direttamente. Nota: Dopo aver toccato il dispositivo sterile stereotassica, il chirurgo non è più sterile e non deve toccare il sito chirurgico né parti delle apparecchiature che toccare il sito chirurgico.
- Individuare lambda, il punto posteriore dove i tre piatti principali del cranio si incontrano, come depicted in Figura 2. Sollevare l'ago di infusione leggermente e spostarlo subito al lambda. Abbassare l'ago sia a contatto con il cranio a lambda. Leggi il dorso-ventrale coordinate. Se il livello è cranio, sarà di 0,1 mm del bregma lettura. Se è più lontano di questo, spostare l'ago verso l'alto (fuori strada), allentare la barra di naso, o alzare o abbassare la piattaforma bar morso, a seconda di quale lato della testa è troppo alto, e poi ri-misura.
- Spostare l'ago infusione bregma e registrare le coordinate antero-posteriore e medio-laterale. Calcolare in cui l'ago deve essere spostato in base alle coordinate della zona del cervello di interesse secondo un cervello atlante 12. Per il BLA, sottrarre 2,8 millimetri dal antero-posteriore coordinate e aggiungere o sottrarre 5,1 millimetri da / per l'mediale-laterale coordinate a seconda se si vuole indirizzare verso sinistra o destra. Spostare l'ago di infusione alla posizione calcolata.
- Spostare la needle di mezzo, avendo cura di tenere traccia di dove si trovava e poi praticare un foro di circa 2 mm di diametro in quella posizione con un Dremel moto-tool con un po 'sterile fresa attaccata. Praticare con attenzione come quando si rompe il trapano attraverso il cranio, tenderà ad abbattere e danneggiare il tessuto cerebrale e dura sotto. Alesare il foro per ingrandirla.
- Assorbire il sangue con un tampone di cotone sterile.
6. L'infusione di Neurotossina
- Spostare l'ago in posizione. Abbassare l'ago fino a toccare la superficie del cervello. Registrare la dorso-ventrale coordinate. Questo è il livello di dura. Sottrarre il valore appropriato per raggiungere la regione del cervello di interesse. Per l'amigdala basolaterale, sottrarre 6,7 millimetri.
- Abbassare l'ago di infusione al livello calcolato lentamente. Poi sollevare il backup, ben al di sopra del cranio. Utilizzare un filo siringa Hamilton pulizia per sbloccare la punta dell'ago di infusione, facendo attenzione a non tOuch l'estremità del filo che viene in contatto con l'ago di infusione con guanti non sterili.
- Funzionare la pompa a> 5 microlitri / min e assicurarsi di vedere una goccia di liquido uscire l'ago di infusione. In caso contrario, sbloccare con il filo e riprovare.
- Abbassare l'ago di infusione alla desiderata dorsale / ventrale livello lentamente.
- Impostare la velocità della pompa di infusione a 0,1 microlitri / min e iniziare l'infusione. Lasciare in infusione per 2 min.
- Una volta che l'infusione è iniziata, contrassegnare le due estremità della bolla d'aria nel tubo con un pennarello nero. Se entrambe le estremità non si muovono, l'ago è ostruito. Interrompere l'infusione, sollevare l'ago, sbloccare con il filo, verificare la presenza di flusso con una portata elevata, ri-abbassare l'ago e riprovare.
- Una volta che l'infusione è completa, fermare la pompa e attendere 5 minuti per il NMDA a diffondere lontano dalla punta dell'ago.
- Sollevare l'ago di 0,5 millimetri, e infondere di nuovo per 1 min. Attendere 2,5 minuti per il NMDA a diffondere lontano dalla punta dell'ago. Questa infusione supplementare haLPS garantire tutto il BLA è coperta dalla infusione. Se questo sia necessario per altre regioni del cervello deve determinare sperimentalmente.
- Sollevare l'ago del cervello lentamente e ruotare il braccio stereotassico di mezzo.
7. Chiusura del Incision
- Don nuovi guanti sterili per chiudere l'incisione.
- Togliere ogni eccesso di sangue sul cranio con punte sterili di cotone e rimuovere le pinze dalla fascia.
- Utilizzando pinze Londra, spingere i due lati della incisione insieme. I bordi interni della pelle deve soddisfare e il bordo esterno della pelle non dovrebbe essere consentito di arricciarsi nell'incisione. Tenendo premuto il ferita chiusa, applicare clip ferita per chiudere la sporgenza con fermezza. Continuare a spingere la pelle ed fiocco lungo la lunghezza dell'incisione. Questo richiede di solito 3-5 clip ferita.
- Dopo aver collocato tutti i clip ferita, usare le pinze per pizzicare i punti ancora una volta, assicurandosi che siano sicuri. Il t più sicuroegli clip, meno è probabile un topo li tirare fuori prima che l'incisione è guarita.
- Swab l'incisione pinzati con la soluzione di povidone 10% di iodio e tornare il ratto alla sua gabbia di casa e monitor fino a quando viene ripristinata la mobilità (di solito 1-2 ore dopo l'anestesia, la chirurgia tempo totale di induzione alla chiusura essere 30-45 min). A questo punto, il ratto può essere restituito al camera colonia. Dopo una settimana, estrarre punti con un utensile di rimozione fiocco sotto anestesia con isoflurano.
- Utilizzare uno sterilizzatore a caldo tallone per sterilizzare le superfici di punta di tutti gli strumenti prima dell'uso sul ratto successiva. Gli strumenti devono essere immersi nelle perle per non più di 15 secondi, o possono diventare troppo caldo per gestire. Gli strumenti devono essere completamente raffreddata prima utilizzata su un altro animale.
8. Recupero
- E 'possibile che i ratti esporrà l'attività convulsiva nei giorni successivi la lesione. A seconda della regione del cervello danneggiate, altri comportamenti quali il consumo alimentare o grooming può essere influenzata. E 'importante che gli animali essere monitorati su base giornaliera per assicurare che essi rimangano sani durante il recupero. La terapia di supporto, come il cibo liquido, ad alto contenuto calorico degli alimenti, o analgesia supplementare può essere richiesto. La mortalità a causa di anestesia avviene in una bassa percentuale di ratti, solitamente meno del 5%. La mortalità dovuta ad altre cause (infezioni, emorragie) è estremamente rara. Eventuali segni di sofferenza dopo il recupero di anestesia può essere motivo di esclusione da studi futuri, ma sono estremamente rare. Figura 4 rappresenta la perdita di peso durante i primi giorni dopo l'intervento chirurgico come dovrebbe essere previsto. Il peso corporeo dovrebbe rimbalzare entro 1 settimana.
9. Risultati rappresentativi
Una settimana o più dopo l'infusione NMDA, la lesione può essere visualizzato usando un cresile-viola di contrasto e di microscopia a campo chiaro. Brains deve essere perfusi con paraformaldeide ghiacciata del 4%, equilibrata nel 30% di saccarosio in PBS 0,1 M e Spinacien. Essi devono poi essere tagliati a 30-60 um, in una serie di 1:06-1:12 e montato su di gelatina rivestite vetrini prima di subire una serie di contrasto violetto cresolo. La lesione deve corrispondere a una "zona calva" o una zona di ridotta violetto cresolo macchia dovuta alla morte delle cellule a seguito di lesione. Figure 5A e B mostrano una lesione rappresentante del BLA e CEA. Questa immagine è stata ottenuta utilizzando uno scanner piano con una scansione ad alta risoluzione (1200 dpi). Per visualizzare la lesione, aiuta a di contrasto di una serie di sezioni per gran parte del tessuto circostante l'area bersaglio così una lesione fuori posto può essere localizzato.

Figura 1. Installazione stereotassico. Questa figura mostra la stereotassica topo con parti rilevanti etichettati.

Figura 2. Bregma e lambda sul sku rattoll. Questa illustrazione mostra le posizioni dei bregma e lambda. Tutte le coordinate sono misurate rispetto al bregma. Lambda viene utilizzato per garantire che il cranio è livello.
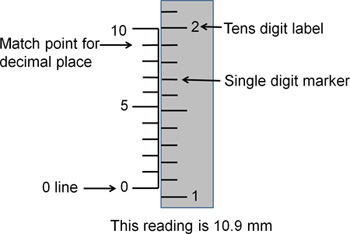
Figura 3. Lettura coordinate stereotassiche. Questo disegno illustra una lettura standard di stereotassico. Per ottenere le cifre a sinistra della posizione decimale, utilizzare i marcatori sul lato destro. La cifra etichetta corrisponde al luogo decine (cioè 1 = 10, 2 = 20). I segni di hash tra le cifre etichettati corrispondono alle singole unità (1-9). La linea dello zero indica a che l'intero stereotax è impostato. Qui, la linea di zero è tra il 10 e 11 marcatori, indicando che la lettura sia tra 10 e 11. Per determinare i numeri a destra della posizione decimale, utilizzare i marcatori sul lato sinistro. I segni hash a sinistra sono numerati da 0 a 10, con ogni hash senza etichetta che rappresenta una differenza unità dacoloro che accanto ad essa. Qualunque sia dei marchi hash sulle linee di sinistra fino al meglio con i trattini sulla destra indica la prima cifra decimale della lettura coordinata. Qui, il cancelletto sulla sinistra, corrispondente al numero 9 si allinea al meglio con i marchi di hash sul lato destro in modo che la cifra decimale è 9. La lettura finale è pari a 10,9 mm.

Figura 4. Cambiamento di peso dopo l'intervento chirurgico. Questo grafico mostra la media (± SEM) peso di ratti sottoposti a chirurgia stereotassica (n = 17) o non ha avuto la chirurgia (n = 6). Day 0 è il giorno dell'intervento. Dopo l'intervento chirurgico, il peso di ratti diminuito per 2-3 giorni dopo l'intervento e quindi aumentata di circa 5-6 giorni.
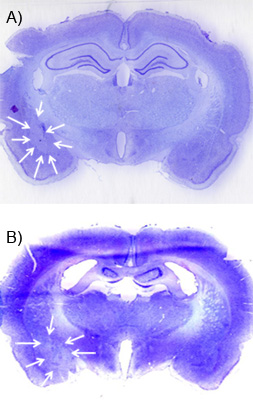
Figura 5. Esempio lesione eccitotossico. A) Questa immagine mostra un violetto cresolo di contrasto su una fetta 30 micron coronale con il "calvospot "da NMDA lesione dell'amigdala basolaterale. Le frecce bianche delineano la lesione. Esso può essere paragonato al lato controlaterale della fetta cervello che non ha alcuna lesione. B) Una lesione simile del nucleo centrale dell'amigdala.
Discussione
Il metodo qui presentato permette stereotassico per lesione eccitotossico su specifiche aree cerebrali tramite infusione di NMDA. I metodi di base stereotassiche può essere adattato per infondere una varietà di agenti farmacologici e biologici in un sito-specifica. Si possono anche essere adattate per indirizzare una varietà di aree cerebrali, definito dalle rispettive coordinate stereotassiche in un cervello atlante 12. Adattamento ad altre specie come i topi possono essere realizzati con dispositivi simi...
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Questo lavoro è stato supportato ya CIRM comunione predoctoral (CDPE), Investigator Award NARSAD Young (DK) e il premio NIMH BRAINS (R01MH087495) (DK).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Comments |
| N-metil-D-aspartico 98% | Fisher Scientific | AC32919-0500 | |
| Doppio Lab standard stereotassico w/45 gradi. Ear Bars | Stoelting | 51653 | Alternative venditore: Kopf * nota di cautela: assicurare la compatibilità degli accessori stereotassiche se acquisti da fornitori diversi |
| 10 pl SYR SPECIALE (* / * / *) | Hamilton | 701SN | |
| Dremel Moto-Tool | Stoelting | 58600 | Alternative venditore: Kopf |
| Frese in metallo duro, manipolo HP, taglia 2 | Schein Dental | 2284578 | |
| Stoelting 6 Program siringapompa programmabile | Stoelting | 53140 | Alternative venditore: Kopf |
| Acciaio 316 Hypodermic Regular parete Tubing 30 Gauge 0,0123 "OD x 0,00625" ID x 0,003 "Wall (ago infusione) | Parti piccole | HTXX-30R-06-05 | |
| Intramedic PE 20 tubo (tubo di infusione) | VWR | 63019-025 | |
| Clips Reflex, 9mm, non sterili | Kent Scientific Corp. | INS500346 | Alternative venditore: strumenti per le scienze Belle |
| Clip Applier Reflex per i clip 9mm | Kent Scientific Corp. | 12031-09 | Alternative venditore: strumenti per le scienze Belle |
| Curvo Hartman emostato | Strumenti di Scienze Belle | 13003-10 | |
| London pinza | Strumenti Sceince Belle | 11080-02 | |
| Clorexidina soluzione al 2% | Allivet | 30159 | Alternative venditore: PetSolutions |
| 10% di soluzione di iodio povidone | CVS | SKU # 739575 | |
| Hot tallone sterilizzatore | Harvard Apparatus | 610183 |
Tabella 1. Tabella di reagenti e attrezzature specifiche.
Riferimenti
- Kirby, E. D. Basolateral amygdala regulation of adult hippocampal neurogenesis and fear-related activation of newborn neurons. Mol. Psychiatry. , (2011).
- Goosens, K. A., Maren, S. Contextual and auditory fear conditioning are mediated by the lateral, basal, and central amygdaloid nuclei in rats. Learn Mem. 8, 148-155 (2001).
- Korz, V., Frey, J. U. Bidirectional modulation of hippocampal long-term potentiation under stress and no-stress conditions in basolateral amygdala-lesioned and intact rats. J. Neurosci. 25, 7393-7400 (2005).
- Bhatnagar, S., Vining, C., Denski, K. Regulation of chronic stress-induced changes in hypothalamic-pituitary-adrenal activity by basolateral amygdala. Ann. N.Y. Acad. Sci. 1032, 315-319 (2004).
- Ikegaya, Y., Saito, H., Abe, K. Attenuated hippocampal long-term potentiation in basolateral amygdala-lesioned rats. Brain Res. 656, 157-164 (1994).
- Ikegaya, Y., Saito, H., Abe, K. The basomedial and basolateral amygdaloid nuclei contribute to the induction of long-term potentiation in the dentate gyrus in vivo. Eur. J. Neurosci. 8, 1833-1839 (1996).
- Carter, R. N., Pinnock, S. B., Herbert, J. Does the amygdala modulate adaptation to repeated stress. Neurosciene. 126, 9-19 (2004).
- Roozendaal, B., McGaugh, J. L. Basolateral amygdala lesions block the memory-enhancing effects of glucocorticoid administration in the dorsal hippocampus of rats. Eur. J. Neurosci. 9, 76-83 (1997).
- Roesler, R., Roozendaal, B., McGaugh, J. L. Basolateral amgdala lesions block the memory-enhancing effect of 8-Br-cAMP infused into the entorhinal cortex of rats after training. Eur. J. Neurosci. 15, 905-910 (2002).
- Roozendaal, B. Glucocorticoid effects on memory consolidation depend on functional interactions between the medial prefrontal cortex and basolateral amygdala. J. Neurosci. 29, 14299-14308 (2009).
- Kaufer, D. Restructuring the neuronal stress response with anti-glucocorticoid gene delivery. Nat. Neurosci. 7, 947-953 (2004).
- Paxinos, G., Watson, C. . The rat brain: in stereotaxic coordinates-the new coronal set. , (2004).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable Stereotaxic Surgery in Rodents. J. Vis. Exp. (20), e880 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon