Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Evaluación funcional de la motilidad intestinal y la inflamación de la pared intestinal en roedores: Análisis de un modelo estandarizado de manipulación intestinal
En este artículo
Resumen
El íleo postoperatorio (POI) es una complicación de la cirugía abdominal que lleva a una mayor morbilidad y una estancia hospitalaria prolongada. Como las estrategias profilácticas o terapéuticas faltan intensificación de la investigación es necesaria. Por lo tanto, se estableció un modelo de ratón estandarizado y factible para investigar la fisiopatología de la PDI y estudiar posibles opciones terapéuticas.
Resumen
Inflamación del tracto gastrointestinal es una razón común para una variedad de enfermedades humanas. Los modelos animales de investigación son fundamentales en la investigación del complejo celular y molecular de la patología intestinal. Aunque la túnica mucosa es a menudo el órgano de interés en muchas enfermedades inflamatorias, las obras recientes demostraron que la muscular externa (ME) es también un órgano altamente inmunocompetente que alberga una densa red de inmunocitos residentes. 1,2 Estos trabajos se realizaron dentro de la estandarizado modelo de manipulación intestinal (MI) que conduce a la inflamación de la pared del intestino, principalmente limitada a la ME. Clínicamente esta inflamación conduce a la alteración de la motilidad intestinal prolongado, conocido como el íleo postoperatorio (POI), que es una complicación frecuente e inevitable después de la cirugía abdominal. 3 La inflamación se caracteriza por la liberación de mediadores proinflamatorios tales como IL-6 4 o neurotransmisores IL-1β o inhibidora como Nitric óxido (NO). 5 Posteriormente, un tremendo número de inmunocitos extravasarse en el ME, dominado por los neutrófilos polimorfonucleares (PMN) y monocitos y finalmente mantener POI. Lasting para 2 días, esta parálisis intestinal conduce a un aumento del riesgo de aspiración, la translocación bacteriana y complicaciones infecciosas hasta sepsis y fallo de órganos múltiples y causa una alta carga económica. 6
En este manuscrito se demuestra el modelo normalizado de mensajería instantánea y evaluación in vivo de tránsito gastrointestinal (GIT) y el tránsito colónico. Además se demuestra un método para la separación de la EM a partir de la túnica mucosa seguido de análisis inmunológico, que es crucial para distinguir entre las respuestas inflamatorias en estos compartimentos de pared ambos altamente inmunoactivos intestinales. Todos los análisis son fácilmente transferibles a los otros modelos de investigación, que afecta la función gastrointestinal.
Protocolo
1. Animales
Hombre C57BL6 / J ratones con un peso medio de 25 g se obtuvieron de Harlan Winkelmann (Borchen, Alemania). Todos los experimentos se realizaron de acuerdo con la ley federal acerca de la protección de los animales. Los principios del cuidado de los animales de laboratorio fueron seguidos. Los animales se mantuvieron en una luz de 12-hr / oscuridad ciclo y provisto de roedor comercialmente disponible chow y agua del grifo ad libitum. Animales deben ser alojados por lo menos 7 días después de la llegada en su instalación de animales antes de los experimentos. Tenga en cuenta que todos los experimentos se puede adaptar fácilmente a las ratas u otras especies y con ligeras modificaciones en los modelos de animales grandes.
2. Procedimiento Operativo
- La anestesia se induce y mantiene con isoflurano (Abbott, Wiesbaden, Alemania) en oxígeno. Después de la aparición de los animales en lugar de anestesia posición supina y las extremidades arreglar con cinta adhesiva (Leukosilk, Beiersdorf, Hamburgo, Alemania).
- Después de la desinfección de afeitado y quirúrgica de la pared abdominal de una laparotomía mediana se realiza en una longitud de 2 centímetros. Introduzca la cavidad abdominal a través de una incisión a lo largo de la línea alba. Coloque dos retractores estériles para mantener el abdomen abierto. Cuidadosamente eventerate el intestino delgado hacia la izquierda y colóquela sobre una gasa de algodón húmeda.
- Evacuar todo el contenido luminal del intestino delgado con dos aplicadores de algodón húmedo y estéril (MaiMed, Neunkirchen, Alemania) a la vez rodando el aplicador del píloro al ciego. PRECAUCIÓN: Evite las hemorragias de la pared del intestino delgado o lesiones de los vasos intestinales. Vuelve a colocar la tripa en la caverna peritoneal sin torcer para prevenir la isquemia o la obstrucción mecánica y cerrar la incisión abdominal utilizando una capa de dos continua 5/0 poliamida suturas no absorbibles (Ethicon, Norderstedt, Alemania).
3. Cuidado Postoperatorio
- Después de que el procedimiento de colocar al animal bajo una lámpara de calentamiento, observing hasta que se recupere de la anestesia. Ponga el ratón de nuevo en su jaula y permitir el acceso a agua y comida. Debido a la propiedad de los opiáceos afectan a peristalsis, realizamos analgesia perioperatoria con AINE (por ejemplo metamizol) en el agua potable.
4. Funcional estudios de 24 horas después de IM
- Tránsito gastrointestinal (GIT)
- Anestesiar ligeramente ratones con isoflurano en oxígeno 22,5 horas después del IM. Cuidadosamente hiperextensión de la cabeza del ratón y tire de la lengua con unas pinzas romas. Llene una jeringa de 1 ml con al menos 100 l dextrano marcado con fluoresceína (FITC-dextrano, 70.000 MW, Sigma Aldrich, Taufkirchen, Alemania), se conecta a un catéter arterial (Vygon, Ecouen, Francia) e inserte con cuidado el catéter como tubo gástrico en el estómago.
- Brevemente se inyectan 100 l de FITC-dextrano y sacar el catéter. Dejar que el animal despierto y esperar 90 min. Durante este tiempo, los ratones tienen acceso a los alimentos o el agua.
- Preparar quince tubos de 2 ml de hilado y etiquetar consecutivamente.
- La eutanasia a los ratones 90 minutos después de la alimentación forzada y eliminar todo el tracto gastrointestinal desde el estómago hasta el recto. Coloque el intestino en una almohadilla de poliestireno y evitar el estiramiento. CAVE: Es crucial para eliminar el intestino suavemente para evitar el desplazamiento de líquido FITC-dextrano en el segmento de cerca. Para el principio podría ser útil usar clips al principio y al final de cada segmento.
- Medir la longitud completa del intestino delgado y de longitud completa del colon. Divida el intestino delgado en 10 segmentos de igual tamaño por clavándolo a la almohadilla de poliestireno con cánulas. Divida el colon en 3 segmentos. Se han preparado 15 segmentos (estómago # 1), diez segmentos pequeños de igual tamaño intestinales (# 2-11), el ciego (# 12) y tres 3 segmentos colónicos igual tamaño (# 13-15).
- Corte transversal del intestino en las posiciones marcadas, agarra con unas pinzas y lavar una vez con 1,0 ml KHB en el preparado previamente containi KHB2,0 ng ml tubos y agitar vigorosamente durante 20 segundos. El estómago y el intestino ciego se colocan directamente y corte en los tubos preparados. Llenar estos tubos con 1,0 ml de KHB, así enjuague trazas de contenido luminal de la tijera en los tubos.
- Centrifugar las sondas a 12.000 rcf durante 5 min a temperatura ambiente en una centrífuga de mesa. Durante la centrifugación preparar otros 15 numerados consecutivamente tubos de 1,5 ml.
- Transfiera los sobrenadantes claros en el tubo de 1,5 ml nuevo y almacenar en la oscuridad a 4 ° C hasta su análisis (paso siguiente). Las sondas se pueden almacenar durante varios días a 4 ° C sin pérdida significativa de señal de FITC. Para un almacenamiento más prolongado añadir 0,09% Natrium-azida o tienda a <-18 ° C.
- Pipeta 100 dosillos mu l de los sobrenadantes en un negro de 96 pocillos (Greiner Bio One, Frickenhausen, Alemania). Pipeta dos muestras de 100 l de KHB como blanco.
- Leer la placa en un lector de fluorescencia (Safire, Tecan, Crailsheim, Alemania) y cuantificar la fluorescence a 494 nm (absorción) / 521 nm (emisión) de longitud de onda. Restar los valores en blanco de muestras.
- Calcular el centro geométrico (GC) de FITC-dextrano distribución, que es en realidad el centro de gravedad de la distribución de marcador, por la fórmula siguiente: GC = Σ (% del total de la señal fluorescente por segmento * número de segmento) / 100
Nota: Por multiplicando el porcentaje de fluorescencia de cada segmento con su número de segmento una media ponderada de la distribución del marcador en el intestino se evalúa. Este punto está influenciada tanto por la distribución y la distancia recorrida por el marcador, pero no asume ninguna distribución subyacente específica. 7 El valor calculado GC se presenta a menudo en combinación con un gráfico que demuestra la distribución del FITC dextrano sobre el tracto gastrointestinal (Figura 1A).
- Tránsito colónico
- Los ratones deben ser débilmente anestesiaron con isoflurane 2% en oxígeno. PRECAUCIÓN: Asegúrese de que el animal se despertará dentro de 40 seg.
- Examine cuidadosamente la permeabilidad del colon mediante la inserción de una sonda de fístula (varilla de metal, 2 mm de diámetro) a través del ano hacia el colon.
- Uso de la sonda de fístula impulsar un vidrio de 2 mm de bola de 3 cm en el colon y saque la sonda inmediatamente. Coloque el ratón en una jaula transparente y comience a medir el tiempo después de la sonda de fístula fue sacado del colon. Mantenga un ojo en el ratón y detener el tiempo inmediatamente después de la bola de cristal se excreta.
5. Análisis histoquímico de las muestras aisladas ME
- Midjejunal segmentos se cortan del intestino y se sumergieron en KHB frío en un plato lleno de Sylgard.
- Mesenterio se fija en el plato con agujas de 0,2 mm de insectos (Herramientas Artes Ciencias, Heidelberg, Alemania).
- Cortar el segmento a lo largo de su borde mesentérico y se extienden a ~ 120% de su longitud y anchura. Finalizar la fijación de los insectospins en el sitio opuesto de la mesenterio. Enjuagar la cápsula sylgard cuidadosamente con KHB fresco frío hielo, con lo que el lavado todos los contenidos luminales.
ME puede ahora mecánicamente separada de la túnica mucosa de partida del mesenterio. Durante la preparación reemplazar frescos refrigerados varias veces KHB. - Separado túnica mucosa se puede choque congelados en nitrógeno líquido para su posterior análisis o descartados.
- Fijar el aislado ME todo el montaje con 100% de etanol durante 10 min a temperatura ambiente.
Lavar los enteros montaje tres veces usando KHB fría. Nota: otros fijadores de formaldehído (es decir, 4%, ácido acético, acetona) también se puede utilizar después de la comprobación de su compatibilidad con el análisis posterior. - Los soportes ME enteros listos para la tinción histoquímica o más immunhistochemical:
- Histoquímica: mieloperoxidasa (MPO) tinción
PMNs infiltrados pueden ser examinadas por el protocolo de tinción siguiente MPO.- Resuelve 10 mg Hancla reactivo Yates (Polyscience Europa, Eppelheim, Alemania) en 10 ml KHB y añadir 100 ml de 3% de H 2 O 2. Prepare la solución recién inmediatamente antes de su uso y no se vuelva a usar.
- Incubar montajes completos para 10 min a temperatura ambiente.
- Enjuague muestras extensamente con KHB frío y se incuba durante 10 min.
- Montar los especímenes en el medio de montaje acuoso (Aquatek, Merck, Darmstadt, Alemania) Después de secar durante 2 hr analizar portaobjetos con un microscopio de luz.
- Contar el número de células en 5 campos seleccionados al azar y calcular como MPO células positivas / mm 2.
- Tinción inmunohistoquímica:
En consecuencia para la tinción histoquímica de MPO, coloraciones de inmunohistoquímica de los montajes enteros se puede realizar. Principalmente, sus protocolos establecidos tinción inmunohistoquímica de cultivos de células o cortes de tejido se puede adaptar fácilmente a una tinción de todo el montaje. Sin embargo, la optimización del procedimiento para anti específicacuerpos es muy recomendable.- Cortar las muestras en trozos de 5 mm x 5 y realizar tinción en 2,0 ml de fondo redondo tubos de centrífuga en ~ 150 l - 200 l solución de anticuerpos.
- La fijación y el bloqueo de procedimiento (es decir, BSA 3% en PBS durante 1 hora a temperatura ambiente) se puede realizar en el "plato sylgard".
- Los pasos de lavado en PBS o otros tampones puede realizarse en placas de 12-pocillos.
- Transfiera los especímenes. Cuidadosamente con unas pinzas cortantes entre los tubos y placas de tinción de lavado.
- Después de que las muestras de lavado final en el procedimiento de montaje anti-desvanecimiento medio de montaje con cubreobjetos y analizar con un microscopio de fluorescencia.
6. Órganos de Cultura ME
- El intestino delgado entero se reseca 24 hr después de IM y se coloca en KHB frío que contenía 200 U / ml de penicilina G y 100 mg / ml de estreptomicina (KHB + P / S).
- Cortar el intestino a 3 cm de longitud y el pin de cada segmento a un Sylgard contiene glass plato.
- Retire el mesenterio con tijeras finas y deslice el intestino en una aguja de tejer.
- Con cuidado corta el ME con unas pinzas afiladas y despojarlo de la submucosa de usar un aplicador de algodón húmedo. La túnica mucosa permanece en la aguja de tejer y puede ser congelaron para análisis adicionales. El ME se recoge en frío KHB + P / S.
- Cortar las tiras aisladas ME en pequeños trozos de 2 a 4 mm de longitud y se incuba en hielo frío KHB + P / S durante media hora y enjuagar la muestra varias veces.
- Transferir aproximadamente 50-60 mg ME (al menos la mitad de uno ME intestino delgado) en un recipiente estéril 24-así placa que contiene 500 l modificado Dulbecco s medio Eagle (DMEM).
- Incubar a 37 º C y 5% de CO 2 por 24 horas adicionales.
- Inspeccionar los cultivos celulares para la contaminación bacteriana o fúngica en un microscopio.
- Recoger el sobrenadante, girar hacia abajo durante 5 min a 1000 fcr y congelamiento rápido en nitrógeno líquido. Mientras tanto secar secar el muscLe tejido en un tejido limpio durante 30 segundos y peso.
- Los sobrenadantes se puede utilizar para el análisis posterior de la liberación de citocinas (IL-6) por ELISA o otros metabolitos (es decir, nitrito) en el sobrenadante, siguiendo las instrucciones del fabricante.
- Normalizar las concentraciones medidas por peso de tejido ME.
7. Los resultados representativos
- Estudios funcionales
El parámetro más importante para evaluar la gravedad de POI es el examen de GIT in vivo. Figura 1A muestra una distribución típica de FITC dextrano a lo largo del tracto gastrointestinal en los controles no tratados y ratones manipulados intestinalmente 24 hr después de la cirugía. "Operación simulada" animales mostraron un GIT normal con un centro geométrica calculada (GC) en el ciego mientras IM condujo a un retraso significativo del GIT en el yeyuno proximal (Figura 1B)
Motilidad colónica se centró por separado en la medición del tiempo bola excreción ofa 2 mm bola de cristal. Sham operado ratones muestran un tiempo de excreción de 48 a 200 segundos, mientras IM llevó a un tiempo prolongado entre la excreción de 470 a 775 seg (Figura 1C). - Estudios Morfológicos
Para describir el inflamatoria se extienden dentro de los fenotipos ME varios de los leucocitos pueden ser analizados mediante histoquímica o inmunohistoquímica. En la figura 2A + B una escasa presencia de PMN en la "operación simulada" los animales se observó (39 ± 7 células / mm 2). IM del intestino delgado condujo a una fuerte infiltración de PMN (660 ± 86 células / mm 2) en comparación con los ratones operación simulada - ME Organ Culture
Muchos mediadores inflamatorios liberados de las células son difíciles de detectar en lisados tisulares. Cultivos de órganos permitir la detección de los mediadores liberados en el sobrenadante de cultivo. Un mediador representante en POI es NO, que es como neurotransmisor inhibidor en el tracto gastrointestinal. 5
NO no podía ser detectado en cul órgano MEtura sobrenadantes de los animales de control no operados (5 ± 6 micras / 24 tejidos hr / mg). En operación simulada (laparotomía) ratones los niveles de NO basal de 53 ± 36 micras / 24 tejidos hr / mg se observaron. ME cultivos de ratones manipulados intestinalmente (cosecharon 24 h después de la cirugía) producen significativamente más NO (2254 ± 853 micras / 24 tejidos hr / mg) durante 24 h de cultivo de órganos ME (Figura 3).

Figura 1. Efecto de IM en GIT (A + B) y el tránsito colónico (C) GIT se midió como el porcentaje de no absorbible dextrano marcado con fluoresceína en 15 segmentos gastrointestinales del estómago (STO), intestino delgado (ID 1-9 ), ciego (CCA) y colon (Co) -90 minutos después de la ingestión oral. Tránsito colónico se midió como el tiempo desde tirando de la sonda de fístula hasta que la excreción de un 2 mm de cuentas de vidrio. (A) Gastrointestinal distribución de isotiocianato de fluoresceína-dextran después de la operación simulada o mensajería instantánea. En los animales operación simulada más del marcador está localizado en el ciego o el colon proximal en comparación con la ubicación proximal del yeyuno en los animales manipulados. Las líneas de puntos indican calculado GC. (B) Cálculo de la GC demostró una prolongación del tránsito gastrointestinal después de IM. (C) el tiempo de tránsito colónico mostró un retraso significativo en ratones IM en comparación con los animales operación simulada. GC para los 15 segmentos de intestino se muestran como la media (n = 5). Tiempos de tránsito colónico se visualiza decir con todos los valores individuales (n = 6). *** = P <0,001, t de Student prueba.
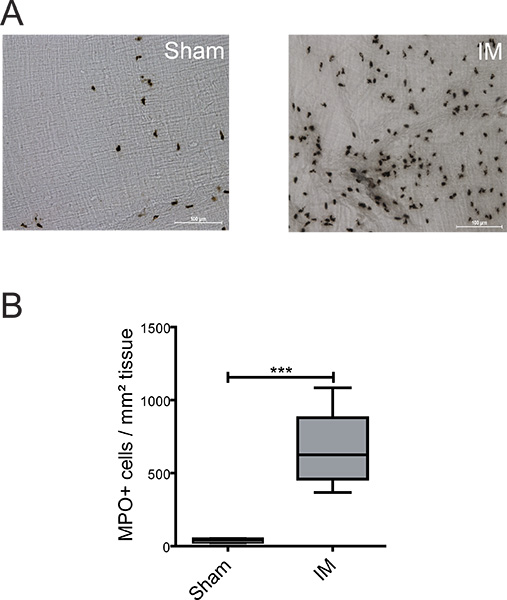
Figura 2. Detección de MPO positivos dentro de las células del intestino delgado ME. (A) ME montajes completos fueron teñidas con Hanker Yates reactivo para la detección de MPO positivo PMN 24 horas después de la laparotomía (simulacro) o el procedimiento de MI. (B) Cuantificación de las células positivas MPO dentro de 5 campos seleccionados al azar por ratón. n = 6 unanimals por grupo. *** = P <0,001, t de Student prueba.
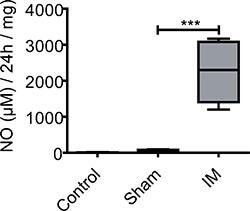
Figura 3. Producción de NO en los sobrenadantes del cultivo de ME. Muestras musculares de los controles no operados, operación simulada y ratones IM fueron tomadas 24 horas después de la operación y se cultivaron durante 24 horas. Ratones no tratados mostraron sólo una producción basal muy bajo de NO. Después de la laparotomía NO liberación se incrementa sin medir diferencias significativas entre el grupo control y los ratones operación simulada. 24 horas después del IM producción de NO se incrementa dramáticamente en comparación con los ratones no tratados operados o simulada. n = 5 animales por grupo. *** = P <0,001, un ANOVA de una vía.
Discusión
Un estudio comparativo de análisis de los diferentes niveles de IM (eventración intestino delgado durante 10 min versus suavemente inspección del intestino delgado usando dos aplicadores de algodón versus IM con la evacuación del contenido del intestino delgado en el ciego) reveló una correlación entre la magnitud de la manipulación quirúrgica y PDI. En comparación con los otros grupos IM mostraron la mayor cantidad de leucocitos en el ME (PNMS, macrófagos y mastocitos) que resulta en POI prolongada y severa....
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por becas de la Deutsche Forschungsgemeinschaft (KA1270/3-1/2) y BONFOR (O-112.0040).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo / Equipo | Empresa | Número de catálogo | |
| Ethilon 5/0 | Ethicon | 1666H | |
| Aplicadores de algodón | MaiMed | 71010 | |
| catéter arterial | Vygon | 115-798 | |
| Placa de 96 pocillos (negro) | Greiner Bio One | 655096 | |
| bola de cristal (2 mm de diámetro) | Worf | disponible a petición | |
| Los alfileres entomológicos | Herramientas Artes Ciencias | 26000-25 | |
| Hanker Yates Reactivo | Polyscience | 560694 | |
| Aquatek | Merck | HC109850 | |
| DMEM | Lonza | BE12-604 F | |
| FITC-dextrano (PM 70000) | Sigma Aldrich | 46945-500MG-F |
Referencias
- Wehner, S., Behrendt, F. F., Lyutenski, B. N., Lysson, M., Bauer, A. J., Hirner, A., Kalff, J. C. Inhibition of macrophage function prevents intestinal inflammation and postoperative ileus in rodents. Gut. 56, 176-185 (2007).
- Kalff, J. C., Schwarz, N. T., Walgenbach, K. J., Schraut, W. H., Bauer, A. J. Leukocytes of the intestinal muscularis: their phenotype and isolation. J. Leukoc. Biol. 63, 683-691 (1998).
- Kehlet, H. Postoperative ileus. Gut. 47, iv85-iv86 (2000).
- Wehner, S., Schwarz, N. T., Hundsdoerfer, R., Hierholzer, C., Tweardy, D. J., Billiar, T. R., Bauer, A. J., Kalff, J. C. Induction of IL-6 within the rodent intestinal muscularis after intestinal surgical stress. Surgery. 137, 436-446 (2005).
- Kalff, J. C., Schraut, W. H., Billiar, T. R., Simmons, R. L., Bauer, A. J. Role of inducible nitric oxide synthase in postoperative intestinal smooth muscle dysfunction in rodents. Gastroenterology. 118, 316-327 (2000).
- Iyer, S., Saunders, W. B., Stemkowski, S. Economic burden of postoperative ileus associated with colectomy in the United States. J. Manag. Care Pharm. 15, 485-494 (2009).
- Miller, M. S., Galligan, J. J., Burks, T. F. Accurate measurement of intestinal transit in the rat. J. Pharmacol. Methods. 6, 211-217 (1981).
- Kalff, J. C., Schraut, W. H., Simmons, R. L., Bauer, A. J. Surgical manipulation of the gut elicits an intestinal muscularis inflammatory response resulting in postsurgical ileus. Ann. Surg. 228, 652-663 (1998).
- Wehner, S., Straesser, S., Vilz, T. O., Pantelis, D., Sielecki, T., de lC, V., Hirner, A., Kalff, J. C. Inhibition of p38 mitogen-activated protein kinase pathway as prophylaxis of postoperative ileus in mice. Gastroenterology. 136, 619-629 (2009).
- Konigsrainer, I., Turck, M. H., Eisner, F., Meile, T., Hoffmann, J., Kuper, M., Zieker, D., Glatzle, J. The Gut is not only the Target but a Source of Inflammatory Mediators Inhibiting Gastrointestinal Motility During Sepsis. Cell Physiol. Biochem. 28, 753-760 (2011).
- Schwarz, N. T., Kalff, J. C., Turler, A., Speidel, N., Grandis, J. R., Billiar, T. R., Bauer, A. J. Selective jejunal manipulation causes postoperative pan-enteric inflammation and dysmotility. Gastroenterology. 26, 159-169 (2004).
- Engel, D. R., Koscielny, A., Wehner, S., Maurer, J., Schiwon, M., Franken, L., Schumak, B., Limmer, A., Sparwasser, T., Hirner, A. T helper type 1 memory cells disseminate postoperative ileus over the entire intestinal tract. Nat. Med. , (2010).
- Stoffels, B., Schmidt, J., Nakao, A., Nazir, A., Chanthaphavong, R. S., Bauer, A. J. Role of interleukin 10 in murine postoperative ileus. Gut. 58, 648-660 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados