このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
げっ歯類における腸運動と腸壁の炎症の機能評価:腸管操作の標準化されたモデルで分析
要約
術後イレウス(POI)が増加し、罹患率および長期の入院期間につながる腹部手術の合併症である。予防的または治療的戦略が激化研究を欠いているので必要です。そこで我々は、POIの病態生理を調査し、潜在的な治療の選択肢を研究するために標準化され、実行可能なマウスモデルを確立した。
要約
消化管の炎症はヒト疾患の様々な一般的な理由です。動物の研究モデルは、腸病変の複雑な細胞および分子を検討する上で重要である。粘膜は、しばしば外筋層は(ME)は、常駐免疫細胞の密なネットワークを抱いて非常に免疫担当臓器であることを実証し多くの炎症性疾患、働く最近の関心の臓器ですが。1,2これらの作品は、標準化の中で行われた腸壁の炎症につながる腸の操作のモデル(IM)は、私に主に限られた。炎症は、例えば、IL-6 4やIL-1βまたは抑制性神経伝達物質などの炎症性メディエーターの遊離によって特徴づけられる臨床的にこの炎症は、腹部手術後の頻繁かつ不可避な合併症である術後イレウス(POI)として知られている長時間腸の運動障害は、図3につながるnitri様C酸化物(NO)、続いて5、免疫細胞の驚異的な数字がMEに浸出、多形核好中球(PMN)および単球によって支配し、最終的にポイを維持しています。2ラスティング日間、この腸管麻痺は、誤嚥のリスクの増加、細菌転座につながるおよび感染性合併症アップ敗血症と多臓器不全へと高い経済的負担が発生します。6
本稿では、IMのと胃腸通過(GIT)と結腸通過の in vivo評価において標準化されたモデルを示しています。さらに私たちは、これらの両方の高い免疫活性腸壁コンパートメントの炎症反応を区別することが重要である免疫学的分析、続いて粘膜から私を分離する方法を示しています。すべての分析は、胃腸機能に影響を与え、他の研究モデルに簡単に譲渡することはできません。
プロトコル
1。動物
25グラムの平均体重を有する雄C57BL6 / JマウスをHarlanウィンケルマン手術(Borchen、ドイツ)から得た。すべての実験は、動物の保護に関する連邦法に従って行った。実験動物ケアの原則に従った。動物は、12時間の明/暗サイクルに維持し、市販のげっ歯類および水道水を自由に与えた。動物は、少なくとも7日間の実験の前にあなたの動物施設に到着した後に収納することがあります。 すべての実験が簡単にラットや他の種に適応し、大型動物モデルに若干の修正によりできることに注意してください。
2。手術手技
- 麻酔は酸素で(アボット、ヴィースバーデン、ドイツ)イソフルランで誘導され、維持されます。仰臥位で麻酔場所動物の発症後、粘着テープ(Leukosilk、バイヤスドルフ、ハンブルク、ドイツ)を用いて四肢を固定します。
- シェービングと腹壁の外科消毒後正中開腹は2センチメートルの長さで実行されます。白線に沿って切開を経由して腹腔を入力します。腹部を開いたままにして2つの滅菌リトラクターを配置します。慎重に左に小腸をeventerateとウェット綿のガーゼの上に置きます。
- 同時に幽門から盲腸にアプリケーターを圧延して、2つのしっとりとした滅菌綿棒のアプリケーター(ノインキルヒェン、ドイツ、不具)で全体の小腸内腔の内容を退避します。注意:小腸壁や腸の血管の病変の出血を避けてください。虚血または機械的閉塞を防止し、5/0連続2層ポリアミド非吸収性縫合糸(エチコン、ノルダーシュテット、ドイツ)を用いて腹部切開を閉じるために、ねじれずに腹膜洞窟に戻って腸を入れてください。
3。術後処置
- 手順は加熱ランプの下に動物を配置した後、observingのそれそれが麻酔から回復するまで。そのケージに戻ってマウスを入れ、水や食料へのアクセスを許可します。蠕動運動に影響を与えるためにオピオイドの特性のために、我々は、飲料水中の非ステロイド性抗炎症薬(例えばmetamizol用)と周術期鎮痛を行う。
4。 IMの後の機能研究の24時間
- 胃腸通過(GIT)
- IMの後の酸素22.5 hrでイソフルランで少しマウスをAnaesthetize。慎重にマウスの頭を過度に伸ばすと鈍い鉗子で舌を引き出します。少なくとも100μlのフルオレセイン標識デキストラン(FITC-デキストラン、70,000 MWで、シグマアルドリッチ、Taufkirchen、ドイツ)は、動脈カテーテル(Vygon、ルエ、フランス)に接続した1 mlシリンジを記入し、慎重にカテーテルを挿入する胃の中に胃管。
- 簡単に言うと、100μlのFITC-デキストランを注入し、カテーテルを引き抜きます。動物の目を覚ましましょう、90分間待ちます。この間マウスは食べ物や水へのアクセスを持っています
- 15 2ミリリットルスピニングチューブを準備して、連続してラベルを付けます。
- マウスに強制経口投与90分後に安楽死させると、胃から直腸までの全消化管を取り外します。ポリスチレンパッド上に腸を置き、ストレッチングは避けてください。 CAVE:それは最寄りのセグメントの中に液体のFITC-デキストランのシフトを避けるために、穏やかに腸を除去することが重要です。初めのためには、初めに、各セグメントの両端のクリップを使用すると便利かもしれません。
- 小腸と大腸の全長の全長を測定します。カニューレを有するポリスチレンパッドにそれを固定することによって、10に等しい大きさのセグメントに小腸を割ります。 3セグメントにコロンを割ります。あなたは、15セグメント(胃#1)、10の等しいサイズ小腸セグメント(#2-11)、盲腸(#12)と、3つの3等しいサイズの結腸セグメント(#13-15)用意しました。
- マークした位置に腸を横断する、ピンセットでそれをつかむと、先に調製したKHB containiに1.0ミリリットルKHBで一度それらを洗い流すngの2.0ミリリットルチューブおよび20秒間激しくボルテックスする。胃と盲腸を直接配置され、準備されたチューブにカットされています。これにより、チューブにハサミから管腔内容物の痕跡をすすぎ、1.0ミリリットルKHBと、これらのチューブを埋める。
- テーブルトップ遠心機で室温で5分間、12,000 rcfでプローブを遠心分離します。遠心中に別の15連続した番号を1.5 mlチューブを準備します。
- 4℃の暗所で新しい1.5 mlチューブや店舗°Cの分析まで(次のステップ)に明確な上清を移す。プローブはFITCシグナルの有意な損失なく4で数日間℃で保存することができる。長期保存のための℃<-18℃0.09パーセントナトリウムアジドまたはストアを追加
- 黒色96ウェルプレート(グライナーバイオワン、Frickenhausen、ドイツ)上清をピペットで100μlのduplets。ピペット2ブランクとしてKHB100μlのサンプル。
- 蛍光リーダー(サファイア、テカン、クライルスハイム、ドイツ)のプレートを読むとfluorescencを定量494 nmの(吸収)/ 521 nmの(発光)波長におけるe。サンプルからブランク値を減算します。
- 以下の式で実際にマーカーの分布の重心であるFITC-デキストラン分布の幾何学的中心(GC)を、計算:GCは=Σ(セグメントあたりの総蛍光シグナルの%*セグメント番号)/ 100
注:そのセグメント番号と各セグメントの蛍光の割合を乗じることにより腸内のマーカーの分布の加重平均が評価されています。この点については、マーカーが移動した分布と距離の両方の影響を受けませんが、特定の基本的な分布を仮定しないされています。7計算GCの値はしばしば消化管( 図1A)上のFITCデキストランの分布を示すグラフとの組み合わせで表示されます。
- 結腸通過
- マウスはisoflurと弱い麻酔しなければならない酸素でANE 2パーセント。注意:動物が目を覚まして40秒以内であることを確認する。
- 慎重に肛門から結腸に瘻孔プローブ(金属棒、直径2mm)を挿入して大腸の開存性を調べます。
- 瘻孔プローブを使用すると、大腸にまで前方に2mmのガラス玉3cmを押して、すぐにプローブを引き抜きます。透明な檻の中にマウスを置き、瘻孔プローブがコロンから引き出された後時間の計測を開始。マウスに目が離せないとガラスボールが排泄になった直後に時間を停止します。
5。隔離されたMEの標本の組織化学的解析
- Midjejunalセグメントは腸から切り取り、シルガード満たされた皿に冷たいKHBに浸漬される。
- 腸間膜は0.2mm昆虫針(ファイン科学ツール、ハイデルベルク、ドイツ)で皿に固定されます。
- その腸間膜の境界に沿ってセグメントを開いて、その長さと幅の約120%にストレッチカット。昆虫との固定を完成させる腸間膜の反対サイト上のピン。これにより、すべての管腔内容物を洗い流す、新鮮な氷冷KHBで丁寧SYLGARD皿をすすぐ。
MEは今や機械的に腸間膜から始まる粘膜から分離することができます。準備中に新鮮な冷蔵KHB数回交換してください。 - 分離した粘膜は、ショックをさらに分析するために液体窒素中で凍結または廃棄することができる。
- 室温で10分間、100%エタノールで孤立したMEのホールマウントを固定します。
チルドKHBを使用して全体のマウント3回洗浄する。注:他の固定剤( すなわち 4%ホルムアルデヒド、酢酸、アセトン)もその後の分析との互換性をテストした後に使用することができます。 - MEのホールマウントはさらに組織化学またはimmunhistochemical染色のための準備が整いました。
- 組織化学:ミエロペルオキシダーゼ(MPO)染色
潜入PMNは以下MPO染色プロトコールで調べることができる。- 10 mgのHを解く10mlのKHBでアンカーイエーツ試薬(Polyscienceヨーロッパ、Eppelheimから、ドイツ)および3%H 2 O 2の100μlを添加する。使用前に新たに直ちに溶液を調製し、再利用しないでください。
- 室温で10分間ホールマウントをインキュベートする。
- 10分間冷KHBとインキュベートと広く標本を洗浄します。
- 光学顕微鏡下で2時間分析スライド乾燥させた後、水性マウンティングメディウム(Aquatek、メルク、ダルムシュタット、ドイツ)の標本をマウントします。
- 5ランダムに選択されたフィールド内のセルの数を数えるとMPO陽性細胞/ mm 2のように計算します。
- 免疫組織化学的染色:
したがって組織化学MPO染色に、ホールマウントの免疫染色を行うことができます。主に、細胞培養または組織切片のあなたの確立された免疫組織化学的染色のプロトコルは、簡単にホールマウント染色に適合させることができます。ただし、特定の抗手順を最適化体を強くお勧めします。- 5×5 mmの片に試験片をカットし、〜150μlに2.0ミリリットルの丸底遠沈管に染色実行 - 200μlの抗体溶液。
- 固定して、手順をブロッキング(室温で1時間、PBS中すなわち 3%BSA)を"SYLGARD皿"で行うことができます。
- PBSまたは他のバッファで洗浄工程を、12ウェルプレート中で行うことができる。
- 染色チューブと洗濯板との間に鋭いピンセットで慎重に。標本を転送します。
- 後の最終的な洗浄手順は、カバースリップを持つ抗退色封入の標本をマウントし、蛍光顕微鏡で分析します。
6。 MEの器官培養
- 全小腸はIM 24時間後に切除し、200 U / mlのペニシリンGおよび100μg/ mlストレプトマイシン(KHB + P / S)を含有する冷KHBに配置されます。
- 3cmの長さに腸を切って、GLAを含むシルガードに各セグメントを突き止めるSS皿。
- 細かいハサミで腸間膜を取り外し、編針に腸をスリップ。
- 優しく鋭い鉗子で私を切開し、湿った綿棒を使用して、粘膜下層からそれをはがします。粘膜は編針に残り、さらなる調査のために瞬間凍結することができます。 MEは冷たいKHB + P / Sで収集され
- 2の小さな断片に孤立MEのストリップをカット - 4ミリメートルの長さと半時間氷冷KHB + P / Sでそれをインキュベート及び試料を数回すすいでください。
- 500μlのダルベッコの改変イーグル培地(DMEM)を含む滅菌24ウェルプレートに約50〜60 mgのMEを(1小腸の半分ME少なくとも)に転送します。
- 37℃でさらに24時間インキュベート℃、5%CO 2でインキュベートする 。
- 顕微鏡下で細菌や真菌汚染のための細胞培養を点検してください。
- 上清を回収し、液体窒素で1,000 RCFとスナップ凍結で5分間スピンダウンします。一方、乾燥MUSCを吸い取る30秒と重量のためのクリーンな組織上のleの組織。
- 上清は、命令を製造に従ってELISAまたは上清中の他の代謝物( すなわち、亜硝酸塩)によって放出されたサイトカインのその後の分析(IL-6)のために使用することができる。
- MEの組織の単位重量当たりの測定濃度を正常化する。
7。代表的な結果
- 機能的研究
POIの重症度を評価するための最も重要なパラメータは、in vivoで GITの試験であり、 図1(a)は、未処理のコントロールにおける消化管に沿ったFITCデキストランの典型的な分布を示し、腸管手術後24時間マウスを操作した。 IMは近位空腸におけるGITの著しい遅延( 図1B)につながっている間動物は盲腸で計算された幾何学的中心(GC)を持つ通常のGITを示した"シャムは、運営する"
結腸運動は別途ボール排泄時間はOを測定することにより焦点を当てていたFA 2mmのガラス玉。 IMは470の間に長時間排泄時間につながっている間200秒- -偽手術マウスは48の排泄時間を表示775秒( 図1C)を 。 - 形態学的研究
記述するために白血球の炎症ME内に延びるいくつかの表現型は、組織化学または免疫組織化学を用いて分析することができます。 図中の2A + BのPMNの低い存在の動物が(39±7細胞/ mm 2)が観察された"偽が運営する"。偽手術マウスと比較して強いPMNの浸潤(660±86個/ mm 2)につながった小腸のIM - MEの器官培養
細胞から遊離した、多くの炎症性メディエーターは組織溶解物で検出するのは困難である。器官培養は、培養上清中の遊離メディエーターの検出を可能にする。 POIで代表的なメディエーターは消化管における主要な抑制性神経伝達物質としてである、NOです。5
NOは、ME臓器文化で検出できませんでした無操作コントロール動物のの温度の上清(5±6μM/ 24時間/ mgの組織)。偽手術(開腹)マウスでは53の基礎NOレベル±36μM/ 24時間/ mgの組織は観察されなかった。腸管(手術24時間後に収穫された)改変マウスのMEの文化が( 図3)24時間MEの器官培養中(2254±853μM/ 24時間/ mgの組織)よりNO著しく生じない。

図1はGITのIMの影響(A + B)と結腸通過(C)のGitは、非吸収性のフルオレセイン標識デキストランのパーセントとして測定された15胃腸の内のセグメント·胃(STO)、小腸(SI:1月9日)、盲腸(CEC)、コロン(Co)を経口摂取後-90分。結腸通過を2mmガラスビーズの排泄まで瘻孔プローブを抜くまでの時間として測定した。フルオレセインイソチオシアネート-DEXの()消化分布偽手術またはIM後TRAN。偽手術動物ではマーカーのほとんどは操作動物における近位空腸の場所と比較して盲腸や結腸に位置しています。点線は計算されたGCを示す。 (B)は、GCの計算は、IM後の長引く胃腸通過時間を示した。 (C)の結腸通過時間は、偽手術動物に比べて、IMマウスにおいて有意な遅延が認められた。 15腸のセグメントのためのGCは、平均値(n = 5)のように表示されます。結腸通過時間は、すべての個々の値(n = 6)を意味する表示されていました。 *** = P <0.001、スチューデントのt検定。
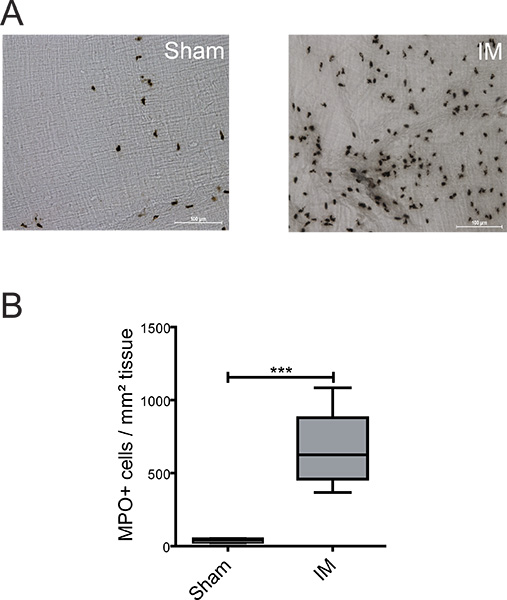
図2小腸私の中のMPO陽性細胞の検出(A)MEホールマウントはMPO陽性の開腹手術後のPMNの24時間(偽)またはIM手順の検出のために切望イェーツ試薬で染色した。 (B)は、マウスあたり5ランダムに選択されたフィールド内のMPO陽性細胞の定量。 n = 6のグループごとにnimals。 *** = P <0.001、スチューデントのt検定。
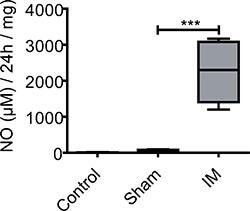
図3 MEの培養上清中のNO産生。無操作コントロールから筋標本は、偽は運営とIMマウスは術後24時間を取られ、24時間培養した。未治療のマウスはNOのごく低い基礎生産を示した。開腹後NO解放は、対照群と偽手術マウスとの間に有意な差を測定することなく増加されていません。 IMのNO産生後24時間は劇的に治療や偽手術マウスと比較して増加します。群あたりn = 5動物。 *** = p <0.001で、1元配置分散分析。
ディスカッション
IMの異なるレベル(10分対優しく盲腸に小腸内容の避難を持つ2つの綿のアプリケーター対IMを使用して小腸の検査のために小腸内臓脱出症)を解析比較研究は、手術操作やPOIの程度との相関関係を明らかにした。 IMが長引くと厳しいPOI結果としてME(PNMs、マクロファージおよびマスト細胞)に白血球の最高額を示した。8他のグループと比較した。
IMのモデルを確...
開示事項
特別な利害関係は宣言されません。
謝辞
この作品は、ドイツ学術振興(KA1270/3-1/2)とBONFOR(O-112.0040)からの補助金によって支えられている。
資料
| Name | Company | Catalog Number | Comments |
| 試薬/機器の名称 | 会社 | カタログ番号 | |
| Ethilon 5/0 | エチコン | 1666H | |
| 綿のアプリケーター | 不具になった | 71010 | |
| 動脈カテーテル | Vygon | 115から798 | |
| 96ウェルプレート(黒) | グライナーバイオワン | 655096 | |
| ガラス玉(直径2mm) | ウォーフ | リクエストに応じて利用可能 | |
| 虫ピン | ファイン科学ツール | 26000から25 | |
| 憧れるイェーツ試薬 | Polyscience | 560694 | |
| Aquatek | メルク | HC109850 | |
| DMEM | ロンザ | BE12-604、F | |
| FITC-デキストラン(分子量70000) | シグマアルドリッチ | 46945-500mgの-F |
参考文献
- Wehner, S., Behrendt, F. F., Lyutenski, B. N., Lysson, M., Bauer, A. J., Hirner, A., Kalff, J. C. Inhibition of macrophage function prevents intestinal inflammation and postoperative ileus in rodents. Gut. 56, 176-185 (2007).
- Kalff, J. C., Schwarz, N. T., Walgenbach, K. J., Schraut, W. H., Bauer, A. J. Leukocytes of the intestinal muscularis: their phenotype and isolation. J. Leukoc. Biol. 63, 683-691 (1998).
- Kehlet, H. Postoperative ileus. Gut. 47, iv85-iv86 (2000).
- Wehner, S., Schwarz, N. T., Hundsdoerfer, R., Hierholzer, C., Tweardy, D. J., Billiar, T. R., Bauer, A. J., Kalff, J. C. Induction of IL-6 within the rodent intestinal muscularis after intestinal surgical stress. Surgery. 137, 436-446 (2005).
- Kalff, J. C., Schraut, W. H., Billiar, T. R., Simmons, R. L., Bauer, A. J. Role of inducible nitric oxide synthase in postoperative intestinal smooth muscle dysfunction in rodents. Gastroenterology. 118, 316-327 (2000).
- Iyer, S., Saunders, W. B., Stemkowski, S. Economic burden of postoperative ileus associated with colectomy in the United States. J. Manag. Care Pharm. 15, 485-494 (2009).
- Miller, M. S., Galligan, J. J., Burks, T. F. Accurate measurement of intestinal transit in the rat. J. Pharmacol. Methods. 6, 211-217 (1981).
- Kalff, J. C., Schraut, W. H., Simmons, R. L., Bauer, A. J. Surgical manipulation of the gut elicits an intestinal muscularis inflammatory response resulting in postsurgical ileus. Ann. Surg. 228, 652-663 (1998).
- Wehner, S., Straesser, S., Vilz, T. O., Pantelis, D., Sielecki, T., de lC, V., Hirner, A., Kalff, J. C. Inhibition of p38 mitogen-activated protein kinase pathway as prophylaxis of postoperative ileus in mice. Gastroenterology. 136, 619-629 (2009).
- Konigsrainer, I., Turck, M. H., Eisner, F., Meile, T., Hoffmann, J., Kuper, M., Zieker, D., Glatzle, J. The Gut is not only the Target but a Source of Inflammatory Mediators Inhibiting Gastrointestinal Motility During Sepsis. Cell Physiol. Biochem. 28, 753-760 (2011).
- Schwarz, N. T., Kalff, J. C., Turler, A., Speidel, N., Grandis, J. R., Billiar, T. R., Bauer, A. J. Selective jejunal manipulation causes postoperative pan-enteric inflammation and dysmotility. Gastroenterology. 26, 159-169 (2004).
- Engel, D. R., Koscielny, A., Wehner, S., Maurer, J., Schiwon, M., Franken, L., Schumak, B., Limmer, A., Sparwasser, T., Hirner, A. T helper type 1 memory cells disseminate postoperative ileus over the entire intestinal tract. Nat. Med. , (2010).
- Stoffels, B., Schmidt, J., Nakao, A., Nazir, A., Chanthaphavong, R. S., Bauer, A. J. Role of interleukin 10 in murine postoperative ileus. Gut. 58, 648-660 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved