É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Avaliação Funcional da motilidade intestinal e inflamação da parede do intestino em Roedores: Análises em um modelo padronizado de Manipulação Intestinal
Neste Artigo
Resumo
Íleo pós-operatório (POI) é uma complicação da cirurgia abdominal levando a um aumento da morbidade e permanência hospitalar prolongada. Porque estratégias profiláticas e terapêuticas faltam pesquisa intensificada é necessário. Por isso, estabeleceu um modelo de mouse padronizada e viável para o entendimento da fisiopatologia POI e estudar potenciais opções terapêuticas.
Resumo
Inflamação do tracto gastrointestinal é um motivo comum para uma grande variedade de doenças humanas. Modelos de pesquisa com animais são fundamentais na investigação do complexo celular e molecular da patologia intestinal. Embora a túnica mucosa é frequentemente o órgão de interesse em muitas doenças inflamatórias, trabalhos recentes demonstraram que a muscularis externa (ME) também é um órgão altamente imunocompetente que abriga uma densa rede de imunócitos residentes. 1,2 Estes trabalhos foram realizados dentro do padronizada modelo de manipulação intestinal (GI) que conduz à inflamação da parede do intestino, principalmente limitada à ME. Clinicamente isto leva a inflamação dismotilidade intestinal prolongada, conhecido como íleo pós-operatório (POI) que é uma complicação frequente e inevitável após cirurgia abdominal. 3 A inflamação é caracterizada pela libertação de mediadores pró-inflamatórios tais como IL-6, 4 ou IL-1β neurotransmissores ou inibitória como Nitric óxido (NO). 5 Posteriormente, os números enormes de imunócitos extravasate no ME, dominado por neutrófilos (PMN) e monócitos e, finalmente, manter POI. 2 com duração de dias, esta paralisia intestinal leva a um aumento do risco de aspiração, a translocação bacteriana infecciosas e complicações até sepsis e falência de órgãos múltiplos e causa um grande fardo econômico. 6
Neste artigo, demonstramos o modelo padronizado de mensagens instantâneas e avaliação in vivo do trânsito gastrointestinal (TGI) e colônico. Além disso, demonstramos um método para a separação do ME da túnica mucosa seguida de análise imunológica, que é crucial para distinguir entre as respostas inflamatórias nestes dois compartimentos de parede altamente Imunoactivas intestinais. Todas as análises são facilmente transferíveis para todos os modelos de outras pesquisas, afetando a função gastrointestinal.
Protocolo
1. Animais
Machos C57BL6 / J ratos com um peso médio de 25 g foram obtidos de Harlan Winkelmann (Borchen, Alemanha). Todos os experimentos foram realizados em conformidade com a lei federal sobre a protecção dos animais. Os princípios de cuidados com animais de laboratório foram seguidas. Os animais foram mantidos com uma luz de 12 h / ciclo escuro e desde com comercialmente disponível para roedores e água da torneira ad libitum. Os animais devem ser alojados pelo menos 7 dias após a chegada a sua instalação para animais antes de experimentos. Note-se que todas as experiências pode ser facilmente adaptada a ratos ou outras espécies e com ligeiras modificações em modelos animais de grande porte.
2. Procedimento operatório
- A anestesia é induzida e mantida com isoflurano (Abbott, Wiesbaden, Alemanha) em oxigênio. Após o início dos animais anestesia local em decúbito dorsal e extremidades fixar com fita adesiva (Leukosilk, Beiersdorf, Hamburgo, Alemanha).
- Após o barbear e desinfecção cirúrgica da parede abdominal uma laparotomia mediana é realizada num comprimento de 2 cm. Entrar na cavidade abdominal através de uma incisão na linha alba. Coloque dois afastadores estéreis para manter o abdômen aberto. Cuidadosamente eventerate do intestino delgado para a esquerda e coloque-o sobre uma gaze de algodão molhado.
- Evacuar os todo o conteúdo do intestino delgado luminais com dois aplicadores de algodão úmido e estéril (mutilados, Neunkirchen, Alemanha), ao mesmo tempo rolando o aplicador do piloro ao ceco. CUIDADO: Evite hemorragias na parede do intestino delgado ou lesões dos vasos do intestino. Voltar a colocar o intestino para a caverna peritoneal sem torcer a evitar a isquemia ou obstrução mecânica e fechar a incisão abdominal utilizando uma de duas camadas contínuas 5/0 poliamida fios não absorvíveis (Ethicon, Norderstedt, Alemanha).
3. Cuidados no pós-operatório
- Após o processo de colocar o animal sob uma lâmpada de aquecimento, observing até que ela recuperou da anestesia. Colocar o rato para trás na sua gaiola e permitir o acesso a água e comida. Devido à propriedade de opióides para afetar o peristaltismo, realizamos analgesia perioperatória com AINEs (por metamizol exemplo) na água potável.
4. Estudos funcional 24 horas após IM
- Gastrointestinal Trânsito (GIT)
- Anestesiar ratos ligeiramente com isoflurano em oxigênio 22,5 horas após IM. Cuidadosamente hiperextensão da cabeça do rato e puxe a língua com uma pinça sem corte. Encher uma seringa de 1 ml, com, pelo menos, 100 uL de dextrano marcado com fluoresceína (FITC-dextrano, 70,000 MW, Sigma Aldrich, Taufkirchen, Alemanha), ligá-lo a um cateter arterial (Vygon, Ecouen, França) e cuidadosamente inserir o cateter como um tubo gástrico no estômago.
- Resumidamente, injectar 100 ul FITC-dextran e retirar o cateter. Deixe o animal acordado e esperar por 90 min. Durante esse tempo, os ratos têm acesso a comida ou água.
- Prepare 15 ml 2 tubos de fiação e classificá-los consecutivamente.
- Eutanásia ratos 90 minutos após administração por sonda e remover todo o trato gastrointestinal do estômago ao recto. Coloque o intestino num bloco de poliestireno e evitar alongamento. CAVE: É crucial para remover o intestino com cuidado para evitar a transferência de líquido de FITC-dextrano para o segmento de perto. Para o início, pode ser útil usar grampos no início e no fim de cada segmento.
- Medir o comprimento total do intestino delgado e comprimento total de cólon. Divida o intestino delgado em 10 segmentos iguais, fixando-a para o bloco de isopor com cânulas. Divida o cólon em 3 segmentos. Você preparou 15 segmentos (estômago # 1), 10 de tamanho igual segmentos do intestino delgado (# 2-11), ceco (# 12) e três 3 de mesmo tamanho segmentos do cólon (# 13-15).
- Transecto intestino nas posições marcadas, agarrá-lo com uma pinça e lave-os uma vez com 1,0 ml KHB no previamente preparado KHB containi2,0 ng ml tubos de vórtice e vigorosamente durante 20 sec. O estômago e ceco são colocados diretamente e corte nos tubos preparados. Encher os tubos com 1,0 ml KHB, assim enxaguamento vestígios de conteúdo luminal da tesoura para os tubos.
- Centrifugar as sondas a 12.000 rcf durante 5 min à temperatura ambiente numa centrífuga de topo de mesa. Durante a centrifugação, preparar mais 15 numeradas consecutivamente tubos de 1,5 ml.
- Transfira os sobrenadantes claros para o tubo de ml com 1,5 e são armazenadas no escuro a 4 ° C até à análise (passo seguinte). As sondas podem ser armazenadas durante vários dias a 4 ° C sem perda significativa de sinal de FITC. Para armazenamento adicionar 0,09% Natrium azida ou loja em <-18 ° C.
- Pipetar 100 duplets uL dos sobrenadantes de uma placa de 96 poços preta (Greiner Bio One, Frickenhausen, Alemanha). Pipeta duas amostras de 100 ul de KHB como em branco.
- Ler a placa num leitor de fluorescência (Safire, Tecan, Crailsheim, Alemanha) e quantificar a fluorescence em 494 nm (absorção) / 521 nm (emissão) de comprimento de onda. Subtrair valores em branco a partir de amostras.
- Calcula-se o centro geométrico (GC) de FITC-dextrano de distribuição, que é, na verdade, o centro de gravidade para a distribuição do marcador, através da fórmula seguinte: GC = Σ (% do sinal de fluorescência total por segmento número do segmento *) / 100
Nota: Multiplicando percentagem de fluorescência de cada um dos segmentos com o seu número de segmento de uma média ponderada da distribuição do marcador dentro do intestino é avaliada. Este ponto é influenciado por tanto a distribuição e a distância percorrida pelo marcador, mas não assume nenhuma distribuição subjacente específica. 7 O valor calculado GC é muitas vezes apresentada em combinação com um gráfico que demonstra a distribuição de FITC dextrano ao longo do tracto gastrointestinal (Figura 1A).
- Trânsito cólon
- Mice deve ser fracamente anestesiados com isoflurane 2% em oxigênio. CUIDADO: Certifique-se de que o animal vai despertar dentro de 40 seg.
- Examinar cuidadosamente a permeabilidade do cólon através da inserção de uma sonda de fístula (metal haste, 2 mm de diâmetro) através do ânus para o cólon.
- Usando a sonda fístula avançar de 2 mm de vidro esfera de 3 cm no cólon e retirar a sonda imediatamente. Posicione o mouse em uma gaiola transparente e começar a medir o tempo após a sonda fístula foi puxado para fora do cólon. Fique de olho para o mouse e parar o tempo logo após a bola de vidro se tornou excretado.
5. Análise histoquímica de espécimes isolados ME
- Midjejunal segmentos são cortados a partir do intestino e imerso em KHB a frio num prato de Sylgard-cheia.
- Mesentério é preso ao prato com agulhas 0,2 milímetros de insetos (Ferramentas Ciência Fine, Heidelberg, Alemanha).
- Cortar abrir o segmento ao longo de sua borda mesentérica e esticar a ~ 120% do seu comprimento e largura. Finalize a fixação com insetopinos no lado oposto do mesentério. Lave o prato Sylgard cuidadosamente com KHB fresco gelado, assim, a lavagem todos os conteúdos luminais.
ME podem agora mecanicamente separada da túnica mucosa a partir do mesentério. Durante a preparação substituir frescas, refrigeradas KHB várias vezes. - Túnica mucosa pode ser separado choque congelado em azoto líquido para posterior análise ou descartados.
- Fixar a montagem ME isolada inteiro com etanol a 100% durante 10 min à temperatura ambiente.
Lavar os integrais de montagem três vezes usando KHB refrigerados. Nota: fixadores outros (ou seja, 4% de formaldeído, ácido acético, acetona), também pode ser utilizado depois de testar a sua compatibilidade com a análise subsequente. - As montagens ME inteiras estão prontos para a coloração histoquímica ou imuno-histoquímico mais:
- Histoquímica: coloração de mieloperoxidase (MPO)
PMNs infiltradas pode ser analisado pelo seguinte protocolo MPO coloração.- Resolva 10 mg HEscora reagente Yates (Polyscience Europa, Eppelheim, Alemanha) em 10 ml de KHB e adicionar 100 ul de 3% de H 2 O 2. Prepare a solução recentemente imediatamente antes de usar e não reutilizar.
- Incubar as peças inteiras durante 10 min à temperatura ambiente.
- Enxaguar espécimes extensivamente com KHB frio e incubar durante 10 min.
- Montar os espécimes em meio de montagem aquoso (Aquatek, Merck, Darmstadt, Alemanha) Após a secagem durante 2 hr analisam as lâminas sob um microscópio de luz.
- Conte o número de células em 5 campos escolhidos aleatoriamente e calcular como MPO células positivas / mm 2.
- A coloração imuno-histoquímica:
De acordo com a coloração histoquímica MPO, colorações imunohistoquímicas das montagens inteiras podem ser executadas. Principalmente, os protocolos estabelecidos coloração imuno-histoquímica da cultura de células ou fatias de tecidos podem ser facilmente adaptados a uma coloração de montagem inteira. No entanto, otimizando o processo de anti específicacorpos é altamente recomendável.- Cortar amostras em peças de 5 x 5 mm e realizar a coloração em tubos de centrífuga de 2,0 ml, de fundo redondo, em ~ 150 ul - 200 ul de solução de anticorpo.
- Fixação e de bloqueio interno (isto é, 3% BSA em PBS durante 1 h à temperatura ambiente) pode ser realizada no "prato Sylgard".
- Passos de lavagem em PBS, ou outros tampões podem ser realizados em placas de 12 poços.
- Transferir as amostras. Cuidadosamente com uma pinça nítidas entre tubos e placas de coloração de lavar.
- Após os finais de lavagem espécimes procedimento de montagem no anti-desbotamento meio de montagem com lamínulas e analisar com um microscópio fluorescente.
6. Cultura órgão do ME
- Todo o intestino pequeno é ressecado 24 hr após IM e colocados em KHB a frio, contendo 200 U / ml de penicilina G e estreptomicina 100 ug / ml (KHB + P / S).
- Corte o intestino em 3 cm de comprimento e pino de cada segmento para baixo a uma Sylgard contendo glaprato ss.
- Retire o mesentério com tesoura fina e desliza o intestino em uma agulha de tricô.
- Gentilmente incisão no ME com uma pinça afiada e tira-lo do submucosa usando um aplicador de algodão úmido. A mucosa túnica permanece na agulha de tricotar e pode ser congelada estalo para uma investigação mais aprofundada. O ME é coletado em KHB frio + P / S.
- Corte as tiras isoladas ME em pequenos pedaços de 2-4 mm de comprimento e incubar em gelo frio KHB + P / S durante meia hora e enxaguar a amostra várias vezes.
- Transferir aproximadamente 50-60 mg ME (pelo menos a metade de um ME de intestino delgado), numa placa de 24 poços estéreis contendo Dulbecco modificado 500 ul de meio de Eagle (DMEM).
- Incubar a 37 ° C e 5% CO 2 durante 24 h adicionais.
- Inspeccionar as culturas de células de contaminação bacteriana ou fúngica sob um microscópio.
- Recolher o sobrenadante, girar por 5 min a 1000 rcf e congelar pressão em nitrogênio líquido. Enquanto isso secar o muscle tecido em um tecido limpo durante 30 segundos e o peso.
- Os sobrenadantes podem ser utilizados para a análise subsequente de citocinas (IL-6) por meio de ELISA ou outros metabolitos (por exemplo, nitrito) no sobrenadante, seguindo instruções do fabricante.
- Normalizar concentrações medidas por peso do ME tecido.
7. Resultados representativos
- Estudos funcionais
O parâmetro mais importante na avaliação da gravidade da PI é a análise do GIT in vivo. Figura 1A demonstra uma distribuição típica de FITC dextrano ao longo do tracto gastrointestinal, em controlos não tratados e ratinhos manipulados intestinally hr 24 após a cirurgia. "Sham operados" animais mostraram uma GIT normal com um centro de cálculo geométrico (GC) no ceco enquanto IM levou a um atraso significativo do GIT no jejuno proximal (Figura 1B)
Motilidade do cólon foi focada em separado através da medição do tempo de excreção de bola ofa 2 bola de vidro mm. Sham operados ratinhos mostram um tempo de excreção de 48 - 200 seg enquanto IM conduziu a um tempo prolongado entre a excreção de 470-775 segundos (Figura 1C). - Estudos morfológicos
Para descrever a inflamatório estender dentro dos fenótipos ME vários dos leucócitos podem ser analisados utilizando histoquímica ou imuno-histoquímica. Na figura 2A + B baixa presença de PMNs em "operação simulada" animais foi observado (39 ± 7 células / mm 2). IM do intestino delgado levou a uma infiltração PMN forte (660 ± 86 células / mm 2), em comparação com camundongos operação simulada - ME Organ Culture
Muitos mediadores inflamatórios libertados a partir de células são difíceis de detectar, em lisados de tecido. Culturas de órgãos de permitir a detecção de mediadores libertados no sobrenadante de cultura. Um mediador representativo de POI é NO, que é como neurotransmissor inibidor principal no tracto gastrointestinal 5.
NO não pôde ser detectado em ME cul órgãotura sobrenadantes de animais de controlo não-operados (5 ± 6 pM / 24 tecido hr / mg). Na operação simulada (laparotomia) ratos basal os níveis de NO de 53 ± 36 nM / 24 tecido h / mg foram observados. ME culturas de murganhos manipulados intestinally (colhido 24 horas após a cirurgia) produzem significativamente mais NÃO (2254 ± 853 pM / 24 tecido hr / mg) durante 24 horas de cultura de órgãos ME (Figura 3).

Figura 1. Efeito de IM em GIT (A + B) e do trânsito do cólon (C) GIT foi medido como a percentagem de não-absorvível de dextrano marcado com fluoresceína em 15 gastrointestinal segmentos-estômago (STO), intestino delgado (SI 1-9 ), ceco (Cec) e cólon (Co) -90 min após a ingestão oral. Trânsito colónico foi medida como o tempo desde a puxar para fora da sonda, até a excreção de fístula de 2 mm de contas de vidro. (A) de distribuição gastrointestinal de isotiocianato de fluoresceína-dextran após operação simulada ou IM. Em animais de operação simulada a maior parte do marcador está localizado no ceco ou o cólon proximal em relação à localização do jejuno proximal em animais manipulados. As linhas pontilhadas indicam calculado GC. (B) Cálculo do GC demonstrou um tempo de trânsito gastrintestinal prolongada após IM. (C) o tempo de trânsito do cólon mostraram um atraso significativo em ratos em comparação com os animais de MI operação simulada. GC para os 15 segmentos intestinais são apresentados como média (n = 5). Tempo de trânsito colônico foram exibidos dizer com todos os valores individuais (n = 6). *** = P <0,001, teste t de Student.
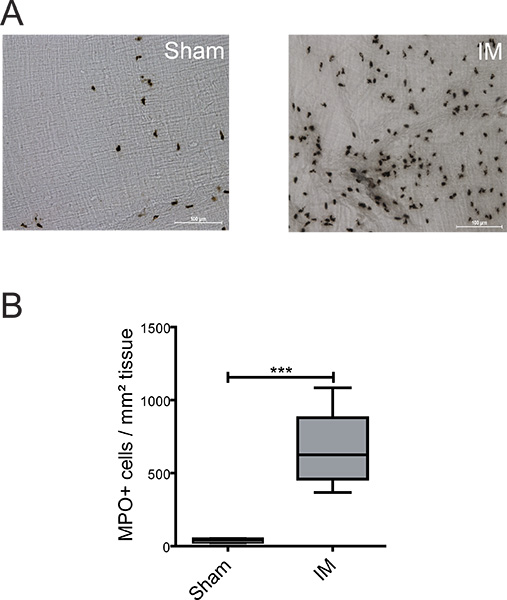
Figura 2. Detecção de MPO células positivas dentro do intestino delgado ME. (A) ME montagens inteiras foram coradas com reagente Hanker Yates para a detecção de MPO positiva PMN 24 horas após laparotomia (sham) ou procedimento IM. (B) Quantificação da célula positiva MPO em 5 campos aleatoriamente escolhidos por rato. n = 6 animals por grupo. *** = P <0,001, teste t de Student.
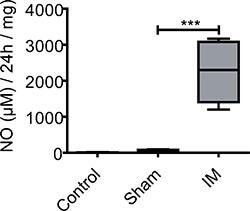
Figura 3. Produção de NO nos sobrenadantes de cultura de ME. Espécimes musculares de controles não operados, simulação e ratos IM foram 24 horas de pós-operatório e cultivados por 24 horas. Ratos não tratados apresentaram apenas uma produção muito baixa basal de NO. Após laparotomia NÃO libertação é aumentada sem medir diferenças significativas entre o grupo controle e os ratos operação simulada. 24 horas após a produção de NO IM é dramaticamente aumentada em comparação com ratinhos não tratados ou sham operados. n = 5 animais por grupo. *** = P <0,001, ANOVA uma via.
Discussão
Um estudo comparativo analisando diferentes níveis de IM (eventração intestino delgado por 10 min versus suavemente inspeção do intestino delgado através de dois aplicadores de algodão contra o IM com a evacuação do conteúdo do intestino delgado para o ceco) revelou uma correlação entre a extensão da manipulação cirúrgica e POI. Em comparação com os outros grupos IM apresentaram maior quantidade de leucócitos no ME (PNMS, macrófagos e mastócitos), resultando em POI prolongada e severa. 8....
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado por doações do Deutsche Forschungsgemeinschaft (KA1270/3-1/2) e BONFOR (O-112,0040).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente / Equipamentos | Companhia | Número de catálogo | |
| Ethilon 5/0 | Ethicon | 1666H | |
| Aplicadores de algodão | Mutilados | 71010 | |
| cateter arterial | Vygon | 115-798 | |
| Placa de 96 poços (preto) | Greiner Bio One | 655096 | |
| bola de vidro (2 mm de diâmetro) | Worf | disponível a pedido | |
| Pinos de insetos | Belas Science Tools | 26000-25 | |
| Hanker Reagente Yates | Polyscience | 560694 | |
| Aquatek | Merck | HC109850 | |
| DMEM | Lonza | BE12-604 F | |
| FITC-dextrano (PM 70000) | Sigma Aldrich | 46945-500 mg-F |
Referências
- Wehner, S., Behrendt, F. F., Lyutenski, B. N., Lysson, M., Bauer, A. J., Hirner, A., Kalff, J. C. Inhibition of macrophage function prevents intestinal inflammation and postoperative ileus in rodents. Gut. 56, 176-185 (2007).
- Kalff, J. C., Schwarz, N. T., Walgenbach, K. J., Schraut, W. H., Bauer, A. J. Leukocytes of the intestinal muscularis: their phenotype and isolation. J. Leukoc. Biol. 63, 683-691 (1998).
- Kehlet, H. Postoperative ileus. Gut. 47, iv85-iv86 (2000).
- Wehner, S., Schwarz, N. T., Hundsdoerfer, R., Hierholzer, C., Tweardy, D. J., Billiar, T. R., Bauer, A. J., Kalff, J. C. Induction of IL-6 within the rodent intestinal muscularis after intestinal surgical stress. Surgery. 137, 436-446 (2005).
- Kalff, J. C., Schraut, W. H., Billiar, T. R., Simmons, R. L., Bauer, A. J. Role of inducible nitric oxide synthase in postoperative intestinal smooth muscle dysfunction in rodents. Gastroenterology. 118, 316-327 (2000).
- Iyer, S., Saunders, W. B., Stemkowski, S. Economic burden of postoperative ileus associated with colectomy in the United States. J. Manag. Care Pharm. 15, 485-494 (2009).
- Miller, M. S., Galligan, J. J., Burks, T. F. Accurate measurement of intestinal transit in the rat. J. Pharmacol. Methods. 6, 211-217 (1981).
- Kalff, J. C., Schraut, W. H., Simmons, R. L., Bauer, A. J. Surgical manipulation of the gut elicits an intestinal muscularis inflammatory response resulting in postsurgical ileus. Ann. Surg. 228, 652-663 (1998).
- Wehner, S., Straesser, S., Vilz, T. O., Pantelis, D., Sielecki, T., de lC, V., Hirner, A., Kalff, J. C. Inhibition of p38 mitogen-activated protein kinase pathway as prophylaxis of postoperative ileus in mice. Gastroenterology. 136, 619-629 (2009).
- Konigsrainer, I., Turck, M. H., Eisner, F., Meile, T., Hoffmann, J., Kuper, M., Zieker, D., Glatzle, J. The Gut is not only the Target but a Source of Inflammatory Mediators Inhibiting Gastrointestinal Motility During Sepsis. Cell Physiol. Biochem. 28, 753-760 (2011).
- Schwarz, N. T., Kalff, J. C., Turler, A., Speidel, N., Grandis, J. R., Billiar, T. R., Bauer, A. J. Selective jejunal manipulation causes postoperative pan-enteric inflammation and dysmotility. Gastroenterology. 26, 159-169 (2004).
- Engel, D. R., Koscielny, A., Wehner, S., Maurer, J., Schiwon, M., Franken, L., Schumak, B., Limmer, A., Sparwasser, T., Hirner, A. T helper type 1 memory cells disseminate postoperative ileus over the entire intestinal tract. Nat. Med. , (2010).
- Stoffels, B., Schmidt, J., Nakao, A., Nazir, A., Chanthaphavong, R. S., Bauer, A. J. Role of interleukin 10 in murine postoperative ileus. Gut. 58, 648-660 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados