Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Функциональная оценка моторики кишечника и воспаление стенки кишечника у грызунов: Анализы в стандартной модели Кишечные Манипуляции
В этой статье
Резюме
Послеоперационная кишечная непроходимость (POI) является осложнением абдоминальной хирургии приводит к увеличению заболеваемости и длительного пребывания в больнице. Потому профилактических или терапевтических стратегий не хватает активизировались исследования необходимы. Поэтому мы установили стандартизированных и возможности мышь модель для изучения патофизиологии POI и изучить потенциальные терапевтические возможности.
Аннотация
Воспаление желудочно-кишечного тракта является общей причиной различных заболеваний человека. Исследования на животных моделях имеют решающее значение в расследовании комплекс клеточных и молекулярных кишечной патологии. Хотя слизистой оболочки часто является органом интерес во многих воспалительных заболеваний, последние работы показали, что мышечной наружная (ME) также высоко иммунокомпетентных орган, который таит в себе густую сеть резидентов иммуноцитов. 1,2 Эти работы были выполнены в рамках стандартизированного Модель кишечного манипуляции (IM), что приводит к воспалению стенки кишечника, в основном, ограничивается ME. Клинически это воспаление приводит к длительной кишечной моторики, известный как послеоперационная кишечная непроходимость (POI), который является частым и неизбежных осложнений после абдоминальной хирургии. 3 воспаление характеризуется освобождением провоспалительных медиаторов, таких как IL-6 4 или IL-1β или тормозных нейромедиаторов как нитриС азота (NO) 5. Впоследствии огромное количество иммуноцитов вытекать из сосудов в ткань в ME, преобладают полиморфноядерные нейтрофилы (ПМН) и моноцитов и, наконец, сохранить POI. 2 длятся по нескольку дней, это кишечная паралич приводит к увеличению риска аспирации, бактериальная транслокация и инфекционных осложнений до сепсиса и несколько органной недостаточности и приводит к высоким экономическим бременем 6.
В этой рукописи мы демонстрируем стандартизированной модели IM и в естественных условиях оценка желудочно-кишечный тракт (ЖКТ) и толстой транзита. Кроме того мы демонстрируем метод для разделения меня от слизистой оболочки следует иммунологического анализа, которая имеет решающее значение для различия между воспалительной реакции в эти оба очень иммуноактивные отсеков стенки кишечника. Все анализы легко переносятся на любой другой модели исследования, затрагивающие желудочно-кишечного функции.
протокол
1. Животные
Мужской C57BL6 / J мышей со средним весом 25 г были получены от Harlan Винкельман (Borchen, Германия). Все эксперименты проводились в соответствии с федеральным законом о защите животных. Принципы ухода за животными лаборатории были соблюдены. Животные находились на 12-часа цикле свет / темнота и при условии, имеющиеся в продаже грызунов и водопроводной воды вволю. Животные должны быть размещены не позднее 7 дней после прибытия животных объекта до экспериментов. Заметим, что все эксперименты могут быть легко адаптированы для крыс или других видов и с небольшими изменениями в больших моделях животных.
2. Оперативные процедуры
- Анестезия индуцируется и поддерживается изофлураном (Abbott, Висбаден, Германия) в кислороде. После наступления анестезии животных месте в лежачем положении и закрепите конечностей с помощью клейкой ленты (Leukosilk, Beiersdorf, Гамбург, Германия).
- После бритья и хирургической дезинфекции брюшной стенки срединная лапаротомия выполняется на длину 2 сантиметра. Введите в брюшную полость через разрез вдоль белой линии. Поместите два стерильных втягивающих держать открытым животом. Осторожно eventerate тонкой кишки слева и поместите его на мокрой марлей хлопка.
- Эвакуировать весь просвет тонкой кишки содержимое с двумя влажной стерильной ватой и аппликаторы (увечья, Neunkirchen, Германия) одновременно прокатки аппликатор от привратника до слепой кишки. ВНИМАНИЕ: Не кровоизлияния малого стенки кишечника или поражениями кишечника сосудов. Положить кишки обратно в брюшную пещеру без перекручивания для предотвращения ишемии или механическая обструкция и закрыть разрез брюшной стенки с использованием двух слоев непрерывный 5/0 полиамида, не рассасывающиеся нити (Ethicon, Нордерштедт, Германия).
3. Ведение послеоперационного периода
- После процедуры поместить животное под нагревательную лампу, observiнг, пока она оправилась от наркоза. Наведите обратно в свою клетку и разрешить доступ к воде и пище. Благодаря свойству опиоидов повлиять на перистальтику, мы выполняем периоперационной аналгезии с НПВП (например, метамизол) в питьевой воде.
4. Функциональные исследования через 24 часа после IM
- Желудочно-кишечный тракт (ЖКТ)
- Анестезию мышей немного изофлураном в кислороде 22,5 ч после ИМ. Осторожно hyperextend глава мыши и вытащить язык с тупым пинцетом. Заполнить 1 мл шприц с по крайней мере 100 мкл флуоресцеин-меченого декстрана (FITC-декстрана, 70000 МВт, Sigma Aldrich, Taufkirchen, Германия), подключите его к артериального катетера (Выгон, Ecouen, Франция) и осторожно вставьте катетер желудочный зонд в желудок.
- Коротко вводят 100 мкл FITC-декстрана и вытащить катетер. Пусть животное бодрствует и подождите 90 мин. В течение этого времени мышам доступ к пище и воде.
- Подготовка пятнадцать 2 мл спиннинг труб и обозначить их последовательно.
- Усыпить мышей через 90 мин после введения через зонд и удалить весь желудочно-кишечный тракт от желудка к прямой кишке. Поместите кишечника на полистирол площадку и избежать растяжения. CAVE: Очень важно, чтобы удалить кишечник осторожно, чтобы избежать смещения жидких FITC-декстрана в соседний сегмент. Для начала было бы полезно использовать клипы в начале и в конце каждого сегмента.
- Измерьте всей длине тонкой кишки и полная длина толстой кишки. Разделите тонкой кишки на 10 равных размеров сегментов, закрепив его до полистирола площадку с канюль. Разделите толстой кишки на 3 сегмента. Вы подготовили 15 сегментов (желудок № 1), десять одинаковых по размеру небольших сегментов кишечника (# 2-11), слепой кишки (# 12) и три 3 одинаковых по размеру сегментов толстой (# 13-15).
- Разрез кишечника в отмеченных позиций, захватить его пинцетом и промойте их один раз с 1,0 мл KHB в заранее подготовленные KHB containiнг 2,0 мл трубки и вихрь энергично в течение 20 сек. Желудка и слепой кишки располагаются непосредственно и сократить в подготовленном труб. Заполните эти трубки с 1,0 мл KHB, таким образом, промывка следы просвета содержимое из ножниц в трубах.
- Центрифуга зондов при 12000 RCF в течение 5 мин при комнатной температуре в центрифуге верхней таблице. Во время центрифугирования подготовить еще 15 пронумерованных пробирки на 1,5 мл.
- Передача четкого супернатантов в новой трубки 1,5 мл и хранят в темноте при 4 ° С до анализа (следующий шаг). Зонды могут быть сохранены в течение нескольких дней при температуре 4 ° C без значительных потерь FITC сигнала. Для более длительного хранения добавляют 0,09% натрия азид-магазине или при <-18 ° C.
- Внесите 100 мкл Duplets из супернатантов на черный 96-луночный планшет (Greiner Bio One, Frickenhausen, Германия). Внесите два 100 мкл образцов KHB как пустые.
- Читайте пластины в Флюориметры (Сафир, Tecan, Crailsheim, Германия) и количественно fluorescencе при 494 нм (поглощение) / 521 нм (излучение) длин волн. Вычтите пустые значения из образцов.
- Рассчитать геометрический центр (GC) из FITC-декстрана распределения, которая на самом деле центр тяжести распределения маркер, по следующей формуле: GC = Σ (% от общего числа флуоресцентного сигнала в сегменте * номер сегмента) / 100
Примечание: Умножая процент флуоресценции каждого сегмента с ее номер сегмента среднее взвешенное распределение маркеров в кишечнике оценивается. Эта точка находится под влиянием как распределение и расстояние, пройденное маркер, но не несет никакой конкретной исходного распределения. 7 рассчитывается GC значение часто представляют в сочетании с график распределения ФИТЦ декстрана на желудочно-кишечный тракт (рис. 1А).
- Кишечное транзитных
- Мышь должна быть слабой анестезии isoflurане 2% кислорода. ВНИМАНИЕ: Убедитесь, что животное проснется в течение 40 сек.
- Тщательно осмотрите толстого проходимости, вставив свищ зонда (металлический стержень, диаметром 2 мм) через анус в толстую кишку.
- Использование свища зонд продвижения 2 мм стеклянный шарик 3 см в прямую кишку и вытащить зонд немедленно. Наведите в прозрачную клетку и начать измерения времени после свища зонд вышел из толстой кишки. Следите, чтобы мыши и остановить время непосредственно после стеклянный шар стал выводятся из организма.
5. Гистохимические анализ единичных экземплярах ME
- Midjejunal сегменты, вырезанные из кишечника и погружали в холодную KHB в Sylgard заполненные блюдо.
- Брыжейка закреплен на блюдо с иглами 0,2 мм насекомых (Fine Инструменты наук, Гейдельберг, Германия).
- Разрезать вдоль сегмента брыжеечной границе и растянуть на ~ 120% его длины и ширины. Завершение фиксации с насекомымиконтакты на противоположной брыжейки. Промыть тщательно Sylgard блюдо со свежим KHB холодный лед, тем самым сбрасывать все содержимое просвета.
ME теперь можно механически отделить от слизистой оболочки, начиная от брыжейки. В ходе подготовки заменить свежей охлажденной KHB несколько раз. - Отдельно слизистой оболочки может быть ударных замораживали в жидком азоте для дальнейшего анализа или отбрасываются.
- Исправить изолированные ME целые горы со 100% этанола в течение 10 мин при комнатной температуре.
Вымойте все крепления в три раза использованием охлажденной KHB. Примечание: другие фиксаторы (т.е. 4% формальдегида, уксусной кислоты, ацетона) также может быть использована после проверки его совместимости с последующим анализом. - ME тотальных готовы к дальнейшему гистохимических или immunhistochemical окрашивания:
- Гистохимия: миелопероксидазы (МПО) окрашивания
Проникли PMNs может быть рассмотрен следующий протокол окрашивания MPO.- Решите 10 мг HАнкер Yates реагента (Polyscience Европе, Eppelheim, Германия) в 10 KHB мл и добавляют 100 мкл 3% H 2 O 2. Приготовьте раствор свежей непосредственно перед использованием и не использовать повторно.
- Инкубируйте тотальных в течение 10 мин при комнатной температуре.
- Промыть образцов широко холодной KHB и инкубировать в течение 10 мин.
- Установите образцов в водном монтаж среды (Акватек, Merck, Дармштадт, Германия) После сушки в течение 2 часов анализировать слайды под световым микроскопом.
- Граф количество клеток в 5 случайно выбранных полей и вычислить, как MPO-положительных клеток / мм 2.
- Иммуногистохимического окрашивания:
Соответственно в гистохимических окрашивания МПО, иммуногистохимического окрашивания всей крепления могут быть выполнены. В принципе, ваши установленные протоколы иммуногистохимического окрашивания культур клеток или тканей кусочки могут быть легко адаптированы к целому окрашивания горе. Тем не менее, оптимизация процедур для конкретных борьбеорганов настоятельно рекомендуют.- Вырезать образцы в 5 х 5 штук мм и выполнить окрашивание в 2,0 мл круглые трубы центрифуги дна в ~ 150 мкл - 200 мкл раствора антител.
- Фиксация и блокирование процедуры (т.е. 3% BSA в PBS в течение 1 часа при комнатной температуре) может быть выполнена в "Sylgard блюдо".
- Стиральные шаги в PBS или другие буферы могут быть выполнены в 12-луночных планшетах.
- Перенесите. Образцы тщательно с острым пинцетом между окрашивание труб и промывка пластин.
- После окончательной промывки крепления образцов в анти-выцветанию монтажа среду с крышкой промахи и проанализировать с помощью флуоресцентного микроскопа.
6. Органной культуры ME
- Весь тонкой кишки иссекают через 24 часа после IM и помещают в холодную KHB, содержащих 200 ЕД / мл пенициллина G и 100 мкг / мл стрептомицина (KHB + P / S).
- Сокращение кишечника на 3 см длиной и пин-код каждого сегмента до Sylgard содержащие GLAсс блюдо.
- Удалить брыжейки с мелкими ножницами и ускользнуть кишечника на вязальную спицу.
- Аккуратно надрезать ME с острым пинцетом и лишить ее от подслизистой помощью влажного аппликатора хлопка. Слизистой оболочки остается на спицу и может быть быстро замораживают для дальнейшего расследования. ME собираются в холодных KHB + P / S.
- Вырезать изолированные ME полосы на мелкие кусочки 2 - 4 мм длиной и инкубировать ее в ледяную KHB + P / S на полчаса и смыть образца в несколько раз.
- Передача примерно 50-60 мг ME (по крайней мере половина ME одного тонкого кишечника) в стерильных 24-луночный планшет, содержащий 500 мкл Дульбекко с Изменено Eagle среде (DMEM).
- Инкубировать при температуре 37 ° С и 5% СО 2 в течение дополнительных 24 часов.
- Осмотрите клеточных культур для бактериального или грибкового загрязнения под микроскопом.
- Сбор супернатант, спин вниз в течение 5 мин при 1000 RCF и оснастки замораживание в жидком азоте. Между тем промокните насухо MUSCле ткани на чистую ткань в течение 30 сек и вес.
- Супернатанты могут быть использованы для последующего анализа выпустила цитокинов (IL-6) с помощью ИФА или других метаболитов (например, нитриты) в надосадочной, следуя инструкции производителя.
- Нормализация измеренные концентрации по весу ME ткани.
7. Представитель Результаты
- Функциональные исследования
Наиболее важным параметром для оценки тяжести POI это исследование желудочно-кишечного тракта в естественных условиях. Рис. 1А демонстрирует типичное распределение FITC декстрана вдоль желудочно-кишечного тракта в необработанных контрольных и кишечно манипулировать мышей через 24 часа после операции. "Шам работать" животных показали нормальную желудочно-кишечного тракта с расчетным геометрическим центром (GC) в слепой кишке в то время как IM привело к значительной задержке ЖКТ в проксимальной тощей кишки (рис. 1б)
Моторику толстой кишки было сосредоточено на отдельно путем измерения выделения времени мяч OFA 2 мм стеклянный шар. Sham работать мышах показывают, выделения времени из 48 - 200 сек, а IM привело к длительному времени экскреции между 470 - 775 сек (рис. 1С). - Морфологических исследований
Для описания воспалительных распространяется в меня несколько фенотипов лейкоциты могут быть проанализированы с помощью гистохимия или иммуногистохимии. На рисунке 2A + B низкое присутствие PMNs в "фиктивный работать" животных наблюдалось (39 ± 7 клеток / мм 2). IM тонкой кишки привело к сильной инфильтрации ПМН (660 ± 86 клеток / мм 2) по сравнению с мнимым управлением мышей - ME органной культуры
Многие медиаторы воспаления освобожденные из клеток, которые трудно обнаружить в тканях лизатов. Органной культуры позволяют выявлять освобожденных посредников в супернатант культуры. Представитель посредника в POI НЕТ, которая является как основным тормозным нейромедиатором в желудочно-кишечном тракте 5.
NO не могли быть обнаружены в ME органа культуртуры супернатантах неоперированных контрольных животных (5 ± 6 мкм / 24 часа / мг ткани). В мнимого управлением (лапаротомия) мышей базального NO уровня 53 ± 36 мкм / 24 ч / мг ткани не наблюдается. ME культур кишечно манипулировать (собрано 24 часа после операции) мышей производят значительно больше НЕТ (2254 ± 853 мкмоль / 24 ч / мг ткани) в течение 24 часов органной культуры ME (рис. 3).

Рисунок 1. Влияние IM на ЖКТ (A + B) и толстой транзита (C) GIT измерялась как процент нерассасывающийся флуоресцеин-меченого декстрана в 15-кишечного сегмента желудка (STO), тонкой кишки (SI 1-9 ), слепой кишки (ЦИК) и толстой кишки (Co) -90 мин после перорального приема. Кишечное транзита измеряется как время от вытягивания свища зонд до выделения 2 мм, стеклянная бусина. (A) Желудочно-кишечный распределения флуоресцеина изотиоцианат-Dexпереход после мнимого операции или IM. В мнимого оперированных животных большинстве маркер находится в слепой кишке и проксимальных толстой кишки по сравнению с проксимальной тощей место в манипулировал животных. Пунктирные линии показывают, рассчитанные GC. (B) Расчет GC показали длительные желудочно-кишечного время транзита через IM. (C) Кишечное транзитное время показало значительные задержки в IM мышей по сравнению с мнимым оперированных животных. GC для 15 кишечного сегмента отображается в виде среднего (n = 5). Кишечное время транзита были показаны значит все индивидуальные значения (n = 6). = *** Р <0,001, Стьюдента-тест.
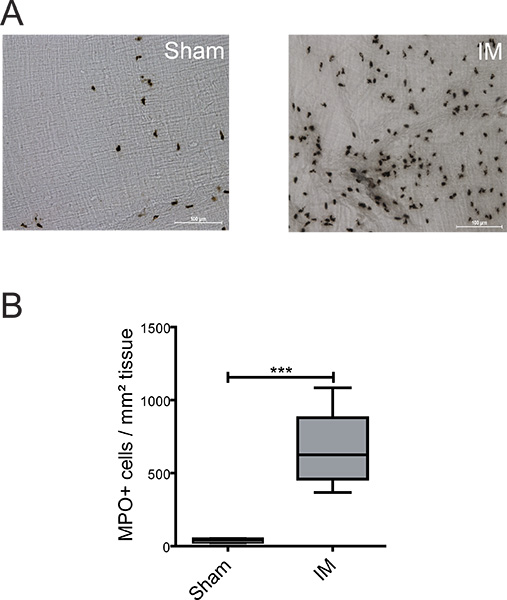
Рисунок 2. Обнаружение МПО положительных клеток в тонкой кишке ME. (A) ME тотальных окрашивали реагентом Hanker Yates для обнаружения МПО положительные PMN 24 часов после лапаротомии (обман) или IM процедуры. (B) Количественная МПО положительных клеток в течение 5 случайно выбранных полях на мышь. п = 6nimals в группе. = *** Р <0,001, Стьюдента-тест.
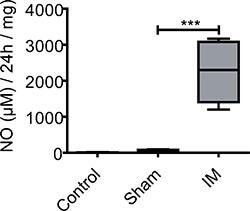
Рисунок 3. НЕТ производство в культуре супернатантов ME. Мышцы образцов из неоперированных управления, обман эксплуатации и IM мышей были взяты 24 часов после операции и культивировали в течение 24 часов. Необработанные мышах показали только очень низкие базальные производство NO. После лапаротомии NO освобождения увеличивается без измерения существенных различий между контрольной группой и фиктивных управлением мышей. Через 24 часа после IM NO производства резко возросла по сравнению с необработанными или фиктивных управлением мышей. п = 5 животных в группе. = *** Р <0,001, 1 дисперсионного анализа.
Обсуждение
Сравнительное исследование анализом различных уровней IM (небольшие эвентрация кишечника в течение 10 мин по сравнению с нежно осмотр тонкой кишки с помощью двух аппликаторов хлопка по сравнению с IM с эвакуацией небольшого содержания кишечника в слепой кишке) показали корреляцию между...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана грантами от Deutsche Forschungsgemeinschaft (KA1270/3-1/2) и BONFOR (O-112,0040).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента / Оборудование | Компания | Номер в каталоге | |
| Ethilon 5/0 | Ethicon | 1666H | |
| Хлопок аппликаторы | Искалеченный | 71010 | |
| артериального катетера | Выгон | 115-798 | |
| 96-луночный планшет (черный) | Greiner Bio один | 655096 | |
| стеклянный шар (2 мм в диаметре) | Ворф | предоставляется по запросу | |
| Насекомое контакты | Средства изобразительных наук | 26000-25 | |
| Hanker Yates реагентов | Polyscience | 560694 | |
| Акватек | Merck | HC109850 | |
| DMEM | Lonza | BE12-604 F | |
| FITC-декстрана (молекулярная масса 70000) | Sigma Aldrich | 46945-500мг-F |
Ссылки
- Wehner, S., Behrendt, F. F., Lyutenski, B. N., Lysson, M., Bauer, A. J., Hirner, A., Kalff, J. C. Inhibition of macrophage function prevents intestinal inflammation and postoperative ileus in rodents. Gut. 56, 176-185 (2007).
- Kalff, J. C., Schwarz, N. T., Walgenbach, K. J., Schraut, W. H., Bauer, A. J. Leukocytes of the intestinal muscularis: their phenotype and isolation. J. Leukoc. Biol. 63, 683-691 (1998).
- Kehlet, H. Postoperative ileus. Gut. 47, iv85-iv86 (2000).
- Wehner, S., Schwarz, N. T., Hundsdoerfer, R., Hierholzer, C., Tweardy, D. J., Billiar, T. R., Bauer, A. J., Kalff, J. C. Induction of IL-6 within the rodent intestinal muscularis after intestinal surgical stress. Surgery. 137, 436-446 (2005).
- Kalff, J. C., Schraut, W. H., Billiar, T. R., Simmons, R. L., Bauer, A. J. Role of inducible nitric oxide synthase in postoperative intestinal smooth muscle dysfunction in rodents. Gastroenterology. 118, 316-327 (2000).
- Iyer, S., Saunders, W. B., Stemkowski, S. Economic burden of postoperative ileus associated with colectomy in the United States. J. Manag. Care Pharm. 15, 485-494 (2009).
- Miller, M. S., Galligan, J. J., Burks, T. F. Accurate measurement of intestinal transit in the rat. J. Pharmacol. Methods. 6, 211-217 (1981).
- Kalff, J. C., Schraut, W. H., Simmons, R. L., Bauer, A. J. Surgical manipulation of the gut elicits an intestinal muscularis inflammatory response resulting in postsurgical ileus. Ann. Surg. 228, 652-663 (1998).
- Wehner, S., Straesser, S., Vilz, T. O., Pantelis, D., Sielecki, T., de lC, V., Hirner, A., Kalff, J. C. Inhibition of p38 mitogen-activated protein kinase pathway as prophylaxis of postoperative ileus in mice. Gastroenterology. 136, 619-629 (2009).
- Konigsrainer, I., Turck, M. H., Eisner, F., Meile, T., Hoffmann, J., Kuper, M., Zieker, D., Glatzle, J. The Gut is not only the Target but a Source of Inflammatory Mediators Inhibiting Gastrointestinal Motility During Sepsis. Cell Physiol. Biochem. 28, 753-760 (2011).
- Schwarz, N. T., Kalff, J. C., Turler, A., Speidel, N., Grandis, J. R., Billiar, T. R., Bauer, A. J. Selective jejunal manipulation causes postoperative pan-enteric inflammation and dysmotility. Gastroenterology. 26, 159-169 (2004).
- Engel, D. R., Koscielny, A., Wehner, S., Maurer, J., Schiwon, M., Franken, L., Schumak, B., Limmer, A., Sparwasser, T., Hirner, A. T helper type 1 memory cells disseminate postoperative ileus over the entire intestinal tract. Nat. Med. , (2010).
- Stoffels, B., Schmidt, J., Nakao, A., Nazir, A., Chanthaphavong, R. S., Bauer, A. J. Role of interleukin 10 in murine postoperative ileus. Gut. 58, 648-660 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены