Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bağırsak Manipülasyon bir Standart Model Analizleri: Kemirgenler Barsak Motilite ve Gut Duvar İnflamasyon İşlevsel Değerlendirilmesi
Bu Makalede
Özet
Postoperatif ileus (POI) artmış morbidite ve uzamış hastanede kalış yol abdominal cerrahi bir komplikasyonudur. Profilaktik veya terapötik stratejiler yoğunlaştırılmış araştırma yokluğu nedeniyle gereklidir. Bu nedenle İÇN patofizyolojisi araştırmak ve olası tedavi seçenekleri incelemek için bir standart ve uygulanabilir fare modeli kurulmuştur.
Özet
Gastrointestinal sistemin iltihaplanması, insan hastalıklarının bir dizi için yaygın nedenlerinden biridir. Hayvan araştırma modelleri intestinal patoloji hücresel karmaşık ve moleküler soruşturmada kritik önem taşımaktadır. Tunika mukoza muskularis eksterna (ME) ayrıca, yerleşik immunocytes yoğun bir ağ barındırdığı bir çok immün organı olduğunu genellikle birçok inflamatuar hastalıklar, ortaya yeni eserler ilgi organlardan biri olmasına rağmen. 1,2 Bu eserler standardize içinde yapıldı ağırlıklı ME sınırlı, barsak duvarında inflamasyona neden olur bağırsak manipülasyon modeli (IM). Inflamasyon IL-6 4 veya IL-1β veya inhibitör nörotransmitter gibi proinflamatuar mediatörlerin kurtuluşu ile karakterize klinik bu iltihap karın cerrahisi sonrası sık ve kaçınılmaz bir komplikasyondur postoperatif ileus (POI) olarak bilinen uzun süreli bağırsak dismotilite,. 3 yol açar nitri gibic oksit (NO). 5 Akabinde, immunocytes muazzam sayıda polimorfonükleer nötrofiller (PMN) ve monositler tarafından hakim, ME içine extravasate ve nihayet POI korumak. gün süren 2, bu bağırsak felci aspirasyonu riski, bakteriyel translokasyon yol açar ve sepsis ve multi organ yetmezliğine kadar komplikasyonlar enfeksiyon ve yüksek bir ekonomik yük getirmektedir. 6
Bu yazıda IM ve gastrointestinal geçiş (GYTE) ve kolonik transit vivo değerlendirilmesinde standart modelini göstermektedir. Ayrıca biz bu son derece immunoactive barsak duvarında bölümlerinde hem inflamatuvar yanıtları ayırt etmek önemlidir immünolojik analizi takiben tunika mukoza gelen ME ayrılması için bir yöntem gösterilmektedir. Tüm analizler gastrointestinal fonksiyon etkileyen, kolayca herhangi bir diğer araştırma modelleri devredilemez.
Protokol
1. Hayvanlar
25 g arasında bir ortalama ağırlık Erkek C57Bl6 / J fareler Harlan Winkelmann (Borchen, Almanya) dan elde edilmiştir. Tüm deneyler hayvanların korunmasına ilişkin federal yasa uyarınca yapıldı. Laboratuvar hayvan bakım prensiplerini takip edildi. Hayvanlar 12 saat ışık / karanlık döngüsü üzerinde tutulan ve piyasada mevcut kemirgen diyeti ve musluk suyu ad libitum verilmiştir. Hayvanlar en az 7 gün deneyler önce hayvan tesisi geldikten sonra muhafaza edilmelidir. Tüm deneylerde kolayca sıçan ya da diğer türler için uyarlanmış ve büyük hayvan modelleri içine hafif değişiklikler olabilir unutmayın.
2. Operatif Prosedür
- Anestezi oksijen (Abbott, Wiesbaden, Almanya) izofluran ile indüklenen ve korunur. Yapışkan bant ile sırtüstü ve düzeltme ekstremitelerde (Leukosilk, Beiersdorf, Hamburg, Almanya) anesteziye yere hayvanların başlangıçlı sonra.
- Karın duvarının tıraş ve cerrahi dezenfeksiyonu sonra median laparotomi 2 santimetre uzunluğunda yapılır. Linea alba boyunca bir insizyon ile karın boşluğuna girin. Sıra İki steril retraktörler karın açık tutmak için. Dikkatlice sola barsak eventerate ve ıslak pamuk gazlı bez üzerine yerleştirin.
- Eşzamanlı çekum pilor gelen aplikatör yuvarlayarak iki nemli ve steril pamuklu aplikatörler (sakat, Neunkirchen, Almanya) ile tüm ince barsak lümen içeriğini boşaltın. DİKKAT: ince bağırsak duvarı veya bağırsak damarlarının lezyonları kanamalar kaçının. Iskemi veya mekanik tıkanıklığı önlemek ve sürekli bir iki katmanı 5/0 naylon emilmeyen dikişlerle (Ethicon, Norderstedt, Almanya) kullanılarak abdominal insizyon kapatmak için bükmeden periton mağaraya gut geri koy.
3. Postoperatif Bakım
- Prosedürü bir ısıtma lambası, observi altında hayvan yerleştirdikten sonrang o anestezi kendini toparlayana kadar. Kafesine geri fare koyun ve su ve gıdaya erişim sağlar. Peristaltizm etkileyecek opioidlerin özelliği nedeniyle, içme suyu NSAID (örneğin metamizol için) ile perioperatif analjezi gerçekleştirin.
4. Sohbet sonrasında Fonksiyonel Çalışmalar 24 saat
- Gastrointestinal Transit (GYTE)
- Sohbet sonrası oksijen 22.5 saat izofluran ile biraz fareler Anesteziyoloji. Dikkatle fare kafası hyperextend ve künt forseps ile dilini dışarı çekin. Ile 1 ml şırınga doldurun en az 100 ul floresein etiketli dekstran (FITC-dekstran, 70.000 MW, Sigma Aldrich, Taufkirchen, Almanya), arteryel kateter (VYGON, Ecouen, Fransa) bağlayın ve dikkatli olarak kateter yerleştirin mideye gastrik tüp.
- Kısaca 100 ul FITC-dekstran enjekte ve kateter dışarı çekin. Uyanık hayvan edelim ve 90 dakika bekleyin. Bu süre boyunca fareler yiyecek veya suya erişimi yok.
- Onbeş 2 ml iplik tüpleri hazırlayın ve ardışık olarak etiketleyin.
- Fareler gavaj sonra 90 dk Euthanize ve mide anüse kadar tüm gastrointestinal sistem kaldırın. Bir polistiren ped üzerine bağırsak yerleştirin ve germe kaçının. MAĞARASI: Bu yakındaki segmenti içine sıvı FITC-dekstran kayması önlemek için yavaşça bağırsak çıkarmak için çok önemlidir. Başlangıçta için bu başlangıcında ve her bir parçanın görüntüleri sonundaki kullanım için yararlı olabilir.
- Ince barsak ve kolonun tam uzunluğunun tam uzunluğunu ölçün. Kanüller ile polistiren pad aşağı iğneleyerek 10 eşit büyüklükte parça halinde ince bağırsak bölün. 3 parça halinde kolon bölün. Sen 15 segment (mide # 1), on eşit büyüklükte ince barsak segmentleri (# 2-11), çekum (# 12) ve üç 3 eşit büyüklükte kolon segmentleri (# 13-15) hazırladık.
- İşaretli pozisyonlarda bağırsak transeksiyonu, bir forseps ile yakala ve önceden hazırlanmış KHB containi içine 1.0 ml KHB ile bir kez yıkayınng 2.0 ml tüpler ve 20 saniye boyunca kuvvetlice karıştırın. Mide ve çekum doğrudan yerleştirilir ve hazırlanan tüpler kesilir. Böylece tüpler içine makas dan luminal içeriği durulama izler, 1.0 ml KHB ile bu tüpler doldurun.
- Bir masa üstü santrifüjü içinde oda sıcaklığında 5 dakika için 12,000 RCF probları santrifüjleyin. Santrifüjleme sırasında başka bir 15 numaralandırılmalıdır 1.5 ml tüpler hazırlamak.
- 4'te yeni 1.5 ml tüp ve karanlıkta mağaza ° analizi kadar C (sonraki adım) içine net süpernatantlar aktarın. Problar FITC sinyal önemli bir kayıp olmaksızın 4, birkaç gün ° C'de saklanabilir. Uzun depolama <-18% 0.09 Sodyum-azit veya deposu eklemek için ° C
- Siyah bir 96-kuyucuklu levha (Greiner Bio biri, Frickenhausen, Almanya) üzerinde yüzer maddelerinin pipetle 100 ul duplets. Boş olarak KHB pipetleyin iki 100 ul örnekleri.
- Bir floresan okuyucu (Safire, Tecan, Crailsheim, Almanya) plaka okuyun ve fluorescenc ölçmek494 nm (soğurma) / 521 nm (emisyon) dalga boyunda e. Örneklerinden boş değerler çıkarın.
- Aşağıdaki formül tarafından fiilen işaretleyici dağıtımı için ağırlık merkezi olan FITC-dekstran dağıtım geometrik merkezi (GC), hesaplayın: GC = Σ (kademeli başına toplam floresan sinyalinin% * bölüm sayısı) / 100
Not: bu bölüm numarası ile her bir parçanın floresans yüzdesi ile çarpılarak bağırsak içinde işaretleyici dağılımının bir ağırlıklı ortalama değerlendirilir. Bu nokta işareti ile seyahat dağıtım ve mesafe hem de etkilenmiştir, ancak belirli yatan dağılımı varsayar hiçbir edilir. 7 hesaplanan GC değeri genellikle gastrointestinal sistem (Şekil 1A) üzerinde FITC dekstran dağılımını gösteren bir grafik ile birlikte sunulmaktadır.
- Kolon Transit
- Fare isoflur ile zayıf anestezi olmalıdırOksijen ane% 2'dir. DİKKAT: hayvan 40 saniye içinde uyanık olacak ki.
- Dikkatle anüs yoluyla kolon içine bir fistül prob (metal çubuk, 2 mm çapında) takarak kolon açıklığını incelemek.
- Fistül prob kolon içine doğru 2 mm cam topu 3 cm itin ve hemen prob çekin kullanma. Şeffaf bir kafes içinde fare yerleştirin ve fistül prob kolon çıkardı sonra zamanı ölçmeye başlamak. Fare bir göz atın ve cam top atılır olduktan sonra doğrudan zaman durdurabilirsiniz.
5. İzole ME Örneklerinin Histokimyasal Analizi
- Midjejunal segmentleri barsak kesilir ve Sylgard dolu tabak soğuk KHB batırılır.
- Mezenter 0,2 mm böcek iğne (Güzel Bilim Araçları, Heidelberg, Almanya) ile çanak tutturulmuştur.
- Onun mezenterik sınırı boyunca segmentini açmak ve uzunluğu ve genişliği ~% 120 streç kesin. Böcek ile fiksasyon Finalizemezenter ters sitede işaretçilerine. Dolayısıyla tüm lümen içeriğinin kızarma, taze buz KHB dikkatlice Sylgard çanak durulayın.
ME şimdi mekanik mezenter başlayarak tunika mukoza ayrılmış olabilir. Hazırlanması sırasında taze, soğutulmuş KHB birkaç kez değiştirin. - Ayrı tunika mukoza şok daha fazla analiz için sıvı nitrojen içinde dondurulmuş veya iptal edilebilir.
- Oda sıcaklığında 10 dakika için% 100 etanol ile izole ME tüm montaj aparatı.
Soğutulmuş KHB kullanarak tüm montaj üç kez yıkayın. Not: Diğer fiksatif (yani,% 4 formaldehit, asetik asit, aseton) aynı zamanda daha sonraki analiz ile uyumluluğunu test edildikten sonra da kullanılabilir. - ME bütün bağlar daha histokimyasal veya immünohistokimyasal boyama için hazır:
- Histokimya: miyeloperoksidaz (MPO) boyama
Sızma PMN aşağıdaki MPO boyama protokolü tarafından incelenebilir.- 10 mg H çözünanker Yates 10 ml KHB reaktif (Polyscience Avrupa, Eppelheim, Almanya) ve% 3 H 2 O 2 100 ul ekleyin. Kullanın ve tekrar kullanmayın taze hemen önce çözelti hazırlayın.
- Oda sıcaklığında 10 dakika için bütün bağlar inkübe edin.
- 10 dakika süreyle soğuk KHB ve inkübe kapsamlı örnekler durulayın.
- Bir ışık mikroskop altında 2 saat analiz slaytlar için Kuruduktan sonra sulu montaj ortamında örnekleri (Aquatek, Merck, Darmstadt, Almanya) monte edin.
- 5 rastgele seçtikleri alanlarda hücre sayıları sayma ve MPO pozitif hücre / mm 2 olarak hesaplamak.
- İmmünhistokimyasal Boyama:
Buna uygun olarak, histokimyasal MPO boyama için, tüm bağlar immünohistokimyasal boyamalar gerçekleştirilebilir. Prensip olarak, hücre kültürleri veya doku dilim sizin köklü immünohistokimyasal boyama protokolleri tamamına kolaylıkla monte boyama adapte edilebilir. Bununla birlikte, özel anti prosedür optimizeorganları şiddetle tavsiye edilir.- 5 x 5 mm parçalar halinde numunelerin kesin ve ~ 150 ul 2.0 ml'lik tabanı yuvarlak santrifüj tüplerine boyama gerçekleştirmek - 200 ul antikor çözüm.
- Sabitleme ve işlem engelleme (oda sıcaklığında 1 saat için PBS içinde yani% 3 BSA) "Sylgard çanak" de gerçekleştirilebilir.
- PBS ya da başka tampon içinde yıkama adımları 12 oyuklu plakalar içinde gerçekleştirilebilir.
- Boyama tüpleri ve çamaşır plakaları arasında keskin bir forseps ile dikkatlice. Örnekleri aktarın.
- Kapağı makbuzları ile anti-fading montaj orta son yıkama prosedürü montaj örnekleri sonra ve bir floresan mikroskop ile analiz.
6. ME Organ Kültürü
- Bütün ince bağırsak İM sonra çıkarıldı ve 24 saat 200 U / ml penisilin G ve 100 ug / ml streptomisin (KHB + P / S) ihtiva eden soğuk KHB yerleştirilir.
- 3 cm uzunlukta bağırsak kesin ve gla içeren bir Sylgard her segmenti aşağı pinss çanak.
- Ince makas ile mezenter çıkarın ve bir örgü iğne bağırsak kayma.
- Hafifçe keskin bir forseps ile ME kesilirken ve nemli bir pamuk aplikatör kullanarak submukozadan kapalı şerit. Tunika mukoza örgü iğne kalır ve daha fazla araştırma için dondurulmuş çırpıda olabilir. ME soğuk KHB toplanır + P / S
- 2 küçük parçalar halinde ME izole şeritler Kes - 4 mm uzunluğunda ve + P / S yarım saat buz KHB onu inkübasyon ve numune birkaç kez durulayın.
- 500 ul Dulbecco s modifiye Eagle (DMEM) içeren steril 24-plaka yaklaşık 50-60 mg ME (bir ince barsak yarısı ME azından) aktarın.
- 37 inkübe ° C ve% 5, ilave 24 saat boyunca CO2.
- Bir mikroskop altında bakteriyel veya mantar açısından hücre kültürleri inceleyin.
- Süpernatant toplayın, sıvı azot içinde 1.000 rcf ve ek dondurma az 5 dakika boyunca aşağı doğru döndürün. Bu arada musc kurulayın leke30 sn ve ağırlık için temiz bir mendil üzerine le doku.
- Süpernatantlar talimatları izlenerek ELISA üreten ya da üstte yüzen madde içindeki diğer metabolitler (örneğin nitrit) tarafından yayımlanan sitokin sonraki analiz (IL-6) için de kullanılabilir.
- ME doku ağırlığı başına ölçülen konsantrasyon Normalize.
7. Temsilcisi Sonuçlar
- İşlevsel Araştırmalar
İÇN şiddetini değerlendirmek için en önemli parametre in vivo GYTE sınavdır. Şekil 1A arıtılmamış kontrollerde gastrointestinal sistem boyunca FITC dekstran tipik bir dağılım gösterir ve intestinally ameliyattan sonra fareler 24 saat manipüle. IM proksimal jejunum GYTE önemli bir gecikme (Şekil 1B) neden olurken hayvanlarda çekum hesaplanan geometrik merkezi (GC) ile normal GYTE gösterdi "Sham Opere"
Kolon motilitesi ayrı topu atılım süresi o ölçümü ile odaklanmıştırfa 2 mm cam topu. IM 470 arasında uzamış bir atılım süresi yol ise 200 sn - - Sham farelerde 48 bir atılım süresi göstermek işletilen 775 sn (Şekil 1C). - Morfolojik Araştırmalar
Inflamatuar tanımlamak için lökositlerin ME birkaç fenotipleri içinde uzatmak histokimyası veya immünohistokimyasal kullanılarak analiz edilebilir. Şekilde 2A + B PMNs'nin düşük varlığı hayvanlar (39 ± 7 hücre / mm 2) gözlenmiştir "sham operasyonu". Ince bağırsak IM sham operasyonu fareler ile karşılaştırıldığında güçlü bir PMN infiltrasyonu (660 ± 86 hücre / mm 2) yol açtı - ME Organ Culture
Hücre kurtuldu Birçok inflamatuar mediatörler doku özütündeki tespit etmek zordur. Organ kültürleri kültür üstte yüzen madde içindeki serbest mediatörlerin tespitine izin verir. POI bir temsilcisi arabulucu gastrointestinal önemli inhibitör nörotransmitter olarak, hangi YOK. 5
NO ME organı cul tespit edilemediOpere kontrol hayvanlarının Ture süpernatantlar (5 ± 6 uM / 24 sa / mg doku). Sham operasyonu (laparatomi) farelerde bazal 53 NO düzeyleri ± 36 uM / 24 saat / mg doku gözlenmiştir. Intestinally (ameliyattan sonra 24 saat hasat) manipüle farelerin ME kültürleri (Şekil 3) 24 saat ME organ kültürü sırasında (2254 ± 853 mM / 24 saat / mg doku) daha fazla NO anlamlı üretirler.

Şekil 1. GYTE (A + B) ve kolonik transit IM etkisi (C) GYTE 15 gastrointestinal segmentleri-mide (Sto), ince bağırsak (SI 1-9 emilmeyen floresein etiketli dekstran yüzde olarak ölçüldü ), çekum (CEC) ve kolon (Co) oral alımından sonra -90 dk. Kolon geçiş, bir 2 mm cam boncuk boşaltım kadar fistül sonda dışarı doğru çekilmesini saat olarak ölçüldü. Floresin izotiyosiyanat-Dex (A) Gastrointestinal dağıtımSham veya IM sonra tran. Sham ameliyesi uygulanmış hayvanlarda işaretleyici en çok manipüle edilmiş hayvanlarda proksimal jejunumda konumu ile karşılaştırıldığında, körbağırsak ve proksimal kolon içinde yer almaktadır. Noktalı çizgiler GC hesaplanır göstermektedir. (B) GC hesaplanması IM sonra uzun bir gastrointestinal transit zamanı göstermiştir. (C) Kolon transit süresi Sham ameliyesi uygulanmış hayvanlar ile karşılaştırıldığında, İM farelerde önemli bir gecikme gösterdi. 15 intestinal segmentler için GC (n = 5) ortalama olarak görüntülenir. Kolon transit kez tüm bireysel değerleri (n = 6) ile ifade sergilendi. *** = P <0.001, Student t-testi.
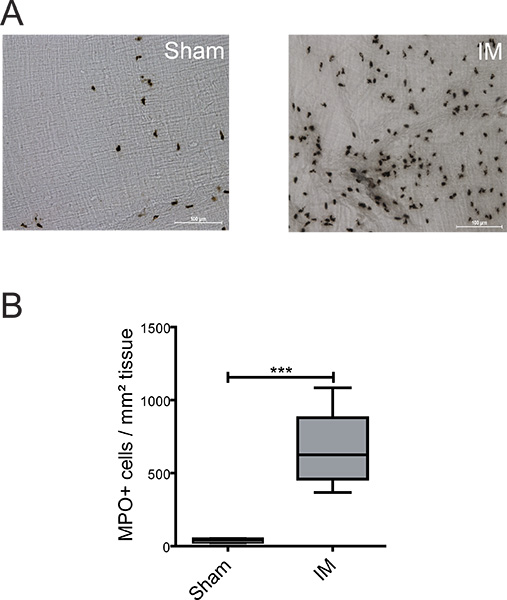
Şekil 2. Incebarsak ME içinde MPO pozitif hücrelerin saptanması. (A) ME bütün bağlar MPO pozitif laparotomi sonrası PMN 24 saat (plasebo) veya IM prosedürün tespiti için arzulamak Yates reaktifi ile boyandı. Fare başına 5 rastgele seçilmiş alanlarında MPO pozitif hücre (B) Sayısallaştırma. n = 6grup başına nimals. *** = P <0.001, Student t-testi.
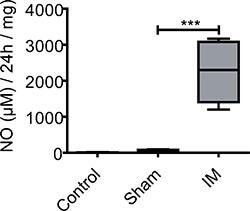
Şekil 3. ME kültür yüzer NO üretimi. Opere kontrollerden kas örnekleri, sham operasyonu ve IM fareler postoperatif 24 saat alınır ve 24 saat boyunca kültüre edildi. Tedavi edilmeyen fareler NO sadece çok düşük bir bazal üretimi göstermiştir. Laparatomi sonrası NO kurtuluş kontrol grubu ve sham operasyonu fareler arasında önemli farklılıklar ölçüm olmadan artar. IM NO üretimi sonrası 24 saat önemli ölçüde arıtılmamış veya sham operasyonu fareler ile karşılaştırıldığında artmaktadır. Grup başına n = 5 hayvan. *** = P <0.001, 1 yönlü ANOVA.
Tartışmalar
IM (10 dk karşı yavaşça çekum içine ince bağırsak içeriğinin boşaltılması ile IM karşı iki pamuk aplikatör kullanarak ince barsak muayene için ince barsak evantrasyonu) farklı düzeylerde analiz karşılaştırmalı bir çalışmada cerrahi manipülasyon ve İÇN ölçüde arasında bir korelasyon saptandı. IM uzun süreli ve şiddetli POI sonuçlanan ME (PNMs, makrofajlar ve mast hücreleri) lökositlerin yüksek miktarda gösterdi. 8 diğer gruplar ile karşılaştırıldığında.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu çalışma Deutsche Forschungsgemeinschaft (KA1270/3-1/2) ve BONFOR (O-112,0040) hibe tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif / Ekipman Adı | Şirket | Katalog numarası | |
| Ethilon 5/0 | Ethicon | 1666H | |
| Pamuk aplikatörler | Sakat | 71010 | |
| arteryel kateter | VYGON | 115-798 | |
| 96 oyuklu plaka (siyah) | Greiner Bio One | 655096 | |
| cam topu (2 mm çapında) | Worf | istek üzerine | |
| Böcek işaretçilerine | Güzel Bilim Araçları | 26000-25 | |
| Arzulamak Yates Reaktif | Polyscience | 560694 | |
| Aquatek | Merck | HC109850 | |
| DMEM | Lonza | BE12-604 F | |
| FITC-dekstran (MW 70.000) | Sigma Aldrich | 46945-500MG-F |
Referanslar
- Wehner, S., Behrendt, F. F., Lyutenski, B. N., Lysson, M., Bauer, A. J., Hirner, A., Kalff, J. C. Inhibition of macrophage function prevents intestinal inflammation and postoperative ileus in rodents. Gut. 56, 176-185 (2007).
- Kalff, J. C., Schwarz, N. T., Walgenbach, K. J., Schraut, W. H., Bauer, A. J. Leukocytes of the intestinal muscularis: their phenotype and isolation. J. Leukoc. Biol. 63, 683-691 (1998).
- Kehlet, H. Postoperative ileus. Gut. 47, iv85-iv86 (2000).
- Wehner, S., Schwarz, N. T., Hundsdoerfer, R., Hierholzer, C., Tweardy, D. J., Billiar, T. R., Bauer, A. J., Kalff, J. C. Induction of IL-6 within the rodent intestinal muscularis after intestinal surgical stress. Surgery. 137, 436-446 (2005).
- Kalff, J. C., Schraut, W. H., Billiar, T. R., Simmons, R. L., Bauer, A. J. Role of inducible nitric oxide synthase in postoperative intestinal smooth muscle dysfunction in rodents. Gastroenterology. 118, 316-327 (2000).
- Iyer, S., Saunders, W. B., Stemkowski, S. Economic burden of postoperative ileus associated with colectomy in the United States. J. Manag. Care Pharm. 15, 485-494 (2009).
- Miller, M. S., Galligan, J. J., Burks, T. F. Accurate measurement of intestinal transit in the rat. J. Pharmacol. Methods. 6, 211-217 (1981).
- Kalff, J. C., Schraut, W. H., Simmons, R. L., Bauer, A. J. Surgical manipulation of the gut elicits an intestinal muscularis inflammatory response resulting in postsurgical ileus. Ann. Surg. 228, 652-663 (1998).
- Wehner, S., Straesser, S., Vilz, T. O., Pantelis, D., Sielecki, T., de lC, V., Hirner, A., Kalff, J. C. Inhibition of p38 mitogen-activated protein kinase pathway as prophylaxis of postoperative ileus in mice. Gastroenterology. 136, 619-629 (2009).
- Konigsrainer, I., Turck, M. H., Eisner, F., Meile, T., Hoffmann, J., Kuper, M., Zieker, D., Glatzle, J. The Gut is not only the Target but a Source of Inflammatory Mediators Inhibiting Gastrointestinal Motility During Sepsis. Cell Physiol. Biochem. 28, 753-760 (2011).
- Schwarz, N. T., Kalff, J. C., Turler, A., Speidel, N., Grandis, J. R., Billiar, T. R., Bauer, A. J. Selective jejunal manipulation causes postoperative pan-enteric inflammation and dysmotility. Gastroenterology. 26, 159-169 (2004).
- Engel, D. R., Koscielny, A., Wehner, S., Maurer, J., Schiwon, M., Franken, L., Schumak, B., Limmer, A., Sparwasser, T., Hirner, A. T helper type 1 memory cells disseminate postoperative ileus over the entire intestinal tract. Nat. Med. , (2010).
- Stoffels, B., Schmidt, J., Nakao, A., Nazir, A., Chanthaphavong, R. S., Bauer, A. J. Role of interleukin 10 in murine postoperative ileus. Gut. 58, 648-660 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır