Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
De alto rendimiento de una sola célula y múltiple las células de micro-encapsulación
En este artículo
Resumen
La combinación de generación monodispersas gota con ordenamiento inercial de células y partículas, se describe un método para encapsular un número deseado de células o partículas en una sola gota a tasas kHz. Se demuestra la eficiencia de dos veces superiores a las de la encapsulación no ordenada de las gotas de una y dos partículas.
Resumen
Microfluidic encapsulation methods have been previously utilized to capture cells in picoliter-scale aqueous, monodisperse drops, providing confinement from a bulk fluid environment with applications in high throughput screening, cytometry, and mass spectrometry. We describe a method to not only encapsulate single cells, but to repeatedly capture a set number of cells (here we demonstrate one- and two-cell encapsulation) to study both isolation and the interactions between cells in groups of controlled sizes. By combining drop generation techniques with cell and particle ordering, we demonstrate controlled encapsulation of cell-sized particles for efficient, continuous encapsulation. Using an aqueous particle suspension and immiscible fluorocarbon oil, we generate aqueous drops in oil with a flow focusing nozzle. The aqueous flow rate is sufficiently high to create ordering of particles which reach the nozzle at integer multiple frequencies of the drop generation frequency, encapsulating a controlled number of cells in each drop. For representative results, 9.9 μm polystyrene particles are used as cell surrogates. This study shows a single-particle encapsulation efficiency Pk=1 of 83.7% and a double-particle encapsulation efficiency Pk=2 of 79.5% as compared to their respective Poisson efficiencies of 39.3% and 33.3%, respectively. The effect of consistent cell and particle concentration is demonstrated to be of major importance for efficient encapsulation, and dripping to jetting transitions are also addressed.
Introduction
Continuous media aqueous cell suspensions share a common fluid environment which allows cells to interact in parallel and also homogenizes the effects of specific cells in measurements from the media. High-throughput encapsulation of cells into picoliter-scale drops confines the samples to protect drops from cross-contamination, enable a measure of cellular diversity within samples, prevent dilution of reagents and expressed biomarkers, and amplify signals from bioreactor products. Drops also provide the ability to re-merge drops into larger aqueous samples or with other drops for intercellular signaling studies.1,2 The reduction in dilution implies stronger detection signals for higher accuracy measurements as well as the ability to reduce potentially costly sample and reagent volumes.3 Encapsulation of cells in drops has been utilized to improve detection of protein expression,4 antibodies,5,6 enzymes,7 and metabolic activity8 for high throughput screening, and could be used to improve high throughput cytometry.9 Additional studies present applications in bio-electrospraying of cell containing drops for mass spectrometry10 and targeted surface cell coatings.11 Some applications, however, have been limited by the lack of ability to control the number of cells encapsulated in drops. Here we present a method of ordered encapsulation12 which increases the demonstrated encapsulation efficiencies for one and two cells and may be extrapolated for encapsulation of a larger number of cells.
To achieve monodisperse drop generation, microfluidic "flow focusing" enables the creation of controllable-size drops of one fluid (an aqueous cell mixture) within another (a continuous oil phase) by using a nozzle at which the streams converge.13 For a given nozzle geometry, the drop generation frequency f and drop size can be altered by adjusting oil and aqueous flow rates Qoil and Qaq. As the flow rates increase, the flows may transition from drop generation to unstable jetting of aqueous fluid from the nozzle.14
When the aqueous solution contains suspended particles, particles become encapsulated and isolated from one another at the nozzle. For drop generation using a randomly distributed aqueous cell suspension, the average fraction of drops Dk containing k cells is dictated by Poisson statistics, where Dk = λk exp(-λ)/(k!) and λ is the average number of cells per drop. The fraction of cells which end up in the "correctly" encapsulated drops is calculated using Pk = (k x Dk)/Σ(k' x Dk'). The subtle difference between the two metrics is that Dk relates to the utilization of aqueous fluid and the amount of drop sorting that must be completed following encapsulation, and Pk relates to the utilization of the cell sample. As an example, one could use a dilute cell suspension (low λ) to encapsulate drops where most drops containing cells would contain just one cell. While the efficiency metric Pk would be high, the majority of drops would be empty (low Dk), thus requiring a sorting mechanism to remove empty drops, also reducing throughput.15
Combining drop generation with inertial ordering provides the ability to encapsulate drops with more predictable numbers of cells per drop and higher throughputs than random encapsulation. Inertial focusing was first discovered by Segre and Silberberg16 and refers to the tendency of finite-sized particles to migrate to lateral equilibrium positions in channel flow. Inertial ordering refers to the tendency of the particles and cells to passively organize into equally spaced, staggered, constant velocity trains. Both focusing and ordering require sufficiently high flow rates (high Reynolds number) and particle sizes (high Particle Reynolds number).17,18 Here, the Reynolds number Re =uDh/ν and particle Reynolds number Rep =Re(a/Dh)2, where u is a characteristic flow velocity, Dh [=2wh/(w+h)] is the hydraulic diameter, ν is the kinematic viscosity, a is the particle diameter, w is the channel width, and h is the channel height. Empirically, the length required to achieve fully ordered trains decreases as Re and Rep increase. Note that the high Re and Rep requirements (for this study on the order of 5 and 0.5, respectively) may conflict with the need to keep aqueous flow rates low to avoid jetting at the drop generation nozzle. Additionally, high flow rates lead to higher shear stresses on cells, which are not addressed in this protocol. The previous ordered encapsulation study demonstrated that over 90% of singly encapsulated HL60 cells under similar flow conditions to those in this study maintained cell membrane integrity.12 However, the effect of the magnitude and time scales of shear stresses will need to be carefully considered when extrapolating to different cell types and flow parameters. The overlapping of the cell ordering, drop generation, and cell viability aqueous flow rate constraints provides an ideal operational regime for controlled encapsulation of single and multiple cells.
Because very few studies address inter-particle train spacing,19,20 determining the spacing is most easily done empirically and will depend on channel geometry, flow rate, particle size, and particle concentration. Nonetheless, the equal lateral spacing between trains implies that cells arrive at predictable, consistent time intervals. When drop generation occurs at the same rate at which ordered cells arrive at the nozzle, the cells become encapsulated within the drop in a controlled manner. This technique has been utilized to encapsulate single cells with throughputs on the order of 15 kHz,12 a significant improvement over previous studies reporting encapsulation rates on the order of 60-160 Hz.4,15 In the controlled encapsulation work, over 80% of drops contained one and only one cell, a significant efficiency improvement over Poisson (random) statistics, which predicts less than 40% efficiency on average.12
In previous controlled encapsulation work,12 the average number of particles per drop λ was tuned to provide single-cell encapsulation. We hypothesize that through tuning of flow rates, we can efficiently encapsulate any number of cells per drop when λ is equal or close to the number of desired cells per drop. While single-cell encapsulation is valuable in determining individual cell responses from stimuli, multiple-cell encapsulation provides information relating to the interaction of controlled numbers and types of cells. Here we present a protocol, representative results using polystyrene microspheres, and discussion for controlled encapsulation of multiple cells using a passive inertial ordering channel and drop generation nozzle.
Protocolo
Los protocolos de esta sección describen los materiales y equipos utilizados específicamente para obtener los resultados experimentales presentados. Tenga en cuenta que los proveedores alternativos para los productos químicos y equipos pueden ser utilizados.
1. Fabricación de los dispositivos y la litografía blanda
Las técnicas estándar de la litografía blanda, 21 algunos de los cuales se han presentado en los artículos anteriores JOVE, 22 se utilizaron para la creación de polidimetilsiloxano (PDMS) las redes de microcanales adheridos a sustratos de vidrio. Aparte de fabricación del molde maestro réplica por SU-8 fotolitografía, los procesos pueden llevarse a cabo fuera de una sala limpia o campana limpia, sin embargo, el polvo y las partículas aún debe ser minimizada para lograr resultados consistentes.
- Diseño de un patrón de micro-canal como se muestra en la Figura 1 en AutoCAD (Autodesk Inc.). Emplear a un fabricante de terceros (Fineline Imaging Inc.) para imprimir una alta resolución (50.000 ppp) transtransparencia en la máscara de la película de Mylar o de cuarzo, donde los canales son transparentes sobre un fondo oscuro.
- Crear un silicio y SU-8 amo fotosensible para el moldeo de réplica. Brevemente, girar SU-8 2050 (MicroChem) fotorresistencia negativa con rpm recomendado por el fabricante en un spin-revestidor para crear una capa de 52 micras de espesor sobre una superficie limpia de 7,5 cm o 10 cm de obleas de silicio. Después de hornear suave, con el borde la eliminación de cuentas, los rayos UV a través de una máscara de contacto, al horno después de la exposición, desarrollo y exposición a inundaciones, medir el espesor real de la capa de SU-8 mediante un perfilómetro Dektak (Veeco). Cinta del molde maestro en el fondo de un 4 "o 5" placa de Petri para preparar PDMS moldeo réplica.
- Mezcla PDMS base de elastómero con el agente de curado elastómero (Dow Corning) en una relación 10:1 w / w de base para el agente de curado. Verter bien mezclada precursor de PDMS en el patrón de silicio para crear una capa de 2-3 mm de espesor final. Una mezcla de 20 g de base de elastómero con 2 g de agente de curado es suficiente para cubrir un 4 "superficie diámetro.
- Coloque el master molde y PDMS en el desecador de vacío (Jencons) para des-gas no curado PDMS. El uso de un regulador de presión (Cole Parmer), lentamente disminuir la presión manométrica de 0 cámara "de Hg a -27" Hg durante 20 minutos para evitar la excesiva formación de espuma. Deje el dispositivo en la cámara de vacío a -27 "Hg durante 30 minutos o hasta que las burbujas de aire desaparezcan.
- De liberación de vacío y mover el molde maestro y PDMS a un horno de 65 ° C (Thermo Scientific) durante un mínimo de cuatro horas. El dispositivo se puede dejar en el horno durante la noche para mejorar el curado.
- Retire el dispositivo del horno y dejar enfriar. Corte cuidadosamente alrededor de la oblea PDMS circular usando un cuchillo de precisión y la cáscara de PDMS. Cortar contorno dispositivo como se muestra en la Figura 1 con un escalpelo.
- Ponche de fluidos puertos (tres por equipo) en las tres regiones circunvecinas se muestra en la Figura 1 con una biopsia por punción. Para este dispositivo, use un 0,75 mm de diámetro exterior de golpe (Harris).
- Adherirse cinta adhesiva al lado del patrón y la cáscara de PDMS para eliminar cualquierpolvo. Como una alternativa de ahorro de costes, pero viable a los convencionales aparatos de plasma de oxígeno, 21,22 de plasma tratar el lado estampado de la PDMS y una limpieza de 3 "x 1" portaobjetos de vidrio con un manual de laboratorio Tratamiento de corona (Electro-Técnica Products Inc .) 23. Tenga en cuenta que este dispositivo se debe utilizar en una campana de humos o área bien ventilada, debido a la descarga de ozono, y todos los relojes y teléfonos celulares se deben mantener por lo menos diez pies de distancia. Ajustar la descarga en corona para alcanzar una corona estable con un mínimo de chispas. Poco a poco agitar el electrodo aproximadamente 1/4 "por encima de la superficie de cada unos 20 segundos y luego poner inmediatamente las superficies tratadas en contacto para formar una fuerte unión permanente antes de que las superficies de PDMS volver a su estado natal.
- Coloque el aparato sobre una placa de metal, colocar en un horno frío, ponga el horno a 120 ° C y hornear durante toda la noche para completar la unión y para devolver el PDMS a su estado hidrofóbico original. 24 Durante este horno de alta temperatura, tque la superficie de vidrio del canal también se representará hidrófobo debido a la deposición de una capa hidrófoba delgada sobre el vidrio. Alternativamente, los recubrimientos hidrófobos tales como Aquapel (PPG Industries) puede ser inyectado en los puertos de fluidos utilizando una jeringa de 1 ml y una aguja de la jeringa. 12 cuidadosamente pero con firmeza inyectar el Aquapel seguido de purga de aire en los puertos de fluidos sin romper el vidrio a PDMS enlace . Agresivamente repetir la purga de aire en todos los puertos de entrada y salida, mientras limpiando cualquier exceso Aquapel con el fin de evitar los depósitos que pueden obstruir los canales durante el secado.
2. Preparación de la muestra
- Preparar un cultivo de células de acuerdo a los procedimientos establecidos para el tipo celular elegido. Para el dispositivo particular usado en este estudio, 8-15 micras partículas o células adecuadamente debe ordenar para la encapsulación. Más pequeñas o más grandes tipos de células pueden requerir cambiar las dimensiones del canal de enfoque para lograr p Re adecuada. Para el meresultados thod demostración se muestra en este trabajo, el 9,9 micras microesferas de poliestireno (G1000, Thermo Scientific) se utilizan como sustitutos de células.
- Preparar la partícula acuosa o suspensión de células a través de la mezcla suave. Cuando se usan células o partículas de poliestireno, el control de la concentración es esencial (véase Figura 4) para alcanzar la encapsulación ideales ordenado. Utilizando los datos anteriores 12 como una guía, calcular la celda deseada o la concentración de partículas basado en el espaciamiento tren ordenado y micro-canal tamaño como: una célula o partícula por esperados veces longitudinales del tren de espaciamiento del canal centrado en sección transversal de la zona. Si la concentración de valores (1% w / w) es insuficiente, aumentar la concentración (en este caso a 1,5% w / w) por centrifugación suavemente la muestra de stock, la eliminación de líquido sobrenadante, y re-suspensión de las partículas por un mezclador vortex, o más suave mezclado utilizando células. Preparar un volumen adecuado para tener en cuenta el volumen deseado y recogida por el tiempo de ejecución asociado con flujo de sintonía.
- Tanto las células y partículas de poliestireno tienen un peso específico mayor que uno. Aunque no se ha demostrado en este protocolo, para experimentos a largo plazo con una duración del orden de varios minutos a horas, la flotabilidad que coincida con la solución mediante la adición de un soluto, como CaCl 2 para partículas o OptiPrep (Sigma-Aldrich) para las células.
- Preparar una muestra de 10 ml de la fase continua de aceite de hidrocarburo fluorado mezclando el aceite fluorocarbonado FC-40 (3M) y PFPE-PEG bloque copolímero tensioactivo 25 (2,5% w / w) (RainDance Technologies) en un tubo de centrífuga de 15 ml. Alternativamente, el aceite mineral ligero (Productos químicos de proceso PTI) puede ser utilizado con ABIL-EM 90 tensioactivo (2,5% w / w) (Evonik Goldschmidt Corporation).
3. Montaje experimental
- Encienda el microscopio invertido óptica (Axio Observer, Zeiss) y cámara de alta velocidad (Phantom V310, Visión de Investigación). Enfoque e inspeccionar las canales de los zuecos y los desechos, ya sea moviendo manualmente el dispositivo omediante el uso de una platina del microscopio motorizado. Algunos residuos de pequeño tamaño pueden ser empujados a cabo cuando el líquido fluye a través de. Para residuos de gran tamaño u obstrucciones evidentes, seleccione otro canal en el dispositivo como los desechos en el canal centrado puede degradar significativamente la calidad de pedido. Tenga en cuenta que obstruye a menudo puede ser removido en virtud de flujo, presionando firmemente sobre la superficie de PDMS sobre la región afectada con unas pinzas romas.
- Corte tres trozos de tubo de PVC (0,01 "ID/0.03" de diámetro exterior, Tygon) para la entrada de la acuosa, de entrada y salida de aceite, emulsión. Para reducir al mínimo el volumen muerto, cortado lo suficiente como para llegar a la tubería de las bombas de jeringa de la platina del microscopio. Corte los extremos de tubería en un ángulo de 45 ° para facilitar la inserción en los puertos de fluidos.
- Utilice pinzas para presionar encajar el tubo termina en los puertos de fluidos perforados en el paso 1 y luego presione encajar dos de calibre 30 de acero inoxidable con puntas romas agujas de jeringas de acero (SmallParts) en los extremos libres de la fase acuosa respectivo y tubos de entrada de aceite (sin adhesivo es necesario) . Coloque el tubo de salida en una r de residuoseservoir. Este tubo más tarde se trasladó a un depósito de recogida.
- Mueva el dispositivo y el tubo conectado a la platina del microscopio, alinear, y se centran en la boquilla del dispositivo, utilizando un objetivo disponible (20x fue utilizado para este experimento). Ajustar para obtener el K hler iluminación y otros ajustes del microscopio como se requiere para una grabación óptima.
- Llenar una jeringa de 1 ml (BD) con la fase acuosa bien mezclada y una jeringa de 3 ml (BD) con la solución de la fase aceite preparado en el Paso 2. Tenga en cuenta que las jeringas de un determinado volumen puede ser utilizada y debe ser cuidadosamente seleccionados en función de los tiempos de ejecución deseados y la minimización de cualquier pulsatilidad. Incline una jeringa vertical y con un tirón para mover las burbujas de aire a la salida de la jeringa. Lentamente presione el émbolo lo suficiente como para empujar el aire hacia la punta de la jeringa. Sosteniendo la jeringa vertical, conectar las jeringas a la aguja de la jeringa respectiva ya conectada al dispositivo en el Paso 3,3. Presione el émbolo para forzar el aire a través de la aguja de la jeringa el volumen muerto hasta que el líquido es pushed a través del tubo casi al dispositivo. Monte firmemente la jeringa en una bomba de jeringa (Nexus 3000, Chemyx) y activar el bloqueo del émbolo. Repita las conexiones para la segunda jeringa y montar a una bomba de segunda jeringa.
- Potencia en cada bomba de jeringa y el programa utilizando los protocolos del fabricante de la bomba. Establecer los caudales iniciales a Q aceite = 50 l / min y aq Q = 5 l / min para la fase oleosa y fase acuosa, respectivamente. Inicio de las bombas.
- Espere a que cada fluido para entrar en el dispositivo y llenar los canales, empujando hacia fuera el aire que queda muerta. Esto puede tardar varios minutos. Si hay una gran cantidad de aire en la tubería de entrada, aumentar temporalmente cada velocidad de flujo hasta que el aire es expulsado. No aumentar las tasas de flujo tan altas que se producen grandes presiones en el canal, que podría dar lugar a fallo de la unión de PDMS-a-vidrio.
- Uso de los caudales iniciales, se observa la formación de gotas en la boquilla (los resultados se muestra aquí: 20x magnification, 21005 fps velocidad de fotogramas, la exposición a 3 ms). Reducir el campo de vista de la cámara sólo la boquilla para maximizar la velocidad de cuadro y reducir los requisitos de memoria, si es posible. Captura de vídeos de muestra y confirmar que la tasa de muestreo es el adecuado para evitar el aliasing.
- Para evitar la inyección (ver Figura 2), comience con las bajas tasas de flujo acuoso. Lentamente aumentar la velocidad de flujo acuoso para observar ordenamiento de partículas en el canal de solución acuosa largo medida que aumenta la velocidad de flujo.
- Si la concentración de partículas es demasiado baja para proporcionar trenes con relativamente pocas "falta" partículas y la muestra no fue acompañado de flotabilidad, físicamente inclinar la bomba de jeringa hacia la salida de la jeringa para proporcionar gradual sedimentación de partículas hacia la salida de la jeringa. Este método se muestra en el protocolo de vídeo. Periódicamente girar la jeringa a lo largo de su eje también puede reducir sedimentación no deseado.
- Una vez que se produce ordenamiento adecuado, regular el caudal de aceite para sintonizar la frecuencia de generación ytamaño de las gotas. El volumen de la gota media puede calcularse utilizando la tasa de flujo acuoso dividida por la frecuencia de generación gota, medida por la captura de vídeo. Iterativamente ajustar tanto las tasas de flujo para lograr las tasas deseadas de encapsulación y el volumen de la gota.
- Encapsulación ordenado Una vez estable se confirma, mover el tubo de salida desde el depósito de residuos en un depósito de recogida o alimentar en otro dispositivo para pruebas posteriores.
- Determinar el tiempo de recogida basada en el número deseado de gotas y la frecuencia de generación calculado.
- Anotar la fracción de gotas que contienen 0, 1, 2, ..., N partículas para cuantificar la eficiencia utilizando ya sea gota video resultados generación o pipeteando una muestra de emulsión recogieron para su inspección.
4. Los resultados representativos
Los resultados se presentan que lograr tanto una partícula controlado y controlado doble partícula encapsulación (Figura 3). Al reducirla velocidad de flujo del FC-40 aceite en un medio, de una sola partícula de encapsulación se convierte en dos partículas de encapsulación. Por el contrario, se podría haber aumentado la velocidad de flujo acuoso para suministrar partículas a la boquilla de forma más rápida, pero también nos han aumentado el riesgo de inyección de la corriente acuosa. Los histogramas en la Figura 3 se presenta el número fraccionario de partículas por caída de los dos casos, junto con las comparaciones con las estadísticas de Poisson. Las gotas ocasionales con partículas de cero se deben principalmente a "desaparecido" las partículas en los trenes solicitados, mientras que los casos en que hay más partículas encapsuladas que resultado deseado de locales altas concentraciones de partículas y las partículas que a veces emigran hacia una de las dos posiciones verticales de enfoque. Tenga en cuenta que la flotabilidad juego tal como se describe en la Sección 2 no se utilizó. En su lugar, la bomba de jeringa se inclina físicamente para permitir la sedimentación de partículas hacia la salida de la jeringa, que conduce a una alta concentración de partículas durante la carrera.
Una carrera experimental que ilustra la necesidad de partícula adecuado y las concentraciones de células se muestra en la Figura 4. Sin orden completa, grupos locales de orden y se encapsulan las partículas, pero muchas gotas son sin partículas. Un histograma muestra la disminución de la eficiencia de encapsulación para la encapsulación de partículas deseado dos.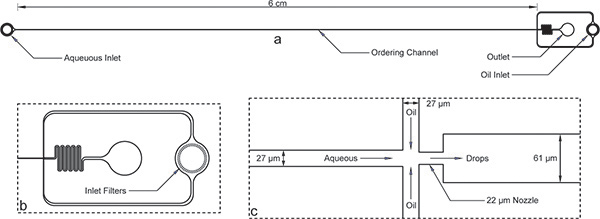
Figura 1. Dispositivo de encapsulación. a) En general el dispositivo con las entradas, salida y el canal de largo el pedido. La altura del dispositivo es de 52 micras y el ancho del canal de pedido es de 27 micras. b) Tanto acuosa y entradas de petróleo tienen filtros grandes escombros con huecos en el orden de la anchura del canal de pedido para la vista ampliada de la entrada de aceite. c) La vista ampliada de la boquilla muestra la misma anchura de canal de 27 m para los canales acuosos y aceite, seguido por la contracción de la boquilla de 22 micras y la expansión súbita a un canal más ancho 61 micras.Tenga en cuenta que las dimensiones del dispositivo que se muestran aquí han sido verificadas mediante un perfilómetro después de la microfabricación y difieren ligeramente de las dimensiones nominales de la máscara. Una verdadera imagen del canal de pedidos y la boquilla están disponibles en línea, como la figura de consulta 1 . El archivo de máscara de AutoCAD también ha sido incluido en línea como un suplemento a este manuscrito.

Figura 2. Histéresis de un goteo de transición chorro usando un dispositivo más amplio (80 micras de ancho x 22 m de altura). a) A velocidad constante FC-40 de flujo (Q aceite = 45 l / min), la formación de descenso constante se produce a 10 kHz utilizando una solución acuosa de caudal Q aq = 8 l / min. A medida que la tasa de flujo acuoso se incrementa lentamente a 10 y mu, l / min, chorro de la corriente de fluido acuoso se dispara. b) Cuando el caudal es devuelto a 8 l / min chorro sigue. Tenga en cuenta que la formación de gotas constante puede ser re-establecido por la breve pausa de la bomba de flujo acuoso (una pausa de 1 segundo es típico).
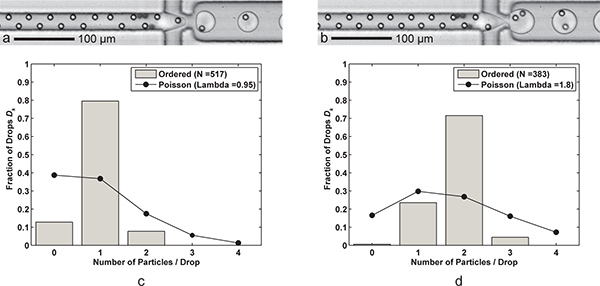
Figura 3. Encapsulación individual o doble-partícula. Una formación de gotas) con una célula por gota (Q aceite = 60 l / min, Q aq = 9 l / min) con una tasa de generación de gota de 6,1 kHz, el tamaño promedio de gota 24.4 PL, y una eficiencia de captura de una sola célula D k = 79,5% y K p = 83,7% (λ = 0,95) para un tamaño de muestra de n = 517 gotas d y n p = 491 partículas. b) la formación de gotas con dos celdas por gota se consigue simplemente mediante la reducción de la FC-40 caudal Q de aceite a 30 μL / min. Los más grandes (39,8 pL) gotas se forman a un ritmo de 3,8 kHz con una eficiencia de captura de dos células D k = 71,5% y P = k el 79,5% (λ = 1,80) para un tamaño de muestra de n d = 383 gotas y n p = 689 partículas. cd) Dos histogramas de comparar la eficiencia de encapsulación de partículas gota D k de la encapsulación ordenó una y dos partículas con las estadísticas de Poisson (encapsulado al azar). Nótese que en ambos casos, el espaciamiento de las partículas en la dirección del flujo es de aproximadamente 17-18 micras para totalmente ordenadas, partículas que se alternan. Vídeos complementarios que muestran tanto la encapsulación de uno y dos partículas están disponibles en línea. Haga clic aquí para ver la 3a suplementarios Película . Haga clic aquí para ver la película 3b suplementarios .

Concentración Figura 4. Afecta grandemente la eficiencia de encapsulación. A) A medida que disminuye la concentración, el ordenamiento completo no se produce, y así "agujeros" en los trenes de emerger, dejando unas gotas con menos de partículas previstos. B) El histograma muestra la disminución de la eficiencia ( D k = 55,9%, p k = 70,9%) para la encapsulación de dos partículas debido a un menor valor de λ = 1,57 donde hay casi la misma cantidad de una sola partícula cae a medida que hay doble de partículas gotas. Esta cifra es el resultado de aceite Q = 30 l / min y aq Q = 9 l / min, las condiciones de flujo mismas para la Figura 3b. Un video suplementario representante está disponible en línea. Haga clic aquí para ver la película de consulta 4 .
Discusión
A pesar de grados relativamente altos de pedidos, no todas las gotas contendrá el número apropiado de partículas o células. Eficiencia de encapsulación puede ser calculada como el número de células o partículas que quedan encapsulados en gotas con la ocupación deseado dividido por su número total. Estos datos en bruto se puede obtener ya sea desde un sistema automatizado de algoritmo de video de alta velocidad o de imágenes de una muestra de emulsión de recogida. Esto puede ser comparado con la fracción de ...
Divulgaciones
JE es un inventor de una patente en trámite sobre la base de la tecnología utilizada en este manuscrito.
Agradecimientos
Damos las gracias a RainDance Technologies para la muestra de PFPE-PEG surfactante utilizado en este estudio, y agradecemos al Centro de Recursos de BioMEMS (Mehmet Toner, director) para el molde de obleas de silicio para crear réplicas de los canales de PDMS.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| AutoCAD | AutoDesk | ||
| Transparencia Máscara | Fineline Imaging Inc. | ||
| SU-8 Fotoresinas | MicroChem | 2050 | |
| Dektak Perfilómetro | Veeco | ||
| Petri | BD Falcon | 351058 | |
| Kit de elastómero de silicona PDMS | Dow Corning Corp. | Sylgard 184, Número de material (240) 4019862 | |
| Desecador de vacío | Jencons | 250-030 | |
| Bomba de vacío | Alcatel Vacuum Technology | 2010 C2 | |
| Regulador de vacío | Cole-Parmer | EW-00910-10 | |
| Horno | Thermo Scientific | Lindberg Blue M, OV800F | |
| Biopsia en sacabocados, 0,75 mm | Harris | Uni-Core 15072 | |
| Laboratorio de Tratamiento de corona | Electrotécnica Products Inc. | BD-20AC, SKU 12051A | |
| Las láminas de vidrio | Sello de Oro | 3010 | |
| Aquapel | PPG Industries | Estrategia Alternativa | |
| Microesferas de poliestireno, 9,9 m | Thermo | G1000 | |
| OptiPrep | Sigma-Aldrich | D1556 | No se ha demostrado |
| Jeringas Luer-Lok | BD | 1 ml: 309628 3 ml: 309585 | |
| FC-40 fluorocarbono aceite | 3M Inc. | Sigma Aldrich, F9755 | |
| PFPE-PEG fluorotensioactivo | RainDance Tecnologías | ||
| Aceite mineral ligero | PTI Productos químicos de proceso | 08042-47-5 | Estrategia Alternativa |
| Mineral de surfactante de aceite | Evonik Goldschmidt Corporación | Abil EM 90 | Estrategia Alternativa |
| Tygon tubo de PVC | SmallParts | TGY-010 | |
| Calibre 30 Luer-Lok de agujas y jeringas, 1/2 " | SmallParts | NE-301PL-C | |
| Microscopio invertido | Carl Zeiss de imágenes | Axio Observer.Z1 | |
| Cámara de alta velocidad | Investigación de la Visión | Phantom V310 | |
| Las bombas de jeringa (2) | Chemyx Inc. | Nexus 3000 | |
| Aceite de silicona | Dow Corning | 200 fluido, 10 cSt | Opcional para el almacenamiento de emulsión |
Referencias
- Zagnoni, M., Lain, G. L. e., Cooper, J. M. Electrocoalescence mechanisms of microdroplets using localized electric fields in microfluidic channels. Langmuir : the ACS journal of surfaces and colloids. 26, 14443-14449 (2010).
- Niu, X. Z., Gielen, F., Edel, J. B., deMello, A. J. A microdroplet dilutor for high-throughput screening. Nat. Chem. 3, 437-442 (2011).
- Vincent, M. E., Liu, W., Haney, E. B., Ismagilov, R. F. Microfluidic stochastic confinement enhances analysis of rare cells by isolating cells and creating high density environments for control of diffusible signals. Chemical Society reviews. 39, 974-984 (2010).
- Huebner, A. Quantitative detection of protein expression in single cells using droplet microfluidics. Chemical communications. , 1218-1220 (2007).
- Love, J. C., Ronan, J. L., Grotenbreg, G. M., van der Veen, A. G., Ploegh, H. L. A microengraving method for rapid selection of single cells producing antigen-specific antibodies. Nature biotechnology. 24, 703-707 (2006).
- Bradshaw, E. M. Concurrent detection of secreted products from human lymphocytes by microengraving: Cytokines and antigen-reactive antibodies. Clin. Immunol. 129, 10-18 (2008).
- Liu, W. S., Kim, H. J., Lucchetta, E. M., Du, W. B., Ismagilov, R. F. Isolation, incubation, and parallel functional testing and identification by FISH of rare microbial single-copy cells from multi-species mixtures using the combination of chemistrode and stochastic confinement. Lab on a chip. 9, 2153-2162 (2009).
- Boedicker, J. Q., Li, L., Kline, T. R., Ismagilov, R. F. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics. Lab on a chip. 8, 1265-1272 (2008).
- Koster, S. Drop-based microfluidic devices for encapsulation of single cells. Lab on a chip. 8, 1110-1115 (2008).
- Kelly, R. T., Page, J. S., Marginean, I., Tang, K., Smith, R. D. Dilution-free analysis from picoliter droplets by nano-electrospray ionization mass spectrometry. Angew Chem. Int. Ed. Engl. 48, 6832-6835 (2009).
- Hong, J., deMello, A. J., Jayasinghe, S. N. Bio-electrospraying and droplet-based microfluidics: control of cell numbers within living residues. Biomedical materials. 5, 21001 (2010).
- Edd, J. F. Controlled encapsulation of single-cells into monodisperse picolitre drops. Lab on a chip. 8, 1262-1264 (2008).
- Anna, S. L., Bontoux, N., Stone, H. A. Formation of dispersions using "flow focusing" in microchannels. Applied Physics Letters. 82, 364 (2003).
- Utada, A., Fernandez-Nieves, A., Stone, H., Weitz, D. Dripping to Jetting Transitions in Coflowing Liquid Streams. Physical Review Letters. 99, (2007).
- Chabert, M., Viovy, J. L. Microfluidic high-throughput encapsulation and hydrodynamic self-sorting of single cells. Proceedings of the National Academy of Sciences of the United States of America. 105, 3191-3196 (2008).
- Segrí, G., Silberberg, A. Radial Particle Displacements in Poiseuille Flow of Suspensions. Nature. 189, 209-210 (1961).
- Carlo, D. D. i. Inertial microfluidics. Lab on a chip. 9, 3038-3046 (2009).
- Carlo, D. D. i., Edd, J., Humphry, K., Stone, H., Toner, M. Particle Segregation and Dynamics in Confined Flows. Physical Review Letters. 102, (2009).
- Humphry, K. J., Kulkarni, P. M., Weitz, D. A., Morris, J. F., Stone, H. A. Axial and lateral particle ordering in finite Reynolds number channel flows. Physics of Fluids. 22, 081703 (2010).
- Lee, W., Amini, H., Stone, H. A., Carlo, D. D. i. Dynamic self-assembly and control of microfluidic particle crystals. Proceedings of the National Academy of Sciences of the United States of America. 107, 22413 (2010).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane. Anal. Chem. 70, 4974-4984 (1998).
- Kotz, K., Cheng, X., Toner, M. PDMS Device Fabrication and Surface Modification. J. Vis. Exp. (8), e319 (2007).
- Haubert, K., Drier, T., Beebe, D. PDMS bonding by means of a portable, low-cost corona system. Lab on a chip. 6, 1548-1549 (2006).
- Hatch, A. C. 1-Million droplet array with wide-field fluorescence imaging for digital PCR. Lab on a chip. , 3838-3845 (2011).
- Holtze, C. Biocompatible surfactants for water-in-fluorocarbon emulsions. Lab on a chip. 8, 1632-1639 (2008).
- Garstecki, P., Stone, H., Whitesides, G. Mechanism for Flow-Rate Controlled Breakup in Confined Geometries: A Route to Monodisperse Emulsions. Physical Review Letters. 94, (2005).
- Garstecki, P., Fuerstman, M. J., Stone, H. A., Whitesides, G. M. Formation of droplets and bubbles in a microfluidic T-junction-scaling and mechanism of break-up. Lab on a chip. 6, 437-446 (2006).
- Nie, Z. Emulsification in a microfluidic flow-focusing device: effect of the viscosities of the liquids. Microfluidics and Nanofluidics. , (2008).
- Holt, D. J., Payne, R. J., Chow, W. Y., Abell, C. Fluorosurfactants for microdroplets: interfacial tension analysis. Journal of colloid and interface science. 350, 205-211 (2010).
- Holt, D. J., Payne, R. J., Abell, C. Synthesis of novel fluorous surfactants for microdroplet stabilisation in fluorous oil streams. Journal of Fluorine Chemistry. 131, 398-407 (2010).
- Hatch, A. C., Fisher, J. S., Pentoney, S. L., Yang, D. L., Lee, A. P. Tunable 3D droplet self-assembly for ultra-high-density digital micro-reactor arrays. Lab on a chip. 11, 2509-2517 (2011).
- Baret, J. C. Surfactants in droplet-based microfluidics. Lab on a chip. 12, 422-433 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados