Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yüksek Verim Micro-encapsulation Tek hücreli ve Çoklu-hücre
Bu Makalede
Özet
Hücre ve parçacıkların eylemsizlik sıralamayı kümil potasyum başlatıcısı varlığında damla nesil birleştirerek, biz kHz fiyatlara tek bir damla hücre veya parçacıkların İstediğiniz bir numarayı kapsüllemek için bir yöntem tarif. Biz iki kez tek ve çift-parçacık damla sırasız encapsulation geçecek verimlilik göstermektedir.
Özet
Microfluidic encapsulation methods have been previously utilized to capture cells in picoliter-scale aqueous, monodisperse drops, providing confinement from a bulk fluid environment with applications in high throughput screening, cytometry, and mass spectrometry. We describe a method to not only encapsulate single cells, but to repeatedly capture a set number of cells (here we demonstrate one- and two-cell encapsulation) to study both isolation and the interactions between cells in groups of controlled sizes. By combining drop generation techniques with cell and particle ordering, we demonstrate controlled encapsulation of cell-sized particles for efficient, continuous encapsulation. Using an aqueous particle suspension and immiscible fluorocarbon oil, we generate aqueous drops in oil with a flow focusing nozzle. The aqueous flow rate is sufficiently high to create ordering of particles which reach the nozzle at integer multiple frequencies of the drop generation frequency, encapsulating a controlled number of cells in each drop. For representative results, 9.9 μm polystyrene particles are used as cell surrogates. This study shows a single-particle encapsulation efficiency Pk=1 of 83.7% and a double-particle encapsulation efficiency Pk=2 of 79.5% as compared to their respective Poisson efficiencies of 39.3% and 33.3%, respectively. The effect of consistent cell and particle concentration is demonstrated to be of major importance for efficient encapsulation, and dripping to jetting transitions are also addressed.
Introduction
Continuous media aqueous cell suspensions share a common fluid environment which allows cells to interact in parallel and also homogenizes the effects of specific cells in measurements from the media. High-throughput encapsulation of cells into picoliter-scale drops confines the samples to protect drops from cross-contamination, enable a measure of cellular diversity within samples, prevent dilution of reagents and expressed biomarkers, and amplify signals from bioreactor products. Drops also provide the ability to re-merge drops into larger aqueous samples or with other drops for intercellular signaling studies.1,2 The reduction in dilution implies stronger detection signals for higher accuracy measurements as well as the ability to reduce potentially costly sample and reagent volumes.3 Encapsulation of cells in drops has been utilized to improve detection of protein expression,4 antibodies,5,6 enzymes,7 and metabolic activity8 for high throughput screening, and could be used to improve high throughput cytometry.9 Additional studies present applications in bio-electrospraying of cell containing drops for mass spectrometry10 and targeted surface cell coatings.11 Some applications, however, have been limited by the lack of ability to control the number of cells encapsulated in drops. Here we present a method of ordered encapsulation12 which increases the demonstrated encapsulation efficiencies for one and two cells and may be extrapolated for encapsulation of a larger number of cells.
To achieve monodisperse drop generation, microfluidic "flow focusing" enables the creation of controllable-size drops of one fluid (an aqueous cell mixture) within another (a continuous oil phase) by using a nozzle at which the streams converge.13 For a given nozzle geometry, the drop generation frequency f and drop size can be altered by adjusting oil and aqueous flow rates Qoil and Qaq. As the flow rates increase, the flows may transition from drop generation to unstable jetting of aqueous fluid from the nozzle.14
When the aqueous solution contains suspended particles, particles become encapsulated and isolated from one another at the nozzle. For drop generation using a randomly distributed aqueous cell suspension, the average fraction of drops Dk containing k cells is dictated by Poisson statistics, where Dk = λk exp(-λ)/(k!) and λ is the average number of cells per drop. The fraction of cells which end up in the "correctly" encapsulated drops is calculated using Pk = (k x Dk)/Σ(k' x Dk'). The subtle difference between the two metrics is that Dk relates to the utilization of aqueous fluid and the amount of drop sorting that must be completed following encapsulation, and Pk relates to the utilization of the cell sample. As an example, one could use a dilute cell suspension (low λ) to encapsulate drops where most drops containing cells would contain just one cell. While the efficiency metric Pk would be high, the majority of drops would be empty (low Dk), thus requiring a sorting mechanism to remove empty drops, also reducing throughput.15
Combining drop generation with inertial ordering provides the ability to encapsulate drops with more predictable numbers of cells per drop and higher throughputs than random encapsulation. Inertial focusing was first discovered by Segre and Silberberg16 and refers to the tendency of finite-sized particles to migrate to lateral equilibrium positions in channel flow. Inertial ordering refers to the tendency of the particles and cells to passively organize into equally spaced, staggered, constant velocity trains. Both focusing and ordering require sufficiently high flow rates (high Reynolds number) and particle sizes (high Particle Reynolds number).17,18 Here, the Reynolds number Re =uDh/ν and particle Reynolds number Rep =Re(a/Dh)2, where u is a characteristic flow velocity, Dh [=2wh/(w+h)] is the hydraulic diameter, ν is the kinematic viscosity, a is the particle diameter, w is the channel width, and h is the channel height. Empirically, the length required to achieve fully ordered trains decreases as Re and Rep increase. Note that the high Re and Rep requirements (for this study on the order of 5 and 0.5, respectively) may conflict with the need to keep aqueous flow rates low to avoid jetting at the drop generation nozzle. Additionally, high flow rates lead to higher shear stresses on cells, which are not addressed in this protocol. The previous ordered encapsulation study demonstrated that over 90% of singly encapsulated HL60 cells under similar flow conditions to those in this study maintained cell membrane integrity.12 However, the effect of the magnitude and time scales of shear stresses will need to be carefully considered when extrapolating to different cell types and flow parameters. The overlapping of the cell ordering, drop generation, and cell viability aqueous flow rate constraints provides an ideal operational regime for controlled encapsulation of single and multiple cells.
Because very few studies address inter-particle train spacing,19,20 determining the spacing is most easily done empirically and will depend on channel geometry, flow rate, particle size, and particle concentration. Nonetheless, the equal lateral spacing between trains implies that cells arrive at predictable, consistent time intervals. When drop generation occurs at the same rate at which ordered cells arrive at the nozzle, the cells become encapsulated within the drop in a controlled manner. This technique has been utilized to encapsulate single cells with throughputs on the order of 15 kHz,12 a significant improvement over previous studies reporting encapsulation rates on the order of 60-160 Hz.4,15 In the controlled encapsulation work, over 80% of drops contained one and only one cell, a significant efficiency improvement over Poisson (random) statistics, which predicts less than 40% efficiency on average.12
In previous controlled encapsulation work,12 the average number of particles per drop λ was tuned to provide single-cell encapsulation. We hypothesize that through tuning of flow rates, we can efficiently encapsulate any number of cells per drop when λ is equal or close to the number of desired cells per drop. While single-cell encapsulation is valuable in determining individual cell responses from stimuli, multiple-cell encapsulation provides information relating to the interaction of controlled numbers and types of cells. Here we present a protocol, representative results using polystyrene microspheres, and discussion for controlled encapsulation of multiple cells using a passive inertial ordering channel and drop generation nozzle.
Protokol
Bu bölümde protokolleri, deney sonuçları elde etmek için özel olarak kullanılan malzemeler ve ekipman açıklanmaktadır. Kimyasallar ve ekipmanlar için alternatif tedarikçiler kullanılabilir unutmayın.
1. Cihaz İmalat ve Yumuşak Litografi
Standard, yumuşak litografi teknikleri, 21 bir önceki Jove makaleler özellikli edilmiş olan bir dizi, 22 cam yüzeye bağlı polidimetilsiloksan (PDMS) mikrokanal ağlar oluşturmak için kullanılmıştır. Kenara SU-8 fotolitografi ile ana kopya kalıp imalatını, süreçlerin bir temiz oda veya temiz davlumbaz dışında yapılabilir ancak, toz ve partiküller hala tutarlı sonuçlar elde etmek için en aza indirilmelidir.
- AutoCAD (AutoDesk Inc) Şekil 1 'de gösterildiği gibi bir mikro-kanallı desen tasarımı. Yüksek çözünürlüklü (50.000 dpi) trans yazdırmak için üçüncü taraf üreticinin (Fineline Imaging Inc) istihdamkanal karanlık bir arka plan üzerinde şeffaf Mylar film veya kuvars parency maskesi.
- Çoğaltma kalıplama için silikon ve SU-8 fotorezist ana oluşturun. Kısaca, dönmeye SU-8 2050 temiz bir 7.5 cm veya 10 cm silikon üzerinde 52 mikron kalınlığında bir katman yaratmak için bir spin-lak bir üreticinin tavsiye rpm (MicroChem) negatif fotorezist. Sonra yumuşak bir fırında, kenar boncuk kaldırılması, bir kişi maske, maruziyet sonrası fırında, geliştirme, ve sel maruz kalma, bir Dektak profilometre (Veeco) kullanarak SU-8 katmanlı gerçek kalınlığı ölçümü ile UV ışınlarına maruz kalma. Teyp 4 "veya 5" Petri kabının alt üzerine master kalıp PDMS çoğaltma kalıp hazırlamak için.
- Sertleştirici bir 10:1 oranını w / w baz elastomer sertleştirici (Dow Corning) ile karıştırın PDMS elastomer tabanı. 2-3 mm kalınlığında son katman yaratmak için silikon ana üzerine iyi karıştırılmış PDMS habercisi dökün. 2 g sertleştirme maddesi ile 20 g elastomer baz ile bir karışımı, bir 4 "çapı yüzeyini kaplayan için yeterlidir.
- Maste yerleştirinde-gaz sertleşmemiş PDMS vakum desikatörde r kalıp ve PDMS (Jencons). Bir basınç regülatörü (Cole Parmer) kullanarak, yavaş yavaş aşırı köpük önlemek için 20 dakika içinde Hg "-27 için Hg" 0 odası Gage basıncı azaltmak. Hava kabarcıkları kayboluncaya kadar yaklaşık 30 dakika -27 "Hg'de vakum odasında cihazı bırakın.
- Vakum bırakın ve bir 65 ° dört saat en az C fırında (Thermo Scientific). Için ana kalıp ve PDMS hareket Cihaz kür iyileştirmek için bir gece boyunca fırın içinde kalabilir.
- Fırından çıkarın ve cihazın soğumasını bekleyin. Dikkatle PDMS dışarı hassas bir bıçak ve kabuğu kullanarak dairesel gofret etrafında PDMS kesti. Bir neşter ile Şekil 1'de gösterildiği gibi cihaz anahat kesin.
- Bir punch biyopsi ile Şekil 1'de gösterildiği gibi üç turda bölgelerinde Punch akışkan bağlantı noktası (cihaz başına üç). Bu cihaz için, bir 0.75 mm dış çaplı delme (Harris) kullanın.
- Herhangi kaldırmak için PDMS ve kabuğu desenli tarafına seloteyip uyuntoz. Geleneksel oksijen plazma cihazları için bir maliyet tasarrufu sağlayan, ancak alternatif olarak, 21,22 plazma elde tutulan bir laboratuar korona işlemcinize (Elektro-Teknik Ürünler A.Ş. kullanarak PDMS ve temiz bir 3 "x 1" cam mikroskop slayt desenli yan tedavi .). 23 Bu cihaz çeker ocak veya ozon akıntı nedeniyle iyi havalandırılan bir alanda kullanılması gerektiğini unutmayın ve tüm saatler ve cep telefonları en az on metre uzakta tutulmalıdır. Minimal kıvılcım ile istikrarlı bir korona ulaşmak için korona boşalma ayarlayın. Yavaşça yaklaşık 20 saniye boyunca her yüzey üzerinde "yaklaşık 1/4 elektrot dalgalandıracak ve sonra hemen PDMS yüzeyler doğdukları duruma dönmek önce güçlü bir bağ oluşturmak için temas yüzeyleri muamele getirebilir.
- Metal bir plaka üzerine cihazı yerleştirin, serin bir fırın yer, 120 ° C fırında ayarlayın ve yapıştırma tamamlamak ve bu yüksek sıcaklıkta pişirme, t sırasında orijinal hidrofobik devlet. 24 PDMS dönmek için gece boyunca fırındaO kanalın cam yüzeye de cam üzerine ince bir tabaka hidrofobik birikimi nedeniyle hidrofobik işlenecek. Alternatif olarak, bu tür Aquapel (PPG Industries) gibi hidrofobik kaplama 12 dikkatlice. Bir 1 mL şırınga ve şırınga iğne kullanılarak akışkan portu içine enjekte edilebilir, ancak sıkıca cam bağa PDMS bozmadan akışkan portu içine hava püskürtme tarafından takip Aquapel enjekte . Kuruma bağlı kanallar tıkayabilir herhangi birikmeleri önlemek için herhangi bir aşırı Aquapel silmeye ise agresif, tüm giriş ve çıkış delikleri üzerinde pürjörü tekrarlayın.
2. Numune Hazırlama
- Seçtiğiniz hücre tipi için prosedürlere göre bir hücre kültürü hazırlayın. Bu çalışmada kullanılan özel cihaz için, 8-15 mikron partiküller veya hücrelerin yeterince encapsulation için sipariş etmeniz gerekir. Daha küçük veya daha büyük bir hücre tipleri yeterli Re p elde etmek için odaklanarak kanalının boyutları değişen gerektirebilir. Me içinThOD gösteri sonuçlar bu yazıda görüldüğü gibi, 9.9 mikron polystyrene küreler (G1000, Thermo Scientific) hücre vekilleri olarak kullanılmaktadır.
- Nazik karıştırma yoluyla sulu parçacık veya hücre süspansiyonu hazırlayın. Hücreleri veya polistiren partiküller kullanırken, konsantrasyon kontrolü ideal bir sipariş kapsülleme ulaşmak için (bkz. Şekil 4) esastır. Önceki verileri 12 bir kılavuz olarak kullanarak, sipariş tren aralığı ve mikro-kanal boyutuna göre istenen hücre veya partikül konsantrasyonu hesaplamak gibi: bir hücre ya da beklenen boyuna tren boşluğu kez odaklama kanal kesit alanı başına parçacık. Stok konsantrasyonları (% 1 w / w) yetersiz olduğu durumda, hafifçe bir karıştırma veya yumuşak bir vorteks ile parçacıklar, stok Örnek santrifüj süpernatan sıvıyı, ve yeniden süspanse ederek ve süspansiyonu (burada% 1.5 w / w) konsantrasyonunu arttırmak hücreleri kullanırken. İstenen toplama hacmi ve fl ile ilişkili çalışma süresi hesabı için yeterli hacmi hazırlayınow ayarlama.
- Hücreleri ve polistiren parçacıkların her ikisi birden büyük bir özgül ağırlığa sahiptir. Bu protokolde gösterilmiştir olmamakla birlikte, saat için pek çok dakika için kalıcı uzun süreli deneyler için, yüzdürme hücreleri için partiküller ya OptiPrep (Sigma-Aldrich) için bu tür CaCI2 olarak çözünen ekleyerek çözeltisi eşleşir.
- Bir 15 ml'lik bir santrifüj tüpüne flüorokarbon yağı FC-40 (3M) ve doldurulmuş vaziyette sevk-PEG blok kopolimeri sürfaktan 25 (% 2.5 w / w) (Raindance Technologies) karıştırılması ile sürekli bir flüorokarbon yağ fazı bir 10 ml numunesinin hazırlanması. Alternatif olarak, ışık mineral yağ (PTI Proses Chemicals) Abil-EM 90 yüzey aktif madde (% 2.5 w / w) (Evonik Goldschmidt Corporation) ile birlikte kullanılabilir.
3. Deney Düzeneği
- Ters optik mikroskop (Axio Observer, Zeiss) ve yüksek hızlı kamera (Phantom V310, Vision Research) açın. Veya elle cihazı hareket ettirerek takunyalar ve enkaz kanalları Odak ve teftişmotorlu bir mikroskop sahne kullanarak. Sıvı akar Bazı küçük birikimler itilmiş olabilir. Odaklanan kanalda enkaz kaliteyi önemli ölçüde sipariş düşürebilir gibi büyük enkaz veya bariz takunya için, cihaz başka bir kanalı seçin. Takunyalar genellikle künt cımbızla etkilenen bölgenin üstüne PDMS yüzeye sıkıca basarak akışı altında çıkarılabilir unutmayın.
- Üç sulu giriş için PVC boru uzunluğu (0.01 "ID/0.03" OD, Tygon), yağ giriş ve çıkış emülsiyon kesin. Ölü hacmi en aza indirmek için yeterli boru şırınga pompaları ile mikroskop aşamaya ulaşmak için kesti. Akışkan liman içine yerleştirilmesi kolaylaştırmak için 45 ° açıyla boru uçlarını kesin.
- Tüp Adım 1 yumrukladı akışkan portlarına biter sığacak basın ve ardından ilgili sulu ve yağ giriş tüpleri (Yapışkan gerekli) serbest biter içine iki adet 30 ayar künt uçlu paslanmaz çelik şırınga iğneleri (SmallParts) sığacak basın cımbız kullanın . Bir atık r içine çıkış boruları yerleştirineservoir. Bu tüp daha sonra toplama haznesi içerisine taşınacaktır.
- , Mikroskop sahneye cihazı ve bağlı boru taşıma hizalayın ve kullanılabilir bir nesnel (20x Bu deney için kullanılan) kullanan cihaz meme odaklanın. Optimal kayıt için gerekli K hler aydınlatma ve diğer mikroskop ayarları için ayarlayın.
- Adım 2 'de hazırlanan yağ fazı çözeltisi ile iyi karıştırılmış, sulu faz ve bir 3 mL şırınganın (BD) ile 1 mL şırınganın (BD) doldurur. Herhangi bir ses herhangi bir şırınga kullanılabilir ve dikkatle istenilen çalışma sürelerini ve herhangi bir pulsatilite azaltılması bağlı olarak seçilmesi gerektiğini unutmayın. Dikey bir şırınga yatırın ve enjektör çıkışına hava kabarcıkları taşımak için hafifçe vurun. Yavaş yavaş şırınga ucu için hava itmek için yeterli piston basınız. Şırınga tutarak dikey olarak, zaten Basamak 3.3 'de cihazına bağlanmış ilgili şırınga iğneye şırınga bağlanabilir. Sıvı p kadar şırınga iğnesinin ölü hacim ile hava zorlamak için piston sıkıpneredeyse cihaza borular yoluyla ushed. Güvenli bir şırınga pompası (Nexus 3000, Chemyx) için şırınga monte ve pistonu blok meşgul. İkinci şırınga bağlantıları tekrarlayın ve ikinci bir şırınga pompası için monte edin.
- Her bir şırınga pompası ve pompa üreticinin protokolleri kullanarak programı açın. Q yağa başlangıç akış oranı ayarlamak = 50 ul / dak ve Q aq = 5 ul / sırasıyla yağ fazında ve sulu faz için dak. Pompalar başlatın.
- Kalan ölü havayı dışarı iterek, cihaz girin ve kanalları doldurmak için her bir akışkan için bekleyin. Bu işlem birkaç dakika sürebilir. Giriş hortumu bir hava büyük miktarda olması durumunda havanın dışarı atılır kadar, geçici bir süre için her bir akış hızını artırmaktadır. Potansiyel PDMS-to-cam bağı yetmezliğine yol, kanal büyük basınçlar meydana böylece yüksek debi artışı yok.
- İlk akım hızları kullanarak, ağzında damla oluşumu gözlemlemek (sonuçları burada gösterilmiştir: 20x magnification, kare hızı 21005 fps, pozlama 3 μs). Çerçeve hızı en üst düzeye çıkarmak ve mümkünse bellek gereksinimlerini azaltmak için sadece memeye kameranın görüş alanını azaltın. Örnek videoları yakalayın ve örnekleme oranı aliasing önlemek için yeterli olduğunu onaylayın.
- (Bkz. Şekil 2) jeti önlemek için, düşük sulu akış oranları ile başlar. Yavaşça akış hızı arttıkça, uzun sulu çözeltisi kanalda parçacıkların sipariş gözlemlemek için sulu bir akış hızını artırmaktadır.
- Partikül konsantrasyonu nispeten az "eksik" parçacıklar ve örnek yüzdürme perçinlenememesiydi trenleri sağlamak için çok düşük ise, fiziksel şırınga çıkışına doğru parçacıkların çökelme kademeli sağlamak için şırınga çıkışına doğru şırınga pompası eğin. Bu yöntem, video protokolü gösterilmiştir. Periyodik olarak kendi ekseni boyunca şırınga dönen da istenmeyen çöktürme azaltabilir.
- Yeterli sipariş kez, nesil frekansı ayarlamak için yağ akış hızı ayarlamak vedamla büyüklüğü. Ortalama düşüş hacim olarak video yakalama tarafından ölçülen damla nesil frekans bölünür sulu debi kullanılarak hesaplanabilir. Iteratif istenilen kapsülleme oranları ve damla hacmi elde etmek için akış oranları hem ayarlayın.
- Bir kez kararlı sipariş kapsülleme teyit, bir toplama haznesine atık hazneden çıkış boruları taşımak veya sonraki testleri için başka bir cihazın içine beslenir.
- Damlacıklarının istenen sayıda ve hesaplanan oluşum frekansı dayalı toplama zamanı belirler.
- Veya denetimi için toplanmıştır emülsiyon bir numune pipet ile damla nesil video sonuçlar kullanılarak verim ölçmek için 0, 1, 2, ..., N parçacıklar içeren damla kısmını kaydeder.
4. Temsilcisi Sonuçlar
Sonuçlar hem kontrollü tek-parçacık ve kontrollü çift parçacık kapsülleme (Şekil 3) elde hangi sunulmaktadır. Keserekyarısında FC-40 yağ akış hızı, tek-parçacık kapsülleme iki tane encapsulation olur. Tersine, biz daha çabuk memeye parçacıklar sunmak için sulu akış hızını arttırmış olabilir, ama biz de sulu dere jeti riski artacaktır. Şekil 3 içinde histogram Poisson verilerine karşılaştırmaları ile birlikte, iki durumda için damla ortalama parçacık fraksiyonel numarası sunulmuştur. Sıfır parçacıkları ile zaman zaman damlalar öncelikle sipariş trenlerde "eksik" parçacıklar nedeniyle vardır, yerel yüksek partikül konsantrasyonu ve bazen iki dikey odaklanarak pozisyon birine doğru göç parçacıklar istenen sonucu daha kapsüllü parçacıklar vardır durumlarda ise. Bölüm 2'de açıklandığı üzere, eşleştirme bir yüzdürme kullanılmaz edildi not edin. Bunun yerine, şırınga pompası fiziksel çalışması sırasında parçacıklar yüksek bir konsantrasyonda yol açan, şırınganın çıkışına doğru parçacık çökeltme izin verecek şekilde hareket ettirildiğinde edildi.
düzgün partikül ve hücre konsantrasyonları için ihtiyaç gösteren deneysel bir çalıştırma Şekil 4 'de gösterilmiştir. Tam sıralama olmadan, lokalize parçacıklar düzenin gruplar ve kapsüllü olan, ancak birçok damla partikül içermeyen vardır. Histogram istenen iki tane encapsulation için azalmış kapsülleme verimliliğini gösterir.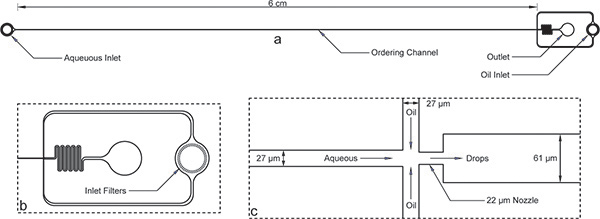
1. Encapsulation cihazı Şekil. girişleri, çıkış ve uzun sipariş kanal a) Genel cihazı. Cihaz yüksekliği 52 mikron ve sipariş kanal genişliği 27 mikron olduğunu. b) sulu ve yağ girişleri Hem petrol girişinin büyütülmüş görünümü için sipariş kanal genişliği sırasına boşluklar ile büyük enkaz filtreleri var. c) büyütülmüş bir görünümünü memesi 22 um ve 61 um, daha geniş bir kanala ani bir genişleme memesi kasılması, ardından sulu ve yağ kanalları için, 27 mikron arasında eşit genişlikte kanalı gösterir.Burada gösterilen cihazın boyutları mikroimalat sonra bir profilometre kullanılarak teyit edilmiştir unutmayın ve maske anma boyutlarını biraz farklı. Sipariş kanal ve meme gerçek bir görüntü olarak online olarak mevcuttur Ek Şekil 1 . AutoCAD maskesi dosyası da bu yazıya ek olarak çevrimiçi dahil edilmiştir.

Şekil 2. Bir daha geniş bir cihaz (80 mikron genişliğinde x 22 mikron yüksek) kullanarak jeti geçiş için damlama Histeresis. a) sabit FC-40 debisi (Q yağ = 45 uL / dk), sabit damla oluşumu sulu debisi Q aq = 8 uL / dak ile 10 kHz oluşur. Sulu akış oranı yavaş yavaş 10 ve m arttıkçau; sulu sıvı akışı jeti L / dk, tetiklenir. b) akış hızı 8 ul / dk 'ya kadar devam eder jeti döndürülür. Istikrarlı bir damla oluşumu kısaca sulu akış pompası (1 saniyelik bir bekleme tipik) duraklatarak yeniden kurulabilir unutmayın.
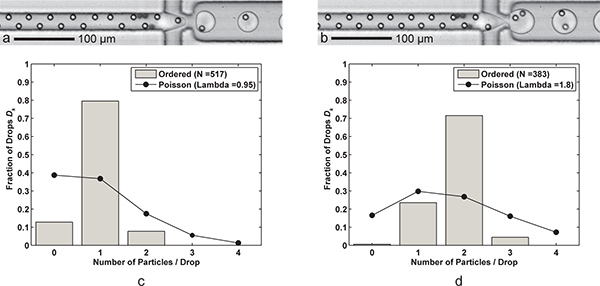
Şekil 3. Tek ve çift parçacık kapsülleme. Damla başına bir hücre (a) Damla oluşumu Q yağ = 60 uL / dk, Q aq = 6.1 kHz bir damla nesil oranı, ortalama damla boyutu ile 9 uL / dk) 24.4 pL ve tek hücreli yakalama verimliliği iki hücre ile D k =% 79.5 ve P k = n bir örnek boyutu için% 83.7 (λ = 0.95) d = 517 damla ve n p = 491 parçacıklar. b) Damla oluşumu damla başına 30 μ için FC-40 debisi Q yağı azaltarak sadece elde edilirL / dk. Daha büyük (39.8 pL) damla iki hücreli yakalama verimliliği ile 3.8 kHz oranında oluşur D k =% 71.5 ve P k =% 79.5 (λ = 1.80) n bir örneklem büyüklüğü için d = 383 damla ve n p = 689 parçacıklar. cd) İki histogramlar damla kapsülleme tane verimleri Poisson istatistikleri (rastgele kapsülleme) ile sipariş tek ve çift-parçacık kapsülleme D k karşılaştırın. Her iki durum için, akış yönünde parçacık boşluk tam olarak sipariş, değişen parçacıklar için yaklaşık 17-18 mikron olduğunu unutmayın. Hem de tek ve çift-parçacık kapsülleme gösteren Ek videolar online olarak mevcuttur. Ek Film 3a görmek için buraya tıklayın . Ek Film 3b görmek için buraya tıklayın .

Şekil 4. Konsantrasyon büyük ölçüde konsantrasyonu azaldıkça a), tam sipariş oluşmaz. Kapsülleme verimliliği etkiler ve trenlerde böylece "delik" beklenen parçacıklar daha az olan bazı damla bırakarak ortaya. B) histogram azaltması (gösterir D k = çift parçacık damla vardır yaklaşık olarak çok tek-parçacık vardır = 1.57 düşer λ daha düşük bir değer nedeniyle iki parçacık encapsulation için% 55.9, p k =% 70.9). Q yağından Bu sonuçlar Şekil = 30 ul / dak ve Q aq = 9 ul / dak, Şekil 3b için aynı akım şartları. Bir temsilci tamamlayıcı Video online olarak kullanılabilir. Ek Film 4 görmek için buraya tıklayın .
Tartışmalar
Sipariş nispeten yüksek derecede rağmen, tüm parçacıkları damla veya hücre uygun sayıda içerecektir. Encapsulation verimliliği hücreleri veya bunların toplam sayısına bölünerek istenilen doluluk ile damla kapsüllenmiş olur parçacıkların sayısı olarak hesaplanabilir. Bu ham veriler elde emülsiyon bir numune otomatik bir yüksek hızlı video algoritması ya da görüntü ile elde edilebilir. Bu parçacıklar k ve k parçacıklar içerir damla D k fraksiyonu içeren bir damla k...
Açıklamalar
JE Bu yazıda kullanılan teknolojiye dayalı bir patent bir mucididir.
Teşekkürler
Biz bu çalışmada kullanılan doldurulmuş vaziyette sevk-PEG yüzey örnek için Raindance Teknolojileri teşekkür ederim, ve biz PDMS kanal çoğaltmalarını oluşturmak için kullanılan silikon kalıp için BioMEMS Kaynak Merkezi (Mehmet Toner, yönetmen) teşekkür ederim.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar |
| AutoCAD | AutoDesk | ||
| Şeffaflık Maskesi | Fineline Imaging Inc | ||
| SU-8 rezist | MicroChem | 2050 | |
| Dektak Profilometre | Veeco | ||
| Petri Dish | BD Falcon | 351058 | |
| PDMS Silikon Elastomer Kiti | Dow Corning Corp | Sylgard 184, Malzeme Numarası (240) 4019862 | |
| Vakum Desikatör | Jencons | 250-030 | |
| Vakum Pompası | Alcatel Vakum Teknolojisi | 2010 C2 | |
| Vakum Regülatörü | Cole-Parmer | EW-00.910-10 | |
| Fırın | Thermo Scientific | Lindberg Mavi M, OV800F | |
| Biyopsi Punch, 0,75 mm | Harris | Uni-Core 15.072 | |
| Laboratuvar Corona treater | Elektro-Teknik Ürünler A.Ş. | BD-20AC, SKU 12051A | |
| Cam Slaytlar | Altın Mühür | 3010 | |
| Aquapel | PPG Industries | Alternatif Strateji | |
| Polistiren Mikroküreler, 9.9 mikron | Thermo | G1000 | |
| OptiPrep | Sigma-Aldrich | D1556 | Kanıtlanmış değil |
| Luer-Lok Şırınga | BD | 1 mL: 309.628 3 ml: 309.585 | |
| FC-40 Florokarbon Yağ | 3M A.Ş. | Sigma Aldrich, F9755 | |
| Doldurulmuş vaziyette sevk-PEG Fluorosurfactant | Raindance Teknolojileri | ||
| Işık Madeni Yağ | PTI Proses Kimyasalları | 08042-47-5 | Alternatif Strateji |
| Madeni Yağ Yüzey | Evonik Goldschmidt Şirketi | Abil EM 90 | Alternatif Strateji |
| Tygon PVC Boru | SmallParts | TGY-010 | |
| 30 Gauge Luer-Lok Şırınga İğne, 1/2 " | SmallParts | ND-301PL-C | |
| Ters Mikroskop | Carl Zeiss Görüntüleme | Axio Observer.Z1 | |
| Yüksek Hızlı Kamera | Vizyon Araştırma | Phantom V310 | |
| Şırınga Pompaları (2) | Chemyx A.Ş. | Nexus 3000 | |
| Silikon Yağı | Dow Corning | 200 sıvısı, 10 cSt | Emülsiyon Depolama için opsiyonel |
Referanslar
- Zagnoni, M., Lain, G. L. e., Cooper, J. M. Electrocoalescence mechanisms of microdroplets using localized electric fields in microfluidic channels. Langmuir : the ACS journal of surfaces and colloids. 26, 14443-14449 (2010).
- Niu, X. Z., Gielen, F., Edel, J. B., deMello, A. J. A microdroplet dilutor for high-throughput screening. Nat. Chem. 3, 437-442 (2011).
- Vincent, M. E., Liu, W., Haney, E. B., Ismagilov, R. F. Microfluidic stochastic confinement enhances analysis of rare cells by isolating cells and creating high density environments for control of diffusible signals. Chemical Society reviews. 39, 974-984 (2010).
- Huebner, A. Quantitative detection of protein expression in single cells using droplet microfluidics. Chemical communications. , 1218-1220 (2007).
- Love, J. C., Ronan, J. L., Grotenbreg, G. M., van der Veen, A. G., Ploegh, H. L. A microengraving method for rapid selection of single cells producing antigen-specific antibodies. Nature biotechnology. 24, 703-707 (2006).
- Bradshaw, E. M. Concurrent detection of secreted products from human lymphocytes by microengraving: Cytokines and antigen-reactive antibodies. Clin. Immunol. 129, 10-18 (2008).
- Liu, W. S., Kim, H. J., Lucchetta, E. M., Du, W. B., Ismagilov, R. F. Isolation, incubation, and parallel functional testing and identification by FISH of rare microbial single-copy cells from multi-species mixtures using the combination of chemistrode and stochastic confinement. Lab on a chip. 9, 2153-2162 (2009).
- Boedicker, J. Q., Li, L., Kline, T. R., Ismagilov, R. F. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics. Lab on a chip. 8, 1265-1272 (2008).
- Koster, S. Drop-based microfluidic devices for encapsulation of single cells. Lab on a chip. 8, 1110-1115 (2008).
- Kelly, R. T., Page, J. S., Marginean, I., Tang, K., Smith, R. D. Dilution-free analysis from picoliter droplets by nano-electrospray ionization mass spectrometry. Angew Chem. Int. Ed. Engl. 48, 6832-6835 (2009).
- Hong, J., deMello, A. J., Jayasinghe, S. N. Bio-electrospraying and droplet-based microfluidics: control of cell numbers within living residues. Biomedical materials. 5, 21001 (2010).
- Edd, J. F. Controlled encapsulation of single-cells into monodisperse picolitre drops. Lab on a chip. 8, 1262-1264 (2008).
- Anna, S. L., Bontoux, N., Stone, H. A. Formation of dispersions using "flow focusing" in microchannels. Applied Physics Letters. 82, 364 (2003).
- Utada, A., Fernandez-Nieves, A., Stone, H., Weitz, D. Dripping to Jetting Transitions in Coflowing Liquid Streams. Physical Review Letters. 99, (2007).
- Chabert, M., Viovy, J. L. Microfluidic high-throughput encapsulation and hydrodynamic self-sorting of single cells. Proceedings of the National Academy of Sciences of the United States of America. 105, 3191-3196 (2008).
- Segrí, G., Silberberg, A. Radial Particle Displacements in Poiseuille Flow of Suspensions. Nature. 189, 209-210 (1961).
- Carlo, D. D. i. Inertial microfluidics. Lab on a chip. 9, 3038-3046 (2009).
- Carlo, D. D. i., Edd, J., Humphry, K., Stone, H., Toner, M. Particle Segregation and Dynamics in Confined Flows. Physical Review Letters. 102, (2009).
- Humphry, K. J., Kulkarni, P. M., Weitz, D. A., Morris, J. F., Stone, H. A. Axial and lateral particle ordering in finite Reynolds number channel flows. Physics of Fluids. 22, 081703 (2010).
- Lee, W., Amini, H., Stone, H. A., Carlo, D. D. i. Dynamic self-assembly and control of microfluidic particle crystals. Proceedings of the National Academy of Sciences of the United States of America. 107, 22413 (2010).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane. Anal. Chem. 70, 4974-4984 (1998).
- Kotz, K., Cheng, X., Toner, M. PDMS Device Fabrication and Surface Modification. J. Vis. Exp. (8), e319 (2007).
- Haubert, K., Drier, T., Beebe, D. PDMS bonding by means of a portable, low-cost corona system. Lab on a chip. 6, 1548-1549 (2006).
- Hatch, A. C. 1-Million droplet array with wide-field fluorescence imaging for digital PCR. Lab on a chip. , 3838-3845 (2011).
- Holtze, C. Biocompatible surfactants for water-in-fluorocarbon emulsions. Lab on a chip. 8, 1632-1639 (2008).
- Garstecki, P., Stone, H., Whitesides, G. Mechanism for Flow-Rate Controlled Breakup in Confined Geometries: A Route to Monodisperse Emulsions. Physical Review Letters. 94, (2005).
- Garstecki, P., Fuerstman, M. J., Stone, H. A., Whitesides, G. M. Formation of droplets and bubbles in a microfluidic T-junction-scaling and mechanism of break-up. Lab on a chip. 6, 437-446 (2006).
- Nie, Z. Emulsification in a microfluidic flow-focusing device: effect of the viscosities of the liquids. Microfluidics and Nanofluidics. , (2008).
- Holt, D. J., Payne, R. J., Chow, W. Y., Abell, C. Fluorosurfactants for microdroplets: interfacial tension analysis. Journal of colloid and interface science. 350, 205-211 (2010).
- Holt, D. J., Payne, R. J., Abell, C. Synthesis of novel fluorous surfactants for microdroplet stabilisation in fluorous oil streams. Journal of Fluorine Chemistry. 131, 398-407 (2010).
- Hatch, A. C., Fisher, J. S., Pentoney, S. L., Yang, D. L., Lee, A. P. Tunable 3D droplet self-assembly for ultra-high-density digital micro-reactor arrays. Lab on a chip. 11, 2509-2517 (2011).
- Baret, J. C. Surfactants in droplet-based microfluidics. Lab on a chip. 12, 422-433 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır