É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Alta taxa de transferência de célula única e múltipla de células Micro-encapsulamento
Neste Artigo
Resumo
Combinando monodispersos geração gota com ordenação de inércia de células e partículas, nós descrevemos um método para encapsular um número desejado de células ou partículas em uma única gota a taxas kHz. Nós demonstramos a eficiência duas vezes superiores às de encapsulamento desordenada para gotas simples e dupla-partícula.
Resumo
Microfluidic encapsulation methods have been previously utilized to capture cells in picoliter-scale aqueous, monodisperse drops, providing confinement from a bulk fluid environment with applications in high throughput screening, cytometry, and mass spectrometry. We describe a method to not only encapsulate single cells, but to repeatedly capture a set number of cells (here we demonstrate one- and two-cell encapsulation) to study both isolation and the interactions between cells in groups of controlled sizes. By combining drop generation techniques with cell and particle ordering, we demonstrate controlled encapsulation of cell-sized particles for efficient, continuous encapsulation. Using an aqueous particle suspension and immiscible fluorocarbon oil, we generate aqueous drops in oil with a flow focusing nozzle. The aqueous flow rate is sufficiently high to create ordering of particles which reach the nozzle at integer multiple frequencies of the drop generation frequency, encapsulating a controlled number of cells in each drop. For representative results, 9.9 μm polystyrene particles are used as cell surrogates. This study shows a single-particle encapsulation efficiency Pk=1 of 83.7% and a double-particle encapsulation efficiency Pk=2 of 79.5% as compared to their respective Poisson efficiencies of 39.3% and 33.3%, respectively. The effect of consistent cell and particle concentration is demonstrated to be of major importance for efficient encapsulation, and dripping to jetting transitions are also addressed.
Introduction
Continuous media aqueous cell suspensions share a common fluid environment which allows cells to interact in parallel and also homogenizes the effects of specific cells in measurements from the media. High-throughput encapsulation of cells into picoliter-scale drops confines the samples to protect drops from cross-contamination, enable a measure of cellular diversity within samples, prevent dilution of reagents and expressed biomarkers, and amplify signals from bioreactor products. Drops also provide the ability to re-merge drops into larger aqueous samples or with other drops for intercellular signaling studies.1,2 The reduction in dilution implies stronger detection signals for higher accuracy measurements as well as the ability to reduce potentially costly sample and reagent volumes.3 Encapsulation of cells in drops has been utilized to improve detection of protein expression,4 antibodies,5,6 enzymes,7 and metabolic activity8 for high throughput screening, and could be used to improve high throughput cytometry.9 Additional studies present applications in bio-electrospraying of cell containing drops for mass spectrometry10 and targeted surface cell coatings.11 Some applications, however, have been limited by the lack of ability to control the number of cells encapsulated in drops. Here we present a method of ordered encapsulation12 which increases the demonstrated encapsulation efficiencies for one and two cells and may be extrapolated for encapsulation of a larger number of cells.
To achieve monodisperse drop generation, microfluidic "flow focusing" enables the creation of controllable-size drops of one fluid (an aqueous cell mixture) within another (a continuous oil phase) by using a nozzle at which the streams converge.13 For a given nozzle geometry, the drop generation frequency f and drop size can be altered by adjusting oil and aqueous flow rates Qoil and Qaq. As the flow rates increase, the flows may transition from drop generation to unstable jetting of aqueous fluid from the nozzle.14
When the aqueous solution contains suspended particles, particles become encapsulated and isolated from one another at the nozzle. For drop generation using a randomly distributed aqueous cell suspension, the average fraction of drops Dk containing k cells is dictated by Poisson statistics, where Dk = λk exp(-λ)/(k!) and λ is the average number of cells per drop. The fraction of cells which end up in the "correctly" encapsulated drops is calculated using Pk = (k x Dk)/Σ(k' x Dk'). The subtle difference between the two metrics is that Dk relates to the utilization of aqueous fluid and the amount of drop sorting that must be completed following encapsulation, and Pk relates to the utilization of the cell sample. As an example, one could use a dilute cell suspension (low λ) to encapsulate drops where most drops containing cells would contain just one cell. While the efficiency metric Pk would be high, the majority of drops would be empty (low Dk), thus requiring a sorting mechanism to remove empty drops, also reducing throughput.15
Combining drop generation with inertial ordering provides the ability to encapsulate drops with more predictable numbers of cells per drop and higher throughputs than random encapsulation. Inertial focusing was first discovered by Segre and Silberberg16 and refers to the tendency of finite-sized particles to migrate to lateral equilibrium positions in channel flow. Inertial ordering refers to the tendency of the particles and cells to passively organize into equally spaced, staggered, constant velocity trains. Both focusing and ordering require sufficiently high flow rates (high Reynolds number) and particle sizes (high Particle Reynolds number).17,18 Here, the Reynolds number Re =uDh/ν and particle Reynolds number Rep =Re(a/Dh)2, where u is a characteristic flow velocity, Dh [=2wh/(w+h)] is the hydraulic diameter, ν is the kinematic viscosity, a is the particle diameter, w is the channel width, and h is the channel height. Empirically, the length required to achieve fully ordered trains decreases as Re and Rep increase. Note that the high Re and Rep requirements (for this study on the order of 5 and 0.5, respectively) may conflict with the need to keep aqueous flow rates low to avoid jetting at the drop generation nozzle. Additionally, high flow rates lead to higher shear stresses on cells, which are not addressed in this protocol. The previous ordered encapsulation study demonstrated that over 90% of singly encapsulated HL60 cells under similar flow conditions to those in this study maintained cell membrane integrity.12 However, the effect of the magnitude and time scales of shear stresses will need to be carefully considered when extrapolating to different cell types and flow parameters. The overlapping of the cell ordering, drop generation, and cell viability aqueous flow rate constraints provides an ideal operational regime for controlled encapsulation of single and multiple cells.
Because very few studies address inter-particle train spacing,19,20 determining the spacing is most easily done empirically and will depend on channel geometry, flow rate, particle size, and particle concentration. Nonetheless, the equal lateral spacing between trains implies that cells arrive at predictable, consistent time intervals. When drop generation occurs at the same rate at which ordered cells arrive at the nozzle, the cells become encapsulated within the drop in a controlled manner. This technique has been utilized to encapsulate single cells with throughputs on the order of 15 kHz,12 a significant improvement over previous studies reporting encapsulation rates on the order of 60-160 Hz.4,15 In the controlled encapsulation work, over 80% of drops contained one and only one cell, a significant efficiency improvement over Poisson (random) statistics, which predicts less than 40% efficiency on average.12
In previous controlled encapsulation work,12 the average number of particles per drop λ was tuned to provide single-cell encapsulation. We hypothesize that through tuning of flow rates, we can efficiently encapsulate any number of cells per drop when λ is equal or close to the number of desired cells per drop. While single-cell encapsulation is valuable in determining individual cell responses from stimuli, multiple-cell encapsulation provides information relating to the interaction of controlled numbers and types of cells. Here we present a protocol, representative results using polystyrene microspheres, and discussion for controlled encapsulation of multiple cells using a passive inertial ordering channel and drop generation nozzle.
Protocolo
Os protocolos nesta secção descrever os materiais e equipamentos utilizados especificamente para obter os resultados experimentais apresentados. Note-se que os fornecedores alternativos para produtos químicos e os equipamentos podem ser utilizados.
1. Fabricação de dispositivos e litografia suave
Técnicas padrão de litografia suave, 21 um número de que foram caracterizados em artigos Jové anteriores, 22 foram utilizados para a criação de polidimetilsiloxano (PDMS) redes de microcanais ligados a substratos de vidro. Além de mestre fabricação de moldes de réplica por SU-8 fotolitografia, os processos podem ser realizados fora de uma sala limpa ou capuz limpo, no entanto, poeiras e partículas deve ainda ser minimizada para alcançar resultados consistentes.
- Conceber um padrão de micro-canais, como mostrado na Figura 1 em AutoCAD (AutoDesk Inc.). Empregar um fabricante terceiro (Fineline Imaging Inc.) para imprimir uma alta resolução (50.000 dpi) transmáscara de transparência em filme Mylar ou de quartzo, onde os canais são transparentes sobre um fundo escuro.
- Criar um silício e SU-8 mestre fotorresiste para a moldagem de réplica. Resumidamente, girar SU-8 2050 (Microchem) fotorresiste negativo com rpm recomendado pelo fabricante sobre um spin-coater para criar uma camada de 52 mM de espessura em uma superfície limpa de 7,5 cm ou 10 wafer de silício cm. Depois de cozer macio, borda interna do cordão de, exposição aos raios UV através de uma máscara de contato, pós-exposição cozer, desenvolvimento e exposição de inundação, medir a espessura real da camada SU-8 usando um perfilômetro Dektak (Veeco). Tape o molde mestre para o fundo de um 4 "ou 5" placa de Petri para preparar PDMS moldagem de réplica.
- Mix base de elastómero de PDMS com o agente de cura de elastómero (Dow Corning) em uma razão de 10:1 de base w / w para agente de cura. Verter bem misturada precursor PDMS para o mestre de silício para criar uma camada de espessura de 2-3 mm final. Uma mistura de 20 g de base de elastómero com 2 g do agente de cura é suficiente para cobrir uma superfície de diâmetro 4 ".
- Coloque a master molde e PDMS em exsicador de vácuo (Jencons) para o PDMS de-gás não curado. Usando um regulador de pressão (Cole Parmer), lentamente diminuir a pressão manométrica câmara de 0 "Hg para -27" Hg durante 20 minutos para evitar a excessiva formação de espuma. Deixar dispositivo na câmara de vácuo a -27 "Hg durante 30 minutos ou até que as bolhas de ar desaparecer.
- Libertação de vácuo e mover o molde mestre e PDMS para um forno de 65 ° C (Thermo Scientific) para um mínimo de quatro horas. O dispositivo pode ser deixado no forno durante a noite para melhorar a cura.
- Remova o dispositivo de forno e deixa-se arrefecer. Corte com cuidado em torno de PDMS wafer circular usando uma faca de precisão e casca fora PDMS. Cortar contorno dispositivo como mostrado na Figura 1 com um bisturi.
- Portas de perfurador fluídicos (três por dispositivo) nas três regiões redondos mostrados na Figura 1, usando um punção de biópsia. Para este dispositivo, usar um 0,75 milímetros de diâmetro exterior perfurador (Harris).
- Respeite fita adesiva para o lado modelado do PDMS e casca para remover qualquerpó. Como uma alternativa de redução de custos, mas viável para aparelhos de plasma convencionais de oxigênio, 21,22 plasma tratar o lado modelado do PDMS e um 3 limpa "x 1" lâmina de vidro usando um hand-held laboratório corona tratador (Electro-Technic Products Inc .) 23. Note-se que este dispositivo deve ser utilizado em um exaustor ou área bem ventilada devido à descarga de ozônio, e todos os relógios e telefones celulares devem ser mantidos pelo menos dez metros de distância. Ajustar a descarga de coroa para atingir uma coroa estável com o mínimo de faíscas. Lentamente acenar o eletrodo aproximadamente 1/4 "acima de cada superfície de cerca de 20 segundos e logo em seguida trazer as superfícies tratadas em contato para formar um forte vínculo permanente antes de as superfícies de PDMS retornar ao seu estado nativo.
- Coloque o dispositivo sobre uma placa de metal, lugar num forno de fresco, definir o forno a 120 ° C, e cozer durante a noite para completar a ligação e para retornar o PDMS ao seu estado hidrofóbico original. 24 Durante este fermento de alta temperatura, tele superfície de vidro do canal também ser processado hidrofóbico devido à deposição de uma camada hidrofóbica fina sobre o vidro. Alternativamente, os revestimentos hidrofóbicos tais como Aquapel (PPG Industries) pode ser injectado nas portas fluídicos usando uma seringa de 1 mL e uma agulha de seringa 12. Cuidadosamente, mas firmemente injectar a Aquapel seguido por purga de ar para as portas fluídicos sem quebrar o vínculo PDMS ao vidro . Agressivamente repetir a purga de ar em todas as portas de entrada e saída, enquanto limpando qualquer Aquapel excesso, a fim de evitar quaisquer depósitos que podem entupir os canais de secagem.
2. Preparação da Amostra
- Prepara-se uma cultura de células de acordo com procedimentos estabelecidos para o seu tipo de célula escolhido. Para o dispositivo particular usado neste estudo, 8-15 uM partículas ou células devem adequadamente requisitar para encapsulamento. Tipos de células menores ou maiores podem exigir alterar as dimensões do canal de focagem para alcançar p Re adequada. Para o meresultados de demonstração Thod mostrados neste trabalho, 9,9 mM de poliestireno microesferas (G1000, Thermo Scientific) são utilizados como substitutos das células.
- Preparar a partícula aquosa ou suspensão de células através de agitação suave. Quando se utiliza células ou partículas de poliestireno, o controlo de concentração é essencial (ver Figura 4) para alcançar o encapsulamento ordenados ideal. Usando os dados anteriores 12 como um guia, calcular a célula desejado ou concentração de partículas com base no espaçamento trem ordenada e tamanho do canal de micro-como: uma célula ou partícula por esperados vezes trem longitudinais de espaçamento a concentração de canal na área de corte transversal. Se a concentração de estoque (1% w / w) é inadequado, aumentar a concentração (aqui a 1,5% w / w) suavemente por centrifugação da amostra banco de remoção de líquido sobrenadante, e re-suspensão das partículas por vórtice de mistura, ou mais suave mistura quando se utiliza células. Preparar um volume adequado de conta para o volume desejado e recolha para o tempo de execução associado com flow sintonia.
- Ambas as células e partículas de poliestireno têm um peso específico maior do que um. Apesar de não ser demonstrado neste protocolo, a longo prazo experiências com uma duração da ordem de vários minutos a horas, a flutuabilidade coincidir com a solução pela adição de um soluto tal como CaCl 2 para partículas ou OptiPrep (Sigma-Aldrich) para as células.
- Prepara-se uma amostra de 10 mL da fase contínua de óleo de fluorocarbono por mistura do óleo de fluorocarbono FC-40 (3M) e PFPE-PEG bloco tensioactivo de copolímero 25 (2,5% w / w) (Raindance Technologies) em um tubo de centrífuga de 15 mL. Alternativamente, o óleo mineral leve (Chemicals Processo PTI) pode ser utilizado com ABIL-EM surfactante 90 (2,5% w / w) (Evonik Goldschmidt Corporation).
3. Instalação Experimental
- Ligue o microscópio óptico invertido (Axio Observer, Zeiss) e câmera de alta velocidade (Phantom V310, Vision Research). Concentre-se e inspecionar os canais de tamancos e detritos por qualquer mover manualmente o dispositivo ouusando um microscópio de fase motorizado. Alguns fragmentos pequeno pode ser empurrado para fora quando o líquido flui através de. Para partículas grandes ou tamancos óbvias, selecione outro canal no dispositivo como detritos no canal de focagem pode degradar significativamente a qualidade ordenação. Note-se que obstruções pode muitas vezes ser removido sob fluxo pressionando firmemente na superfície PDMS acima da região afectada com uma pinça romba.
- Corte três pedaços de tubos de PVC (0,01 "ID/0.03" OD, Tygon) para a entrada aquoso, óleo de entrada e saída de emulsão. Para minimizar o volume morto, cortado apenas o suficiente para alcançar tubagem a partir das bombas de seringa para a platina do microscópio. Cortar as extremidades de tubos a um ângulo de 45 ° para facilitar a inserção em portos fluídicos.
- Use pinças para pressionar encaixar o tubo termina nas portas fluídicos perfurados no Passo 1 e pressione encaixar dois calibre 30 blunt-ponteira de aço inoxidável agulhas de seringa de aço (SmallParts) nas extremidades livres do aquosa respectivo e os tubos de alimentação de óleo (não necessário adesivo) . Colocar o tubo de saída para um r resíduoseservoir. Este tubo irá mais tarde ser movido para um reservatório de recolha.
- Mova o dispositivo ea tubulação em anexo ao estágio do microscópio, alinhar e focar o bico dispositivo usando um objetivo disponível (20x foi utilizado para este experimento). Ajustar para K hler iluminação e configurações microscópio outros, conforme necessário para uma excelente gravação.
- Encher uma seringa de 1 mL (BD) com a fase aquosa bem misturada e uma seringa de 3 ml (BD) com a solução de fase oleosa preparada no Passo 2. Observe que todas as seringas de qualquer volume pode ser usado e deve ser cuidadosamente selecionados em função dos tempos de execução desejados e minimização de qualquer pulsatilidade. Incline uma seringa na vertical e um ligeiro toque para mover as bolhas de ar à saída de seringa. Lentamente deprimir êmbolo suficiente para empurrar o ar para a ponta da seringa. Segurando a seringa na vertical, ligar as seringas para a agulha da seringa respectivo já ligado ao dispositivo no Passo 3,3. Deprimir êmbolo para forçar o ar através do volume morto agulha de seringa até que o fluido é pushed através da tubagem quase para o dispositivo. Firmemente montar a seringa a uma bomba de seringa (Nexus 3000, Chemyx) e envolver o bloco êmbolo. Repita as ligações para a segunda seringa e montar a uma bomba de seringa segundo.
- Potência em cada bomba de seringa e programa usando os protocolos do fabricante da bomba. Estabelecer as taxas de fluxo inicial de Q óleo = 50 uL / min e Q aq = 5 uL / min para a fase de óleo e fase aquosa, respectivamente. Iniciar as bombas.
- Espere para cada fluido para introduzir o dispositivo e preencher os canais, empurrando para fora o ar morto restante. Isso pode levar vários minutos. Se houver uma grande quantidade de ar na tubagem de entrada, aumentar temporariamente a cada taxa de fluxo até que o ar é expelido. Não aumente as taxas de fluxo tão alto que as pressões ocorrem grandes no canal, levando potencialmente a PDMS-para-vidro falha vínculo.
- Usando as taxas de fluxo inicial, observar a formação de gotas no bico (resultados mostrados aqui: 20x magnification, frame rate 21005 fps, exposição 3 mS). Reduzir o campo de vista da câmera para apenas o bocal para maximizar a taxa de frame e reduzir os requisitos de memória, se possível. Captura vídeos de amostra e confirmar que a taxa de amostragem é adequada para evitar aliasing.
- Para evitar a jacto (ver Figura 2), começar com baixas taxas de fluxo aquoso. Lentamente, aumentar a taxa de fluxo aquoso para observar ordenação de partículas no canal de solução aquosa de longo com o aumento da taxa de fluxo.
- Se a concentração de partículas é demasiado baixo para proporcionar comboios com relativamente poucos "em falta" partículas e da amostra não foi flutuabilidade encontrados, fisicamente inclinar a bomba de seringa para a saída da seringa para proporcionar gradual sedimentação de partículas para a saída de uma seringa. Este método é demonstrado no protocolo de vídeo. Periodicamente rotativo a seringa ao longo do seu eixo pode também reduzir a sedimentação indesejada.
- Uma vez ordenação adequada ocorre, ajustar a taxa de fluxo de óleo para sintonizar a frequência de geração etamanho de gotas. O volume da gota média pode ser calculado utilizando a taxa de fluxo aquoso dividido pela frequência geração gota como medido por captura de vídeo. Iterativamente ajustar as taxas de ambos os fluxos de atingir taxas de encapsulamento desejados e volumes de gota.
- Uma vez estável de encapsulação é confirmada ordenada, mover o tubo de saída a partir do reservatório de resíduos para um reservatório de recolha ou alimentá-lo em outro dispositivo para teste subsequente.
- Determinar o tempo de recolha com base no número desejado de gotículas e da frequência de geração calculada.
- Gravar a fracção de gotas contendo 0, 1, 2, ..., N partículas para quantificar a eficiência usando quer gota video resultados da produção ou por pipetagem de uma amostra de emulsão recolhidos para inspecção.
4. Os resultados representativos
Os resultados são apresentados que alcançar tanto controlada de partícula única e controlada de encapsulação de duplo de partícula (Figura 3). Ao cortara taxa de fluxo de FC-40 óleo em meia, uma única partícula de encapsulação torna-se dois-partícula de encapsulação. Por outro lado, poderíamos ter aumentado a taxa de fluxo aquoso para fornecer partículas para o bico mais rapidamente, mas também teria aumentado o risco de ejecção do fluxo aquoso. Histogramas da Figura 3 apresenta o número fraccionário de partículas por gota para os dois casos, juntamente com as comparações com estatística de Poisson. As gotas ocasionais com partículas de zero são principalmente devido à "faltando" partículas nos comboios ordenadas, enquanto que os casos em que existem partículas mais do que encapsulados resultado desejado a partir de locais altas concentrações de partículas e as partículas que, por vezes, migram para uma das duas posições verticais de focagem. Note-se que a flutuabilidade correspondente conforme descrito na Seção 2, não foi utilizado. Em vez disso, a bomba de seringa foi fisicamente inclinada para permitir sedimentação de partículas para a saída da seringa, levando a uma elevada concentração de partículas durante a corrida.
Uma execução experimental ilustra a necessidade de partícula adequada e as concentrações de células é mostrado na Figura 4. Sem ordenação completa, os grupos localizados de forma de partículas e são encapsulados, mas muitas gotas são sem partículas. Um histograma mostra a diminuição da eficiência de encapsulação para o encapsulamento de partícula desejado dois.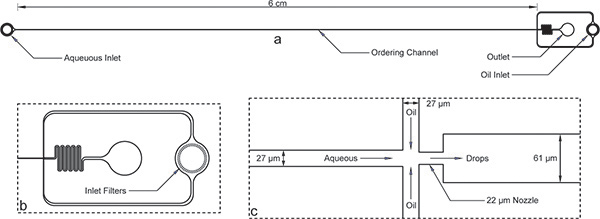
Figura 1. Dispositivo de encapsulamento. a) dispositivo geral com entradas, saída, e canal de ordenação muito tempo. A altura do dispositivo é de 52 mM ea largura do canal ordenação é de 27 mM. b) Tanto aquosa e as entradas de óleo têm filtros detritos grandes com aberturas do fim da largura do canal ordenar para o ponto de vista ampliada da entrada de óleo. c) A vista alargada do bico mostra larguras de canal iguais de 27 mm para os canais aquosos e óleo, seguido pela contracção do bocal de 22 uM e expansão súbita de um canal mais largo iM 61.Note-se que as dimensões do dispositivo mostrado aqui foram verificados utilizando um perfilómetro após microfabricação e diferem um pouco das dimensões nominais da máscara. A verdadeira imagem do canal de ordenação e bico estão disponíveis on-line como Suplementar Figura 1 . A máscara de arquivo AutoCAD também foi incluída on-line como um complemento a este manuscrito.

Figura 2. Histerese de um gotejamento para a transição de jacto usando um mais amplo do dispositivo (80 mM de largura x 22 uM alta). a) Para a taxa de FC-40 de fluxo constante (Q óleo = 45 uL / min), a formação de gota constante ocorre a 10 kHz utilizando uma solução aquosa caudal Q aq = 8 uL / min. Como a taxa de fluxo aquosa é lentamente aumentada para 10 e mu; L / min, ejecção do fluxo de fluido aquoso é disparado. b) Quando a taxa de fluxo é retornado a 8 mL / min de jacto continua. Note-se que a formação de gota constante pode ser re-estabelecido, por breves instantes parando a bomba de fluxo aquoso (uma pausa de 1 segundo é típico).
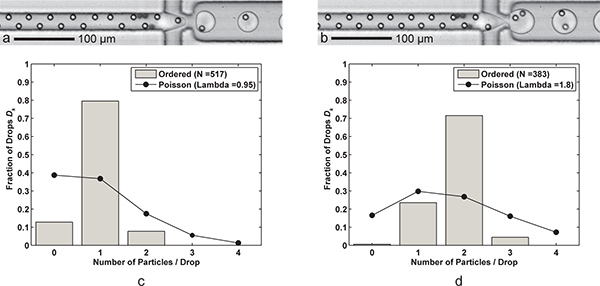
Figura 3. Encapsulação simples e dupla-partícula. Uma formação da gota) com uma célula por gota (Q óleo = 60 uL / min, Q aq = 9 mL / min) com uma taxa de geração de gota de 6,1 kHz, o tamanho médio de gota 24,4 pL, e uma eficiência de captura de uma única célula D k = 79,5% e P k = 83,7% (λ = 0,95) para um tamanho de amostra de n d = 517 gotas e n p = 491 partículas formação da gota. b) com duas células por gota é conseguido simplesmente por redução da FC-40 caudal de óleo Q para 30 μL / min. As maiores (39,8 pL) gotas são formados a uma taxa de 3,8 kHz com uma eficiência de captura de duas células D k = 71,5% e P k = 79,5% (λ = 1,80) para um tamanho de amostra de n D = 383 gotas e n p = 689 partículas. CD) Dois histogramas comparar as eficiências de encapsulação de queda de partículas de D k ordenou encapsulamento simples e duplo de partículas, com estatística de Poisson (encapsulamento aleatório). Note-se que para ambos os casos, o espaçamento de partícula na direcção do fluxo é de cerca de 17-18 mm para totalmente ordenadas, as partículas alternados. Vídeos Suplementares mostrando tanto o encapsulamento de um único e duplo-partícula estão disponíveis online. Clique aqui para ver 3 filmes complementares . Clique aqui para ver 3b filme Suplementares .

Concentração Figura 4. Afecta grandemente a eficiência de encapsulamento. A) Como as reduções de concentração, ordenação completa não ocorre, e assim "buracos" nos trens emergir, deixando algumas gotas com menos do que as partículas previstas. B) O histograma mostra a eficiência diminuiu ( D k = 55,9%, P k = 70,9%) para dois-partícula de encapsulação devido a um valor mais baixo de λ = 1,57, onde há quase a mesma quantidade de partículas de um único cai como existem duas vezes de partículas gotas. Isto resulta a partir de óleo figura Q = 30 uL / min e Q aq = 9 mL / min, as condições de escoamento mesmas para Figura 3b. Um vídeo representante suplementar está disponível online. Clique aqui para ver 4 Movie Suplementar .
Discussão
Apesar graus relativamente elevados de ordenação, nem todos os gotas conterá o número apropriado de partículas ou células. Eficiência de encapsulação pode ser calculada como o número de células ou partículas que ficam encapsulados em gotas com a ocupação desejado dividido pelo seu número total. Estes dados em bruto pode ser obtido quer a partir de um algoritmo de vídeo de alta velocidade automático ou de imagiologia de uma amostra de emulsão recolhida. Isto pode ser comparado com a fracção de par...
Divulgações
JE é um inventor em uma patente pendente baseado na tecnologia utilizada neste manuscrito.
Agradecimentos
Agradecemos Technologies Raindance para a amostra de PFPE-PEG surfactante utilizada neste estudo, e agradecemos a BioMEMS Resource Center (Mehmet Toner, diretor) para o molde de wafer de silício usado para criar réplicas dos canais de PDMS.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| AutoCAD | AutoDesk | ||
| Máscara de transparência | Fineline Imaging Inc. | ||
| SU-8 Photoresist | Microchem | 2050 | |
| Profilometer Dektak | Veeco | ||
| Placa de Petri | BD Falcon | 351058 | |
| PDMS Kit Elastômero de Silicone | A Dow Corning Corp | Sylgard 184, número de material (240) 4019862 | |
| Exsicador de vácuo | Jencons | 250-030 | |
| Bomba de vácuo | Alcatel Vacuum Technology | 2010 C2 | |
| Regulador de vácuo | Cole-Parmer | EW-00910-10 | |
| Forno | Thermo Scientific | Lindberg Blue M, OV800F | |
| Biópsia com punch, 0,75 mm | Harris | Uni-Core 15072 | |
| Laboratório de Corona Treater | Electro-Technic Products Inc. | BD-20AC, SKU 12051A | |
| Lâminas de vidro | Gold Seal | 3010 | |
| Aquapel | PPG Industries | Estratégia Alternativa | |
| Microesferas de poliestireno, 9,9 mM | Thermo | G1000 | |
| OptiPrep | Sigma-Aldrich | D1556 | Não demonstraram |
| Luer-Lok Seringas | BD | 1 mL: 309,628 3 mL: 309,585 | |
| FC-40 Óleo Fluorocarbon | 3M Inc. | Sigma Aldrich, F9755 | |
| PFPE-PEG fluorotensioactivo | Raindance Technologies | ||
| Óleo Mineral Luz | Processos Químicos PTI | 08042-47-5 | Estratégia Alternativa |
| Surfactante Óleo Mineral | Evonik Goldschmidt Corporação | ABIL EM 90 | Estratégia Alternativa |
| Tygon Tubing PVC | SmallParts | TGY-010 | |
| Calibre 30 Luer-Lok Seringa Agulha, 1/2 " | SmallParts | NE-301PL-C | |
| Microscópio invertido | Carl Zeiss imagem | Axio Observer.Z1 | |
| Câmera de alta velocidade | Vision Research | Fantasma V310 | |
| Bombas de seringa (2) | Chemyx Inc. | Nexus 3000 | |
| Óleo de silicone | A Dow Corning | 200 de fluido, a 10 cSt | Opcional para armazenamento de emulsão |
Referências
- Zagnoni, M., Lain, G. L. e., Cooper, J. M. Electrocoalescence mechanisms of microdroplets using localized electric fields in microfluidic channels. Langmuir : the ACS journal of surfaces and colloids. 26, 14443-14449 (2010).
- Niu, X. Z., Gielen, F., Edel, J. B., deMello, A. J. A microdroplet dilutor for high-throughput screening. Nat. Chem. 3, 437-442 (2011).
- Vincent, M. E., Liu, W., Haney, E. B., Ismagilov, R. F. Microfluidic stochastic confinement enhances analysis of rare cells by isolating cells and creating high density environments for control of diffusible signals. Chemical Society reviews. 39, 974-984 (2010).
- Huebner, A. Quantitative detection of protein expression in single cells using droplet microfluidics. Chemical communications. , 1218-1220 (2007).
- Love, J. C., Ronan, J. L., Grotenbreg, G. M., van der Veen, A. G., Ploegh, H. L. A microengraving method for rapid selection of single cells producing antigen-specific antibodies. Nature biotechnology. 24, 703-707 (2006).
- Bradshaw, E. M. Concurrent detection of secreted products from human lymphocytes by microengraving: Cytokines and antigen-reactive antibodies. Clin. Immunol. 129, 10-18 (2008).
- Liu, W. S., Kim, H. J., Lucchetta, E. M., Du, W. B., Ismagilov, R. F. Isolation, incubation, and parallel functional testing and identification by FISH of rare microbial single-copy cells from multi-species mixtures using the combination of chemistrode and stochastic confinement. Lab on a chip. 9, 2153-2162 (2009).
- Boedicker, J. Q., Li, L., Kline, T. R., Ismagilov, R. F. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics. Lab on a chip. 8, 1265-1272 (2008).
- Koster, S. Drop-based microfluidic devices for encapsulation of single cells. Lab on a chip. 8, 1110-1115 (2008).
- Kelly, R. T., Page, J. S., Marginean, I., Tang, K., Smith, R. D. Dilution-free analysis from picoliter droplets by nano-electrospray ionization mass spectrometry. Angew Chem. Int. Ed. Engl. 48, 6832-6835 (2009).
- Hong, J., deMello, A. J., Jayasinghe, S. N. Bio-electrospraying and droplet-based microfluidics: control of cell numbers within living residues. Biomedical materials. 5, 21001 (2010).
- Edd, J. F. Controlled encapsulation of single-cells into monodisperse picolitre drops. Lab on a chip. 8, 1262-1264 (2008).
- Anna, S. L., Bontoux, N., Stone, H. A. Formation of dispersions using "flow focusing" in microchannels. Applied Physics Letters. 82, 364 (2003).
- Utada, A., Fernandez-Nieves, A., Stone, H., Weitz, D. Dripping to Jetting Transitions in Coflowing Liquid Streams. Physical Review Letters. 99, (2007).
- Chabert, M., Viovy, J. L. Microfluidic high-throughput encapsulation and hydrodynamic self-sorting of single cells. Proceedings of the National Academy of Sciences of the United States of America. 105, 3191-3196 (2008).
- Segrí, G., Silberberg, A. Radial Particle Displacements in Poiseuille Flow of Suspensions. Nature. 189, 209-210 (1961).
- Carlo, D. D. i. Inertial microfluidics. Lab on a chip. 9, 3038-3046 (2009).
- Carlo, D. D. i., Edd, J., Humphry, K., Stone, H., Toner, M. Particle Segregation and Dynamics in Confined Flows. Physical Review Letters. 102, (2009).
- Humphry, K. J., Kulkarni, P. M., Weitz, D. A., Morris, J. F., Stone, H. A. Axial and lateral particle ordering in finite Reynolds number channel flows. Physics of Fluids. 22, 081703 (2010).
- Lee, W., Amini, H., Stone, H. A., Carlo, D. D. i. Dynamic self-assembly and control of microfluidic particle crystals. Proceedings of the National Academy of Sciences of the United States of America. 107, 22413 (2010).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane. Anal. Chem. 70, 4974-4984 (1998).
- Kotz, K., Cheng, X., Toner, M. PDMS Device Fabrication and Surface Modification. J. Vis. Exp. (8), e319 (2007).
- Haubert, K., Drier, T., Beebe, D. PDMS bonding by means of a portable, low-cost corona system. Lab on a chip. 6, 1548-1549 (2006).
- Hatch, A. C. 1-Million droplet array with wide-field fluorescence imaging for digital PCR. Lab on a chip. , 3838-3845 (2011).
- Holtze, C. Biocompatible surfactants for water-in-fluorocarbon emulsions. Lab on a chip. 8, 1632-1639 (2008).
- Garstecki, P., Stone, H., Whitesides, G. Mechanism for Flow-Rate Controlled Breakup in Confined Geometries: A Route to Monodisperse Emulsions. Physical Review Letters. 94, (2005).
- Garstecki, P., Fuerstman, M. J., Stone, H. A., Whitesides, G. M. Formation of droplets and bubbles in a microfluidic T-junction-scaling and mechanism of break-up. Lab on a chip. 6, 437-446 (2006).
- Nie, Z. Emulsification in a microfluidic flow-focusing device: effect of the viscosities of the liquids. Microfluidics and Nanofluidics. , (2008).
- Holt, D. J., Payne, R. J., Chow, W. Y., Abell, C. Fluorosurfactants for microdroplets: interfacial tension analysis. Journal of colloid and interface science. 350, 205-211 (2010).
- Holt, D. J., Payne, R. J., Abell, C. Synthesis of novel fluorous surfactants for microdroplet stabilisation in fluorous oil streams. Journal of Fluorine Chemistry. 131, 398-407 (2010).
- Hatch, A. C., Fisher, J. S., Pentoney, S. L., Yang, D. L., Lee, A. P. Tunable 3D droplet self-assembly for ultra-high-density digital micro-reactor arrays. Lab on a chip. 11, 2509-2517 (2011).
- Baret, J. C. Surfactants in droplet-based microfluidics. Lab on a chip. 12, 422-433 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados