JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
높은 처리량 마이크로 캡슐 단일 셀 및 다중 셀
요약
세포 및 입자의 관성 주문과 monodisperse 드롭 생성을 결합하여, 우리는 kHz에서 속도에서 한 방울의 세포 또는 입자의 원하는 숫자를 캡슐하는 방법을 설명합니다. 우리는 두 번 단일 및 이중 입자 술을 정렬되지 않은 캡슐 분들을 초과 효율성을 보여줍니다.
초록
Microfluidic encapsulation methods have been previously utilized to capture cells in picoliter-scale aqueous, monodisperse drops, providing confinement from a bulk fluid environment with applications in high throughput screening, cytometry, and mass spectrometry. We describe a method to not only encapsulate single cells, but to repeatedly capture a set number of cells (here we demonstrate one- and two-cell encapsulation) to study both isolation and the interactions between cells in groups of controlled sizes. By combining drop generation techniques with cell and particle ordering, we demonstrate controlled encapsulation of cell-sized particles for efficient, continuous encapsulation. Using an aqueous particle suspension and immiscible fluorocarbon oil, we generate aqueous drops in oil with a flow focusing nozzle. The aqueous flow rate is sufficiently high to create ordering of particles which reach the nozzle at integer multiple frequencies of the drop generation frequency, encapsulating a controlled number of cells in each drop. For representative results, 9.9 μm polystyrene particles are used as cell surrogates. This study shows a single-particle encapsulation efficiency Pk=1 of 83.7% and a double-particle encapsulation efficiency Pk=2 of 79.5% as compared to their respective Poisson efficiencies of 39.3% and 33.3%, respectively. The effect of consistent cell and particle concentration is demonstrated to be of major importance for efficient encapsulation, and dripping to jetting transitions are also addressed.
Introduction
Continuous media aqueous cell suspensions share a common fluid environment which allows cells to interact in parallel and also homogenizes the effects of specific cells in measurements from the media. High-throughput encapsulation of cells into picoliter-scale drops confines the samples to protect drops from cross-contamination, enable a measure of cellular diversity within samples, prevent dilution of reagents and expressed biomarkers, and amplify signals from bioreactor products. Drops also provide the ability to re-merge drops into larger aqueous samples or with other drops for intercellular signaling studies.1,2 The reduction in dilution implies stronger detection signals for higher accuracy measurements as well as the ability to reduce potentially costly sample and reagent volumes.3 Encapsulation of cells in drops has been utilized to improve detection of protein expression,4 antibodies,5,6 enzymes,7 and metabolic activity8 for high throughput screening, and could be used to improve high throughput cytometry.9 Additional studies present applications in bio-electrospraying of cell containing drops for mass spectrometry10 and targeted surface cell coatings.11 Some applications, however, have been limited by the lack of ability to control the number of cells encapsulated in drops. Here we present a method of ordered encapsulation12 which increases the demonstrated encapsulation efficiencies for one and two cells and may be extrapolated for encapsulation of a larger number of cells.
To achieve monodisperse drop generation, microfluidic "flow focusing" enables the creation of controllable-size drops of one fluid (an aqueous cell mixture) within another (a continuous oil phase) by using a nozzle at which the streams converge.13 For a given nozzle geometry, the drop generation frequency f and drop size can be altered by adjusting oil and aqueous flow rates Qoil and Qaq. As the flow rates increase, the flows may transition from drop generation to unstable jetting of aqueous fluid from the nozzle.14
When the aqueous solution contains suspended particles, particles become encapsulated and isolated from one another at the nozzle. For drop generation using a randomly distributed aqueous cell suspension, the average fraction of drops Dk containing k cells is dictated by Poisson statistics, where Dk = λk exp(-λ)/(k!) and λ is the average number of cells per drop. The fraction of cells which end up in the "correctly" encapsulated drops is calculated using Pk = (k x Dk)/Σ(k' x Dk'). The subtle difference between the two metrics is that Dk relates to the utilization of aqueous fluid and the amount of drop sorting that must be completed following encapsulation, and Pk relates to the utilization of the cell sample. As an example, one could use a dilute cell suspension (low λ) to encapsulate drops where most drops containing cells would contain just one cell. While the efficiency metric Pk would be high, the majority of drops would be empty (low Dk), thus requiring a sorting mechanism to remove empty drops, also reducing throughput.15
Combining drop generation with inertial ordering provides the ability to encapsulate drops with more predictable numbers of cells per drop and higher throughputs than random encapsulation. Inertial focusing was first discovered by Segre and Silberberg16 and refers to the tendency of finite-sized particles to migrate to lateral equilibrium positions in channel flow. Inertial ordering refers to the tendency of the particles and cells to passively organize into equally spaced, staggered, constant velocity trains. Both focusing and ordering require sufficiently high flow rates (high Reynolds number) and particle sizes (high Particle Reynolds number).17,18 Here, the Reynolds number Re =uDh/ν and particle Reynolds number Rep =Re(a/Dh)2, where u is a characteristic flow velocity, Dh [=2wh/(w+h)] is the hydraulic diameter, ν is the kinematic viscosity, a is the particle diameter, w is the channel width, and h is the channel height. Empirically, the length required to achieve fully ordered trains decreases as Re and Rep increase. Note that the high Re and Rep requirements (for this study on the order of 5 and 0.5, respectively) may conflict with the need to keep aqueous flow rates low to avoid jetting at the drop generation nozzle. Additionally, high flow rates lead to higher shear stresses on cells, which are not addressed in this protocol. The previous ordered encapsulation study demonstrated that over 90% of singly encapsulated HL60 cells under similar flow conditions to those in this study maintained cell membrane integrity.12 However, the effect of the magnitude and time scales of shear stresses will need to be carefully considered when extrapolating to different cell types and flow parameters. The overlapping of the cell ordering, drop generation, and cell viability aqueous flow rate constraints provides an ideal operational regime for controlled encapsulation of single and multiple cells.
Because very few studies address inter-particle train spacing,19,20 determining the spacing is most easily done empirically and will depend on channel geometry, flow rate, particle size, and particle concentration. Nonetheless, the equal lateral spacing between trains implies that cells arrive at predictable, consistent time intervals. When drop generation occurs at the same rate at which ordered cells arrive at the nozzle, the cells become encapsulated within the drop in a controlled manner. This technique has been utilized to encapsulate single cells with throughputs on the order of 15 kHz,12 a significant improvement over previous studies reporting encapsulation rates on the order of 60-160 Hz.4,15 In the controlled encapsulation work, over 80% of drops contained one and only one cell, a significant efficiency improvement over Poisson (random) statistics, which predicts less than 40% efficiency on average.12
In previous controlled encapsulation work,12 the average number of particles per drop λ was tuned to provide single-cell encapsulation. We hypothesize that through tuning of flow rates, we can efficiently encapsulate any number of cells per drop when λ is equal or close to the number of desired cells per drop. While single-cell encapsulation is valuable in determining individual cell responses from stimuli, multiple-cell encapsulation provides information relating to the interaction of controlled numbers and types of cells. Here we present a protocol, representative results using polystyrene microspheres, and discussion for controlled encapsulation of multiple cells using a passive inertial ordering channel and drop generation nozzle.
프로토콜
이 섹션의 프로토콜 제시 실험 결과를 얻기 위해 특별히 활용 자재 및 장비를 설명합니다. 화학 물질 및 장비의 대체 공급 업체가 활용할 수 있습니다.
1. 장치 제조 및 소프트 리소그래피
표준 소프트 리소그래피 기법, 21 이전 주피터 문서에 등장되어있는 다수의, 22는 유리 기판에 보세 polydimethylsiloxane (PDMS) microchannel 네트워크를 만드는 데 사용되었습니다. 이외 SU-8 석판술에 의한 마스터 복제 금형 제조에서 공정 클린룸 또는 클린 후드 밖으로 수행될 수 있지만, 먼지와 입자는 아직 일관된 결과를 달성하기 위해 최소화되어야합니다.
- 의 AutoCAD (오토 데스크 주식 회사)의 그림 1에서와 같이 마이크로 채널 패턴을 디자인합니다. 높은 해상도 (50,000 dpi의) 트랜스를 인쇄하여 타사 제조 업체 (Fineline 이미징 주식 회사) 채용채널은 어두운 배경에 투명 Mylar 필름이나 석영에 parency 마스크.
- 복제 성형을위한 실리콘과 SU-8 레지스트 마스터를 만듭니다. 간단히, 회전 SU-8 2050 깨끗한 7.5 cm 또는 10cm의 실리콘 웨이퍼에서 52 μm의 두께의 레이어를 만드는 스핀 - coater에 대한 제조 업체의 권장 RPM과 (MicroChem) 부정적인 포토 레지스트. 이후 소프트 베이킹, 에지 비드 제거, 연락처 마스크, 사후 노출 베이킹, 개발 및 홍수 노출, Dektak의 profilometer (Veeco)를 사용하여 SU-8 레이어의 실제 두께를 측정을 통해 자외선 노출. 테이프 4 "또는 5"배양 접시의 바닥쪽으로 마스터 몰드는 PDMS 복제 성형을 준비합니다.
- 경화 요원에 10시 1분 비율 w / W 기반의 엘라스토머 경화 에이전트 (다우 코닝)와 믹스 PDMS 엘라스토머 기지이다. 2~3mm 최종 두께 레이어를 만드는 실리콘 마스터에 잘 혼합 PDMS 전구체 하거라. 2g의 경화 에이전트와 20g 엘라스토머 기지의 혼합물은 4 "직경이 표면을 커버하기에 충분합니다.
- maste를 배치드 가스 uncured PDMS로 진공 건조기에서 R 금형 및 PDMS (Jencons). 압력 레귤레이터 (콜 Parmer)을 사용하면 천천히 과도한 거품을 피하기 ~ 20 분 동안 HG "-27으로 HG"0에서 챔버 게이지 압력을 줄이십시오. 공기 거품이 사라질 때까지 30 분 또는 -27 "HG에서 진공 챔버에서 장치를 둡니다.
- 진공 풀어 65 ° 4 시간 최소 C 오븐 (써모 과학).로 마스터 몰드와 PDMS를 이동 장치는 경화를 개선하기 하룻밤 오븐에 남아있을 수 있습니다.
- 오븐에서 장치를 제거하고 냉각 수 있습니다. 조심스럽게 PDMS 아웃 정밀 나이프와 껍질을 사용하여 원형 웨이퍼 주변 PDMS를 잘라. 메스로 그림 1과 같이 장치 개요를 잘라 버릴거야.
- 생검 펀치를 사용하여 그림 1에 표시된 세 개의 둥근 지역의 펀치 유체 포트 (장치 지당 3). 이 장치의 경우 0.75 mm 외경 펀치 (해리스)을 사용합니다.
- 를 제거 PDMS와 껍질의 패턴 측면에 스카치 테이프를 부착먼지. 기존의 산소 플라즈마 apparatuses에 대한 비용 절감하지만, 대안으로 21,22 플라즈마는 휴대용 실험실 코로나 treater (전기 기술 제품 INC를 사용하여 PDMS와 깨끗한 3 "X 1"유리 현미경 슬라이드의 패턴 측면을 취급 ..) 23이 장치는 퓸 후드 또는 오존 방전에 의한 환기가 잘되는 장소에서 사용되어야한다는 것을 참고, 모든 시계와 휴대 전화는 적어도 10 피트 정도 떨어져 보관해야합니다. 최소한이 sparking과 함께 안정적인 코로나을 달성하는 데 코로나 방전을 조정합니다. 천천히 약 20 초 동안 각각의 표면 위에 "4분의 1에 대한 전극을 흔들 후 즉시 PDMS 표면들이 기본 상태로 돌아가려면 이전에 강력한 영구적인 유대를 형성하기 위해 접촉하게 대우 표면을 가지고.
- 금속 접시에 장치를 놓고, 시원한 오븐에 곳이, 120 ° C로 오븐을 설정하고 결합을 완료하고이 고온 베이킹, T 중에는 원래 소수성 상태. 24 PDMS를 반환하기 위해 하룻밤 구워그 채널의 유리 표면도 유리쪽으로 얇은 소수성 층의 증착에 의한 소수성 렌더링됩니다. 또는, 그러한 Aquapel (PPG 산업)와 같은 소수성 코팅은 12 신중하게. 1 ML의 주사기와 주사기 바늘을 사용하여 유체 포트에 주입 수 있지만 단단히 유리 결합으로 PDMS 한방울 흘리지 않고 유체 포트에 공기를 정화하여 다음 Aquapel 투입 . 건조시 채널을 방해할 수있는 예금을 방지하기 위해 초과 Aquapel을 닦아 주네하면서 적극적으로 모든 유입구와 배출구 포트에서 공기 퍼지를 반복하십시오.
2. 샘플 준비
- 선택한 셀 유형에 대한 설립 절차에 따라 세포 배양을 준비합니다. 본 연구에 사용된 특정 장치의 경우, 8-15 μm의 입자 또는 세포가 적절하게 캡슐을 위해 주문해야합니다. 작게 또는 더 큰 세포 유형은 적절한 재의 P를 달성하는 주력 채널의 크기를 변경해야 할 수도 있습니다. 날 위해서thod 시범 결과를 본 논문에 나타난, 9.9 μm의 폴리스티렌 microspheres은 (G1000, 써모 과학) 세포 美, 대리모로 활용됩니다.
- 부드러운 혼합을 통해 수성 입자 또는 세포 현탁액을 준비합니다. 셀 또는 폴리스티렌 입자를 사용하는 경우, 농도 제어 이상 주문 캡슐을 달성하기 위해 (그림 4 참조) 필수적입니다. 이전의 데이터를 12 가이드로 사용하기 주문 열차 간격 및 마이크로 채널 크기에 따라 원하는 셀 또는 입자 농도를 계산 등 : 한 셀 또는 예상되는 길이 방향 열차 간격 시간에 초점을 맞추고 채널 단면적 당 입자. 주식 농도 (1 % w / w)이 불충 분한 경우, 부드럽게 혼합 혼합, 또는 gentler 와동에 의해 입자를, 주식 샘플을 centrifuging 뜨는 액체를 제거하고 다시 정지하여 (여기서는 1.5 % w / W까지) 농도를 증가 세포를 사용할 때. 원하는 수거 량과 FL과 관련된 런타임에 대한 계정에 충분한 볼륨을 준비오우, 튜닝.
- 셀 및 폴리스티렌 입자는 모두 하나 이상의 비중 있습니다. 이 프로토콜에서 입증되지 않지만, 시간 많은 분 순서에 지속되는 장기간의 실험, 부력은 세포에 대한 입자 또는 OptiPrep (시그마 - 올드 리치)에 대한 같은 CaCl 2에 용질을 추가하여 솔루션을 일치합니다.
- 15 ML의 원심 관에 플루오로 카본 오일 FC-40 (3M)와 PFPE-PEG 블록 공중 합체 계면 활성제 25 (2.5 % W / W) (레인 댄스 기술)를 혼합하여 지속 플루오로 카본 오일 단계의 10 ML 샘플을 준비합니다. 또는 가벼운 미네랄 오일 (PTI 공정 화학)는 아빌-EM 90 계면 활성제 (2.5 % W / W) (Evonik Goldschmidt 공사)와 함께 활용하실 수 있습니다.
3. 실험 설정
- 거꾸로 광학 현미경 (Axio 옵저버, 자이스 혈구)와 고속 카메라 (팬텀 V310, 비전 연구)의 전원을 켜십시오. 또는 수동 장치를 이동하여 나막신과 파편을위한 채널을 집중하고 검사동력 현미경 스테이지를 사용하여. 액체가 흐르는 경우 일부 작은 파편이 밖으로 밀려 수 있습니다. 초점 채널의 파편 크게 품질을 주문 저하될 수 있으므로 큰 파편이나 명백한 나막신 내용은 장치에 다른 채널을 선택합니다. 나막신이 자주 무딘 핀셋으로 영향을받는 영역 위에 PDMS 표면에 단단히 눌러 흐름 하에서 제거할 수 있습니다.
- 세 수성 유입을위한 PVC 튜브의 길이 (0.01 "ID/0.03"OD, Tygon), 기름 유입, 그리고 유제 콘센트를 자르고. 죽은 부피를 최소화하려면 충분한 튜브가 주사기 펌프에서 현미경 단계에 도달하는 했네요. 유체 포트에 삽입을 용이하게하기 위해 45 ° 각도로 튜브 엔드를 자르고.
- 튜브는 1 단계에서 찍었다고 유체 포트에 끝나는 맞는 찍어서 각각 수성과 오일 유입 튜브 (아무 접착제 필요)의 자유로운 끝을 둘이 30 게이지 야기한 팁 스테인레스 스틸 주사기 바늘을 (SmallParts)에 맞게 눌러 핀셋을 사용하여 . 폐기물 R에 아울렛 튜브를 삽입eservoir. 이 튜브는 나중에 회수 저수지로 이동됩니다.
- , 현미경의 무대 장치와 연결된 튜브를 이동 정렬과 가능한 목표를 (20x이 실험에 사용되었다)를 사용하여 장치의 노즐에 초점. 등 최적의 레코딩에 필요한 K hler 조명 및 기타 현미경 설정을위한 조정합니다.
- 2 단계에서 준비 석유 위상 솔루션을 잘 혼합 수성 단계와 3 ML의 주사기 (BD)와 함께 1 ML의 주사기 (BD)를 입력합니다. 어떤 볼륨의 주사기 사용할 수있다는 조심스럽게 원하는 실행 시간 및 pulsatility의 최소화에 따라 선택해야합니다. 세로로 한 주사기를 기울이고 주사기 콘센트에 공기 방울을 이동 동요. 천천히 주사기 끝에 공기를 밀어 정도로 플런저를 우울하게. 주사기를 개최하는 것은 세로, 이미 단계 3.3에 장치에 연결된 각각의 주사기 바늘에 주사기를 연결합니다. 유체가 P까지 주사기 바늘 죽은 볼륨을 통해 공기를 강제로 플런저를 낮춰거의 장치에 튜브를 통해 ushed. 안전 주사기 펌프 (넥서스 3000, Chemyx)에 주사기를 탑재하고 플런저 블록을 참여. 두 번째 주사기에 대한 연결을 반복하고 두 번째 주사기 펌프를 탑재합니다.
- 각각의 주사기 펌프 및 펌프 제조 업체의 프로토콜을 사용하여 프로그램에 전원. Q 기름에 초기 유량을 설정 = 50 μL / 분 및 Q AQ = 5 μL / 각각 석유 단계와 수성 단계를위한 분. 펌프를 시작합니다.
- 나머지 죽은 공기를 밖으로 밀어내는, 장치를 입력하고 채널을 채우기 위해 각 유체 기다립니다. 이것은 몇 분 정도 걸릴 수 있습니다. 입구 관에 공기의 다량이있다면 공기는 퇴학 때까지 일시적으로 각각의 유동 율을 향상시킬 수 있습니다. 잠재적으로 PDMS - 투 - 유리 채권 실패로 이어지는, 채널에 큰 압력이 발생되도록 높은 흐름 율을 증가하지 마십시오.
- 초기 흐름 속도를 사용하여 노즐에서 드랍스의 형성을 관찰 (결과가 여기에 표시 : 20x magnificatio를N, 프레임 속도 21,005 프레임, 노출 3 μs). 프레임 속도를 극대화하고 가능하면 메모리 요구 사항을 줄이기 위해 전용 노즐로보기의 카메라 필드를 줄입니다. 샘플 동영상을 캡처하여 샘플링 속도가 앨리어싱을 피하기 위해 적절한 있는지 확인합니다.
- (그림 2 참조) 제트 피하기 위해 낮은 수성 유동 률로 시작합니다. 천천히 유량 증가 긴 수용액 채널에서 입자의 순서 관찰하는 수성 흐름 속도를 향상시킬 수 있습니다.
- 입자 농도가 상대적으로 적은 "누락"입자와 샘플은 부력이 일치되지 않았습니다 함께 기차를 제공할 너무 낮으면 물리적으로 주사기 콘센트 방향으로 입자의 정착 점진적 제공하기 위해 주사기 콘센트쪽으로 주사기 펌프를 기울. 이 방법은 비디오 프로토콜에서 시연된다. 주기적으로 그 축을 따라 주사기를 회전하면 원치 않는 정착을 줄일 수 있습니다.
- 적절한 주문이 발생하면, 세대 주파수를 조정하는 오일 유량을 조절하고안약 사이즈. 평균 드롭 볼륨이 같은 비디오 캡처로 측정 드롭 생성 주파수로 나눈 수성 유속을 사용하여 계산됩니다. Iteratively 원하는 캡슐 속도와 드롭 볼륨을 달성하기 위해 유속을 모두 조정할 수 있습니다.
- 일단 안정 주문한 캡슐이 확정되고, 컬렉션 저수지로 폐기물 저수지에서 아울렛 튜브를 움직이거나 후속 테스트를 위해 다른 장치로 그것을 먹이.
- 방울의 원하는 번호와 계산 세대 주파수에 따라 수집 시간을 결정합니다.
- 또는 검사 수집 에멀젼 샘플을 pipetting하여 드롭 생성 비디오 결과 중 하나를 사용하여 효율성을 계량하기 위해 0, 1, 2, ..., N 입자가 들어있는 안약 분수를 기록합니다.
4. 대표 결과
결과는 모두 제어 단일 입자 및 제어 이중 입자 캡슐화 (그림 3)을 달성하는 제공됩니다. 절단에 의한반으로 FC-40 오일 유량은 단일 입자 캡슐은 두 입자의 캡슐이됩니다. 반대로, 우리는 더 빨리 노즐로 입자를 제공하는 수성 유량 증가했을 수 있겠지만 우리는 수성 스트림 제트의 위험을 증가 것입니다. 그림 3에서 Histograms는 Poisson 통계에 대한 비교와 함께 두 가지 경우를 드롭 당 입자의 소수점 숫자를 제시. 제로 입자와 가끔 물방울 주로 주문한 열차에서 "누락된"입자로 인해, 지방 높은 입자 농도와 때로는 두 개의 수직 초점 순위 중 하나으로 마이 그 레이션 입자에서 원하는 결과를보다 캡슐 입자가 가지 경우 잠시. 제 2의 설명에 따라 일치하는 그 부력이 활용되지 않습니다. 대신, 주사기 펌프는 물리적으로 실행하는 동안 입자의 높은 농도로 이어지는, 주사기 콘센트 방향으로 입자의 정착하도록 기울어져되었다.
적절한 입자 및 세포 농도의 필요성을 보여주는 실험적인 실행은 그림 4에 표시됩니다. 전체 주문없이 지역화된 입자의 명령 그룹과이 캡슐하고 있지만 많은 물방울 입자 않고 있습니다. 히스토그램 원하는 두 입자의 캡슐에 대한 감소 캡슐 효율을 보여줍니다.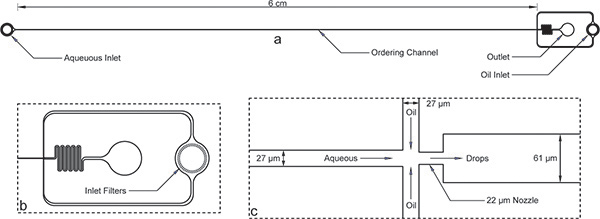
1. 봉지 장치를 그림. inlets, 아울렛, 그리고 긴 주문 채널) 전체 장치. 장치 높이가 52 μm의하며 주문 채널 폭 27 μm의입니다. B) 수성 및 석유 inlets 모두 오일 입구의 확대를위한 주문 채널 너비의 순서에 차이가있는 대형 파편 필터를합니다. C) 확대 노즐보기 22 μm의와 넓은 61 μm의 채널로 갑자기 팽창 노즐 수축에 의해 나타나는 수성 기름 채널, 27 μm의 동등한 채널 폭을 보여줍니다.여기에 표시된 장치의 크기가 microfabrication 후 profilometer를 사용하여 확인되었음을 참고 마스크의 공칭 치수가 약간 다릅니다. 주문 채널 및 노즐의 진정한 이미지로 온라인에서 사용할 수있는 보충 그림 1 . 의 AutoCAD 마스크 파일 도이 원고에 대한 보완으로서 온라인으로 포함되었습니다.

그림 2. 넓은 장치 (80 μm의 x 세로 22 μm의 높이)를 사용 제팅 전환에 물떨어지는의 히스테리 시스. ) 상수 FC-40 유속에서 (Q 오일 = 45 μL / 분), 꾸준한 드롭 형성은 수성 흐름 속도 Q AQ = 8 μL / 분을 사용하여 10 kHz에서에서 발생합니다. 수성 유속이 느리게 10 & M로 증가되면서U; 수성 유체 흐름의 제트 L / 분가 트리거됩니다. 나) 유량은 8 μL / 계속을 제팅 분에 반환하는 경우. 꾸준한 방울 형성이 간략 수성 흐름 펌프 (일초 일시 전형이다) 일시 중지하여 다시 설정할 수 있습니다.
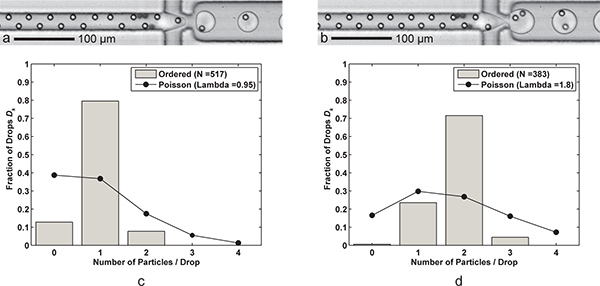
그림 3. 단일 및 이중 입자 캡슐. 드롭 당 하나의 세포 (와) 드롭 형성 Q 오일 = 60 μL / 분, Q AQ = 6.1 kHz에서 한 방울 생성 속도, 평균 방울 크기와 9 μL / 분) 24.4 PL, 그리고 단일 셀 캡쳐 효율성 두 개는 함께 D K = 79.5 % 및 P K = n의 샘플 크기에 83.7 % (λ = 0.95) D = 517 드랍스와 N P = 491 입자. 나) 드롭 형성 드롭 30 μ에 FC-40 유량 Q 오일을 줄임으로써 간단히 이루어진다L / 분. 대형 (39.8 PL) 방울 두 세포 캡처 효율 3.8 kHz에서의 속도로 형성되는 D K = 71.5 % 및 P k는 = 79.5 % (λ = 1.80) n의 샘플 크기에 D = 383 드랍스와 N P는 = 689 입자. CD) 두 histograms가 드롭 캡슐 입자 효율성 Poisson 통계 (무작위 캡슐)에 주문 단일 및 이중 입자 캡슐의 D K를 비교합니다. 두 경우 모두에 대해, 흐름의 방향으로 입자 간격을 완벽하게 주문, 번갈아 입자 17-18 대한 μm의 것이 있습니다. 모두 단일 및 이중 입자 캡슐을 보여주는 보충 동영상이 온라인 사용할 수 있습니다. 보충 영화 3a를 보려면 여기를 누르십시오 . 보충 영화 3B를 보려면 여기를 클릭하십시오 .

그림 4. 농도가 크게 농도 감소로)는, 전체 주문이 발생하지 않습니다. 캡슐의 효율성에 영향을, 그리고 열차에 따라서 "구멍"은 예상 입자 미만으로 몇 방울을 떠나 등장. B) 히스토그램이 줄어들고 효율성 (보여줍니다 D K = 이중 입자 드랍스가있는만큼 많은 단일 입자가 = 1.57가 drops λ의 낮은 값으로 인해 두 입자 캡슐에 대해 55.9 %, P K = 70.9 %). Q 오일에서이 수치 결과 = 30 μL / 분 및 Q AQ = 9 μL / 분, 그림 3B와 동일 유량 조건입니다. 대표 보완 동영상을 온라인으로보실 수 있습니다. 보충 무비 4를 보려면 여기를 클릭하십시오 .
토론
주문 상대적으로 높은 학위에도 불구하고, 모든 물방울 입자 또는 세포의 적절한 숫자를 포함합니다. 봉지 효율은 세포 또는 그 총 개수로 나눈 원하는 인과 드랍스에 캡슐된다 입자의 개수로 계산됩니다. 이러한 원시 데이터가 수집 유제의 견본 자동화된 고속의 비디오 알고리즘이나 이미지에서 어느 얻을 수있다. 이것은 K 입자와 K 입자를 포함하는 것입니다 드랍스 D K의 분수를 ...
공개
JE는이 원고에 활용 기술을 바탕으로 대기중인 특허의 발명가이다.
감사의 말
우리는이 연구에서 널리 사용 PFPE-PEG 계면 활성제의 샘플 레인 댄스 기술 감사, 우리는 PDMS 채널 복제본을 만드는 데 사용되는 실리콘 웨이퍼 금형을위한 BioMEMS 자원 센터 (Mehmet 토너, 감독)을 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 |
| 의 AutoCAD | 오토 데스크 | ||
| 투명 마스크 | Fineline 이미징 주식 회사 | ||
| SU-8 레지스트 | MicroChem | 2050 | |
| Dektak의 Profilometer | Veeco | ||
| 페트리 요리 | BD 팔콘 | 351,058 | |
| PDMS 실리콘 엘라스토머 키트 | 다우 코닝 주식 회사 | Sylgard 184, 자재 번호 (241) 4019862 | |
| 진공 건조기 | Jencons | 250-030 | |
| 배기기 | 알카텔 진공 기술 | 2010 C2 | |
| 진공 레귤레이터 | 콜 - Parmer | EW-00910-10 | |
| 오븐 | 써모 과학 | 린드버그 블루 M, OV800F | |
| 생검 펀치, 0.75 mm | 해리스 | 단일 코어 15,072 | |
| 실험실 코로나 Treater | 전기 제품 기술 주식 회사 | BD-20AC, SKU 12051A | |
| 유리 슬라이드 | 골드 인감 | 3010 | |
| Aquapel | PPG 산업 | 대체 전략 | |
| 폴리스티렌 Microspheres, 9.9 μm의 | 써모 | G1000 | |
| OptiPrep | 시그마 - 올드 리치 | D1556 | 입증되지 않음 |
| Luer-Lok의 주사기 | BD | 한 ML : 309,628 3 ML : 309,585 | |
| FC-40 플루오로 카본 오일 | 3M 주식 회사 | 시그마 알드리치, F9755 | |
| PFPE-PEG의 불화 계면 활성제 | 레인 댄스 기술 | ||
| 가벼운 미네랄 오일 | PTI 프로세스 케미칼 | 08042-47-5 | 대체 전략 |
| 미네랄 오일 계면 활성제 | Evonik Goldschmidt 주식 회사 | 아빌 EM 90 | 대체 전략 |
| Tygon PVC 튜빙 | SmallParts | TGY-010 | |
| 30 게이지 Luer-Lok 주사기 바늘, 1 / 2 " | SmallParts | NE-301PL-C | |
| 거꾸로 현미경 | 칼 자이스 혈구 이미징 | Axio Observer.Z1 | |
| 고속 카메라 | 비전 연구 | 팬텀 V310 | |
| 주사기 펌프 (2) | Chemyx 주식 회사 | 넥서스 3000 | |
| 실리콘 오일 | 다우 코닝 | 200 유체, 10 CST | 에멀젼 저장을위한 옵션 |
참고문헌
- Zagnoni, M., Lain, G. L. e., Cooper, J. M. Electrocoalescence mechanisms of microdroplets using localized electric fields in microfluidic channels. Langmuir : the ACS journal of surfaces and colloids. 26, 14443-14449 (2010).
- Niu, X. Z., Gielen, F., Edel, J. B., deMello, A. J. A microdroplet dilutor for high-throughput screening. Nat. Chem. 3, 437-442 (2011).
- Vincent, M. E., Liu, W., Haney, E. B., Ismagilov, R. F. Microfluidic stochastic confinement enhances analysis of rare cells by isolating cells and creating high density environments for control of diffusible signals. Chemical Society reviews. 39, 974-984 (2010).
- Huebner, A. Quantitative detection of protein expression in single cells using droplet microfluidics. Chemical communications. , 1218-1220 (2007).
- Love, J. C., Ronan, J. L., Grotenbreg, G. M., van der Veen, A. G., Ploegh, H. L. A microengraving method for rapid selection of single cells producing antigen-specific antibodies. Nature biotechnology. 24, 703-707 (2006).
- Bradshaw, E. M. Concurrent detection of secreted products from human lymphocytes by microengraving: Cytokines and antigen-reactive antibodies. Clin. Immunol. 129, 10-18 (2008).
- Liu, W. S., Kim, H. J., Lucchetta, E. M., Du, W. B., Ismagilov, R. F. Isolation, incubation, and parallel functional testing and identification by FISH of rare microbial single-copy cells from multi-species mixtures using the combination of chemistrode and stochastic confinement. Lab on a chip. 9, 2153-2162 (2009).
- Boedicker, J. Q., Li, L., Kline, T. R., Ismagilov, R. F. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics. Lab on a chip. 8, 1265-1272 (2008).
- Koster, S. Drop-based microfluidic devices for encapsulation of single cells. Lab on a chip. 8, 1110-1115 (2008).
- Kelly, R. T., Page, J. S., Marginean, I., Tang, K., Smith, R. D. Dilution-free analysis from picoliter droplets by nano-electrospray ionization mass spectrometry. Angew Chem. Int. Ed. Engl. 48, 6832-6835 (2009).
- Hong, J., deMello, A. J., Jayasinghe, S. N. Bio-electrospraying and droplet-based microfluidics: control of cell numbers within living residues. Biomedical materials. 5, 21001 (2010).
- Edd, J. F. Controlled encapsulation of single-cells into monodisperse picolitre drops. Lab on a chip. 8, 1262-1264 (2008).
- Anna, S. L., Bontoux, N., Stone, H. A. Formation of dispersions using "flow focusing" in microchannels. Applied Physics Letters. 82, 364 (2003).
- Utada, A., Fernandez-Nieves, A., Stone, H., Weitz, D. Dripping to Jetting Transitions in Coflowing Liquid Streams. Physical Review Letters. 99, (2007).
- Chabert, M., Viovy, J. L. Microfluidic high-throughput encapsulation and hydrodynamic self-sorting of single cells. Proceedings of the National Academy of Sciences of the United States of America. 105, 3191-3196 (2008).
- Segrí, G., Silberberg, A. Radial Particle Displacements in Poiseuille Flow of Suspensions. Nature. 189, 209-210 (1961).
- Carlo, D. D. i. Inertial microfluidics. Lab on a chip. 9, 3038-3046 (2009).
- Carlo, D. D. i., Edd, J., Humphry, K., Stone, H., Toner, M. Particle Segregation and Dynamics in Confined Flows. Physical Review Letters. 102, (2009).
- Humphry, K. J., Kulkarni, P. M., Weitz, D. A., Morris, J. F., Stone, H. A. Axial and lateral particle ordering in finite Reynolds number channel flows. Physics of Fluids. 22, 081703 (2010).
- Lee, W., Amini, H., Stone, H. A., Carlo, D. D. i. Dynamic self-assembly and control of microfluidic particle crystals. Proceedings of the National Academy of Sciences of the United States of America. 107, 22413 (2010).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane. Anal. Chem. 70, 4974-4984 (1998).
- Kotz, K., Cheng, X., Toner, M. PDMS Device Fabrication and Surface Modification. J. Vis. Exp. (8), e319 (2007).
- Haubert, K., Drier, T., Beebe, D. PDMS bonding by means of a portable, low-cost corona system. Lab on a chip. 6, 1548-1549 (2006).
- Hatch, A. C. 1-Million droplet array with wide-field fluorescence imaging for digital PCR. Lab on a chip. , 3838-3845 (2011).
- Holtze, C. Biocompatible surfactants for water-in-fluorocarbon emulsions. Lab on a chip. 8, 1632-1639 (2008).
- Garstecki, P., Stone, H., Whitesides, G. Mechanism for Flow-Rate Controlled Breakup in Confined Geometries: A Route to Monodisperse Emulsions. Physical Review Letters. 94, (2005).
- Garstecki, P., Fuerstman, M. J., Stone, H. A., Whitesides, G. M. Formation of droplets and bubbles in a microfluidic T-junction-scaling and mechanism of break-up. Lab on a chip. 6, 437-446 (2006).
- Nie, Z. Emulsification in a microfluidic flow-focusing device: effect of the viscosities of the liquids. Microfluidics and Nanofluidics. , (2008).
- Holt, D. J., Payne, R. J., Chow, W. Y., Abell, C. Fluorosurfactants for microdroplets: interfacial tension analysis. Journal of colloid and interface science. 350, 205-211 (2010).
- Holt, D. J., Payne, R. J., Abell, C. Synthesis of novel fluorous surfactants for microdroplet stabilisation in fluorous oil streams. Journal of Fluorine Chemistry. 131, 398-407 (2010).
- Hatch, A. C., Fisher, J. S., Pentoney, S. L., Yang, D. L., Lee, A. P. Tunable 3D droplet self-assembly for ultra-high-density digital micro-reactor arrays. Lab on a chip. 11, 2509-2517 (2011).
- Baret, J. C. Surfactants in droplet-based microfluidics. Lab on a chip. 12, 422-433 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유