Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
High Throughput unicellulaire et multiples cellules de micro-encapsulation
Dans cet article
Résumé
La combinaison de génération goutte monodispersée avec commande d'inertie de cellules et des particules, on décrit un procédé pour encapsuler un nombre désiré de cellules ou de particules dans une seule goutte à des taux kHz. Nous démontrons l'efficacité deux fois supérieures à celles d'encapsulation non ordonnée pour les gouttes simple et double-particules.
Résumé
Microfluidic encapsulation methods have been previously utilized to capture cells in picoliter-scale aqueous, monodisperse drops, providing confinement from a bulk fluid environment with applications in high throughput screening, cytometry, and mass spectrometry. We describe a method to not only encapsulate single cells, but to repeatedly capture a set number of cells (here we demonstrate one- and two-cell encapsulation) to study both isolation and the interactions between cells in groups of controlled sizes. By combining drop generation techniques with cell and particle ordering, we demonstrate controlled encapsulation of cell-sized particles for efficient, continuous encapsulation. Using an aqueous particle suspension and immiscible fluorocarbon oil, we generate aqueous drops in oil with a flow focusing nozzle. The aqueous flow rate is sufficiently high to create ordering of particles which reach the nozzle at integer multiple frequencies of the drop generation frequency, encapsulating a controlled number of cells in each drop. For representative results, 9.9 μm polystyrene particles are used as cell surrogates. This study shows a single-particle encapsulation efficiency Pk=1 of 83.7% and a double-particle encapsulation efficiency Pk=2 of 79.5% as compared to their respective Poisson efficiencies of 39.3% and 33.3%, respectively. The effect of consistent cell and particle concentration is demonstrated to be of major importance for efficient encapsulation, and dripping to jetting transitions are also addressed.
Introduction
Continuous media aqueous cell suspensions share a common fluid environment which allows cells to interact in parallel and also homogenizes the effects of specific cells in measurements from the media. High-throughput encapsulation of cells into picoliter-scale drops confines the samples to protect drops from cross-contamination, enable a measure of cellular diversity within samples, prevent dilution of reagents and expressed biomarkers, and amplify signals from bioreactor products. Drops also provide the ability to re-merge drops into larger aqueous samples or with other drops for intercellular signaling studies.1,2 The reduction in dilution implies stronger detection signals for higher accuracy measurements as well as the ability to reduce potentially costly sample and reagent volumes.3 Encapsulation of cells in drops has been utilized to improve detection of protein expression,4 antibodies,5,6 enzymes,7 and metabolic activity8 for high throughput screening, and could be used to improve high throughput cytometry.9 Additional studies present applications in bio-electrospraying of cell containing drops for mass spectrometry10 and targeted surface cell coatings.11 Some applications, however, have been limited by the lack of ability to control the number of cells encapsulated in drops. Here we present a method of ordered encapsulation12 which increases the demonstrated encapsulation efficiencies for one and two cells and may be extrapolated for encapsulation of a larger number of cells.
To achieve monodisperse drop generation, microfluidic "flow focusing" enables the creation of controllable-size drops of one fluid (an aqueous cell mixture) within another (a continuous oil phase) by using a nozzle at which the streams converge.13 For a given nozzle geometry, the drop generation frequency f and drop size can be altered by adjusting oil and aqueous flow rates Qoil and Qaq. As the flow rates increase, the flows may transition from drop generation to unstable jetting of aqueous fluid from the nozzle.14
When the aqueous solution contains suspended particles, particles become encapsulated and isolated from one another at the nozzle. For drop generation using a randomly distributed aqueous cell suspension, the average fraction of drops Dk containing k cells is dictated by Poisson statistics, where Dk = λk exp(-λ)/(k!) and λ is the average number of cells per drop. The fraction of cells which end up in the "correctly" encapsulated drops is calculated using Pk = (k x Dk)/Σ(k' x Dk'). The subtle difference between the two metrics is that Dk relates to the utilization of aqueous fluid and the amount of drop sorting that must be completed following encapsulation, and Pk relates to the utilization of the cell sample. As an example, one could use a dilute cell suspension (low λ) to encapsulate drops where most drops containing cells would contain just one cell. While the efficiency metric Pk would be high, the majority of drops would be empty (low Dk), thus requiring a sorting mechanism to remove empty drops, also reducing throughput.15
Combining drop generation with inertial ordering provides the ability to encapsulate drops with more predictable numbers of cells per drop and higher throughputs than random encapsulation. Inertial focusing was first discovered by Segre and Silberberg16 and refers to the tendency of finite-sized particles to migrate to lateral equilibrium positions in channel flow. Inertial ordering refers to the tendency of the particles and cells to passively organize into equally spaced, staggered, constant velocity trains. Both focusing and ordering require sufficiently high flow rates (high Reynolds number) and particle sizes (high Particle Reynolds number).17,18 Here, the Reynolds number Re =uDh/ν and particle Reynolds number Rep =Re(a/Dh)2, where u is a characteristic flow velocity, Dh [=2wh/(w+h)] is the hydraulic diameter, ν is the kinematic viscosity, a is the particle diameter, w is the channel width, and h is the channel height. Empirically, the length required to achieve fully ordered trains decreases as Re and Rep increase. Note that the high Re and Rep requirements (for this study on the order of 5 and 0.5, respectively) may conflict with the need to keep aqueous flow rates low to avoid jetting at the drop generation nozzle. Additionally, high flow rates lead to higher shear stresses on cells, which are not addressed in this protocol. The previous ordered encapsulation study demonstrated that over 90% of singly encapsulated HL60 cells under similar flow conditions to those in this study maintained cell membrane integrity.12 However, the effect of the magnitude and time scales of shear stresses will need to be carefully considered when extrapolating to different cell types and flow parameters. The overlapping of the cell ordering, drop generation, and cell viability aqueous flow rate constraints provides an ideal operational regime for controlled encapsulation of single and multiple cells.
Because very few studies address inter-particle train spacing,19,20 determining the spacing is most easily done empirically and will depend on channel geometry, flow rate, particle size, and particle concentration. Nonetheless, the equal lateral spacing between trains implies that cells arrive at predictable, consistent time intervals. When drop generation occurs at the same rate at which ordered cells arrive at the nozzle, the cells become encapsulated within the drop in a controlled manner. This technique has been utilized to encapsulate single cells with throughputs on the order of 15 kHz,12 a significant improvement over previous studies reporting encapsulation rates on the order of 60-160 Hz.4,15 In the controlled encapsulation work, over 80% of drops contained one and only one cell, a significant efficiency improvement over Poisson (random) statistics, which predicts less than 40% efficiency on average.12
In previous controlled encapsulation work,12 the average number of particles per drop λ was tuned to provide single-cell encapsulation. We hypothesize that through tuning of flow rates, we can efficiently encapsulate any number of cells per drop when λ is equal or close to the number of desired cells per drop. While single-cell encapsulation is valuable in determining individual cell responses from stimuli, multiple-cell encapsulation provides information relating to the interaction of controlled numbers and types of cells. Here we present a protocol, representative results using polystyrene microspheres, and discussion for controlled encapsulation of multiple cells using a passive inertial ordering channel and drop generation nozzle.
Protocole
Les protocoles de cette section décrivent les matériaux et l'équipement utilisés spécifiquement pour obtenir des résultats expérimentaux présentés. Notez que d'autres fournisseurs pour les produits chimiques et des équipements peuvent être utilisés.
1. La fabrication de dispositifs et de lithographie douce
Les techniques standard de lithographie douce, 21 dont un certain nombre ont été présentés dans les articles précédents Jove, 22 ont été utilisés pour créer des polydiméthylsiloxanes (PDMS) réseaux de microcanaux liés à des substrats de verre. Mis à part la fabrication de moule maître réplique par SU-8 photolithographie, les processus peuvent être effectuées en dehors d'une salle blanche ou une hotte propre, mais la poussière et les particules doivent encore être réduite au minimum pour obtenir des résultats cohérents.
- Concevoir un modèle de micro-canaux comme le montre la Figure 1 dans AutoCAD (Autodesk Inc.) Employer un fabricant tiers (Fineline Imaging Inc) pour imprimer une haute résolution (50.000 dpi) transmasque de transparence sur un film de Mylar ou de quartz où les canaux sont transparents sur un fond sombre.
- Créer un silicium et SU-8 maître de résine photosensible pour le moulage de répliques. En bref, tourner SU-8 2050 (MicroChem) photorésist négatif avec un régime recommandé par le fabricant sur un spin-coucheuse pour créer une couche 52 um d'épaisseur sur un 7,5 cm propres ou 10 cm tranche de silicium. Après douce au four, de bord de bourrelet retrait, l'exposition aux UV à travers un masque de contact, post-exposition de pâtisseries, de développement, et l'exposition d'inondation, de mesurer l'épaisseur réelle de la SU-8 calque à l'aide d'un profilomètre Dektak (Veeco). Cassette le moule maître sur le fond d'un 4 "ou 5" boîte de Pétri pour préparer PDMS réplique de moulage.
- Mélanger la base élastomère PDMS avec l'agent de durcissement en élastomère (Dow Corning) dans un ratio de 10:1 w / w de base à l'agent de durcissement. Verser bien mélangée précurseur PDMS sur le maître de silicium pour créer une couche d'épaisseur de 2-3 mm finale. Un mélange de 20 g à base d'élastomère de 2 g agent de durcissement est suffisante pour couvrir une surface de diamètre 4 ".
- Placez le Mastemoule r et PDMS dans le dessiccateur à vide (Jencons) pour dégazer le non durci PDMS. L'utilisation d'un régulateur de pression (Cole Parmer), diminuer lentement la pression relative de la chambre 0 "Hg à -27" Hg de plus de 20 minutes pour éviter un moussage excessif. Laisser l'appareil dans la chambre à vide à -27 "Hg pendant 30 minutes ou jusqu'à ce que des bulles d'air disparaissent.
- Relâchez le vide et passer moule maître et PDMS à un four à 65 ° C (Thermo Scientific) pour un minimum de quatre heures. Le dispositif peut être laissé dans le four toute la nuit pour améliorer durcissement.
- Retirez le dispositif de four et laisser refroidir. Découpez soigneusement PDMS autour de plaquette circulaire en utilisant un couteau de précision et le zeste des PDMS. Découpez les grandes lignes dispositif tel que représenté dans la figure 1 avec un scalpel.
- Poinçon ports fluidiques (trois par appareil) dans les trois régions alentour de la figure 1 en utilisant une biopsie. Pour cet appareil, utilisez un 0,75 mm de diamètre extérieur poinçon (Harris).
- Respecter scotch sur le côté motif du PDMS et le zeste de supprimer toutpoussière. Comme une alternative de réduction des coûts, mais viable pour appareils conventionnels plasma d'oxygène, 21,22 plasma traiter la face à dessin de l'PDMS et d'une propre 3 "x 1" lame de microscope en verre à l'aide d'un appareil portatif de laboratoire Traitement Corona (Electro-Technic Products Inc .) 23. Notez que ce dispositif devrait être utilisé dans une hotte ou bien aéré due à la décharge d'ozone, et toutes les montres et les téléphones cellulaires doivent être conservés au moins dix pieds de distance. Réglez la décharge corona pour atteindre une couronne stable avec un minimum d'étincelles. Lentement agiter l'électrode environ 1/4 "au-dessus de chaque surface pendant environ 20 secondes, puis immédiatement à mettre les surfaces traitées en contact pour former une liaison solide et permanent avant que les surfaces de PDMS revenir à leur état natif.
- Placez l'appareil sur une plaque de métal, dans un four froid, régler le four à 120 ° C, et cuire au four toute la nuit pour terminer le collage et de retourner le PDMS à son état d'origine hydrophobe 24. Au cours de cette cuisson à haute température, til surface de verre du canal est également rendue hydrophobe en raison de dépôt d'une couche hydrophobe mince sur le verre. En variante, revêtements hydrophobes tels que Aquapel (PPG Industries) peut être injecté dans les orifices fluidiques utilisant une seringue 1 mL et une aiguille de seringue. 12 soigneusement mais fermement injecter le Aquapel suivie d'une purge d'air dans les orifices fluidiques sans rompre le lien PDMS de verre . Agressive répéter la purge d'air sur tous les ports d'entrée et de sortie tout en essuyant une Aquapel excès afin d'éviter les dépôts qui peuvent obstruer les canaux lors du séchage.
2. Préparation de l'échantillon
- Préparer une culture de cellules selon les procédures établies pour votre type de cellule choisi. Pour le dispositif particulier utilisé dans cette étude, 8-15 pm particules ou de cellules doivent prendre dûment en commander pour l'encapsulation. Types de cellules plus petites ou plus grandes peuvent nécessiter une modification des dimensions du canal de mise au point d'atteindre p Re adéquate. Pour le moiles résultats de démonstration Thod montré dans le présent document, 9,9 um polystyrène microsphères (G1000, Thermo Scientific) sont utilisés comme substituts des cellules.
- Préparer la particule ou une suspension aqueuse de cellules à travers le mélange doux. Lors de l'utilisation des cellules ou des particules de polystyrène, contrôle de la concentration est essentielle (voir Figure 4) pour atteindre idéale encapsulation commandé. Utilisation des données précédentes 12 comme guide, calculer la cellule désirée ou la concentration des particules sur la base de l'espacement de train commandé et micro chaîne de taille de: une cellule ou particule par attendus longitudinales fois l'espacement former le canal focalisation de la zone en coupe transversale. Si la concentration de stock (1% p / p) est insuffisante, augmenter la concentration (ici à 1,5% p / p) en exerçant une légère centrifugation de l'échantillon stock, enlever le liquide surnageant, et remise en suspension des particules par un agitateur vortex, ou doux mélange lors de l'utilisation des cellules. Préparer un volume adéquat pour rendre compte de volume de collecte souhaité et pendant la durée d'exécution associé à fltuning ow.
- Deux cellules et les particules de polystyrène ont une gravité spécifique supérieure à un. Bien que non démontrée dans le présent protocole, à long terme des expériences d'une durée de l'ordre de plusieurs minutes à plusieurs heures, la flottabilité correspondre à la solution par l'ajout d'un soluté par exemple CaCl 2 pour les particules ou OptiPrep (Sigma-Aldrich) pour les cellules.
- Préparer un échantillon de 10 ml de la phase huileuse continue fluorocarboné en mélangeant l'huile fluorocarbonée FC-40 (3M) et PFPE-PEG copolymère séquencé tensioactif 25 (2,5% p / p) (RainDance Technologies) dans un tube de centrifugation de 15 ml. Sinon, l'huile minérale légère (Process Chemicals PTI) peut être utilisé avec ABIL EM 90-tensioactif (2,5% p / p) (Evonik Goldschmidt Corporation).
3. Configuration expérimentale
- Puissance sur le microscope optique inversé (Axio Observer, Zeiss) et caméra haute vitesse (Phantom V310, Vision Research). Mise au point et d'inspecter les canaux pour les sabots et les débris soit par le déplacement manuel de l'appareil ouen utilisant une platine de microscope motorisé. Certains débris de petite taille peut être poussé hors lorsque le liquide s'écoule à travers. Pour les gros débris ou des sabots évidentes, sélectionnez un autre canal sur le dispositif le plus de débris dans le canal de mise au point peut dégrader la qualité de la commande de manière significative. Notez que des sabots peuvent souvent être éliminés sous flux en appuyant fermement sur la surface de PDMS-dessus de la région touchée avec des pincettes émoussés.
- Couper trois longueurs de tubes en PVC (0,01 "ID/0.03" DO, Tygon) pour l'entrée d'admission d'huile aqueuse, et de sortie d'émulsion. Afin de minimiser le volume mort, coupé juste assez tube pour atteindre des pompes à seringues à la platine du microscope. Couper les extrémités de tubes à un angle de 45 ° pour faciliter l'insertion dans les ports fluidiques.
- Utilisez des pinces pour s'adapter appuyez sur les extrémités du tube dans les ports fluidiques perforées à l'étape 1 et puis appuyez sur monter deux de calibre 30 émoussée-tip aiguilles de seringues en acier inoxydable (SmallParts) dans les extrémités libres de la solution aqueuse respective et les tubes d'entrée d'huile (pas nécessaire avec une colle) . Placez le tuyau de sortie dans un r déchetseservoir. Ce tube sera ensuite déménagé dans un réservoir de collecte.
- Déplacez l'appareil et le tube attaché à la platine du microscope, aligner, et se concentrer sur la buse périphérique à l'aide d'un objectif accessible (20x a été utilisé pour cette expérience). Ajuster afin d'obtenir K hler éclairage et d'autres réglages du microscope tel que requis pour un enregistrement optimal.
- Remplir une seringue 1 ml (BD) avec la phase aqueuse bien mélangée et une seringue 3 ml (BD) avec la solution de phase d'huile préparé dans l'étape 2. Notez que toutes les seringues de n'importe quel volume peut être utilisé et doit être soigneusement choisis en fonction des durées de fonctionnement souhaités et la minimisation de toute pulsatilité. Inclinez une seringue à la verticale et secouez pour déplacer les bulles d'air à la sortie de la seringue. Appuyer lentement sur le piston suffisamment pour pousser l'air à l'extrémité de la seringue. En tenant la seringue verticalement, connecter les seringues à l'aiguille de la seringue respective déjà relié à l'appareil à l'étape 3.3. Enfoncer le piston pour forcer l'air à travers le volume mort aiguille de seringue jusqu'à ce qu'un fluide est pushed à travers le tube pratiquement au dispositif. Monter solidement la seringue à une pompe à seringue (Nexus 3000, Chemyx) et engager le bloc plongeur. Répétez les connexions pour la deuxième seringue et monter à une deuxième pompe à seringue.
- Puissance de chaque pompe à seringue et le programme en utilisant les protocoles du fabricant de la pompe. Définir les débits initiales à Q huile = 50 pl / min et Q aq = 5 pl / min pendant la phase huileuse et la phase aqueuse, respectivement. Début des pompes.
- Attendre pour chaque fluide d'entrer dans l'appareil et remplir les canaux, poussant restante de l'air morte. Cela peut prendre plusieurs minutes. Si il ya une grande quantité d'air dans la tubulure d'entrée, d'augmenter temporairement chaque débit que l'air est expulsé. Ne pas augmenter les débits si élevés que les pressions importants se produisent dans le canal, pouvant conduire à une rupture d'adhérence PDMS-verre.
- En utilisant les débits initiaux, observer la formation de gouttes à la buse (résultats présentés ici: 20x magnification, le frame rate 21005 fps, l'exposition 3 ms). Réduire le champ de la caméra de vue de la buse ne pour maximiser la vitesse de défilement et de réduire les besoins en mémoire si possible. Capturez des vidéos de l'échantillon et confirmer que le taux d'échantillonnage est suffisant pour éviter le repliement.
- Pour éviter d'éjection (voir Figure 2), commencer par de faibles débits aqueuses. Augmenter lentement le débit d'observer aqueuse de particules de commande dans le canal solution aqueuse longtemps que le débit augmente.
- Si la concentration en particules est trop faible pour fournir des trains avec relativement peu de «manquants» les particules et l'échantillon n'a pas été appariés flottabilité, physiquement incliner la pompe à seringue vers la sortie de seringue à fournir progressive sédimentation des particules vers la sortie de seringue. Cette méthode est démontrée dans le protocole vidéo. Périodiquement tourner la seringue le long de son axe peut également réduire décantation indésirable.
- Une fois en ordre adéquat se produit, régler le débit d'huile pour syntoniser la fréquence de génération et dela taille de gouttes. Le volume de la goutte moyenne peut être calculée en utilisant le taux de flux aqueux divisé par la fréquence de génération chute telle que mesurée par la capture vidéo. Ajuster itérativement les deux débits d'atteindre des taux d'encapsulation et les volumes souhaités de chute.
- Une fois stables encapsulation commandé est confirmée, déplacer le tube de sortie à partir du réservoir de déchets dans un réservoir de collecte ou l'alimenter en un autre dispositif de test subséquente.
- Déterminer le temps de collecte basé sur le nombre souhaité de gouttelettes et de la fréquence de génération calculé.
- Enregistrer la fraction de gouttes contenant 0, 1, 2, ..., N particules de quantifier l'efficacité en utilisant soit des résultats de chute de génération vidéo ou par pipetage un échantillon de émulsion collectées pour l'inspection.
4. Les résultats représentatifs
Résultats sont présentés qui obtenir à la fois à une particule contrôlé et commandé à double particules d'encapsulation (figure 3). En coupantle débit d'huile FC-40 en deux, une particule d'encapsulation devient deux particules d'encapsulation. A l'inverse, nous aurions pu augmenter le débit aqueuse pour fournir des particules à la buse plus rapidement, mais nous aurions également augmenté le risque de jet du flux aqueux. Histogrammes de la figure 3 présentent le nombre fractionnaire de particules par chute pour les deux cas, ainsi que des comparaisons avec les statistiques de Poisson. Les gouttes occasionnelles avec des particules zéro sont principalement dues à des particules «manquants» dans les trains commandés, tandis que les cas où il ya plus de particules encapsulées que résultat souhaité à partir locales fortes concentrations de particules et des particules qui, parfois, migrer vers l'une des deux positions verticales de focalisation. Notez que la flottabilité correspondant tel que décrit dans la section 2 n'a pas été utilisé. Au lieu de cela, la pompe à seringue a été physiquement incliné pour permettre la décantation des particules vers la sortie de seringue, ce qui conduit à une concentration élevée de particules pendant la course.
Un essai expérimental illustrant la nécessité d'une particule appropriée et les concentrations cellulaires est montré dans la figure 4. Sans ordre complet, des groupes localisés de l'ordre des particules et sont encapsulés, mais de nombreuses gouttes sont sans particules. Un histogramme montre l'efficacité d'encapsulation a diminué pour la souhaitée en deux encapsulation de particules.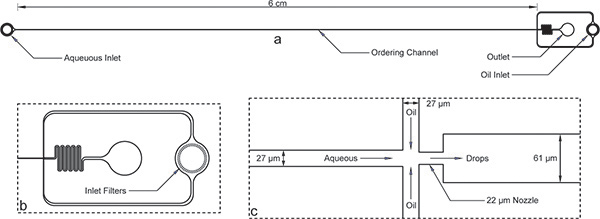
Figure dispositif d'encapsulation 1.. a) ensemble du dispositif avec des entrées, de sortie et à long canal de commande. La hauteur du dispositif est de 52 um et la largeur du canal de commande est de 27 um. b) Les deux aqueuse et des entrées de pétrole ont des filtres gros débris avec des écarts de l'ordre de la largeur du canal de commande pour la vue agrandie de l'entrée d'huile. c) Le point de vue buse élargie montre des largeurs de canal égales de 27 um pour les canaux aqueux et l'huile, suivie par la contraction de la buse 22 um et l'expansion soudaine à un canal um 61 plus large.Notez que les dimensions de l'appareil présentées ici ont été vérifiés à l'aide d'un profilomètre après la microfabrication et différer un peu des dimensions nominales sur le masque. Une vraie image de la chaîne de commande et la buse sont disponibles en ligne en tant que figure supplémentaire 1 . Le fichier de masque d'AutoCAD a également été inclus en ligne comme un complément à ce manuscrit.

Figure 2. Hystérésis d'un goutte à la transition en utilisant un jet plus large dispositif (80 um de large x 22 um de hauteur). a) Au taux de FC-40 à débit constant (Q = 45 uL d'huile / min), la formation de baisse régulière se produit à 10 kHz en utilisant une solution aqueuse de débit Q aq = 8 ul / min. Comme le débit aqueuse est lentement augmenté à 10 m &u; L / min, d'éjection du courant de fluide aqueux est déclenché. b) Lorsque le débit est retourné à 8 ul / min jet continue. Notez que la formation de baisse régulière peut être rétablie par une brève pause de la pompe à débit aqueuse (une pause de 1 seconde est typique).
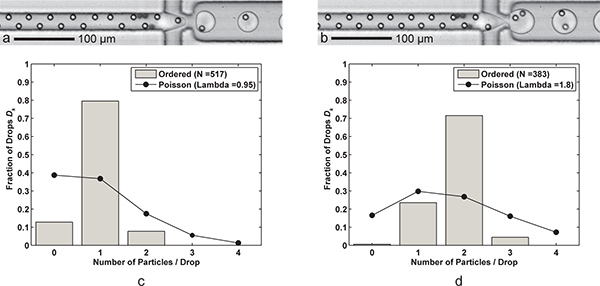
Figure 3. Encapsulation unique et double-particules. Une formation Drop) avec une cellule par goutte (Q = huile de 60 pi / min, Q aq = 9 pi / min) avec un taux de production baisse de 6,1 kHz, la taille de goutte moyenne de 24,4 pL, et une efficacité de capture unicellulaires D k = 79,5% et P = k 83,7% (λ = 0,95) pour une taille de l'échantillon de n = 517 gouttes d et n p = 491 particules de formation de gouttes. b) de deux cellules chaque goutte d'eau se fait simplement par la réduction de la FC-40 débit Q d'huile à 30 μL / min. Les grandes (39,8 pL) gouttes sont formées à un taux de 3,8 kHz avec une efficacité de capture à deux cellules D k = 71,5% et P k = 79,5% (λ = 1,80) pour un échantillon de n d = 383 et n gouttes p = 689 particules. cd) Deux histogrammes comparer les efficacités d'encapsulation de particules de chute D k de l'encapsulation simple et double-particules commandé avec la statistique de Poisson (encapsulation aléatoire). Noter que dans les deux cas, l'espacement des particules dans la direction d'écoulement est d'environ 17 à 18 um de totalement commandés en alternance, des particules. Vidéos supplémentaires montrant à la fois l'encapsulation simple et double-particules sont disponibles en ligne. Cliquez ici pour voir 3a films supplémentaires . Cliquez ici pour voir 3b films supplémentaires .

Concentration Figure 4. Affecte grandement l'efficacité d'encapsulation. A) Comme les baisses de concentration, l'ordre ne se produit pas complète, et donc des "trous" dans les trains sortent, laissant quelques gouttes de moins de particules attendus. B) L'histogramme montre la diminution de l'efficacité ( D k = 55,9%, P k = 70,9%) pour l'encapsulation de deux particules due à une valeur inférieure de λ = 1,57 où il ya peu près autant à une particule gouttes il ya deux particules gouttes. Ce chiffre résulte de l'huile de Q = 30 pi / min et Q aq = 9 pi / min, les conditions d'écoulement mêmes que pour la figure 3b. Une vidéo représentant supplémentaire est disponible en ligne. Cliquez ici pour voir 4 Movie supplémentaire .
Discussion
Malgré des degrés relativement élevés de la commande, tous les gouttes contiennent le bon nombre de particules ou de cellules. Efficacité d'encapsulation peut être calculé comme le nombre de cellules ou de particules qui deviennent encapsulées dans gouttes avec l'occupation souhaitée divisée par le nombre total. Ces données brutes peuvent être obtenus soit à partir d'un algorithme automatisé à grande vitesse vidéo ou de l'imagerie d'un échantillon d'émulsion recueillies. Cela pe...
Déclarations de divulgation
JE est un inventeur sur un brevet en instance sur la base de la technologie utilisée dans ce manuscrit.
Remerciements
Nous remercions RainDance Technologies pour l'échantillon de PFPE-PEG tensioactif utilisé dans cette étude, et nous remercions le BioMEMS Resource Center (Mehmet Toner, metteur en scène) pour le moule plaquette de silicium utilisé pour créer des répliques de canaux PDMS.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| AutoCAD | AutoDesk | ||
| Masque de transparence | Fineline Imaging Inc | ||
| SU-8 Photoresist | MicroChem | 2050 | |
| Profilomètre Dektak | Veeco | ||
| Boîte de Pétri | BD Falcon | 351058 | |
| Kit PDMS élastomère de silicone | Dow Corning Corp | Sylgard 184, numéro de référence (240) 4019862 | |
| Dessiccateur à vide | Jencons | 250-030 | |
| Pompe à vide | Alcatel Vacuum Technology | 2010 C2 | |
| Le régulateur de vide | Cole-Parmer | EW-00910-10 | |
| Four | Thermo Scientific | Lindberg Blue M, OV800F | |
| Biopsie, 0,75 mm | Harris | Uni-Core 15072 | |
| Laboratoire Traitement Corona | Electro-Technic Products Inc | BD-20AC, SKU 12051A | |
| Lames de verre | Sceau d'or | 3010 | |
| Aquapel | PPG Industries | Stratégie Alternative | |
| Microsphères de polystyrène, 9,9 um | Thermo | G1000 | |
| OptiPrep | Sigma-Aldrich | D1556 | Non démontré |
| Seringues Luer-Lok | BD | 1 ml: 309628 3 ml: 309585 | |
| FC-40 huile fluorocarbonée | 3M Inc | Sigma-Aldrich, F9755 | |
| PFPE-PEG fluoré | RainDance Technologies | ||
| Huile minérale légère | Process Chemicals PTI | 08042-47-5 | Stratégie Alternative |
| Surfactant huile minérale | Evonik Goldschmidt Corporation | ABIL EM 90 | Stratégie Alternative |
| Tygon Tuyau PVC | SmallParts | TGY-010 | |
| Calibre 30 Luer-Lok seringue sans aiguille, 1/2 " | SmallParts | NE-301PL-C | |
| Microscope inversé | Carl Zeiss Imaging | Axio Observer.Z1 | |
| Caméra haute vitesse | Vision de la recherche | Phantom V310 | |
| Pompes seringue (2) | Chemyx Inc | Nexus 3000 | |
| Huile de silicone | Dow Corning | 200 fluide, 10 cSt | En option pour le stockage d'émulsion |
Références
- Zagnoni, M., Lain, G. L. e., Cooper, J. M. Electrocoalescence mechanisms of microdroplets using localized electric fields in microfluidic channels. Langmuir : the ACS journal of surfaces and colloids. 26, 14443-14449 (2010).
- Niu, X. Z., Gielen, F., Edel, J. B., deMello, A. J. A microdroplet dilutor for high-throughput screening. Nat. Chem. 3, 437-442 (2011).
- Vincent, M. E., Liu, W., Haney, E. B., Ismagilov, R. F. Microfluidic stochastic confinement enhances analysis of rare cells by isolating cells and creating high density environments for control of diffusible signals. Chemical Society reviews. 39, 974-984 (2010).
- Huebner, A. Quantitative detection of protein expression in single cells using droplet microfluidics. Chemical communications. , 1218-1220 (2007).
- Love, J. C., Ronan, J. L., Grotenbreg, G. M., van der Veen, A. G., Ploegh, H. L. A microengraving method for rapid selection of single cells producing antigen-specific antibodies. Nature biotechnology. 24, 703-707 (2006).
- Bradshaw, E. M. Concurrent detection of secreted products from human lymphocytes by microengraving: Cytokines and antigen-reactive antibodies. Clin. Immunol. 129, 10-18 (2008).
- Liu, W. S., Kim, H. J., Lucchetta, E. M., Du, W. B., Ismagilov, R. F. Isolation, incubation, and parallel functional testing and identification by FISH of rare microbial single-copy cells from multi-species mixtures using the combination of chemistrode and stochastic confinement. Lab on a chip. 9, 2153-2162 (2009).
- Boedicker, J. Q., Li, L., Kline, T. R., Ismagilov, R. F. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics. Lab on a chip. 8, 1265-1272 (2008).
- Koster, S. Drop-based microfluidic devices for encapsulation of single cells. Lab on a chip. 8, 1110-1115 (2008).
- Kelly, R. T., Page, J. S., Marginean, I., Tang, K., Smith, R. D. Dilution-free analysis from picoliter droplets by nano-electrospray ionization mass spectrometry. Angew Chem. Int. Ed. Engl. 48, 6832-6835 (2009).
- Hong, J., deMello, A. J., Jayasinghe, S. N. Bio-electrospraying and droplet-based microfluidics: control of cell numbers within living residues. Biomedical materials. 5, 21001 (2010).
- Edd, J. F. Controlled encapsulation of single-cells into monodisperse picolitre drops. Lab on a chip. 8, 1262-1264 (2008).
- Anna, S. L., Bontoux, N., Stone, H. A. Formation of dispersions using "flow focusing" in microchannels. Applied Physics Letters. 82, 364 (2003).
- Utada, A., Fernandez-Nieves, A., Stone, H., Weitz, D. Dripping to Jetting Transitions in Coflowing Liquid Streams. Physical Review Letters. 99, (2007).
- Chabert, M., Viovy, J. L. Microfluidic high-throughput encapsulation and hydrodynamic self-sorting of single cells. Proceedings of the National Academy of Sciences of the United States of America. 105, 3191-3196 (2008).
- Segrí, G., Silberberg, A. Radial Particle Displacements in Poiseuille Flow of Suspensions. Nature. 189, 209-210 (1961).
- Carlo, D. D. i. Inertial microfluidics. Lab on a chip. 9, 3038-3046 (2009).
- Carlo, D. D. i., Edd, J., Humphry, K., Stone, H., Toner, M. Particle Segregation and Dynamics in Confined Flows. Physical Review Letters. 102, (2009).
- Humphry, K. J., Kulkarni, P. M., Weitz, D. A., Morris, J. F., Stone, H. A. Axial and lateral particle ordering in finite Reynolds number channel flows. Physics of Fluids. 22, 081703 (2010).
- Lee, W., Amini, H., Stone, H. A., Carlo, D. D. i. Dynamic self-assembly and control of microfluidic particle crystals. Proceedings of the National Academy of Sciences of the United States of America. 107, 22413 (2010).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane. Anal. Chem. 70, 4974-4984 (1998).
- Kotz, K., Cheng, X., Toner, M. PDMS Device Fabrication and Surface Modification. J. Vis. Exp. (8), e319 (2007).
- Haubert, K., Drier, T., Beebe, D. PDMS bonding by means of a portable, low-cost corona system. Lab on a chip. 6, 1548-1549 (2006).
- Hatch, A. C. 1-Million droplet array with wide-field fluorescence imaging for digital PCR. Lab on a chip. , 3838-3845 (2011).
- Holtze, C. Biocompatible surfactants for water-in-fluorocarbon emulsions. Lab on a chip. 8, 1632-1639 (2008).
- Garstecki, P., Stone, H., Whitesides, G. Mechanism for Flow-Rate Controlled Breakup in Confined Geometries: A Route to Monodisperse Emulsions. Physical Review Letters. 94, (2005).
- Garstecki, P., Fuerstman, M. J., Stone, H. A., Whitesides, G. M. Formation of droplets and bubbles in a microfluidic T-junction-scaling and mechanism of break-up. Lab on a chip. 6, 437-446 (2006).
- Nie, Z. Emulsification in a microfluidic flow-focusing device: effect of the viscosities of the liquids. Microfluidics and Nanofluidics. , (2008).
- Holt, D. J., Payne, R. J., Chow, W. Y., Abell, C. Fluorosurfactants for microdroplets: interfacial tension analysis. Journal of colloid and interface science. 350, 205-211 (2010).
- Holt, D. J., Payne, R. J., Abell, C. Synthesis of novel fluorous surfactants for microdroplet stabilisation in fluorous oil streams. Journal of Fluorine Chemistry. 131, 398-407 (2010).
- Hatch, A. C., Fisher, J. S., Pentoney, S. L., Yang, D. L., Lee, A. P. Tunable 3D droplet self-assembly for ultra-high-density digital micro-reactor arrays. Lab on a chip. 11, 2509-2517 (2011).
- Baret, J. C. Surfactants in droplet-based microfluidics. Lab on a chip. 12, 422-433 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon