Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Высокая пропускная способность Single-камеру и несколько клеток микро-инкапсуляции
В этой статье
Резюме
Объединение монодисперсных падение поколения с инерционным порядком клеток и частиц, описывается метод инкапсуляции нужное количество клеток или частиц в одной капле в кГц ставки. Мы демонстрируем эффективность в два раза превышающие неупорядоченных инкапсуляции для одно-и двух-частиц падает.
Аннотация
Microfluidic encapsulation methods have been previously utilized to capture cells in picoliter-scale aqueous, monodisperse drops, providing confinement from a bulk fluid environment with applications in high throughput screening, cytometry, and mass spectrometry. We describe a method to not only encapsulate single cells, but to repeatedly capture a set number of cells (here we demonstrate one- and two-cell encapsulation) to study both isolation and the interactions between cells in groups of controlled sizes. By combining drop generation techniques with cell and particle ordering, we demonstrate controlled encapsulation of cell-sized particles for efficient, continuous encapsulation. Using an aqueous particle suspension and immiscible fluorocarbon oil, we generate aqueous drops in oil with a flow focusing nozzle. The aqueous flow rate is sufficiently high to create ordering of particles which reach the nozzle at integer multiple frequencies of the drop generation frequency, encapsulating a controlled number of cells in each drop. For representative results, 9.9 μm polystyrene particles are used as cell surrogates. This study shows a single-particle encapsulation efficiency Pk=1 of 83.7% and a double-particle encapsulation efficiency Pk=2 of 79.5% as compared to their respective Poisson efficiencies of 39.3% and 33.3%, respectively. The effect of consistent cell and particle concentration is demonstrated to be of major importance for efficient encapsulation, and dripping to jetting transitions are also addressed.
Introduction
Continuous media aqueous cell suspensions share a common fluid environment which allows cells to interact in parallel and also homogenizes the effects of specific cells in measurements from the media. High-throughput encapsulation of cells into picoliter-scale drops confines the samples to protect drops from cross-contamination, enable a measure of cellular diversity within samples, prevent dilution of reagents and expressed biomarkers, and amplify signals from bioreactor products. Drops also provide the ability to re-merge drops into larger aqueous samples or with other drops for intercellular signaling studies.1,2 The reduction in dilution implies stronger detection signals for higher accuracy measurements as well as the ability to reduce potentially costly sample and reagent volumes.3 Encapsulation of cells in drops has been utilized to improve detection of protein expression,4 antibodies,5,6 enzymes,7 and metabolic activity8 for high throughput screening, and could be used to improve high throughput cytometry.9 Additional studies present applications in bio-electrospraying of cell containing drops for mass spectrometry10 and targeted surface cell coatings.11 Some applications, however, have been limited by the lack of ability to control the number of cells encapsulated in drops. Here we present a method of ordered encapsulation12 which increases the demonstrated encapsulation efficiencies for one and two cells and may be extrapolated for encapsulation of a larger number of cells.
To achieve monodisperse drop generation, microfluidic "flow focusing" enables the creation of controllable-size drops of one fluid (an aqueous cell mixture) within another (a continuous oil phase) by using a nozzle at which the streams converge.13 For a given nozzle geometry, the drop generation frequency f and drop size can be altered by adjusting oil and aqueous flow rates Qoil and Qaq. As the flow rates increase, the flows may transition from drop generation to unstable jetting of aqueous fluid from the nozzle.14
When the aqueous solution contains suspended particles, particles become encapsulated and isolated from one another at the nozzle. For drop generation using a randomly distributed aqueous cell suspension, the average fraction of drops Dk containing k cells is dictated by Poisson statistics, where Dk = λk exp(-λ)/(k!) and λ is the average number of cells per drop. The fraction of cells which end up in the "correctly" encapsulated drops is calculated using Pk = (k x Dk)/Σ(k' x Dk'). The subtle difference between the two metrics is that Dk relates to the utilization of aqueous fluid and the amount of drop sorting that must be completed following encapsulation, and Pk relates to the utilization of the cell sample. As an example, one could use a dilute cell suspension (low λ) to encapsulate drops where most drops containing cells would contain just one cell. While the efficiency metric Pk would be high, the majority of drops would be empty (low Dk), thus requiring a sorting mechanism to remove empty drops, also reducing throughput.15
Combining drop generation with inertial ordering provides the ability to encapsulate drops with more predictable numbers of cells per drop and higher throughputs than random encapsulation. Inertial focusing was first discovered by Segre and Silberberg16 and refers to the tendency of finite-sized particles to migrate to lateral equilibrium positions in channel flow. Inertial ordering refers to the tendency of the particles and cells to passively organize into equally spaced, staggered, constant velocity trains. Both focusing and ordering require sufficiently high flow rates (high Reynolds number) and particle sizes (high Particle Reynolds number).17,18 Here, the Reynolds number Re =uDh/ν and particle Reynolds number Rep =Re(a/Dh)2, where u is a characteristic flow velocity, Dh [=2wh/(w+h)] is the hydraulic diameter, ν is the kinematic viscosity, a is the particle diameter, w is the channel width, and h is the channel height. Empirically, the length required to achieve fully ordered trains decreases as Re and Rep increase. Note that the high Re and Rep requirements (for this study on the order of 5 and 0.5, respectively) may conflict with the need to keep aqueous flow rates low to avoid jetting at the drop generation nozzle. Additionally, high flow rates lead to higher shear stresses on cells, which are not addressed in this protocol. The previous ordered encapsulation study demonstrated that over 90% of singly encapsulated HL60 cells under similar flow conditions to those in this study maintained cell membrane integrity.12 However, the effect of the magnitude and time scales of shear stresses will need to be carefully considered when extrapolating to different cell types and flow parameters. The overlapping of the cell ordering, drop generation, and cell viability aqueous flow rate constraints provides an ideal operational regime for controlled encapsulation of single and multiple cells.
Because very few studies address inter-particle train spacing,19,20 determining the spacing is most easily done empirically and will depend on channel geometry, flow rate, particle size, and particle concentration. Nonetheless, the equal lateral spacing between trains implies that cells arrive at predictable, consistent time intervals. When drop generation occurs at the same rate at which ordered cells arrive at the nozzle, the cells become encapsulated within the drop in a controlled manner. This technique has been utilized to encapsulate single cells with throughputs on the order of 15 kHz,12 a significant improvement over previous studies reporting encapsulation rates on the order of 60-160 Hz.4,15 In the controlled encapsulation work, over 80% of drops contained one and only one cell, a significant efficiency improvement over Poisson (random) statistics, which predicts less than 40% efficiency on average.12
In previous controlled encapsulation work,12 the average number of particles per drop λ was tuned to provide single-cell encapsulation. We hypothesize that through tuning of flow rates, we can efficiently encapsulate any number of cells per drop when λ is equal or close to the number of desired cells per drop. While single-cell encapsulation is valuable in determining individual cell responses from stimuli, multiple-cell encapsulation provides information relating to the interaction of controlled numbers and types of cells. Here we present a protocol, representative results using polystyrene microspheres, and discussion for controlled encapsulation of multiple cells using a passive inertial ordering channel and drop generation nozzle.
протокол
Протоколы в этом разделе описываются материалов и оборудования, используемого в частности получить экспериментальные результаты. Обратите внимание, что альтернативные поставщики для химикатов и оборудования могут быть использованы.
1. Изготовление устройств и мягкие литографии
Стандартный мягкой литографии, 21 числа, которые были показаны в предыдущих статьях, Юпитер, 22 были использованы для создания полидиметилсилоксана (PDMS) микроканальных сетей связаны с стеклянные подложки. Помимо мастер копия формы изготовление ГУ-8 фотолитографии, процессы могут совершаться вне чистого помещения или чистой капот, однако, пыли и твердых частиц все равно должны быть сведены к минимуму, чтобы достичь согласованных результатов.
- Разработка микро-канал шаблон, как показано на рисунке 1 в AutoCAD (AutoDesk Inc.) Применять стороннему производителю (Fineline изображений Inc) для печати с высоким разрешением (50000 точек на дюйм), транс-прозрачность маски на пленке майлара или кварца, где каналы прозрачны на темном фоне.
- Создать кремния и SU-8 фоторезиста мастера для литья реплики. Короче говоря, спина SU-8 2050 года (MicroChem) отрицательный фоторезиста с рекомендованными производителем мин на спин-для нанесения покрытий для создания 52 мкм слоем на чистую 7,5 см или 10 см кремниевой пластины. После мягкой печь, края шарика удаление, воздействие УФ лучей через контактную маску, после контакта печь, развития и наводнения экспозиции, измерения фактической толщины SU-8 слой с помощью профилометра Dektak (Veeco). Лента мастер формы на дно 4 "и 5" чашке Петри, чтобы подготовить для литья PDMS реплики.
- Mix PDMS эластомера базу эластомера отвердителя (Dow Corning) в соотношении 10:1 / в базу для отвердителя. Залить хорошо перемешанных PDMS предшественник на мастер кремния для создания 2-3 мм окончательного слоя. Смесь из 20 г эластомера база с 2 отвердитель г достаточно для покрытия 4 "диаметр поверхности.
- Поместите masteГ плесени и PDMS в эксикаторе вакуум (Jencons) де-газ неотвержденного PDMS. С помощью регулятора давления (Cole Parmer), медленно уменьшать давление датчика камеры от 0 "Hg до -27" Hg в течение 20 минут, чтобы избежать излишнего пенообразования. Оставьте устройство в вакуумной камере при -27 "Hg в течение 30 минут или пока пузырьки воздуха исчезают.
- Отпустите вакуума и двигаться формы мастера и PDMS на 65 ° C духовке (Thermo Scientific) в течение как минимум четырех часов. Устройство можно оставить в духовке на ночь для улучшения лечения.
- Выньте его из духовки и дать остыть. Аккуратно вырежьте PDMS по круговой пластины с помощью ножа и кожура точности из PDMS. Вырежьте устройство контура, как показано на рисунке 1, с помощью скальпеля.
- Удар жидкостный портов (по три на устройство) в трех регионах круглые показано на рисунке 1 с помощью биопсии удар. Для этого устройства, использовать 0,75 мм наружный диаметр пуансона (Харрис).
- Придерживайтесь скотчем к узорной стороны PDMS и очистить, чтобы удалитьпыли. В экономии средств, но альтернативой обычным аппаратам плазме кислорода, 21,22 плазмы лечения узорные стороны PDMS и чистый 3 "х 1" стекло стекло микроскопа помощью ручных лаборатории короны Протравливатель (Electro-Technic Products Inc .) 23. Обратите внимание, что это устройство должно использоваться в вытяжном шкафу или хорошо проветриваемом помещении в результате воздействия озона разряда, и все часы и сотовые телефоны должны быть не менее десяти метров. Отрегулируйте коронного разряда для достижения стабильного коронного с минимальным искрение. Медленно махать электрода около 1/4 "над каждой поверхностью около 20 секунд, а затем немедленно привести обработанных поверхностей в контакт, чтобы сформировать сильную постоянную связь до PDMS поверхности вернуться в свои родные государства.
- Поместите устройство на металлической пластине, место в прохладном печи, установить духовку до 120 ° С, и выпекать ночь для завершения соединения и возврата PDMS в исходное состояние гидрофобного 24. Во время этой высокой температуры выпечки, тОн стеклянную поверхность канала также будет оказана за счет гидрофобных осаждение тонкого слоя гидрофобной на стекле. Кроме того, гидрофобные покрытия, такие как Aquapel (PPG Industries) может быть введен в жидкостного портов, используя 1 мл шприц и иглу шприца 12. Осторожно, но твердо вводить Aquapel последующей очистки воздуха в жидкостных порты, не нарушая PDMS к стеклу связь . Настойчиво повторяю продувки на всех входных и выходных портов в то время как стереть излишки Aquapel для того, чтобы избежать любых отложений, которые могут засорить каналы при высыхании.
2. Подготовка образцов
- Подготовить культуре клеток в соответствии с установленным порядком для выбранного типа клеток. Для конкретного устройства, используемые в этом исследовании, 8-15 мкм, частицы или клетки должны адекватно заказать для инкапсуляции. Меньше или больше типов клеток может потребоваться изменение размеров фокусирующего канала для достижения адекватного р Re. Для меняметод приводит демонстрации показано в этой статье, 9,9 мкм полистирольных микросфер (G1000, Thermo Scientific) используются как мобильные суррогатов.
- Подготовка водных частиц или суспензии клеток через нежный смешивания. При использовании клетки или частицы полистирола, контроля концентрации существенно (см. Рисунок 4), чтобы достичь идеального приказал инкапсуляции. Используя предыдущие данные 12 как руководство, рассчитать нужную ячейку или концентрация частиц на основе упорядоченных расстояние поезд и микро-канал размер: одна клетка или частица в ожидаемых продольной поезд расстояние фокусировки раз канал площадь поперечного сечения. Если акция концентрации (1% в / в) недостаточно, повышают концентрацию (в данном случае до 1,5% в / в), осторожно центрифугирования фондовом образца, удаления надосадочной жидкости и повторное приостановление частиц вихря смешивания, перемешивания или мягким При использовании клеток. Подготовка достаточного объема для учета требуемый набор объем и время выполнения связанных с этвл настройки.
- Обе клетки и частицы полистирола имеют удельный вес больше единицы. Хотя это и не показано в этом протоколе, для долгосрочных экспериментов длительностью порядка нескольких минут до нескольких часов, плавучесть соответствует решение, добавив растворенного вещества, такие как CaCl 2 для частиц или OptiPrep (Sigma-Aldrich) для клеток.
- Подготовьте 10 мл образец непрерывной фазе масло фторуглерода путем смешивания масла фторуглеродных FC-40 (3М) и PFPE-PEG блок-сополимер поверхностно 25 (2,5% вес / вес) (Raindance технологий) в 15 мл центрифужные пробирки. Кроме того, светлых нефтепродуктов (PTI химических процессов) могут быть использованы с ABIL-EM 90 поверхностно-активных веществ (2,5% вес / вес) (Evonik Goldschmidt Corporation).
3. Экспериментальная установка
- Включите перевернутое оптического микроскопа (Axio наблюдателей, Zeiss) и высокая скорость камеры (Phantom V310, Vision Research). Фокус и проверки каналов сабо и мусор либо вручную, перемещая устройство илис помощью моторизованного микроскопа. Некоторые мелкие обломки могут быть вытеснены, когда жидкость проходит через. Для крупных обломков или очевидной сабо, выберите другой канал на устройство, как мусор в фокусирующего канала может привести к снижению качества заказов значительно. Обратите внимание, что сабо часто может быть удален в потоке, нажав твердо на поверхности PDMS над пострадавшим регионом с тупым пинцетом.
- Нарезать три длины трубы ПВХ (0,01 "ID/0.03" OD, Tygon) на водном входе, масло входе и выходе эмульсии. Чтобы минимизировать мертвый объем, достаточно вырезать трубы, чтобы добраться от шприцевые насосы на предметный столик микроскопа. Отрежьте трубы заканчивается в 45 ° для облегчения вставки в жидкостных портов.
- Используйте пинцет, чтобы соответствовать нажмите концов труб в жидкостного порта кулаками на шаге 1 и нажмите подходят два 30 калибровочных тупым наконечником из нержавеющей стали шприц иглы (SmallParts) в свободные концы соответствующих водных и нефтяных входе трубы (без клея необходимо) . Место выхода трубы в т отходовeservoir. Эта трубка в дальнейшем будут перемещены в коллекцию водохранилища.
- Перемещение устройства и придает трубке микроскопа, выравнивание, и сосредоточить внимание на устройство форсунку с помощью доступных объективных (20x был использован для эксперимента). Установите для K hler освещения и других параметров микроскоп как это требуется для оптимальной записи.
- Наполните шприц 1 мл (BD) с хорошо смешанной водной фазы и 3 мл шприц (BD) с решением масляной фазы подготовлен в шаге 2. Обратите внимание, что любые шприцы любого объема может быть использован и должны быть тщательно отобраны в зависимости от требуемого времени работы и минимизация любых пульсации. Наклоните один шприц вертикально и вылить двигаться пузырьков воздуха в шприце розетки. Медленно нажмите поршень достаточно нажать воздуха в шприц наконечником. Держа шприц вертикально, подключите шприцев иглы шприца соответствующие уже подключен к устройству в шаге 3.3. Нажмите поршень, чтобы заставить воздух через иглу шприца до мертвого объема жидкости рushed через трубку почти на устройстве. Надежно закрепите шприц шприцевой насос (Nexus 3000, Chemyx) и заниматься блока поршень. Повторите для подключения второй шприц и смонтировать на второй насос шприца.
- Мощность каждого насоса шприца и программы с использованием протоколов насос производителя. Установка начальных скоростей потока Q = 50 нефть мкл / мин и Q ад = 5 мкл / мин для масляной фазы и водную фазу, соответственно. Запуск насосов.
- Подождите, пока каждый жидкости в устройство и заполнять каналы, выталкивая оставшиеся мертвый воздух. Это может занять несколько минут. Если есть большое количество воздуха во впускной трубопровод, временно увеличиваться с каждым расходом, пока воздух не выбрасывается. Не увеличивайте скорость потока настолько велика, что происходят большие давления в канале, что может привести к PDMS-стекло связь провал.
- Используя начальные скорости потока, наблюдать образование капель на сопло (результаты, показанные здесь: 20x magnificatioп, частота кадров 21 005 кадров в секунду, экспозиция 3 мкс). Уменьшить поле зрения камеры только сопла максимизировать частоту кадров и уменьшить требования к памяти, если это возможно. Захват видео образец и убедитесь, что частота дискретизации достаточно, чтобы избежать наложения.
- Чтобы избежать струйное (см. Рисунок 2), начните с низкой водной расхода. Медленно увеличивайте водный расход заметить, упорядочение частиц в конечном водный канал решение по мере увеличения скорости потока.
- Если концентрация частиц слишком мала, чтобы обеспечить поезда с относительно небольшим числом "недостающих" частиц и образец не соответствует плавучести, физически наклонить шприц насос к шприц выходе обеспечить постепенное оседание частиц на выходе шприца. Этот метод показан в видео-протокол. Периодически вращающаяся шприц вдоль своей оси может также уменьшить нежелательные поселения.
- После адекватного упорядочение происходит, регулировать скорость потока масла для настройки частоты генерации иРазмер капель. Средний объем падения может быть рассчитана с использованием водного расхода разделены по частоте падения поколения, измеряется захвата видео. Итеративно настроить как расход для достижения желаемого инкапсуляции ставок и падения объемов.
- После стабильного приказал инкапсуляции подтверждается, перенести выход трубы из отходов резервуара в резервуар коллекции или кормить его в другом устройстве для последующего тестирования.
- Определить время сбора основанных на нужное количество капель и расчетные частоты генерации.
- Запись доля капель, содержащих 0, 1, 2, ..., N частиц количественно эффективность использования либо падение результатов поколение видео или с помощью пипетки образца собранной эмульсии для проверки.
4. Представитель Результаты
Результаты представлены достижения которых и контролируемые одночастичных и контролируемом двойном частиц инкапсуляции (рис. 3). СокращаяFC-40 расход масла в два раза, одночастичные инкапсуляции превращается в две частицы инкапсуляции. С другой стороны, мы могли бы увеличить водный расход для доставки частиц в сопло быстрее, но мы также увеличило бы риск струйная водного потока. Гистограммы на рисунке 3 представляет дробное число частиц в капле для двух случаев, а также сравнение статистики Пуассона. Случайные капли с нуля частиц в основном за счет "пропавших без вести" частиц в упорядоченном поездов, а тех случаях, когда есть больше капсулированных частиц, чем желаемый результат от местных высоких концентраций частиц и частиц, которые иногда мигрируют к одному из двух вертикальных внимание позиции. Обратите внимание, что плавучесть для, как описано в разделе 2 не были использованы. Вместо этого, шприцевой насос был физически наклонить, чтобы оседание частиц на выходе шприца, что приводит к высокой концентрации частиц в перспективе.
экспериментальной перспективе иллюстрирующий необходимость надлежащего частиц и клеточных концентрациях показано на рисунке 4. Без полного порядка, локализованные группы порядка частиц и инкапсулируются, но многие капли без частиц. Гистограмма показывает снизилась эффективность инкапсуляции для желаемого двух частиц инкапсуляции.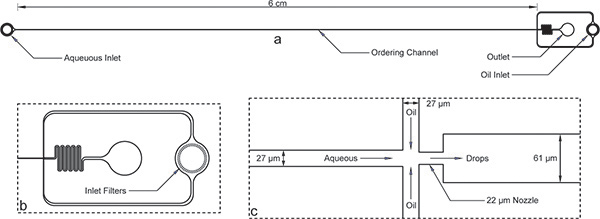
Рисунок 1. Инкапсуляции устройства. а) Общая устройство входов, на выходе, и долго заказ канала. Устройство высотой 52 мкм, а ширина канала заказа составляет 27 мкм. б) На водной и нефтяной входы имеют большие фильтры мусора с пробелами порядка заказе ширина канала для увеличенный вид масла на входе. в) увеличенное изображение сопла показывает, равный ширине канала 27 мкм для водных и масляных каналов, а затем сопла сокращение от 22 мкм и внезапного расширения для более широкого канала 61 мкм.Обратите внимание, что размеры устройства, показанного здесь были проверены с помощью профилометра после микротехнологий и несколько отличаются от номинальных размеров по маске. Истинный образ заказа канал и сопло можно ознакомиться в Интернете, как Справочная Рисунок 1 . Файлов AutoCAD маски также были включены онлайн в качестве дополнения к этой рукописи.

Рисунок 2. Гистерезис капель в струйной переход с использованием более широкого устройства (80 мкм в ширину х 22 мкм высокий). а) При постоянном FC-40 расход (Q масла = 45 мкл / мин), устойчивое образование падение происходит на частоте 10 кГц, используя водный расход Q AQ = 8 мкл / мин. Как водный расход постепенно увеличена до 10 м ищ л / мин, струйное водного потока жидкости срабатывает. б) при скорости потока возвращается на 8 мкл / мин струйное продолжается. Обратите внимание, что устойчивое образование падение может быть восстановлен кратко приостановки водного насоса (1 секунда паузы обычно).
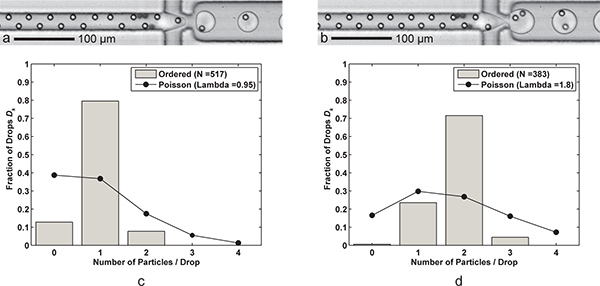
Рисунок 3. Одно-и двухместные частиц инкапсуляции.) Drop образование с одной клетки на каплю (Q масла = 60 мкл / мин, Q = 9 водный мкл / мин) со скоростью падения поколения 6,1 кГц, средний размер капли 24,4 PL, и одноклеточные эффективность захвата D к = 79,5% и P к = 83,7% (λ = 0,95) для образца размером N D = 517 капель и п р = 491 частиц. б) падение образование с двумя ячейками на каплю достигается просто за счет уменьшения FC-40 расход Q нефти до 30 μЛ / мин. Больше (39,8 рь) капли образуются в размере 3,8 кГц с двух клеток эффективности улавливания D к = 71,5% и P к = 79,5% (λ = 1,80) для образца размером N D = 383 капель и н р = 689 частиц. CD) Два гистограммы сравнить падение инкапсуляция частиц эффективность D к упорядоченной одно-и двух-частицы с инкапсуляцией статистике Пуассона (случайная инкапсуляции). Обратите внимание, что в обоих случаях, частицы расстояние в направлении потока составляет около 17-18 мкм полностью упорядоченный, чередуя частиц. Справочная видеозаписи как одно-и двухместных частиц инкапсуляции доступны в Интернете. Щелкните здесь для просмотра фильмов Справочная 3а . Щелкните здесь для просмотра фильмов Справочная 3b .

Рисунок 4. Концентрация сильно влияет на эффективность инкапсуляции.) Поскольку концентрация уменьшается, полный порядок не происходит, и, следовательно, "дыры" в поездах выйти, оставив несколько капель с меньшим, чем ожидалось частиц. Б) гистограмма показывает снижению эффективности ( D к = 55,9%, P к = 70,9%) в течение двух частиц инкапсуляции в связи с меньшим значением λ = 1,57, где есть почти столько же одночастичные падает, поскольку есть двойной частиц падает. Это произошло в результате нефть Q = 30 мкл / мин, Q = 9 водный мкл / мин, на тех же условиях, что и для потока рис. 3б. Представитель дополнительного видео в Интернете. Щелкните здесь для просмотра Справочная 4 фильма .
Обсуждение
Несмотря на относительно высокую степень упорядоченности, не все капли будет содержать нужное количество частиц или клеток. Инкапсуляции эффективность может рассчитываться как число клеток или частиц, которые становятся заключены в каплях с желаемой занятости разделить их общего чи...
Раскрытие информации
JE является изобретателем в ожидании патент, основанный на технологиях, используемых в этой рукописи.
Благодарности
Мы благодарим Raindance технологии для выборки PFPE-PEG поверхностно-активных веществ, используемых в данном исследовании, и мы благодарим BioMEMS ресурсный центр (Mehmet Toner, директор) для формы кремниевой пластины используются для создания реплик PDMS канала.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| AutoCAD | AutoDesk | ||
| Transparency Mask | Fineline изображений Инк | ||
| SU-8 фоторезиста | MicroChem | 2050 | |
| Dektak профилометра | Veeco | ||
| Чашку Петри | BD Сокол | 351058 | |
| PDMS Силиконовый эластомер Kit | Корпорация Dow Corning | Sylgard 184, материал номер (240) 4019862 | |
| Вакуум-эксикатор | Jencons | 250-030 | |
| Вакуум-насос | Alcatel Вакуумная техника | 2010 C2 | |
| Вакуумный регулятор | Коул-Parmer | EW-00910-10 | |
| Печь | Thermo Scientific | Линдберг синий M, OV800F | |
| Биопсия Punch, 0,75 мм | Харрис | Uni процессоров 15072 | |
| Лаборатория Corona Тритер | Электро-Technic продактс инк | BD-20AC, SKU 12051A | |
| Стеклах | Gold Seal | 3010 | |
| Aquapel | PPG Industries | Альтернативная стратегия | |
| Полистирольных микросфер, 9,9 мкм | Thermo | G1000 | |
| OptiPrep | Sigma-Aldrich | D1556 | Не продемонстрировал |
| Луер-Лок Шприцы | BD | 1 мл: 309 628 3 мл: 309 585 | |
| FC-40 Фторуглеродные нефти | 3M Инк | Sigma Aldrich, F9755 | |
| PFPE-PEG фторированные | Raindance технологии | ||
| Светлых нефтепродуктов | Химических процессов PTI | 08042-47-5 | Альтернативная стратегия |
| Поверхностно-минерального масла | Evonik Goldschmidt корпорации | ABIL EM 90 | Альтернативная стратегия |
| Tygon ПВХ труб | SmallParts | TGY-010 | |
| 30 калибровочных Луер-Лок иглу шприца, 1/2 " | SmallParts | NE-301PL-C | |
| Инвертационный микроскоп | Carl Zeiss изображений | Axio Observer.Z1 | |
| Камера высокого скорости | Vision Research | Phantom V310 | |
| Шприцевые насосы (2) | Chemyx Инк | Nexus 3000 | |
| Силиконовое масло | Dow Corning | 200 жидкости, 10 сСт | Опционально для хранения эмульсии |
Ссылки
- Zagnoni, M., Lain, G. L. e., Cooper, J. M. Electrocoalescence mechanisms of microdroplets using localized electric fields in microfluidic channels. Langmuir : the ACS journal of surfaces and colloids. 26, 14443-14449 (2010).
- Niu, X. Z., Gielen, F., Edel, J. B., deMello, A. J. A microdroplet dilutor for high-throughput screening. Nat. Chem. 3, 437-442 (2011).
- Vincent, M. E., Liu, W., Haney, E. B., Ismagilov, R. F. Microfluidic stochastic confinement enhances analysis of rare cells by isolating cells and creating high density environments for control of diffusible signals. Chemical Society reviews. 39, 974-984 (2010).
- Huebner, A. Quantitative detection of protein expression in single cells using droplet microfluidics. Chemical communications. , 1218-1220 (2007).
- Love, J. C., Ronan, J. L., Grotenbreg, G. M., van der Veen, A. G., Ploegh, H. L. A microengraving method for rapid selection of single cells producing antigen-specific antibodies. Nature biotechnology. 24, 703-707 (2006).
- Bradshaw, E. M. Concurrent detection of secreted products from human lymphocytes by microengraving: Cytokines and antigen-reactive antibodies. Clin. Immunol. 129, 10-18 (2008).
- Liu, W. S., Kim, H. J., Lucchetta, E. M., Du, W. B., Ismagilov, R. F. Isolation, incubation, and parallel functional testing and identification by FISH of rare microbial single-copy cells from multi-species mixtures using the combination of chemistrode and stochastic confinement. Lab on a chip. 9, 2153-2162 (2009).
- Boedicker, J. Q., Li, L., Kline, T. R., Ismagilov, R. F. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics. Lab on a chip. 8, 1265-1272 (2008).
- Koster, S. Drop-based microfluidic devices for encapsulation of single cells. Lab on a chip. 8, 1110-1115 (2008).
- Kelly, R. T., Page, J. S., Marginean, I., Tang, K., Smith, R. D. Dilution-free analysis from picoliter droplets by nano-electrospray ionization mass spectrometry. Angew Chem. Int. Ed. Engl. 48, 6832-6835 (2009).
- Hong, J., deMello, A. J., Jayasinghe, S. N. Bio-electrospraying and droplet-based microfluidics: control of cell numbers within living residues. Biomedical materials. 5, 21001 (2010).
- Edd, J. F. Controlled encapsulation of single-cells into monodisperse picolitre drops. Lab on a chip. 8, 1262-1264 (2008).
- Anna, S. L., Bontoux, N., Stone, H. A. Formation of dispersions using "flow focusing" in microchannels. Applied Physics Letters. 82, 364 (2003).
- Utada, A., Fernandez-Nieves, A., Stone, H., Weitz, D. Dripping to Jetting Transitions in Coflowing Liquid Streams. Physical Review Letters. 99, (2007).
- Chabert, M., Viovy, J. L. Microfluidic high-throughput encapsulation and hydrodynamic self-sorting of single cells. Proceedings of the National Academy of Sciences of the United States of America. 105, 3191-3196 (2008).
- Segrí, G., Silberberg, A. Radial Particle Displacements in Poiseuille Flow of Suspensions. Nature. 189, 209-210 (1961).
- Carlo, D. D. i. Inertial microfluidics. Lab on a chip. 9, 3038-3046 (2009).
- Carlo, D. D. i., Edd, J., Humphry, K., Stone, H., Toner, M. Particle Segregation and Dynamics in Confined Flows. Physical Review Letters. 102, (2009).
- Humphry, K. J., Kulkarni, P. M., Weitz, D. A., Morris, J. F., Stone, H. A. Axial and lateral particle ordering in finite Reynolds number channel flows. Physics of Fluids. 22, 081703 (2010).
- Lee, W., Amini, H., Stone, H. A., Carlo, D. D. i. Dynamic self-assembly and control of microfluidic particle crystals. Proceedings of the National Academy of Sciences of the United States of America. 107, 22413 (2010).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane. Anal. Chem. 70, 4974-4984 (1998).
- Kotz, K., Cheng, X., Toner, M. PDMS Device Fabrication and Surface Modification. J. Vis. Exp. (8), e319 (2007).
- Haubert, K., Drier, T., Beebe, D. PDMS bonding by means of a portable, low-cost corona system. Lab on a chip. 6, 1548-1549 (2006).
- Hatch, A. C. 1-Million droplet array with wide-field fluorescence imaging for digital PCR. Lab on a chip. , 3838-3845 (2011).
- Holtze, C. Biocompatible surfactants for water-in-fluorocarbon emulsions. Lab on a chip. 8, 1632-1639 (2008).
- Garstecki, P., Stone, H., Whitesides, G. Mechanism for Flow-Rate Controlled Breakup in Confined Geometries: A Route to Monodisperse Emulsions. Physical Review Letters. 94, (2005).
- Garstecki, P., Fuerstman, M. J., Stone, H. A., Whitesides, G. M. Formation of droplets and bubbles in a microfluidic T-junction-scaling and mechanism of break-up. Lab on a chip. 6, 437-446 (2006).
- Nie, Z. Emulsification in a microfluidic flow-focusing device: effect of the viscosities of the liquids. Microfluidics and Nanofluidics. , (2008).
- Holt, D. J., Payne, R. J., Chow, W. Y., Abell, C. Fluorosurfactants for microdroplets: interfacial tension analysis. Journal of colloid and interface science. 350, 205-211 (2010).
- Holt, D. J., Payne, R. J., Abell, C. Synthesis of novel fluorous surfactants for microdroplet stabilisation in fluorous oil streams. Journal of Fluorine Chemistry. 131, 398-407 (2010).
- Hatch, A. C., Fisher, J. S., Pentoney, S. L., Yang, D. L., Lee, A. P. Tunable 3D droplet self-assembly for ultra-high-density digital micro-reactor arrays. Lab on a chip. 11, 2509-2517 (2011).
- Baret, J. C. Surfactants in droplet-based microfluidics. Lab on a chip. 12, 422-433 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены