Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Modelado Hemorragia intracerebral en ratones: La inyección de sangre autóloga o colagenasa bacteriana
En este artículo
Resumen
Modelos animales clínicamente relevante de hemorragia intracerebral (HIC) son necesarios para profundizar en el conocimiento de accidente cerebrovascular hemorrágico y examinar nuevas estrategias terapéuticas. En este estudio, se describe y evaluar dos modelos que implementan ICH inyecciones unilaterales de sangre autóloga o bien total o colagenasa bacteriana en los ganglios basales (corpus striatum) de ratones.
Resumen
Hemorragia intracerebral espontánea (ICH) define una enfermedad potencialmente mortal neurológico que representa el 10-15% de todas las hospitalizaciones relacionadas con la carrera y para los cuales no hay tratamientos efectivos disponibles hasta la fecha 1,2. Debido a la heterogeneidad de la HIC en los seres humanos, diferentes modelos preclínicos son necesarios para explorar a fondo posibles estrategias terapéuticas 3. ICH Experimental es comúnmente inducida en los roedores mediante inyección intraparenquimatosa de cualquiera de sangre autóloga o colagenasa bacteriana 4. El modelo apropiado se selecciona basándose en la fisiopatología de la inducción y progresión de la lesión hemorragia. El modelo de inyección de sangre imita una hemorragia rápidamente progresivo. Alternativamente, colagenasa bacteriana enzimáticamente interrumpe la lámina basal de los capilares del cerebro, causando una hemorragia activos que generalmente se desarrolla durante varias horas 5. Edema resultante perihematoma y déficits neurofuncionales se puede cuantificar vaivénm ambos modelos. En este estudio, hemos descrito y evaluado un modelo modificado de doble inyección de sangre autóloga conjunto 6, así como un modelo de inyección de ICH de colagenasa bacteriana 7, ambos de los cuales objetivo de los ganglios basales (corpus striatum) de machos CD-1 ratones. Se evaluaron los déficits neurofuncionales y edema cerebral a las 24 y 72 horas después de la inducción de ICH. Inyección intraestriatal de sangre autóloga (30 l) o colagenasa bacteriana (0.075U) causada reproducibles déficit neurofuncionales en ratones y edema cerebral aumentado significativamente a las 24 y 72 h después de la cirugía (p <0,05). En conclusión, tanto los modelos de rendimiento consistentes infartos hemorrágicos y representan métodos básicos para la investigación preclínica ICH.
Protocolo
Todos los procedimientos se realizaron de acuerdo con la Guía del NIH para el Cuidado y Uso de Animales de Laboratorio y aprobados por el Cuidado de Animales y el empleo Comisión de Loma Linda University.
1. Preparación prequirúrgica
Técnicas asépticas se recomiendan para todos los procedimientos quirúrgicos. Desinfecte el aparato estereotáxico y preparar instrumentos quirúrgicos estériles antes de la cirugía. Use el equipo de protección personal (EPP) durante todo el manejo animal. Use una almohadilla eléctrica durante la cirugía para mantener la temperatura corporal del animal fisiológico.
- Pesar el ratón 8-12 semanas de edad mediante una escala haz animales triple.
- Co-inyectar ketamina (100 mg / kg) y xilazina (10 mg / kg) por vía intraperitoneal luego permitir 7-10 minutos a que la anestesia surta efecto (monitor para una adecuada sedación).
- Coloque el ratón sobre una manta térmica y afeitarse la cabeza.
- Aplique ungüento oftálmico en ambos ojos.
- Asegure ellas vías respiratorias, moviendo suavemente la lengua lateralmente, y asegurar cuidadosamente la cabeza del ratón sobre el aparato estereotáxico. Nota: La cabeza debe estar asegurado horizontalmente a la base del marco estereotáxico.
- Desinfecte el área quirúrgica con Betadine y enjuague con un 70% de etanol. Repita alternando aplicaciones de Betadine y etanol al 70% para un total de tres veces. Aplicadores con punta de algodón se puede utilizar para este propósito.
2. Sangre modelo de inyección
- Haz un 1 cm de largo incisión de línea media del cuero cabelludo con una hoja de bisturí # 10.
- Utilice aplicadores con punta de algodón para eliminar el tejido blando que cubre el cráneo, con el fin de exponer el punto de intersección perpendicular de la sutura coronal y sagital (bregma).
- Montar la jeringa de Hamilton (250 l) a la bomba de inyección, y estereotáxicamente dirigir la aguja (26 Gauge) durante bregma.
- A continuación, ajuste los brazos manipuladores estereotácticas para colocar la aguja de 0,2 mm por delante y 2mm lateralmente a la derecha. En estas coordenadas hacer un pequeño agujero craneal rebaba, utilizando un taladro de velocidad variable con una broca de 1 mm.
- Suspender la cola del animal y desinfectar su superficie inferior con 70% de etanol.
- La punción de la arteria central de la cola con una aguja estéril (por ejemplo, 26 Gauge) y recoger la sangre arterial en un tubo capilar unheparinized.
- Transfiera la sangre rápidamente del tubo capilar en el cuerpo de vidrio de la jeringa Hamilton, a continuación, insertar el émbolo.
- Vuelva a colocar el l ahora de 30 años o más de sangre arterial que contiene una jeringa Hamilton en la bomba de inyección e inserte la aguja (con el borde biselado hacia la sutura sagital) a través del orificio de trepanación sólo hasta que su bisel ya no es visible.
- Desde este punto de avance de la aguja 3 mm ventralmente e inyectar 5 l de sangre autóloga a razón de 2 l / min.
- Después de la terminación de la primera avance de inyección de la aguja 0,7 mm más en profundidad.
- Esperar5 min y después se inyectan 25 l de sangre en el cuerpo estriado derecho.
- Al término de la segunda inyección, deje la aguja en la posición de 10 minutos adicionales, antes de retirarlo a una velocidad de 1 mm / min.
- Selle el orificio de trepanación con cera de hueso y suturar la piel.
- Para la analgesia postoperatoria inyectar 0,05 mg / kg de buprenorfina por vía subcutánea en precalentadas líquidos (solución salina normal).
3. La colagenasa modelo de inyección
- A raíz de los preparativos prequirúrgicos, repita los pasos 1-4 como se describe para el modelo de inyección de sangre.
- Llene la jeringa Hamilton (10 l) con 0.075U de bacterias (clostridios) colagenasa VII-S disolvió en 0,5 l de solución salina. Evitar la formación de burbujas de aire.
- Vuelva a colocar la jeringa Hamilton en la bomba de inyección e inserte la aguja (26 Gauge), a través del orificio de trepanación sólo hasta que su bisel ya no es visible.
- Avance la aguja de 3,7 mm ventral e inyectar el 0.075U de la colagenasa into el cuerpo estriado derecho a un ritmo de 2 l / min.
- Una vez completada la inyección, deje la aguja en la posición de 10 minutos adicionales, antes de retirarlo a una velocidad de 1 mm / min.
- Selle el orificio de trepanación con cera de hueso y suturar la piel.
- Inyectar 0,05 mg / kg de buprenorfina por vía subcutánea en precalentadas post-operatorias fluidos.
4. Sham operación
- A raíz de los preparativos prequirúrgicos, repita los pasos 1-4 como se describe para el modelo de inyección de sangre.
- Inserte la aguja (26 Gauge) 3,7 mm ventral a través del orificio de trepanación. La aguja debe permanecer en posición durante 10 min antes de ser retirado a una velocidad de 1 mm / min.
- Selle el orificio de trepanación con cera de hueso y suturar la piel.
- Inyectar 0,05 mg / kg de buprenorfina por vía subcutánea en precalentadas post-operatorias fluidos.
5. Los resultados representativos
Hemorragia intraestriatal Experimental evoca morfológica comoasí como los cambios de comportamiento en los roedores. Estos cambios pueden ser evaluados para asegurar una adecuada ejecución del procedimiento, o para investigar los efectos de los tratamientos potenciales. La generación de la hemorragia en un área del cerebro específica (ganglios de la base, por ejemplo) es más esencial para un enfoque reproducible, y puede ser verificada en las secciones del cerebro brutos o teñido histológico (Figura 1-2). La lesión de los resultados de los ganglios basales en los déficits sensoriomotoras, que pueden ser cuantificados a través de diversas evaluaciones del comportamiento. Resultados de la prueba de esquina a su vez mostraron que, después experimental del lado derecho ICH, los ratones resultó significativamente más a menudo ipsilateralmente y lejos de la alteración contralateral (izquierda), con operación simulada que los animales a las 24 y 72 h después de la cirugía (Figura 3 A). Además, la capacidad de colocar adecuadamente la alteración (a la izquierda) extremidad anterior en una superficie, después de la estimulación vibrisas, se evaluó mediante el test de extremidad anterior de colocación. A las 24 y 72 horas después de la cirugía, ratones subproyectada para el lado derecho ICH mostraron las colocaciones significativamente menos que los animales operación simulada. La medición de edema cerebral se emplea con frecuencia para cuantificar la extensión de la lesión cerebral después de ICH experimental. Las inyecciones intracerebrales de sangre autóloga (30 l) o colagenasa bacteriana (0,075 U) condujo a un aumento significativo del contenido de agua del cerebro en la corteza ipsilateral y los ganglios basales en 24 (Figura 4 A) y 72 h (Figura 4 B) después de la cirugía ( en comparación con el tratamiento simulado). El resultado de las pruebas de comportamiento (Figura 3) y el grado de edema cerebral (Figura 4) no mostraron diferencias entre la sangre y los modelos de inyección de colagenasa en volúmenes dados.
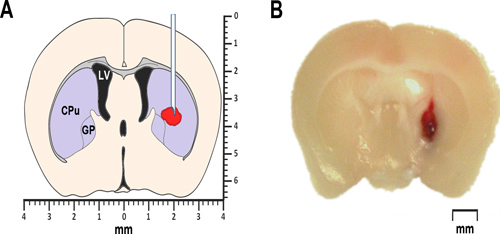
Figura 1. Modelado de la HIC en ratones. (A) El esquema simplificado de una sección coronal del cerebro 0,2 mm anterior del bregma ilustra la proposed ubicación de sangre autóloga o inyección de colagenasa. El ventrículo lateral se marca LV. CPU significa caudado-putamen, una parte del cuerpo estriado, y GP identifica el globus pallidus. Ambos, el cuerpo estriado, así como el globus pallidus pertenecen a un grupo de sub-cortical núcleos, también conocida como los ganglios basales. (B) Representante microfotografía de una sección coronal del cerebro anterior de 0,2 mm bregma, obtenido a las 24 h después de la inyección intraestriatal de sangre entera autóloga.
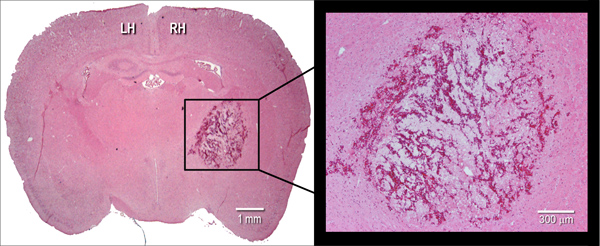
Figura 2. Manifestación histológica del hematoma. Representante hematoxilina y eosina (H & E) criosección manchado coronal (10 micras) de un cerebro de ratón, que ilustra el tamaño del hematoma a las 24 h después de la inyección intraestriatal de colagenasa bacteriana (0,075 U). LH = hemicuerpo izquierdo, HR = hemisferio derecho.
< img alt = "Figura 3" src = "/ files/ftp_upload/4289/4289fig3.jpg" />
Figura 3. Evaluaciones neurofuncionales siguientes ICH experimental en ratones. Inyección intraestriatal de sangre autóloga (30 l) o colagenasa bacteriana (0,075 U) causada reproducibles déficit neurofuncionales. (A) ratones después de ICH experimental mostró vueltas significativamente más derecho que los animales operación simulada a 24 y 72 h después de la cirugía. (B) La capacidad de colocar las patas delanteras de la extremidad izquierda se vio afectada después de ICH a las 24 y 72 horas después de la cirugía. Los valores se expresan como media ± SEM y analizados con el test de Kruskal-Wallis de análisis de varianza unidireccional en Ranks, seguido por el método de Student-Newman-Keuls. Un valor de P <0,05 fue considerado estadísticamente significativo, n = 6-12 por grupo, * p <0,05 en comparación con el tratamiento simulado. Haga clic aquí para ampliar la cifra .
igura 4 "src =" / files/ftp_upload/4289/4289fig4.jpg "/>
Figura 4. Evaluación del contenido de agua del cerebro después de ICH experimental en ratones. Inyección intracerebral de sangre autóloga (30 l) o colagenasa bacteriana (0,075 U) llevó a un aumento significativo del contenido de agua del cerebro en la corteza ipsilateral y los ganglios basales en 24 (A) y 72 hr (B) después de ICH-inducción. Los valores se expresan como media ± SEM y analizados con una forma de análisis de varianza, seguido de Tukey test post hoc. Un valor de P <0,05 fue considerado estadísticamente significativo, n = 6-10 por grupo, * p <0,05 en comparación con el tratamiento simulado. Haga clic aquí para ampliar la cifra .
Discusión
Los modelos animales de hemorragia intracerebral (ICH), contribuyen en gran medida a una comprensión avanzada de la fisiopatología de la enfermedad, y se utilizan para desarrollar y evaluar nuevas estrategias terapéuticas en un ambiente preclínica. Intraparenquimatosa inyecciones de sangre autóloga o colagenasa bacteriana son métodos bien establecidos para generar ICH en los roedores. Ambos métodos se desarrollaron inicialmente en la rata, sin embargo, debido a la disponibilidad creciente de cepas transgénicas y...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este estudio fue parcialmente apoyado por el NIH subvención RO1NS053407 a JH Zhang. Nos gustaría dar las gracias al Sr. Damon Klebe por sus valiosas contribuciones.
Materiales
| Name | Company | Catalog Number | Comments |
| Material | Empresa | Número de catálogo | Comentario |
| Marco de Head estereotáctica | Stoelting Co. | 51600 | |
| Nanomite bomba de jeringa | Harvard Apparatus | PY2 70-2217 | |
| Jeringa Hamilton | Hamilton Company | 1725RN (250 l) 1701 RN (10 l) | 26 Indicador de aguja de 250 l y 10 jeringas mu l. |
| Microtaladro | Herramientas Artes Ciencias | 18000-17 | |
| Microtaladro rebaba | Herramientas Artes Ciencias | 19007-09 | 0,9 mm de diámetro |
| Colagenasa de tipo VII-S | Sigma-Aldrich | C2399 | |
| Tubos capilares de microhematocrito | Fisher Scientific | 22-362-574 | unheparinized |
| Bone Wax | Ethicon | W31 | |
| Suture | Ethicon | 1676G | |
| La ketamina | JHP Farmacia | 42023-115-10 | Ketalar |
| Xilazina | LLOYD Laboratorios | 139-236 | AnaSed |
Referencias
- Broderick, J. P. Guidelines for the management of spontaneous intracerebral hemorrhage: A statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Stroke. 30, 905-915 (1999).
- Qureshi, A. I., Mendelow, A. D., Hanley, D. F. Intracerebral haemorrhage. Lancet. 373, 1632-1644 (2009).
- MacLellan, C. L., Silasi, G., Auriat, A. M., Colbourne, F. Rodent models of intracerebral hemorrhage. Stroke. 41, 95-98 (2010).
- James, M. L., Warner, D. S., Laskowitz, D. T. Preclinical models of intracerebral hemorrhage: a translational perspective. Neurocrit Care. 9, 139-152 (2008).
- MacLellan, C. L. Intracerebral hemorrhage models in rat: comparing collagenase to blood infusion. J. Cereb. Blood Flow Metab. 28, 516-525 (2008).
- Belayev, L. Experimental intracerebral hemorrhage in the mouse: histological, behavioral, and hemodynamic characterization of a double-injection model. Stroke. 34, 2221-2227 (2003).
- Clark, W., Gunion-Rinker, L., Lessov, N., Hazel, K. Citicoline treatment for experimental intracerebral hemorrhage in mice. Stroke. 29, 2136-2140 (1998).
- Nakamura, T. Intracerebral hemorrhage in mice: model characterization and application for genetically modified mice. J. Cereb. Blood Flow Metab. 24, 487-494 (2004).
- Schallert, T. Behavioral tests for preclinical intervention assessment. NeuroRx. 3, 497-504 (2006).
- Hartman, R., Lekic, T., Rojas, H., Tang, J., Zhang, J. H. Assessing functional outcomes following intracerebral hemorrhage in rats. Brain Res. 1280, 148-157 (2009).
- Hua, Y. Behavioral tests after intracerebral hemorrhage in the rat. Stroke. 33, 2478-2484 (2002).
- Tang, J. Mmp-9 deficiency enhances collagenase-induced intracerebral hemorrhage and brain injury in mutant mice. J. Cereb. Blood Flow Metab. 24, 1133-1145 (2004).
- Ma, Q. Vascular adhesion protein-1 inhibition provides antiinflammatory protection after an intracerebral hemorrhagic stroke in mice. J. Cereb. Blood Flow Metab. , (2010).
- Bullock, R., Mendelow, A. D., Teasdale, G. M., Graham, D. I. Intracranial haemorrhage induced at arterial pressure in the rat. Part 1: Description of technique, ICP changes and neuropathological findings. Neurol Res. 6, 184-188 (1984).
- Yang, G. Y., Betz, A. L., Chenevert, T. L., Brunberg, J. A., Hoff, J. T. Experimental intracerebral hemorrhage: relationship between brain edema, blood flow, and blood-brain barrier permeability in rats. J. Neurosurg. 81, 93-102 (1994).
- Rosenberg, G. A., Mun-Bryce, S., Wesley, M., Kornfeld, M. Collagenase-induced intracerebral hemorrhage in rats. Stroke. 21, 801-807 (1990).
- Alkayed, N. J. Gender-linked brain injury in experimental stroke. Stroke. 29, 159-165 (1998).
- Saha, J. K., Xia, J., Grondin, J. M., Engle, S. K., Jakubowski, J. A. Acute hyperglycemia induced by ketamine/xylazine anesthesia in rats: mechanisms and implications for preclinical models. Exp Biol Med. (Maywood). 230, 777-784 (2005).
- Fujiwara, N. Effect of normobaric oxygen therapy in a rat model of intracerebral hemorrhage. Stroke. 42, 1469-1472 (2011).
- Khatibi, N. H. Isoflurane posttreatment reduces brain injury after an intracerebral hemorrhagic stroke in mice. Anesth Analg. 113, 343-348 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados