É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Hemorragia modelagem intracerebral em camundongos: Injeção de sangue autólogo ou colagenase bacteriana
Neste Artigo
Resumo
Modelos animais clinicamente relevantes de hemorragia intracerebral (ICH) são necessários para ampliar nosso conhecimento sobre AVC hemorrágico e para analisar novas estratégias terapêuticas. Neste estudo, descrever e avaliar dois modelos ICH que implementam injeções unilaterais de tanto sangue autólogo todo ou colagenase bacteriana no gânglio basal (corpo estriado) de camundongos.
Resumo
Hemorragia intracerebral espontânea (ICH) define uma doença potencialmente fatal neurológica que responde por 10-15% de todas as internações relacionados ao AVC e para os quais não há tratamentos eficazes estão disponíveis até o momento 1,2. Devido à heterogeneidade do ICH em humanos, vários modelos pré-clínicos são necessários para explorar completamente possíveis estratégias terapêuticas 3. ICH experimental é geralmente induzida em roedores, por injecção ou intraparenquimatosa de sangue autólogo ou colagenase bacteriana 4. O modelo adequado é selecionado com base na fisiopatologia da indução hemorragia e progressão das lesões. O modelo de injeção de sangue imita uma hemorragia evoluindo rapidamente. Alternativamente, a colagenase bacteriana enzimaticamente interrompe a lâmina basal do cérebro capilares, causando uma hemorragia activa, que geralmente se desenvolve ao longo de várias horas 5. Perihematomal edema resultante e déficits neurofuncionais pode ser quantificado from ambos os modelos. Neste estudo, foram descritos e avaliados de um modelo modificado de injecção dupla de sangue total autólogo 6, bem como um modelo de injecção de ICH de colagenase bacteriana 7, ambas as quais alvo os gânglios basais (corpo estriado) do sexo masculino ratinhos CD-1. Foram avaliados os déficits neurofuncionais e edema cerebral em 24 e 72 horas após a indução ICH. Injecção intraestrial de sangue autólogo (30 uL) ou colagenase bacteriana (0.075U) causada reprodutíveis défices neurofuncionais em camundongos e edema cerebral significativamente aumentados em 24 e 72 horas após a cirurgia (p <0,05). Em conclusão, ambos os modelos consistentes produzir infartos hemorrágicos e representam métodos básicos para a pesquisa pré-clínica ICH.
Protocolo
Todos os procedimentos foram realizados de acordo com o Guia de NIH para o Cuidado e Uso de Animais de Laboratório e aprovado pelo Comitê Animal Care e Uso da Universidade Loma Linda.
1. Preparação pré-cirúrgica
Técnicas assépticas são recomendados para todos os procedimentos cirúrgicos. Desinfectar o aparelho estereotáxico e preparar instrumentos cirúrgicos estéreis antes da cirurgia. Usar equipamento de proteção individual (EPI), durante todo o tratamento animal. Use uma almofada de aquecimento durante a cirurgia para manter a temperatura corporal do animal fisiológico.
- Pesar o mouse semana 8-12 de idade usando uma escala animal triplo feixe.
- Co-injecção de cetamina (100 mg / kg) e xilazina (10 mg / kg) por via intraperitoneal, em seguida, permitir que 7-10 minutos para a anestesia tenha efeito (monitor para uma sedação adequada).
- Posicione o mouse sobre um cobertor térmico e raspar o couro cabeludo.
- Aplicar pomada oftálmica para ambos os olhos.
- Fixe avias aéreas, delicadamente movendo a língua lateralmente, e cuidadosamente assegurar a cabeça do rato sobre o aparelho estereotáxica. Nota: A cabeça tem de ser fixada na horizontal para a base da armação estereotáxica.
- Desinfetar a área cirúrgica com Betadine, e enxágüe com etanol 70%. Repita alternando aplicações de Betadine e etanol a 70% para um total de três vezes. Aplicadores com ponta de algodão podem ser utilizados para esta finalidade.
2. Modelo de injeção de sangue
- Faça um 1 centímetro longa incisão na linha média do couro cabeludo com uma lâmina de bisturi n º 10.
- Usar aplicadores com ponta de algodão para limpar o tecido mole que cobre o crânio, a fim de expor o ponto de intersecção perpendicular da sutura sagital e coronal (bregma).
- Montar a seringa de Hamilton (250 ul) para a bomba de injecção, e estereotaxicamente dirigir a agulha (26 Gauge) durante bregma.
- Em seguida, ajuste os braços mecânicos estereotáxicas para posicionar a agulha 0,2 milímetros anterior e 2mm lateralmente para a direita. A estas coordenadas fazer um pequeno orifício de trepanação craniana, usando uma broca de velocidade variável com uma broca de 1 mm.
- Suspender a cauda do animal e desinfectar a sua superfície inferior, com etanol a 70%.
- A punção da artéria cauda central com uma agulha estéril (por exemplo 26 Gauge) e recolher o sangue arterial para um tubo capilar unheparinized.
- Transferir o sangue rapidamente a partir do tubo capilar de vidro para dentro do tambor da seringa de Hamilton, em seguida, inserir o êmbolo.
- Recoloque o ul agora 30 ou mais de sangue arterial contendo seringa de Hamilton para a bomba de injeção e inserir a agulha (com sua borda chanfrada de frente para a sutura sagital) através do orifício de trepanação apenas até seu bisel não é mais visível.
- A partir deste ponto, o avanço da agulha 3 milímetros ventralmente e injectar 5 ul de sangue autólogo, a uma taxa de 2 ul / min.
- Depois de completada a primeira injecção previamente a agulha 0,7 milímetro mais em profundidade.
- Esperar5 min, em seguida, injectar 25 jil de sangue para o corpo estriado direito.
- Após a conclusão da segunda injecção, deixando a agulha em posição por mais 10 min, antes de retirar-lo a uma velocidade de 1 mm / min.
- Selar o furo da rebarba com cera de osso e sutura da pele.
- Para analgesia injectar 0,05 mg / kg de buprenorfina por via subcutânea, em pré-aquecidos fluidos (soro fisiológico normal).
3. Colagenase modelo de injeção
- Seguindo a preparação pré-cirúrgicas, repetir os passos 1-4, como descrito para o modelo de injecção de sangue.
- Encher a seringa de Hamilton (10 ul) com 0.075U de bactérias (Clostridium) colagenase VII-S dissolvidos em 0,5 uL de uma solução salina. Evitar a formação de bolhas de ar.
- Volte a colocar a seringa de Hamilton para a bomba de injeção e inserir a agulha (26 Gauge), através do orifício de trepanação apenas até seu bisel não é mais visível.
- Avançar a agulha 3,7 milímetros ventralmente e injetar o 0.075U de colagenase into striatum a direita a uma taxa de 2 ul / min.
- Após a conclusão da injecção, deixando a agulha em posição por mais 10 min, antes de retirar-lo a uma velocidade de 1 mm / min.
- Selar o furo da rebarba com cera de osso e sutura da pele.
- Injectar de 0,05 mg / kg de buprenorfina por via subcutânea, em pré-aquecidos no pós-operatório fluidos.
4. Operação Sham
- Seguindo a preparação pré-cirúrgicas, repetir os passos 1-4, como descrito para o modelo de injecção de sangue.
- Inserir a agulha (26 Gauge) 3,7 milímetros ventralmente através do orifício de trepanação. A agulha deve permanecer em posição durante 10 minutos, antes de ser retirada a uma taxa de 1 mm / min.
- Selar o furo da rebarba com cera de osso e sutura da pele.
- Injectar de 0,05 mg / kg de buprenorfina por via subcutânea, em pré-aquecidos no pós-operatório fluidos.
5. Resultados representativos
Hemorragia intraestriatal Experimental evoca morfológicabem como alterações comportamentais em roedores. Estas mudanças podem ser avaliados para assegurar uma execução adequada do processo, ou para investigar os efeitos de tratamentos potenciais. Gerando o sangramento em uma área do cérebro alvo (gânglios basais, por exemplo) é mais essencial para uma abordagem reprodutível, e pode ser verificado em seções cerebrais graves ou histologicamente coradas (Figura 1-2). Prejuízo para os resultados dos gânglios da base em alterações sensório-motoras, que podem ser quantificados por meio de várias avaliações comportamentais. Os resultados do teste mostraram que a curva de canto, após HIC do lado direito experimental, os ratos virou uma frequência significativamente superior ipsilateralmente e longe do prejudicada lado (esquerdo) contralateral, com operação simulada do que os animais às 24 e 72 horas após a cirurgia (Figura 3 A). Além disso, a capacidade para colocar adequadamente a prejudicada (esquerda) forelimb numa superfície, após a estimulação das vibrissas, foi avaliada através do teste do membro anterior de colocação. Às 24 e 72 horas após a cirurgia, ratos submetido a do lado direito ICH mostrou colocações significativamente menos do que os animais operação simulada. Medição do edema cerebral é frequentemente empregue para quantificar a extensão da lesão cerebral após hemorragia intracraniana experimental. Injecções intracerebrais de sangue autólogo (30 uL) ou colagenase bacteriana (0,075 U), levou a um aumento significativo do teor de água no córtex ipsilateral e gânglios basais a 24 (Figura 4 A) e 72 h (Figura 4 B) após a cirurgia ( em comparação com placebo). O resultado dos testes de comportamento (Figura 3) e da extensão do edema cerebral (Figura 4) não mostrou qualquer diferença entre o sangue e os modelos de injecção de colagenase em volumes indicados.
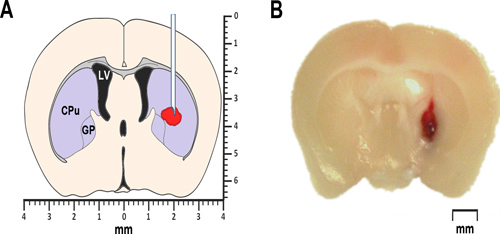
Figura 1. ICH modelagem em ratinhos. (A) O esquema simplificado de uma secção coronal do cérebro anterior de 0,2 milímetros bregma ilustra o proposed localização de sangue autólogo ou injecção colagenase. O ventrículo lateral é marcada LV. CPu significa caudado-putamen, uma parte do corpo estriado, e GP identifica o globus pallidus. Ambos, o striatum, bem como o globo pálido pertencem a um grupo de sub-cortical núcleos, também conhecida como gânglios basais. (B) fotomicrografia representativas de uma secção coronal do cérebro anterior de 0,2 milímetros bregma, obtidos às 24 h após a injecção intraestrial de sangue total autólogo.
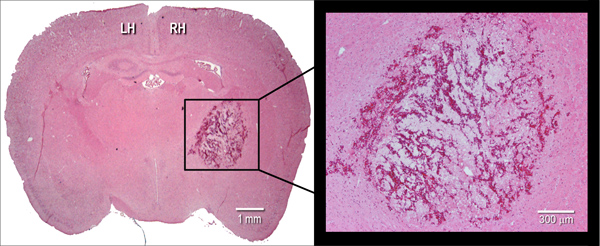
Figura 2. Manifestação histológica do hematoma. Representante hematoxilina e eosina (H & E) criocorte coronal corada (10 mm) de um cérebro de rato, ilustrando tamanho hematoma às 24 h após a injecção intraestrial de colagenase bacteriana (0.075 U). LH = hemisfério esquerdo, RH = hemisfério direito.
< img alt = "Figura 3" src = "files/ftp_upload/4289/4289fig3.jpg /" />
Figura 3. Avaliações neurofuncionais seguintes ICH experimental em ratos. Injecção intraestrial de sangue autólogo (30 uL) ou colagenase bacteriana (0.075 U), causada reprodutíveis défices neurofuncionais. (A) ratos após ICH experimental mostrou espiras significativamente mais direitas do que os animais sham operados a 24 e 72 horas após a cirurgia. (B) A capacidade de colocação das patas dianteiras do membro esquerdo foi alterado após ICH em 24 e 72 horas após a cirurgia. Os valores foram expressos como média ± EPM e analisados com o teste de Kruskal-Wallis análise de variância de sentido único em Ranks, seguido do método de Student-Newman-Keuls. Um valor de p <0,05 foi considerado estatisticamente significativo, n = 6-12 por grupo, * P <0,05 em relação ao placebo. Clique aqui para ver maior figura .
igura 4 "src =" files/ftp_upload/4289/4289fig4.jpg / "/>
Figura 4. Avaliação do conteúdo de água do cérebro após ICH experimental em ratos. Injecção intracerebral de sangue autólogo (30 uL) ou colagenase bacteriana (0.075 U) conduziu a um aumento significativo do teor de água no córtex ipsilateral e gânglios basais de 24 (A) e 72 horas (B) depois de ICH-indução. Os valores foram expressos como média ± EPM e analisados com uma análise de variância, seguido pelo teste de Tukey post hoc. Um valor de p <0,05 foi considerado estatisticamente significativo, n = 6-10 por grupo, * P <0,05 em relação ao placebo. Clique aqui para ver maior figura .
Discussão
Modelos animais de hemorragia intracerebral (ICH) contribuem grandemente para um entendimento avançado da fisiopatologia da doença, e são comumente usados para desenvolver e avaliar novas estratégias terapêuticas em um ambiente pré-clínica. Intraparenquimatosos injecções de sangue autólogo ou colagenase bacteriana são bem estabelecidos métodos para a geração de ICH em roedores. Ambos os métodos foram desenvolvidos inicialmente no rato, no entanto, devido à disponibilidade crescente de estirpes tran...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este estudo foi parcialmente financiado pelo NIH concessão RO1NS053407 a JH Zhang. Gostaríamos de agradecer ao Sr. Damon Klebe por suas valiosas contribuições.
Materiais
| Name | Company | Catalog Number | Comments |
| Material | Companhia | Número de Catálogo | Comentário |
| Quadro Chefe estereotáxica | Stoelting Co. | 51600 | |
| Nanomite bomba de seringa | Harvard Apparatus | PY2 70-2217 | |
| Hamilton Seringa | Hamilton Company | 1725RN (250 ul) 1701 RN (10 ul) | Agulha de calibre 26 para 250 ul e 10 ul de seringas. |
| Microdrill | Belas Science Tools | 18000-17 | |
| Microdrill rebarba | Belas Science Tools | 19007-09 | 0,9 mm de diâmetro |
| Colagenase tipo VII-S | Sigma-Aldrich | C2399 | |
| Microhematócrito tubos capilares | Fisher Scientific | 22-362-574 | unheparinized |
| Cera de osso | Ethicon | W31 | |
| Suture | Ethicon | 1676G | |
| Cetamina | JHP Pharmaceuticals | 42023-115-10 | Ketalar |
| Xilazina | LLOYD Laboratories | 139-236 | AnaSed |
Referências
- Broderick, J. P. Guidelines for the management of spontaneous intracerebral hemorrhage: A statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Stroke. 30, 905-915 (1999).
- Qureshi, A. I., Mendelow, A. D., Hanley, D. F. Intracerebral haemorrhage. Lancet. 373, 1632-1644 (2009).
- MacLellan, C. L., Silasi, G., Auriat, A. M., Colbourne, F. Rodent models of intracerebral hemorrhage. Stroke. 41, 95-98 (2010).
- James, M. L., Warner, D. S., Laskowitz, D. T. Preclinical models of intracerebral hemorrhage: a translational perspective. Neurocrit Care. 9, 139-152 (2008).
- MacLellan, C. L. Intracerebral hemorrhage models in rat: comparing collagenase to blood infusion. J. Cereb. Blood Flow Metab. 28, 516-525 (2008).
- Belayev, L. Experimental intracerebral hemorrhage in the mouse: histological, behavioral, and hemodynamic characterization of a double-injection model. Stroke. 34, 2221-2227 (2003).
- Clark, W., Gunion-Rinker, L., Lessov, N., Hazel, K. Citicoline treatment for experimental intracerebral hemorrhage in mice. Stroke. 29, 2136-2140 (1998).
- Nakamura, T. Intracerebral hemorrhage in mice: model characterization and application for genetically modified mice. J. Cereb. Blood Flow Metab. 24, 487-494 (2004).
- Schallert, T. Behavioral tests for preclinical intervention assessment. NeuroRx. 3, 497-504 (2006).
- Hartman, R., Lekic, T., Rojas, H., Tang, J., Zhang, J. H. Assessing functional outcomes following intracerebral hemorrhage in rats. Brain Res. 1280, 148-157 (2009).
- Hua, Y. Behavioral tests after intracerebral hemorrhage in the rat. Stroke. 33, 2478-2484 (2002).
- Tang, J. Mmp-9 deficiency enhances collagenase-induced intracerebral hemorrhage and brain injury in mutant mice. J. Cereb. Blood Flow Metab. 24, 1133-1145 (2004).
- Ma, Q. Vascular adhesion protein-1 inhibition provides antiinflammatory protection after an intracerebral hemorrhagic stroke in mice. J. Cereb. Blood Flow Metab. , (2010).
- Bullock, R., Mendelow, A. D., Teasdale, G. M., Graham, D. I. Intracranial haemorrhage induced at arterial pressure in the rat. Part 1: Description of technique, ICP changes and neuropathological findings. Neurol Res. 6, 184-188 (1984).
- Yang, G. Y., Betz, A. L., Chenevert, T. L., Brunberg, J. A., Hoff, J. T. Experimental intracerebral hemorrhage: relationship between brain edema, blood flow, and blood-brain barrier permeability in rats. J. Neurosurg. 81, 93-102 (1994).
- Rosenberg, G. A., Mun-Bryce, S., Wesley, M., Kornfeld, M. Collagenase-induced intracerebral hemorrhage in rats. Stroke. 21, 801-807 (1990).
- Alkayed, N. J. Gender-linked brain injury in experimental stroke. Stroke. 29, 159-165 (1998).
- Saha, J. K., Xia, J., Grondin, J. M., Engle, S. K., Jakubowski, J. A. Acute hyperglycemia induced by ketamine/xylazine anesthesia in rats: mechanisms and implications for preclinical models. Exp Biol Med. (Maywood). 230, 777-784 (2005).
- Fujiwara, N. Effect of normobaric oxygen therapy in a rat model of intracerebral hemorrhage. Stroke. 42, 1469-1472 (2011).
- Khatibi, N. H. Isoflurane posttreatment reduces brain injury after an intracerebral hemorrhagic stroke in mice. Anesth Analg. 113, 343-348 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados