Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Моделирование внутримозгового кровоизлияния у мышей: Инъекции аутологичной крови или бактериальной коллагеназы
В этой статье
Резюме
Клинически значимые животных моделях внутримозговое кровоизлияние (ICH) необходимо расширить наши знания о геморрагического инсульта и изучения новых терапевтических стратегий. В данном исследовании мы рассматриваем и оценить две ICH моделей, которые реализуют односторонние инъекции аутологичных или цельной крови или бактериальной коллагеназы в базальных ганглиях (корпус полосатого тела) мышей.
Аннотация
Спонтанные внутримозговые кровоизлияния (ICH) определяет потенциально опасные для жизни неврологическая болезнь, которая составляет 10-15% от всех инсультов госпитализаций в связи и для которой нет эффективного лечения имеются на сегодняшний день 1,2. Из-за неоднородности ICH в организме человека, различных доклинических моделях необходимо тщательно изучить перспективные терапевтические стратегии 3. Экспериментальные ICH обычно индуцированных у грызунов по интрапаренхимальные инъекции либо аутологичной крови или бактериальной коллагеназы 4. Соответствующая модель выбирается на основе патофизиологии индукции кровотечения и травмы прогрессии. Модель имитирует кровь инъекции быстро прогрессирующее кровотечение. Кроме того, бактериальной коллагеназы ферментативно разрушает базальной мембраны капилляров головного мозга, вызывая активное кровотечение, что в целом развивается в течение нескольких часов 5. Результирующая perihematomal отек и нейрофункциональной дефицита может быть определена количественно сюдам обеих моделей. В этом исследовании мы описали и оценили изменение модели двойной инъекции аутологичных цельной крови 6, а также модель ICH введения бактериального коллагеназы 7, оба из которых целевой базальных ганглиев (полосатое тело) мужской CD-1 мышей. Мы оценили нейрофункциональной дефицита и отека головного мозга в 24 и 72 часов после индукции ICH. Intrastriatal инъекции аутологичной крови (30 мкл) или бактериальной коллагеназы (0.075U), вызванных воспроизводимых нейрофункциональной дефицита у мышей и значительно увеличить отек головного мозга через 24 и 72 ч после операции (р <0,05). В заключение обе модели дают последовательное геморрагические инфаркты и представляют основные методы для проведения доклинических исследований ICH.
протокол
Все процедуры были проведены в соответствии с Руководство NIH по уходу и использованию лабораторных животных и одобрен уходу и использованию животных комитета Университета Лома Линда.
1. Предоперационной подготовки
Асептические методы рекомендуются для всех хирургических процедур. Лечить стереотаксической аппарата и подготовить стерильные хирургические инструменты перед операцией. Использовать средства индивидуальной защиты (СИЗ) в течение всего животного обработки. Используйте грелку во время операции для поддержания физиологической температуры тела животного.
- Взвешивание 8-12 недельных мыши, используя тройной шкалой животных пучка.
- Сотрудничество вводить кетамин (100 мг / кг) и ксилазина (10 мг / кг) внутрибрюшинно, то позвольте 7-10 мин для анестезии вступили в силу (монитор для адекватной седации).
- Наведите на тепловое одеяло и бритье головы.
- Применение глазной мази для обоих глаз.
- Закрепитедыхательных путей, осторожно перемещая языком в сторону, и внимательно обеспечения голове мыши на стереотаксической аппаратуры. Примечание: голова должна быть обеспечена горизонтально на основе стереотаксической рамы.
- Лечить хирургической области с Бетадин, и смыть с 70% этанола. Повторите переменного применения Бетадин и 70% этанола в общей сложности три раза. Хлопок наконечником аппликаторы могут быть использованы для этой цели.
2. Модель крови инъекций
- Сделать 1 см в длину срединный разрез кожи головы с № 10 лезвие скальпеля.
- Использование ватным аппликаторы, чтобы убрать мягкую ткань, покрывающая череп, для того, чтобы подвергать точки пересечения перпендикулярна фронтальной и сагиттальной шов (брегмы).
- Установите Гамильтон шприц (250 мкл) на ТНВД, и стереотаксически направить иглу (26 калибр) за темя.
- Затем отрегулируйте стереотаксической манипуляторы для позиционирования иглы 0,2 мм, передняя и 2мм сбоку справа. В этих координатах сделать небольшое отверстие черепа заусенцев, с помощью переменной дрели с 1 мм сверло.
- Приостановить хвост животного и дезинфицировать ее нижней поверхности с 70% этанола.
- Прокол центральной артерии хвоста стерильной иглой (например, 26 калибр) и собирать артериальной крови в unheparinized капиллярной трубке.
- Передача кровь быстро от капиллярной трубке в стакан баррель шприца Гамильтона, а затем вставьте поршень.
- Снова сейчас 30 мкл или более артериальной крови, содержащей Гамильтон шприц на ТНВД и вставить иглу (с его скошенным краем, стоящих перед сагиттального шва) через заусенцев отверстие только до своей конической больше не видна.
- С этой точки заранее иглы 3 мм снизу и вводят 5 мкл аутологичной крови в размере 2 мкл / мин.
- После завершения первого заранее инъекции игла 0,7 мм дальше в глубину.
- Ждать5 мин, затем вводят 25 мкл крови в правое полосатое тело.
- После завершения второй инъекции, оставьте иглу в положение для дополнительных 10 мин, до снятия его со скоростью 1 мм / мин.
- Печать заусенцев отверстие с костью воск и зашить кожу.
- Для послеоперационного обезболивания вводят 0,05 мг / кг бупренорфина подкожно в предварительно нагретой жидкости (физиологический раствор).
3. Коллагеназа инъекций модели
- После предоперационной подготовки, повторите шаги 1-4, как описано для модели инъекции крови.
- Наполните шприц Гамильтон (10 мкл) с 0.075U бактериальной (клостридий) коллагеназы VII-S растворяли в 0,5 мкл физиологического раствора. Избегайте образования пузырьков воздуха.
- Установите на шприце Hamilton на ТНВД и вставить иглу (26 калибр), через заусенцев отверстие только до своей конической больше не видна.
- Переход иглы 3,7 мм снизу и придать 0.075U коллагеназы яNto право стриатума в размере 2 мкл / мин.
- После завершения инъекции, оставить иглу в положение для дополнительных 10 мин, до снятия его со скоростью 1 мм / мин.
- Печать заусенцев отверстие с костью воск и зашить кожу.
- Вводят 0,05 мг / кг бупренорфина подкожно в предварительно нагретой послеоперационный жидкости.
4. Sham операции
- После предоперационной подготовки, повторите шаги 1-4, как описано для модели инъекции крови.
- Вставьте иглу (26 калибр) 3.7 мм снизу через заусенцев отверстие. Игла должна оставаться на месте в течение 10 минут прежде, чем быть сняты со скоростью 1 мм / мин.
- Печать заусенцев отверстие с костью воск и зашить кожу.
- Вводят 0,05 мг / кг бупренорфина подкожно в предварительно нагретой послеоперационный жидкости.
5. Представитель Результаты
Экспериментальные intrastriatal кровоизлияние вызывает морфологические, кака также изменения в поведении грызунов. Эти изменения могут быть оценены для обеспечения адекватного выполнения процедуры, или исследовать влияние потенциальных методов лечения. Создание кровотечение в целевой области мозга (например, базальные ганглии) является наиболее существенным для воспроизводимой подход, и может быть проверена на валовой или гистологически окрашенных срезов головного мозга (рис. 1-2). Повреждение базальных ганглиев в результатах дефицита сенсомоторной, которая может быть определена количественно с помощью различных поведенческих оценок. Результаты теста свою очередь углу показали, что после экспериментальной правосторонней ICH, мышей оказалось значительно чаще ипсилатерально и от нарушения противоположной (левой) стороне, чем притворство работают животных в 24 и 72 часа после операции (рис. 3). Кроме того, способность адекватно разместить нарушениями (слева) передней конечности на поверхность, после стимуляции вибрисс, оценивали с помощью передних конечностей размещения теста. В 24 и 72 ч после операции, мышей к югуподвергнутых правосторонней ICH показали значительно меньше, чем притворство размещения оперированных животных. Измерение отека мозга часто используется для количественной оценки степени повреждения мозга после экспериментального ICH. Внутримозговых инъекций аутологичной крови (30 мкл) или бактериальной коллагеназы (0,075 U) привело к значительному увеличению мозга содержание воды в ипсилатеральной коре головного мозга и базальные ганглии на 24 (рис. 4) и 72 часов (рис. 4 б) после операции ( по сравнению с мнимой). Результаты испытания поведения (рис. 3) и степень отека головного мозга (рис. 4) не выявили различий между кровью и моделей коллагеназы инъекции в данном томах.
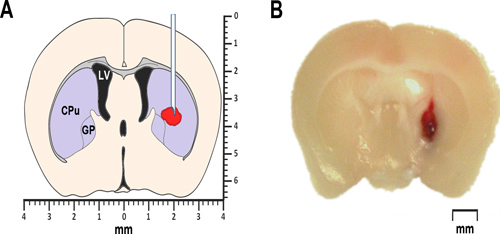
Рисунок 1. Моделирование ICH у мышей. (A) упрощенная схема корональной мозга разделе 0,2 мм, передняя из брегмы иллюстрирует пр.oposed расположение аутологичной крови или инъекции коллагеназы. Бокового желудочка отмечается LV. КПУ за хвостатого-скорлупы, части полосатого тела, и ГП определяет бледного шара. И, полосатом теле, а также бледного шара принадлежат к группе подкорковых ядер, также известный как базальные ганглии. (B) представитель микрофотография корональной мозга разделе 0.2 мм передняя из брегмы, полученные на 24 часа после инъекции intrastriatal аутологичных цельной крови.
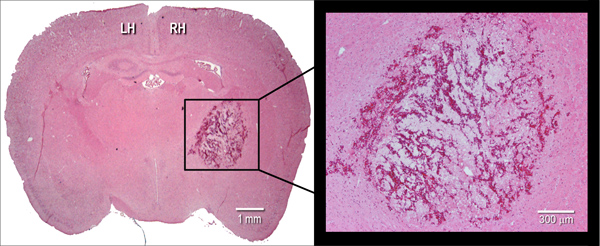
Рисунок 2. Гистологические проявления гематомы. Представитель гематоксилином и эозином (H & E) окрашенных корональной cryosection (10 мкм) из мозга мышей, иллюстрирующие гематомы размером в 24 час после инъекции intrastriatal бактериальной коллагеназы (0,075 U). LH = левое полушарие, RH = правое полушарие.
< IMG ALT = "Рисунок 3" SRC = "/ files/ftp_upload/4289/4289fig3.jpg" />
Рисунок 3. Нейрофункциональной оценок после экспериментальной ICH у мышей. Intrastriatal инъекции аутологичной крови (30 мкл) или бактериальной коллагеназы (0,075 U) вызвало воспроизводимых нейрофункциональной дефицита. (A) мышей после ICH экспериментальных показали значительно больше правых поворотов, чем притворство оперированных животных в 24 и 72 часов после операции. (B) передней лапой размещения емкости левой конечности было нарушено после ICH в 24 и 72 часов после операции. Значения были выражены как среднее ± SEM и проанализированы с Крускала-Уоллиса One Way дисперсионного анализа на ранги, а затем Стьюдента-Ньюмана-Keuls метод. AP значение <0,05 считали статистически значимыми, п = 6-12 в группе, * P <0,05 по сравнению с обманом. Нажмите, чтобы увеличить показатель .
igure 4 "SRC =" / files/ftp_upload/4289/4289fig4.jpg "/>
Рисунок 4. Оценка мозга содержание воды после экспериментальной ICH у мышей. Внутримозговых инъекций аутологичной крови (30 мкл) или бактериальной коллагеназы (0,075 U) привело к значительному увеличению головного мозга содержание воды в ипсилатеральной коре головного мозга и базальные ганглии на 24 (А) и 72 часа (B) после ICH-индукции. Значения были выражены как среднее ± SEM и проанализированы с одной дисперсионного анализа, а затем тест Тьюки постфактум. AP значение <0,05 считали статистически значимыми, п = 6-10 в группе, * P <0,05 по сравнению с обманом. Нажмите, чтобы увеличить показатель .
Обсуждение
Животные модели внутримозгового кровоизлияния (ICH) в значительной степени способствовать передовые понимания патофизиологии болезни, и обычно используются для разработки и оценки новых терапевтических стратегий в доклинических условиях. Интрапаренхимальные инъекции аутологичной ?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Это исследование было частично поддержана NIH грант RO1NS053407 для JH Чжан. Мы хотели бы поблагодарить г-на Дэймона Клебе за его ценный вклад.
Материалы
| Name | Company | Catalog Number | Comments |
| Материал | Компания | Номер по каталогу | Комментировать |
| Стереотаксической рамки руководителя | Stoelting Ко | 51600 | |
| Nanomite шприцевой насос | Harvard Apparatus | PY2 70-2217 | |
| Шприц Гамильтон | Компания Hamilton | 1725RN (250 мкл) 1701 RN (10 мкл) | 26 иглы для 250 мкл и 10 мкл шприца. |
| Microdrill | Средства изобразительных наук | 18000-17 | |
| Microdrill заусенцев | Средства изобразительных наук | 19007-09 | Диаметром 0,9 мм |
| Коллагеназы типа VII-S | Sigma-Aldrich | C2399 | |
| Гематокритной капилляров | Fisher Scientific | 22-362-574 | unheparinized |
| Кость воска | Ethicon | W31 | |
| Шов | Ethicon | 1676G | |
| Кетамин | JHP Фармацевтика | 42023-115-10 | Ketalar |
| Ксилазин | LLOYD лабораторий | 139-236 | AnaSed |
Ссылки
- Broderick, J. P. Guidelines for the management of spontaneous intracerebral hemorrhage: A statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Stroke. 30, 905-915 (1999).
- Qureshi, A. I., Mendelow, A. D., Hanley, D. F. Intracerebral haemorrhage. Lancet. 373, 1632-1644 (2009).
- MacLellan, C. L., Silasi, G., Auriat, A. M., Colbourne, F. Rodent models of intracerebral hemorrhage. Stroke. 41, 95-98 (2010).
- James, M. L., Warner, D. S., Laskowitz, D. T. Preclinical models of intracerebral hemorrhage: a translational perspective. Neurocrit Care. 9, 139-152 (2008).
- MacLellan, C. L. Intracerebral hemorrhage models in rat: comparing collagenase to blood infusion. J. Cereb. Blood Flow Metab. 28, 516-525 (2008).
- Belayev, L. Experimental intracerebral hemorrhage in the mouse: histological, behavioral, and hemodynamic characterization of a double-injection model. Stroke. 34, 2221-2227 (2003).
- Clark, W., Gunion-Rinker, L., Lessov, N., Hazel, K. Citicoline treatment for experimental intracerebral hemorrhage in mice. Stroke. 29, 2136-2140 (1998).
- Nakamura, T. Intracerebral hemorrhage in mice: model characterization and application for genetically modified mice. J. Cereb. Blood Flow Metab. 24, 487-494 (2004).
- Schallert, T. Behavioral tests for preclinical intervention assessment. NeuroRx. 3, 497-504 (2006).
- Hartman, R., Lekic, T., Rojas, H., Tang, J., Zhang, J. H. Assessing functional outcomes following intracerebral hemorrhage in rats. Brain Res. 1280, 148-157 (2009).
- Hua, Y. Behavioral tests after intracerebral hemorrhage in the rat. Stroke. 33, 2478-2484 (2002).
- Tang, J. Mmp-9 deficiency enhances collagenase-induced intracerebral hemorrhage and brain injury in mutant mice. J. Cereb. Blood Flow Metab. 24, 1133-1145 (2004).
- Ma, Q. Vascular adhesion protein-1 inhibition provides antiinflammatory protection after an intracerebral hemorrhagic stroke in mice. J. Cereb. Blood Flow Metab. , (2010).
- Bullock, R., Mendelow, A. D., Teasdale, G. M., Graham, D. I. Intracranial haemorrhage induced at arterial pressure in the rat. Part 1: Description of technique, ICP changes and neuropathological findings. Neurol Res. 6, 184-188 (1984).
- Yang, G. Y., Betz, A. L., Chenevert, T. L., Brunberg, J. A., Hoff, J. T. Experimental intracerebral hemorrhage: relationship between brain edema, blood flow, and blood-brain barrier permeability in rats. J. Neurosurg. 81, 93-102 (1994).
- Rosenberg, G. A., Mun-Bryce, S., Wesley, M., Kornfeld, M. Collagenase-induced intracerebral hemorrhage in rats. Stroke. 21, 801-807 (1990).
- Alkayed, N. J. Gender-linked brain injury in experimental stroke. Stroke. 29, 159-165 (1998).
- Saha, J. K., Xia, J., Grondin, J. M., Engle, S. K., Jakubowski, J. A. Acute hyperglycemia induced by ketamine/xylazine anesthesia in rats: mechanisms and implications for preclinical models. Exp Biol Med. (Maywood). 230, 777-784 (2005).
- Fujiwara, N. Effect of normobaric oxygen therapy in a rat model of intracerebral hemorrhage. Stroke. 42, 1469-1472 (2011).
- Khatibi, N. H. Isoflurane posttreatment reduces brain injury after an intracerebral hemorrhagic stroke in mice. Anesth Analg. 113, 343-348 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены