Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Farelerde Modelleme İntraserebral Kanama: Otolog Kan veya bakteriyel kollajenaz Enjeksiyon
Bu Makalede
Özet
Intraserebral kanama (İSK) ve Klinik ilgili hayvan modelleri hemorajik inme bilgimizi genişletmek ve yeni tedavi stratejileri incelemek gereklidir. Bu çalışmada, biz tanımlamak ve farelerin bazal ganglion (korpus striatum) içine otolog tam kan ya da bakteriyel kollajenaz ya tek taraflı enjeksiyon uygulamak iki ICH modelleri değerlendirir.
Özet
Spontan intraserebral kanama (İSK) tüm inme ile ilişkili hastaneye yatışların% 10-15 ve hiçbir etkili tedavi 1,2 bugüne kadar mevcut olduğu için hesapları potansiyel olarak yaşamı tehdit eden nörolojik illet tanımlar. Çünkü insanlarda İSH heterojenliği, çeşitli preklinik modeller iyice 3 prospektif tedavi stratejileri keşfetmek için ihtiyaç vardır. Deneysel ICH yaygın otolog kan ya da bakteriyel ya da kollajenaz 4 arasında intraparenkimal enjeksiyon yoluyla kemirgenlerde meydana gelir. Uygun modeli kanama indüksiyon ve yaralanma ilerleme patofizyolojisi dayanarak seçilir. Kan enjeksiyon modeli bir hızla ilerleyen kanama taklit eder. Alternatif olarak, bakteriyel kollajenaz enzimatik genellikle birkaç saat içindeki 5 geliştikçe aktif kanama neden, beyin kılcal damarların bazal lamina bozar. Sonuç perihematomal ödem ve nöro açıkları fro ölçülebilirm modelleri hem. Bu çalışmada açıklanan ve otolog kan 6 modifiye edilmiş bir çift enjeksiyon modeli hem de bakteri kollajenaz 7'nin bir ICH enjeksiyon modeli, her ikisi de hedef erkek CD-1 mice ve bazal gangliyonlar (corpus striatum). Değerlendirildi Biz ICH indüksiyon sonrası nörofonksiyonel açıkları ve 24. beyin ödemi ve 72 saat değerlendirilmiştir. Otolog kan (30 ul) veya bakteriyel kollajenaz (0.075U) arasında intrastriatal enjeksiyonu farelerde tekrarlanabilir nörofonksiyonel açıkları ve ameliyat sonrası anlamlı artış beynin 24 ödem ve 72 saat (p <0.05) neden oldu. Sonuç olarak, her iki model de tutarlı hemorajik enfarkt verim ve preklinik ICH araştırma için temel yöntemlerini temsil eder.
Protokol
Tüm prosedürler Laboratuvar Hayvanlarının Bakımı ve Kullanımı için NIH Kılavuz uygun olarak yürütülmesi ve Loma Linda Üniversitesi Hayvan Bakım ve Kullanım Kurulu tarafından onaylanmıştır.
1. Cerrahi öncesi hazırlıklar
Aseptik teknikler tüm cerrahi işlemler için tavsiye edilir. Stereotaktik cihazları dezenfekte ve cerrahi öncesinde steril cerrahi araçları hazırlamak. Tüm hayvan taşıma sırasında kişisel koruyucu ekipman (KKE) giyin. Hayvanın fizyolojik vücut ısısını korumak için ameliyat sırasında bir ısıtma yastığı kullanın.
- Bir üçlü ışın hayvan ölçeği kullanılarak 8-12 hafta eski fare tartılır.
- Co-enjekte ketamin (100 mg / kg) ve ksilazin (10 mg / kg) intraperitoneal sonra anestezi için 7-10 dk (yeterli bir sedasyon için monitör) etkili olması için izin.
- Bir termal battaniye üzerine fare yerleştirin ve kafa derisi traş.
- Her iki göze oftalmik merhem uygulayın.
- Güvenlihavayolu, hafifçe yanal dil hareket ve dikkatle stereotaktik cihaz üzerine fare kafası sabitleyin. Not: baş stereotaksik çerçeve temelinde yatay olarak korunmalıdır.
- Betadine ile cerrahi alanında dezenfekte ve% 70 etanol ile yıkayın. Üç kez toplam Betadin ve% 70 etanol ile ve uygulamaları alternatif tekrarlayın. Pamuk uçlu aplikatör bu amaç için kullanılabilir.
2. Kan Enjeksiyon Modeli
- Bir # 10 Bistüri ile kafa derisi bir 1 cm uzunluğunda orta hat kesi olun.
- Koronal ve sagittal sütür (bregma) ve dik kesişme noktasında ortaya koymak için, kafatası kapsayan yumuşak doku kaldırmak için pamuk uçlu aplikatör kullanın.
- Enjeksiyon pompası üzerine Hamilton şırınga (250 ul) monte edin ve steriotaksik bregma üzerinde iğne (26 Gauge) yönlendirin.
- Daha sonra, iğne 0,2 mm konumlandırmak için stereotaktik manipülatör kollar ayarlamak ön ve 2yanal sağa mm. At bu koordinatları bir 1 mm matkap ucu ile bir değişken devirli kullanarak küçük bir kafatası burr hole yapmak.
- Hayvanın kuyruk askıya alınması ve% 70 etanol ile alt yüzeyi dezenfekte.
- Delinme merkezi kuyruk steril bir iğne (örneğin 26 Gauge) ile arter ve heparinize olmayan kapiler tüp içine kan toplamak.
- Hamilton şırıngası cam varil içine kılcal tüp hızla kan aktarın, sonra dalgıç yerleştirin.
- Enjeksiyon pompası üzerine Hamilton şırınga içeren arteriyel kan artık 30 ul veya daha fazla tekrar takın ve konik artık görünür sadece kadar burr deliğinden iğne (sutur bakan eğimli kenar ile) sokun.
- Bu noktadan itibaren önceden iğne 3 mm ve ventral 2 ul / dak 'lık bir hızla otolog kan 5 ul enjekte edilir.
- Ilk enjeksiyon önceden derinlik de iğne 0.7 mm tamamlanmasından sonra.
- Beklemek5 dk sonra sağ striatum içine kan 25 ul enjekte.
- İkinci enjeksiyon tamamlanmasından sonra, 1 mm / dak 'lık bir hızla o çekilmeden önce, ilave 10 dakika boyunca bir konumda iğne bırakın.
- Kemik balmumu ile burr hole Seal ve cilt sütüre.
- Postoperatif analjezi için önceden ısıtılmış sıvılar (normal salin) subkütan olarak buprenorfin 0.05 mg / kg enjekte.
3. Kollajenaz Enjeksiyon Modeli
- Kan enjeksiyonu modeli için açıklandığı gibi cerrahi öncesi hazırlıklar tamamlandıktan sonra, tekrar 1-4 adımları.
- 0.5 ul tuzlu su içinde çözülmüş bakteri (clostridial) kolajenaz VII-S 0.075U ile Hamilton şırınga (10 ul) doldurun. Hava kabarcıklarının oluşumunu önleyiniz.
- Enjeksiyon pompası üzerine Hamilton şırınga takın ve konik artık görünür sadece kadar burr deliğinden, iğne (26 Gauge) takın.
- Ventral iğne 3,7 mm ilerletin ve kollajenaz 0.075U enjekte i2 ul / dak 'lık bir hızla nto doğru striatuma.
- Enjeksiyon tamamlandığında, 1 mm / dak 'lık bir hızla o çekilmeden önce, ilave 10 dakika boyunca bir konumda iğne bırakın.
- Kemik balmumu ile burr hole Seal ve cilt sütüre.
- Önceden ısıtılmış post-operatif sıvılar içinde subkutan olarak buprenorfinin 0.05 mg / kg enjekte edilir.
4. Sham Operasyonu
- Kan enjeksiyonu modeli için açıklandığı gibi cerrahi öncesi hazırlıklar tamamlandıktan sonra, tekrar 1-4 adımları.
- Burr deliğinden ventral iğne (26 Gauge) 3.7 mm takın. İğne 1 mm / dak 'lık bir hızla içe dönük edilmeden önce 10 dakika boyunca bir konumda kalması gerekmektedir.
- Kemik balmumu ile burr hole Seal ve cilt sütüre.
- Önceden ısıtılmış post-operatif sıvılar içinde subkutan olarak buprenorfinin 0.05 mg / kg enjekte edilir.
5. Temsilcisi Sonuçlar
Deneysel intrastriatal kanama gibi morfolojik çağrıştırıyorkemirgenlerde sıra davranış değişiklikleri. Bu değişiklikler prosedür yeterli bir getirilmesini sağlamak için, ya da potansiyel tedavilerinin etkilerinin araştırılması için değerlendirilebilir. Hedeflenen bir beyin bölgesi (örneğin bazal gangliyon) içinde kanama oluşturma tekrarlanabilir bir yaklaşım için en önemli ve brüt veya histolojik olarak boyanan beyin dokularının (Şekil 1-2) üzerinde doğrulanabilir. Çeşitli davranışsal değerlendirmeler yoluyla ölçülebilir sensorimotor defisitler içinde bazal ganglion sonuçlar yaralanma. Köşe dönüş testi sonuçları deney sağ taraflı İSH'lı, fareler (Şekil 3 A) sham cerrahi sonrası 24 ve 72 saatte hayvanlar ameliyat daha, engelli kontralateral (sol) yan Tortikollis ve uzak anlamlı olarak daha sık döndü, gösterdi. Ayrıca, yeterince vibrissaenin uyarılmasını takiben, bir yüzey üzerine engelli (sol) ön ayakları yere yeteneği, ön ayakları yerleştirme testi ile değerlendirildi. 24 ve 72 saat ameliyat sonrası, fareler altSağ taraflı ICH için jected sham operasyonu hayvanlara oranla daha az yerleşim gösterdi. Beyin ödemi ölçümü sıklıkla deneysel İSH'lı beyin hasarı ölçüde ölçmek için kullanılır. Otolog kan (30 ul) veya bakteriyel kollajenaz intraserebral enjeksiyonu (0.075 U) önemli bir 24. ipsilateral korteks ve bazal ganglionlar beyin su içeriği artışı (Şekil 4 A) ve ameliyat sonrası 72 saat (Şekil 4 B) (yol açtı ) sham karşılaştırıldığında. Davranış testleri (Şekil 3) ve beyin ödemi (Şekil 4) kapsamının sonucu verilen hacimlerde kan ve kollajenaz enjeksiyon modelleri arasında fark göstermedi.
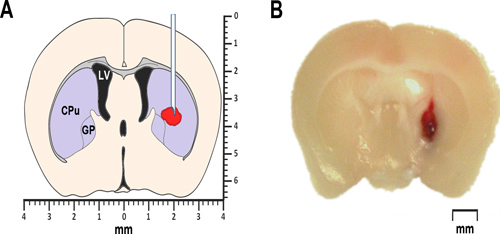
Şekil 1. Farelerde Modelleme ICH. (A) bregma anterior koronal beyin bölümü 0,2 mm basitleştirilmiş şematik pr göstermektedirotolog kan veya kollajenaz enjeksiyon yeri oposed. Lateral ventrikül LV işaretlenir. CPU kaudat-putamen, striatum bir parçası anlamına gelir, ve GP globus pallidus tanımlar. Her ikisi de, striatum hem de globus pallidus da bazal gangliyonlar olarak bilinen alt-kortikal çekirdeklerin bir gruba aittir. Otolog tam kan intrastriatal enjeksiyonu sonrası 24 saatte elde bregma bir koronal beyin bölümü 0.2mm anterior, (B) Temsilcisi fotomikrografıdır.
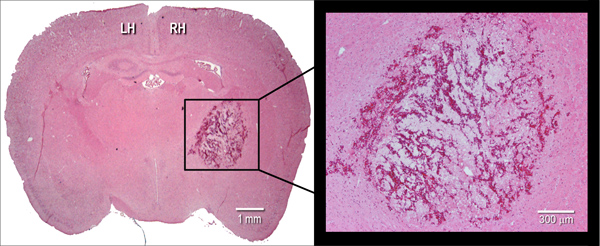
Şekil 2. Hematom histolojik tezahürüdür. Örnek hematoksilen ve eozin (H & E), bir fare beyin lekeli koronal cryosection (10 mikron), bakteriyel kollajenaz intrastriatal enjeksiyonu (0.075 U) sonra 24 saatte hematom boyutu gösteren. LH = sol hemisfer, RH = sağ hemisfer.
< img alt = "Şekil 3" src = "/ files/ftp_upload/4289/4289fig3.jpg" />
Şekil 3,. Farelerde deneysel ICH takip nörofonksiyonel değerlendirmeler. Otolog kan (30 ul) veya bakteriyel kollajenaz intrastriatal enjeksiyonu (0.075 U) tekrarlanabilir nörofonksiyonel açıklarının neden oldu. (A) Deneysel İSH'lı Fare ameliyat sonrası 24 ve 72 saatte sham operasyonu hayvanlara göre çok daha fazla sağa dönüşlerle gösterdi. Sol bacak (B) forepawın yerleştirerek kapasite ameliyattan sonra 24 ve 72 saatte İSH'lı bozulmaktadır. Değerler ortalama ± SEM olarak ifade ve Öğrenci-Newman-Keuls yöntemi izledi rütbeler Varyans Kruskal-Wallis Tek Yönlü Analizi ile analiz edilmiştir. <0.05 AP değeri istatistiksel olarak anlamlı kabul edildi; n = 6-12 grup başına, * P sham göre <0.05. büyük bir rakam görmek için buraya tıklayın .
ŞEKIL 4 "src =" / files/ftp_upload/4289/4289fig4.jpg "/>
Şekil 4. Farelerde deneysel ICH sonrası beyin su içeriğinin değerlendirilmesi. Otolog kan intraserebral enjeksiyonu (30 ul) veya önemli 24 (A) ipsilateral korteks ve bazal ganglionlar beyin su içeriğinin artış ve 72 saat yol bakteriyel kollajenaz (0.075 U) (B) ICH-indüksiyon sonrası. Değerler ortalama ± SEM olarak ifade ve Tukey post hoc testi ile takip Tek yönlü varyans analizi ile incelendi. <0.05 AP değeri istatistiksel olarak anlamlı kabul edildi; n = 6-10, grup başına * P sham göre <0.05. büyük bir rakam görmek için buraya tıklayın .
Tartışmalar
Intraserebral kanama (İSK) hayvan modelleri hastalığın patofizyolojisinin anlaşılmasına büyük katkı, ve genellikle bir preklinik ortamda yeni tedavi stratejileri geliştirmek ve değerlendirmek için kullanılır. Otolog kan veya bakteriyel kollajenaz intraparankimal enjeksiyonları kemirgenlerde ICH oluşturmak için köklü yöntem vardır. Her iki yöntem başlangıçta sıçan geliştirilmiştir, ancak transgenik ve nakavt suşların hızla artan durumu nedeniyle, fareler daha hemorajik beyin yaralanması ...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu çalışma kısmen JH Zhang NIH hibe RO1NS053407 tarafından desteklenmiştir. Biz onun değerli katkıları için Sayın Damon Klebe teşekkür etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Malzeme | Şirket | Katalog Numarası | Yorumlamak |
| Stereotaksik Kafa Çerçeve | Stoelting Co | 51600 | |
| Nanomit Şırınga Pompası | Harvard Apparatus | PY2 70-2217 | |
| Hamilton Şırınga | Hamilton Company | 1725RN (250 ul) 1701 RN (10 ul) | 250 ul ve 10 ul şırıngalar için 26 Gauge iğne. |
| Mikrotur | Güzel Bilim Araçları | 18000-17 | |
| Mikrotur çapak | Güzel Bilim Araçları | 19007-09 | 0.9 mm çapında |
| Kollajenaz Tip VII-S | Sigma-Aldrich | C2399 | |
| Kapiler Tüpler Mikrohematokrit | Fisher Scientific | 22-362-574 | heparinize olmayan |
| Kemik Wax | Ethicon | W31 | |
| Dikin | Ethicon | 1676G | |
| Ketamin | Jhp İlaç | 42023-115-10 | Ketalar |
| Ksilazin | LLOYD Laboratuvarlar | 139-236 | AnaSed |
Referanslar
- Broderick, J. P. Guidelines for the management of spontaneous intracerebral hemorrhage: A statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Stroke. 30, 905-915 (1999).
- Qureshi, A. I., Mendelow, A. D., Hanley, D. F. Intracerebral haemorrhage. Lancet. 373, 1632-1644 (2009).
- MacLellan, C. L., Silasi, G., Auriat, A. M., Colbourne, F. Rodent models of intracerebral hemorrhage. Stroke. 41, 95-98 (2010).
- James, M. L., Warner, D. S., Laskowitz, D. T. Preclinical models of intracerebral hemorrhage: a translational perspective. Neurocrit Care. 9, 139-152 (2008).
- MacLellan, C. L. Intracerebral hemorrhage models in rat: comparing collagenase to blood infusion. J. Cereb. Blood Flow Metab. 28, 516-525 (2008).
- Belayev, L. Experimental intracerebral hemorrhage in the mouse: histological, behavioral, and hemodynamic characterization of a double-injection model. Stroke. 34, 2221-2227 (2003).
- Clark, W., Gunion-Rinker, L., Lessov, N., Hazel, K. Citicoline treatment for experimental intracerebral hemorrhage in mice. Stroke. 29, 2136-2140 (1998).
- Nakamura, T. Intracerebral hemorrhage in mice: model characterization and application for genetically modified mice. J. Cereb. Blood Flow Metab. 24, 487-494 (2004).
- Schallert, T. Behavioral tests for preclinical intervention assessment. NeuroRx. 3, 497-504 (2006).
- Hartman, R., Lekic, T., Rojas, H., Tang, J., Zhang, J. H. Assessing functional outcomes following intracerebral hemorrhage in rats. Brain Res. 1280, 148-157 (2009).
- Hua, Y. Behavioral tests after intracerebral hemorrhage in the rat. Stroke. 33, 2478-2484 (2002).
- Tang, J. Mmp-9 deficiency enhances collagenase-induced intracerebral hemorrhage and brain injury in mutant mice. J. Cereb. Blood Flow Metab. 24, 1133-1145 (2004).
- Ma, Q. Vascular adhesion protein-1 inhibition provides antiinflammatory protection after an intracerebral hemorrhagic stroke in mice. J. Cereb. Blood Flow Metab. , (2010).
- Bullock, R., Mendelow, A. D., Teasdale, G. M., Graham, D. I. Intracranial haemorrhage induced at arterial pressure in the rat. Part 1: Description of technique, ICP changes and neuropathological findings. Neurol Res. 6, 184-188 (1984).
- Yang, G. Y., Betz, A. L., Chenevert, T. L., Brunberg, J. A., Hoff, J. T. Experimental intracerebral hemorrhage: relationship between brain edema, blood flow, and blood-brain barrier permeability in rats. J. Neurosurg. 81, 93-102 (1994).
- Rosenberg, G. A., Mun-Bryce, S., Wesley, M., Kornfeld, M. Collagenase-induced intracerebral hemorrhage in rats. Stroke. 21, 801-807 (1990).
- Alkayed, N. J. Gender-linked brain injury in experimental stroke. Stroke. 29, 159-165 (1998).
- Saha, J. K., Xia, J., Grondin, J. M., Engle, S. K., Jakubowski, J. A. Acute hyperglycemia induced by ketamine/xylazine anesthesia in rats: mechanisms and implications for preclinical models. Exp Biol Med. (Maywood). 230, 777-784 (2005).
- Fujiwara, N. Effect of normobaric oxygen therapy in a rat model of intracerebral hemorrhage. Stroke. 42, 1469-1472 (2011).
- Khatibi, N. H. Isoflurane posttreatment reduces brain injury after an intracerebral hemorrhagic stroke in mice. Anesth Analg. 113, 343-348 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır