Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Modeling Hirnblutung in Mice: Injektion von Eigenblut oder bakterielle Collagenase
In diesem Artikel
Zusammenfassung
Klinisch relevante Tiermodelle Hirnblutung (ICH) sind notwendig, um unser Wissen über hämorrhagischen Schlaganfall zu erweitern und neue therapeutische Strategien zu untersuchen. In dieser Studie beschreiben wir und auswerten beiden ICH Modelle einseitige Injektionen von entweder autologe Vollblut oder bakteriellen Collagenase in den Basalganglien (Corpus striatum) von Mäusen implementieren.
Zusammenfassung
Spontane Hirnblutung (ICH) definiert eine potenziell lebensbedrohliche neurologische Krankheit, die für 10-15% aller Schlaganfall-bedingten Hospitalisierungen und für die keine wirksame Behandlungen stehen zur Verfügung, um 1,2 date ausmacht. Aufgrund der Heterogenität der ICH beim Menschen, werden verschiedene präklinische Modelle benötigt, um gründlich zu erforschen Interessenten therapeutische Strategien 3. Experimentelle ICH wird häufig in Nagetieren durch intraparenchymal Injektion von Eigenblut oder bakterielle Kollagenase 4 induziert. Die entsprechenden Muster auf der Basis der Pathophysiologie von Hämorrhagie Induktion und Verletzungen Progression besteht. Das Blut Injektion Modell imitiert eine rasch voranschreitende Blutungen. Alternativ bakterieller Kollagenase enzymatisch stört die Basallamina des Gehirns Kapillaren, wodurch eine aktive Blutung, die in der Regel entwickelt sich über mehrere Stunden 5. Resultierenden perihematomal Ödeme und neurofunktionalen Defizite her quantifiziert werdenm beide Modelle. In dieser Studie haben wir beschrieben, ausgewertet und ein modifiziertes Doppeleinspritzung Modell der autologen Vollblut 6 sowie eine ICH Injektionsmodell bakterieller Kollagenase 7, welche beide Target die Basalganglien (Corpus striatum) von männlichen CD-1-Mäusen. Wir untersuchten neurofunktionalen Defizite und Hirnödem bei 24 und 72 Stunden nach ICH Induktion. Intrastriatalen Injektion von Eigenblut (30 ul) oder bakterieller Kollagenase (0.075U) verursacht reproduzierbare neurofunktionalen Defizite bei Mäusen und signifikant erhöhte Hirnödem bei 24 und 72 h nach der Operation (p <0,05). Zusammenfassend liefern beide Modelle konsequente hämorrhagischen Infarkte und stellen grundlegende Methoden für die präklinische ICH Forschung.
Protokoll
Alle Verfahren wurden in Übereinstimmung mit den NIH Leitfaden für die Pflege und Verwendung von Labortieren durchgeführt und von der Animal Care und Use Committee an der Loma Linda University.
Ein. Präoperative Vorbereitungen
Aseptische Techniken sind für alle chirurgischen Eingriffe empfohlen. Desinfizieren Sie die stereotaktischen Apparat und bereiten sterile chirurgische Instrumente vor der Operation. Tragen Sie persönliche Schutzausrüstung (PSA) bei allen tierischen Handhabung. Verwenden Sie ein Heizkissen während der Operation des Tieres physiologischen Körpertemperatur aufrecht zu erhalten.
- Wiegen Sie die 8-12 Wochen alten Maus mit einem Triple-Beam Tierwaage.
- Co-Injektion Ketamin (100 mg / kg) und Xylazin (10 mg / kg) intraperitoneal dann erlauben Sie 7-10 min für die Anästhesie wirksam (Monitor für eine ausreichende Sedierung).
- Platzieren Sie die Maus auf eine Wärmedecke und rasieren die Kopfhaut.
- Bewerben Augensalbe in beide Augen.
- Sichern Sie dieAtemwege, durch leichtes Bewegen der Zunge seitlich und sorgfältig sichern die Maus den Kopf auf den stereotaktischen Apparat. Hinweis: Der Kopf muss horizontal an der Basis des stereotaktischen Rahmens befestigt werden.
- Desinfizieren Sie die OP-Bereich mit Betadine, und spülen Sie mit 70% Ethanol. Wiederholen alternierenden Anwendungen Betadine und 70% Ethanol für insgesamt dreimal. Wattestäbchen kann für diesen Zweck verwendet werden.
2. Blut Injection Modell
- Machen Sie eine 1 cm lange Inzision der Kopfhaut mit einem # 10 Skalpell.
- Verwenden Sie Wattestäbchen wegzuräumen das weiche Gewebe für den Schädel, um die senkrechte Schnittpunkt der koronalen und sagittalen Naht (bregma) freizulegen.
- Montieren Sie den Hamilton-Spritze (250 ul) auf der Einspritzpumpe und stereotaktisch leiten die Nadel (26 Gauge) über bregma.
- Weiter, stellen Sie die stereotaktische Manipulatorarme um die Nadel 0,2 mm positionieren vorderen und 2mm seitlich nach rechts. Auf diese Koordinaten einen kleinen Schädel Bohrloch, mit einer variablen Geschwindigkeit Bohrer mit einem 1 mm Bohrer.
- Suspend des Tieres Schwanz und desinfizieren seiner unteren Fläche mit 70% Ethanol.
- Punktion der zentrale Schwanzarterie mit einer sterilen Nadel (zB 26 Gauge) und sammelt das arterielle Blut in eine unheparinized Kapillarrohr.
- Übertragen Sie das Blut schnell aus der Kapillare in das Glas Lauf der Hamilton-Spritze, dann legen Sie den Kolben.
- Bringen Sie die jetzt 30 ul oder mehr des arteriellen Blutes, die Hamilton-Spritze auf die Einspritzpumpe und die Nadel (mit seinen abgeschrägten Kante zur Pfeilnaht) durch das Bohrloch nur bis zu seiner Fase ist nicht mehr sichtbar.
- Von diesem Punkt Voraus die Nadel 3 mm ventral und injizieren 5 ul autologen Blut bei einer Geschwindigkeit von 2 pl / min.
- Nach Beendigung der ersten Injektion die Nadel Voraus 0,7 mm weiter in die Tiefe.
- Warten5 min dann spritzen 25 ul Blut in das rechte Striatum.
- Nach Abschluss der zweiten Injektion nun die Nadel in Position für weitere 10 min, Vor dem Abziehen mit einer Geschwindigkeit von 1 mm / min.
- Verschließen Sie die Bohrloch mit Knochenwachs und vernähen die Haut.
- Für postoperative Analgesie injizieren 0,05 mg / kg subkutan an Buprenorphin in vorgewärmter Fluide (normale Kochsalzlösung).
3. Kollagenase Injection Modell
- Nach den präoperativen Vorbereitung, wiederholen Sie die Schritte 1-4 für die Blutinjektion Modell beschrieben.
- Füllen Sie den Hamilton-Spritze (10 ul) mit 0.075U der bakteriellen (Clostridien) Kollagenase VII-S in 0,5 ul Kochsalzlösung gelöst. Vermeiden Sie die Bildung von Luftblasen.
- Bringen Sie die Hamilton-Spritze auf die Einspritzpumpe und die Nadel (26 Gauge), durch das Bohrloch nur bis zu seiner Fase ist nicht mehr sichtbar.
- Die Kanüle 3,7 mm ventral und spritzen den 0.075U von Kollagenase into das rechte Striatum bei einer Rate von 2 pl / min.
- Nach Abschluss der Injektion, nun die Nadel in Position für weitere 10 min, Vor dem Abziehen mit einer Geschwindigkeit von 1 mm / min.
- Verschließen Sie die Bohrloch mit Knochenwachs und vernähen die Haut.
- Inject 0,05 mg / kg Buprenorphin subkutan in vorgewärmten post-operative Flüssigkeiten.
4. Sham Betrieb
- Nach den präoperativen Vorbereitung, wiederholen Sie die Schritte 1-4 für die Blutinjektion Modell beschrieben.
- Legen Sie die Nadel (26 Gauge) 3,7 mm ventral durch das Bohrloch. Die Nadel sollte in ihrer Position bleiben für 10 Minuten, bevor es bei einer Geschwindigkeit von 1 mm / min abgezogen.
- Verschließen Sie die Bohrloch mit Knochenwachs und vernähen die Haut.
- Inject 0,05 mg / kg Buprenorphin subkutan in vorgewärmten post-operative Flüssigkeiten.
5. Repräsentative Ergebnisse
Experimentelle intrastriatal Blutungen hervorruft morphologischensowie Veränderungen im Verhalten von Nagetieren. Diese Veränderungen können ausgewertet werden, um eine adäquate Durchführung des Verfahrens zu gewährleisten, oder um die Auswirkungen von potentiellen Anwendungen zu untersuchen. Generierung der Anschnitt gezielt Hirnareal (zB Basalganglien) ist sehr wesentlich für eine reproduzierbare Methode, und kann auf Brutto-oder histologisch gefärbten Hirnschnitten (Abbildung 1-2) überprüft werden. Verletzungen der Basalganglien Ergebnisse in sensomotorischen Defiziten, die über verschiedene Verhaltens Einschätzungen quantifiziert werden können. Ergebnisse der Ecke wiederum Test zeigte, dass nach experimenteller rechtsseitigen ICH, Mäusen signifikant häufiger eingeschaltet ipsilateral und weg von dem beeinträchtigten kontralateralen Seite (links), (Abbildung 3 A) als Schein Tieren betrieben bei 24 und 72 Stunden nach der Operation. Ferner die Fähigkeit, angemessen zu platzieren die beeinträchtigte (links) Vordergliedmaße auf einer Oberfläche, nach Vibrissen Stimulation wurde über das Vorderbein Anordnen Test beurteilt. Nach 24 und 72 Stunden nach der Operation, Mäuse subprojiziert nach rechts einseitige ICH zeigten deutlich weniger Platzierungen als sham operierten Tieren. Messung von Hirnödem wird häufig verwendet, um das Ausmaß der Hirnschädigung nach experimenteller ICH quantifizieren. Intrazerebralen Injektionen von Eigenblut (30 ul) oder bakterielle Collagenase (0,075 U) zu einer signifikanten Erhöhung des Gehirns Wassergehalt im ipsilateralen Cortex und Basalganglien bei 24 (Fig. 4 A) und 72 h (Figur 4 B) nach der Operation geführt ( Vergleich zu sham). Das Ergebnis der Verhaltenstests (Abbildung 3) und das Ausmaß der Hirnödem (Abbildung 4) zeigten keinen Unterschied zwischen dem Blut und Kollagenase Einspritzer-Modelle in bestimmten Mengen.
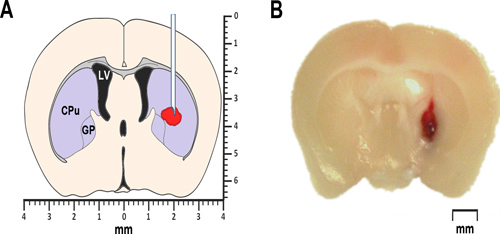
Abbildung 1. Modellierung ICH bei Mäusen. (A) Das vereinfachte Schema eines koronalen Hirnschnitts 0,2 mm anterior von Bregma veranschaulicht die proposed Lage Eigenblut oder Kollagenase Injektion. Die laterale Ventrikel LV markiert. CPU steht für caudatus-Putamen, ein Teil des Striatum und GP kennzeichnet die Globus pallidus. Sowohl das Striatum sowie der Globus pallidus an eine Gruppe von Sub-Zellkernen, die auch als Basalganglien bekannt angehören. (B) Repräsentative Mikrophotographie eines koronalen Hirnschnitts 0.2mm anterior Bregma, bei 24 Stunden nach intrastriatal Injektion von autologen Vollblut gewonnen.
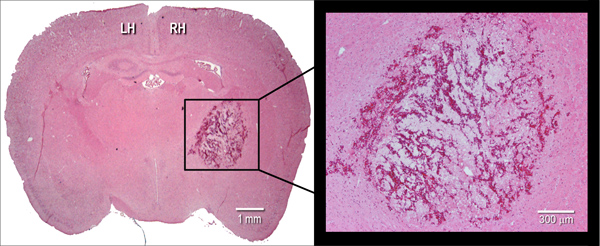
Abbildung 2. Histologische Manifestation des Hämatoms. Vertreter Hämatoxylin und Eosin (H & E) gefärbt koronalen Kryoschnitt (10 um) einer Maus Gehirn, welches Hämatom Größe bei 24 Stunden nach intrastriatal Injektion von bakteriellen Collagenase (0,075 U). LH = linke Hemisphäre, RH = rechte Hemisphäre.
< img alt = "Abbildung 3" src = "/ files/ftp_upload/4289/4289fig3.jpg" />
Abbildung 3. Neurofunktionalen Einschätzungen nach experimenteller ICH bei Mäusen. Intrastriataler Injektion von Eigenblut (30 ul) oder bakterieller Kollagenase (0,075 U) verursacht reproduzierbare neurofunktionalen Defizite. (A) Mäuse nach experimenteller ICH zeigten signifikant mehr nach rechts abzubiegen, als sham operierten Tieren bei 24 und 72 Stunden nach der Operation. (B) Vorderpfote Platzierung Kapazität der linken Extremität wurde nach ICH bei 24 und 72 Stunden nach der Operation beeinträchtigt. Die Werte wurden als Mittelwert ± SEM ausgedrückt und analysiert Kruskal-Wallis One Way Analysis of Variance auf den Rängen, von der Student-Newman-Keuls-Methode gefolgt. AP-Wert von <0,05 wurde als statistisch signifikant; n = 6-12 pro Gruppe, * P <0,05 im Vergleich zur Farce. Klicken Sie hier für eine größere Abbildung zu sehen .
BBILDUNG 4 "src =" / files/ftp_upload/4289/4289fig4.jpg "/>
Abbildung 4. Auswertung Gehirn Wassergehalt nach experimenteller ICH bei Mäusen. Intrazerebrale Injektion von Eigenblut (30 ul) oder bakterielle Collagenase (0,075 U) führte zu einer signifikanten Zunahme des Gehirns Wassergehalt im ipsilateralen Cortex und Basalganglien bei 24 (A) und 72 Std. (B) nach ICH-Induktion. Die Werte wurden als Mittelwert ± SEM ausgedrückt und analysiert One Way Analysis of Variance von Tukey post hoc Test. AP-Wert von <0,05 wurde als statistisch signifikant; n = 6-10 pro Gruppe, * P <0,05 im Vergleich zur Farce. Klicken Sie hier für eine größere Abbildung zu sehen .
Diskussion
Tiermodelle der intrazerebralen Blutung (ICH) tragen in hohem Maße zu einer höheren Verständnis der Krankheit Pathophysiologie und werden häufig verwendet, zu entwickeln und zu evaluieren neue therapeutische Strategien in einer präklinischen Einstellung. Intraparenchymalen Injektionen von Eigenblut oder bakterielle Kollagenase sind gut etablierte Methoden zur ICH bei Nagetieren zu generieren. Beide Methoden wurden in der Ratte entwickelt, jedoch aufgrund der rasch zunehmende Verfügbarkeit von transgenen und Knocko...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Studie wurde teilweise durch NIH RO1NS053407 JH Zhang unterstützt. Wir danken Herrn Damon Klebe für seine wertvollen Beiträge danken.
Materialien
| Name | Company | Catalog Number | Comments |
| Material | Firma | Katalog-Nummer | Kommentar |
| Stereotaktischen Kopfrahmen | Stoelting Co. | 51600 | |
| Nanomite Spritzenpumpe | Harvard Apparatus | PY2 70-2217 | |
| Hamilton Spritze | Hamilton Company | 1725RN (250 ul) 1701 RN (10 ul) | 26-Gauge-Nadel für 250 ul und 10 ul Spritzen. |
| Mikrobohrer | Fine Science Tools | 18000-17 | |
| Mikrobohrer Grat | Fine Science Tools | 19007-09 | 0,9 mm Durchmesser |
| Collagenase Typ VII-S | Sigma-Aldrich | C2399 | |
| Mikrohämatokrit Kapillarröhrchen | Fisher Scientific | 22-362-574 | unheparinized |
| Knochenwachs | Ethicon | W31 | |
| Naht | Ethicon | 1676G | |
| Ketamin | JHP Pharmaceuticals | 42023-115-10 | Ketalar |
| Xylazin | LLOYD Laboratories | 139-236 | AnaSed |
Referenzen
- Broderick, J. P. Guidelines for the management of spontaneous intracerebral hemorrhage: A statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Stroke. 30, 905-915 (1999).
- Qureshi, A. I., Mendelow, A. D., Hanley, D. F. Intracerebral haemorrhage. Lancet. 373, 1632-1644 (2009).
- MacLellan, C. L., Silasi, G., Auriat, A. M., Colbourne, F. Rodent models of intracerebral hemorrhage. Stroke. 41, 95-98 (2010).
- James, M. L., Warner, D. S., Laskowitz, D. T. Preclinical models of intracerebral hemorrhage: a translational perspective. Neurocrit Care. 9, 139-152 (2008).
- MacLellan, C. L. Intracerebral hemorrhage models in rat: comparing collagenase to blood infusion. J. Cereb. Blood Flow Metab. 28, 516-525 (2008).
- Belayev, L. Experimental intracerebral hemorrhage in the mouse: histological, behavioral, and hemodynamic characterization of a double-injection model. Stroke. 34, 2221-2227 (2003).
- Clark, W., Gunion-Rinker, L., Lessov, N., Hazel, K. Citicoline treatment for experimental intracerebral hemorrhage in mice. Stroke. 29, 2136-2140 (1998).
- Nakamura, T. Intracerebral hemorrhage in mice: model characterization and application for genetically modified mice. J. Cereb. Blood Flow Metab. 24, 487-494 (2004).
- Schallert, T. Behavioral tests for preclinical intervention assessment. NeuroRx. 3, 497-504 (2006).
- Hartman, R., Lekic, T., Rojas, H., Tang, J., Zhang, J. H. Assessing functional outcomes following intracerebral hemorrhage in rats. Brain Res. 1280, 148-157 (2009).
- Hua, Y. Behavioral tests after intracerebral hemorrhage in the rat. Stroke. 33, 2478-2484 (2002).
- Tang, J. Mmp-9 deficiency enhances collagenase-induced intracerebral hemorrhage and brain injury in mutant mice. J. Cereb. Blood Flow Metab. 24, 1133-1145 (2004).
- Ma, Q. Vascular adhesion protein-1 inhibition provides antiinflammatory protection after an intracerebral hemorrhagic stroke in mice. J. Cereb. Blood Flow Metab. , (2010).
- Bullock, R., Mendelow, A. D., Teasdale, G. M., Graham, D. I. Intracranial haemorrhage induced at arterial pressure in the rat. Part 1: Description of technique, ICP changes and neuropathological findings. Neurol Res. 6, 184-188 (1984).
- Yang, G. Y., Betz, A. L., Chenevert, T. L., Brunberg, J. A., Hoff, J. T. Experimental intracerebral hemorrhage: relationship between brain edema, blood flow, and blood-brain barrier permeability in rats. J. Neurosurg. 81, 93-102 (1994).
- Rosenberg, G. A., Mun-Bryce, S., Wesley, M., Kornfeld, M. Collagenase-induced intracerebral hemorrhage in rats. Stroke. 21, 801-807 (1990).
- Alkayed, N. J. Gender-linked brain injury in experimental stroke. Stroke. 29, 159-165 (1998).
- Saha, J. K., Xia, J., Grondin, J. M., Engle, S. K., Jakubowski, J. A. Acute hyperglycemia induced by ketamine/xylazine anesthesia in rats: mechanisms and implications for preclinical models. Exp Biol Med. (Maywood). 230, 777-784 (2005).
- Fujiwara, N. Effect of normobaric oxygen therapy in a rat model of intracerebral hemorrhage. Stroke. 42, 1469-1472 (2011).
- Khatibi, N. H. Isoflurane posttreatment reduces brain injury after an intracerebral hemorrhagic stroke in mice. Anesth Analg. 113, 343-348 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten