Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Inyección estereotáctica de microARN que expresan lentivirus al ratón hipocampo CA1 Región y evaluación de los resultados del comportamiento
En este artículo
Resumen
Los microARNs tienen funciones importantes en la estructura y función del cerebro. Aquí se describe un método para hacer cumplir miRNA hipocampo sobreexpresión mediante inyección estereotáxica de un lentivirus que expresan los genes miARN ingeniería. Este enfoque puede servir como una manera relativamente rápida para evaluar la In vivo Efectos de miRNAs sobreexpresados en regiones específicas del cerebro.
Resumen
Los microARN (miRNA) son pequeñas moléculas de ARN de cadena simple reguladoras unos 22 nucleótidos de longitud que pueden cada destino numerosas transcripciones de ARNm y dim toda una expresión de los genes de la vía de la destrucción de inducir y / o inhibición de la traducción de estos objetivos. Varios miRNAs juegan un papel clave en el mantenimiento de la estructura y la función neuronal y en las funciones cerebrales de alto nivel, y se buscan métodos para manipular los niveles para explorar estas funciones. A continuación, presentamos un método directo en vivo para el examen de las consecuencias cognitivas de miRNAs forzadas exceso en ratones mediante la inyección estereotáxica de partículas virales miRNA-codificación. Específicamente, el protocolo actual consiste en la inyección en la región CA1 del hipocampo, lo que contribuye a la consolidación de mamífero memoria, el aprendizaje, y las respuestas al estrés, y ofrece un lugar de la inyección conveniente. Las coordenadas se miden de acuerdo con el bregma ratón y virus de la perfusión se controla y se mantiene muy lento digitalmente.Después de la inyección, la herida de la cirugía se cierra herméticamente y los animales recuperarse. Los lentivirus que codifican silenciadores de los objetivos de mRNA correspondientes sirven para implicar a la interacción específica de los genes miARN / target responsable del efecto observado, con los ratones no tratados, los ratones inyectados con solución salina y ratones inyectados con vectores lentivirus "vacías" como controles. Un mes después de la inyección, los animales se examinan en el laberinto de agua de Morris (MWM) para la evaluación de su aprendizaje navegación y capacidades de la memoria. El MWM es un tanque redondo lleno de agua coloreada con una pequeña plataforma sumergida 1 cm por debajo de la superficie del agua. Señales visuales estable alrededor del tanque para permitir la navegación espacial (sonido y el campo magnético de la tierra también puede ayudar a los animales en la navegación). Vigilancia de la cámara de vídeo permite la medición de la ruta de la natación y el tiempo para encontrar y constituir la plataforma. El ratón se enseña por primera vez que el montaje de la plataforma escondida ofrece un escape de la natación forzada, sino que se prueba para el uso de este escape y finalmente, la plataforma se retira y las pruebas de la sonda examinar si el ratón recuerda su ubicación anterior. Pruebas repetidas durante varios días consecutivos destacan un mejor rendimiento de los ratones examinados en latencias más cortas para encontrar y montar la plataforma, y las rutas que más directas para llegar a la plataforma o la ubicación. Si no se presenta dicha mejora representa problemas de aprendizaje y de la memoria y / o ansiedad, que puede entonces ser probado específicamente (por ejemplo, en el laberinto elevado en cruz). Este enfoque permite la validación de miRNAs específicos y las transcripciones de destino en lo cognitivo estudiado y / o procesos relacionados con el estrés.
Introducción
El papel de los miRNAs específicos en el funcionamiento del sistema nervioso ha sido recientemente cuestionado por inyección lentiviral en varios estudios. MiRNAs se han encontrado para ser crucial para el mantenimiento y la re-formación de la estructura sinapsis 1, 2 sinaptogénesis y la remodelación de sinapsis y mantenimiento 3. Estos estudios sugieren fuertemente que los miRNAs están comprometidos, a través de efectos reguladores múltiples niveles, tanto en la conformación y en el mantenimiento de la salida principal del sistema nervioso, la función cognitiva. Inyección estereotáctica de las partículas de lentivirus en regiones específicas en el cerebro de roedores permite la búsqueda de alteraciones en la morfología de la sinapsis y la actividad neuronal, y se utilizó para establecer el significado funcional de las transcripciones sobreexpresados 4,5. La infección directa de las neuronas en áreas del cerebro bien definidos con miARN-expresión de los lentivirus pueden estar implicados en estudios de envejecimiento, trastornos cerebrales y la neurodegeneración; Estudios de miRNAs en el ámbito de la regulación del comportamiento 6-8 están en un estado mucho menos avanzada, y la inyección estereotáctica de los genes miARN-expresando partículas de lentivirus seguido por pruebas de comportamiento puede ser útil para tales fines. Un método mucho más laborioso para inducir la sobre o sub-expresión implica ingeniería genética knock-in o ratones knockout. Sistemas genéticos pueden permitir para un control condicional y temporal en la expresión (por ejemplo, Cre-Lox, los sistemas Tet), pero éstos apenas ofrecer la especificidad espacial del procedimiento de inyección y casi siempre hay una cierta cantidad de falta de estanqueidad. Además, los procedimientos de ingeniería no requieren cirugía y se pueden utilizar a través de laboratorios con relativamente buena reproducibilidad, sin embargo, son más lentos y requieren mucha más mano de obra y de recursos financieros. Además, el control temporal de la sobre o sub-expresión en ratones inyectados es mucho más preciso en comparación con ratones modificados genéticamente.
Protocolo
1. Preparación Lentivirus
- Se cultivan las células HEK-293FT a 90% de confluencia.
- En el día de la transfección medio celular cambio de DMEM libre de suero suplementado con 1 mM de glutamina y 50 mg / ml de penicilina-estreptomicina.
- Co-transfectar las células con un vector pLKO.1-Puro y con plásmidos que codifican para la delta R8.2 y VSV-G restos y los genes miARN de interés, utilizando 10 l de 1 mg / ml de polietilenimina como un portador 9.
- Recoger lentivirus envasados a las 24 horas y 48 horas después de la transfección, filtrar con filtro de 0,45 micras.
- Concentrar los lentivirus utilizando ultracentrifugación en 70.000 xg, durante 2 horas y 15 ° C, alícuota y almacenar a -70 ° C.
- Medida título del virus mediante la infección de células HEK-293T con preparaciones de virus diluidas en serie (1 a 10 -6 ml de vector por pocillo). El título resultante (se recomienda un mínimo de ~ 1 × 10 9 partículas infecciosas por ml) se evalúa para la expresión de la GEne de interés, utilizando puromycin selección y cuantificación de las buenas prácticas agrarias expresión de los virus a través de recuento de células fluorescentes.
Para el protocolo más detallado de preparación lentivirus ver 10.
2. Preparación de los animales para la cirugía
- Cirujanos atuendo debe incluir bata quirúrgica, guantes estériles, gorro y mascarilla.
- Pesar el animal, a continuación, anestesiar con una IP-inyección de una mezcla de ketamina, con el volumen proporcional al peso de los animales como se especifica para cada fármaco. Para una mezcla de ketamina / xilazina, un intervalo de dosis de 80-200 mg / kg de ketamina y 7-20 mg / kg de xilazina se utiliza por lo general para los ratones.
- Espere hasta que el animal esté totalmente anestesiado, a continuación, comprobar si la falta de reflejo de retirada de la pata trasera del animal mediante la ampliación de la extremidad y pulsando con el dedo.
- Inyectar el animal por vía subcutánea con Rimadyl, tal como se especifica en la caja, para aliviar el dolor. Rango de dosis típica para Rymadil es 5-10 mg.
- Colocar el animal sobre una almohadilla térmica para mantener una temperatura corporal constante y humedecer los ojos con el ungüento.
- Afeitar el área entre los dos oídos con una máquina de recorte.
- Desinfecte la piel con betadine.
3. La exposición de la calavera y perforación
- Colocar el animal en el interior del stereotact mediante el ajuste de las varillas en las grietas justo por delante de las orejas del animal.
- Utilice un bisturí para realizar una incisión anterior-posterior de unos 1,5 cm entre las orejas y mantenerla abierta con pinzas de cirugía (serfines).
- Limpie la superficie del cráneo con un bastoncillo de algodón hasta la intersección de la sutura coronal y las suturas sagital, es decir, el bregma y la intersección entre las suturas coronal y lambdoid, es decir, lambda, son visibles.
- Dirija la punta de la jeringa, que se celebró por la stereotact, hasta el punto de bregma, en los tres ejes. Anote las coordenadas. Este punto podría ser considerado como el po ceroint en los tres ejes.
- Levantar la jeringa en el eje vertical, de manera que un movimiento planar no rayar el cráneo y mover el cabezal de la jeringa a la ubicación correcta. Inyecciones CA1 del hipocampo requieren las siguientes coordenadas en relación con el bregma en mm: -2 en el eje anterior / posterior, ± 1.8 en el eje lateral / medial y -1,5 en el eje dorsal / ventral.
- Baje la punta de la jeringa hasta que toque el cráneo y marcar el lugar con un marcador. Retire la jeringa hacia atrás para evitar puñaladas.
- Perforar un agujero poco profundo, sólo en el hueso del cráneo con una multa perforador. Sostenga el perforador constante para que no se siga perforar en la parte de abajo de tejidos blandos. Usted puede evitar esto se estabiliza por un lado con el otro y por la perforación en pulsos cortos.
4. La inyección de la Lentivirus
- Retirar 0,5 ml de la solución concentrada de lentivirus.
- Coloque la jeringa encima del agujero y baje lentamente en forma vertical hasta que ReaChes la superficie del cráneo. Continuar para bajar la jeringa en el cerebro muy lentamente. En este paso algo de sangrado puede ocurrir que no indica necesariamente una penetración fallado. Si se produce una hemorragia fregar con una esponja de algodón.
- Establecer la bomba digital para 0,02 ml / min (0,5 l se inyecta en 25 min) y comenzar la infusión. Infusión lenta permite la propagación efectiva del virus en el tejido y evita el flujo de retorno. En algunos tipos de jeringas en cuenta la inserción de la jeringa para una mayor profundidad de 0,5 mm antes de retirarse a las coordenadas y la infusión de originales.
- Una vez finalizada la infusión esperar otros 5 minutos para permitir que el material que se extienda en el cerebro en lugar de retirarse de nuevo en el canal formado por la jeringa.
- Retire la jeringa muy lentamente y observar los flujos de espalda. Si se observa un flujo hacia atrás en este paso, una fracción del material inyectado fue probablemente perdió.
5. Cierre de heridas y la recuperación
- Seal ªe enrollado con histoacryl. Asegúrese de evitar fugas del histoacryl en los ojos.
- Inyectar la vía intraperitoneal animales (IP) con 1 ml de solución salina precalentada, para evitar la deshidratación.
- Colocar el animal en una jaula de recuperación que se coloca sobre una almohadilla caliente. Ver el animal mientras se recupera durante una hora adicional.
En caso de pérdida de peso, inapetencia, se debe realizar debilidad / incapacidad para obtener alimentos o agua, estado moribundo o infección, la eutanasia del animal. Los métodos aceptables para la eutanasia de roedores son los barbitúricos, anestésicos inhalados, CO 2, CO, o cloruro de potasio en combinación con la anestesia general.
Después de 4 a 6 semanas, evaluar la memoria de navegación del animal se evalúa en el laberinto de agua de Morris. Los lentivirus se suele infectar a la mayoría de las células dentro de la esfera de la inyección.
6. Evaluación del Comportamiento en el laberinto de agua de Morris
- Capacitar a los animales en el Mlirio laberinto de agua. Para el entrenamiento exacto y el protocolo de pruebas de ver 11. Después de cada ensayo, el animal secar con una toalla seca, reemplazarlo en su jaula y refrescar el agua en el tanque.
- Prueba de los animales en el laberinto de agua de Morris durante 3 días consecutivos, 4 ensayos cada día. Cada día insertar el animal en el laberinto en cada una de las 4 direcciones del laberinto (norte, sur, este y oeste) en un orden cambiante, por ejemplo, el primer día: este-oeste-norte-sur, de dos días: al oeste y el sur -noreste. Limpie los animales después de cada ensayo.
- Durante la prueba de los ensayos realizar el seguimiento del animal con un sistema de seguimiento, tales como el sistema de seguimiento Noldus.
- Después de la prueba de ensayo 12 ª, insertar el animal en el tanque de agua sin la plataforma durante un minuto. Esto se usaría para analizar la estrategia de buscar el animal está tomando.
- Analizar los datos como se sugiere en 12.
Resultados
La inyección de 0,5 l lentivirus en la región CA1 en el hipocampo del ratón, con la velocidad de flujo se indica en la sección de protocolo produce una esfera infectada de alrededor de 1 mm en el eje rostral caudal, y alrededor de 0,5 mm en la dirección medial-lateral y la parte anterior -posterior ejes (Figura 3).
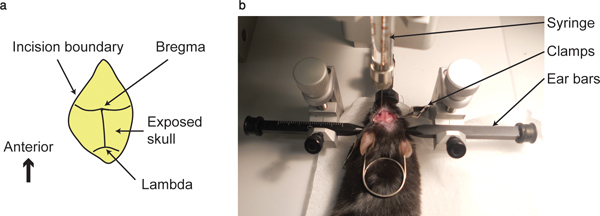
Figura 1. Punto de bregma y aparato de ...
Discusión
Inyección estereotáctica de un lentivirus es relativamente un método rápido para la evaluación in vivo, tanto para la altura o baja regulación de genes diferentes y miRNAs. La principal alternativa es un ratón genéticamente modificado que es una técnica consume mucho más laborioso y a continuación, inyección directa lentivirus. Además, la regulación hacia arriba, en la inyección de lentivirus, se produce en un momento específico en el ratón adulto y no incluye la posibilidad de permeab...
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Este estudio ha sido financiado por el Centro de Edmond Safra y Lily para las Ciencias del Cerebro (SB comunión), The Heritage Biomédica Programa de Asociación de Ciencia legado de la Israel Science Foundation (Grant N º 378/11, a HS) y la Fundación Alemana para la Ciencia de Israel Investigación y Desarrollo (GIF) (Grant No. 1093-32.2/2010, a HS).
Materiales
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Rodent weigh scale | Burtons (UK) | 115-455 | |
| heating pad | FIRstTechnology | DCT-25 | |
| trimming machine | Stoelting | 51465 | |
| stereotact | Stoelting | 51730 | |
| Scalpel and blades | Kent scientific | INS500348 | |
| Harland syringe | Hamilton | 7632-01 | |
| driller | Stoelting | 51449 | |
| digital pump | Harvard apparatus | 704507 | |
| Water tank and platform | Stoelting | 60135 |
| Reagents | |||
| ketamine | Vetoquinol(Lure France) | 3055503 | |
| domitor | Orion pharma | 107140-10 | |
| Rimadyl | Pfizer animal health | 24751 | |
| moisture ointment - Synthomycine 5% | Rekah Pharmaceutical | 195 | |
| histoacryl | Braun | 112101 | |
| saline | Sigma Aldrich | D8662 |
Referencias
- Siegel, G., et al. A functional screen implicates microRNA-138-dependent regulation of the depalmitoylation enzyme APT1 in dendritic spine morphogenesis. Nature Cell Biology. 11, 705-716 (2009).
- Jin, P., et al. Biochemical and genetic interaction between the fragile X mental retardation protein and the microRNA pathway. Nature Neuroscience. 7, 113-117 (2004).
- Simon, D. J. The microRNA miR-1 regulates a MEF-2-dependent retrograde signal at neuromuscular junctions. Cell. 133, 903-915 (2008).
- Consiglio, A. In vivo gene therapy of metachromatic leukodystrophy by lentiviral vectors: correction of neuropathology and protection against learning impairments in affected mice. Nature Medicine. 7, 310-316 (2001).
- Jakobsson, J., Lundberg, C. Lentiviral vectors for use in the central nervous system. Molecular Therapy: The Journal of the American Society of Gene Therapy. 13, 484-493 (2006).
- Berson, A. Cholinergic-associated loss of hnRNP-A/B in Alzheimer's disease impairs cortical splicing and cognitive function in mice. EMBO Molecular Medicine. , (2012).
- Haramati, S. MicroRNA as repressors of stress-induced anxiety: the case of amygdalar miR-34. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 31, 14191-14203 (2011).
- Shaltiel, G., et al. Hippocampal microRNA-132 mediates stress-inducible cognitive deficits through its acetylcholinesterase target. Brain Structure & Function. , 10-1007 (2012).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92, 7297-7301 (1995).
- Mendenhall, A., Lesnik, J., Mukherjee, C., Antes, T., Sengupta, R. Packaging HIV- or FIV-based lentivector expression constructs & transduction of VSV-G pseudotyped viral particles. J. Vis. Exp. (62), e3171 (2012).
- Nunez, J. Morris Water Maze Experiment. J. Vis. Exp. (19), e897 (2008).
- Bromley-Brits, K., Deng, Y., Song, W. Morris water maze test for learning and memory deficits in Alzheimer's disease model mice. J. Vis. Exp. (53), e2920 (2011).
- Regev, L., Ezrielev, E., Gershon, E., Gil, S., Chen, A. Genetic approach for intracerebroventricular delivery. Proceedings of the National Academy of Sciences of the United States of America. 107, 4424-4429 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados