É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Injeção estereotáxica de microRNA-expressando Lentiviruses ao mouse Região CA1 do hipocampo e avaliação do resultado Behavioral
Neste Artigo
Resumo
MicroRNAs têm papéis importantes na estrutura e função cerebral. Aqui nós descrevemos um método para impor miRNA hipocampo sobre-expressão usando a injeção estereotáxica de um lentivírus miRNA-expressando engenharia. Esta abordagem pode servir como um modo relativamente rápido para avaliar a In vivo Efeitos de miRNAs sobre-expressos em regiões específicas do cérebro.
Resumo
MicroRNAs (miRNAs) são moléculas de RNA de fita simples reguladoras pequenas cerca de 22 nucleotídeos de comprimento que podem cada alvo numerosas transcrições de mRNA e dim todo um gene de expressão da via pela destruição indução e / ou inibindo a tradução destes objectivos. Vários miRNAs desempenham papéis fundamentais na manutenção da estrutura e função neuronal e nas funções cerebrais de nível superior, e os métodos são procurados para manipular os seus níveis para explorar essas funções. Aqui, apresentamos uma relação direta método in vivo para examinar as consequências cognitivas de miRNAs aplicadas em excesso em ratos por injeção estereotáxica de partículas virais miRNA-codificação. Especificamente, o protocolo atual envolve a injeção na região CA1 do hipocampo, que contribui para a consolidação de mamíferos memória, aprendizagem, e as respostas ao estresse, e oferece um local de injeção conveniente. As coordenadas são medidas de acordo com a bregma rato e perfusão vírus é controlado digitalmente e mantido muito lento.Após a injecção, a ferida é selada a cirurgia e os animais recuperar. Lentivírus codificação silenciadores dos alvos de RNAm correspondentes servem para envolver a interação miRNA / target específico responsável pelo efeito observado, com camundongos normais, os camundongos injetados com solução salina e camundongos injetados com vetores lentivírus "vazios" como controles. Um mês após a injeção, os animais são examinados no labirinto aquático de Morris (MWM) para avaliar a sua aprendizagem de navegação e capacidades de memória. A MWM é um tanque redondo preenchido com água colorida com uma pequena plataforma submersa um centímetro abaixo da superfície da água. Estímulos visuais constantes ao redor do tanque permitem navegação espacial (som e do campo magnético da Terra pode também ajudar os animais a navegar). Monitoramento de câmeras de vídeo permite medir a rota de mergulho e o tempo para encontrar e atingir a plataforma. O mouse é ensinado pela primeira vez que a montagem da plataforma escondida oferece uma fuga da natação forçada, que é então testado para a utilização deste fuga e finalmente, a plataforma é removida e testes com sondas de examinar se o rato lembra sua localização anterior. Testes repetidos ao longo de vários dias consecutivos destacar melhorou o desempenho de ratinhos testados em menores latências para encontrar e montar a plataforma, e as vias mais directos como para alcançar a plataforma ou a sua localização. Fracasso para mostrar essa melhoria representa aprendizagem e memória prejudicada e / ou ansiedade, que pode então ser testada especificamente (por exemplo, no labirinto em cruz elevado). Esta abordagem permite a validação dos miRNAs específicos e transcrições alvo nos processos relacionados ao estresse cognitivo e / ou estudado.
Introdução
O papel dos miRNAs particulares em funcionamento do sistema nervoso foi recentemente desafiado por injeção lentiviral em vários estudos. MiRNAs foram encontrados para ser crucial para a manutenção e re-moldar uma estrutura sinapse, sinaptogênese 2 e remodelação sinapse e manutenção 3. Estes estudos sugerem fortemente que miRNAs estão envolvidos, através de efeitos de regulação de vários níveis, tanto na formação e na manutenção da saída principal do sistema nervoso, a função cognitiva. Injeção estereotáxica de partículas lentivírus em regiões específicas no cérebro de roedores permite à procura de alterações na morfologia sinapse e atividade neuronal, e foi usado para estabelecer o significado funcional de transcritos sobre-expressos 4,5. Infecção direta de neurônios em áreas do cérebro bem definidas com miRNA-expressando lentivírus podem estar envolvidos em estudos de envelhecimento, distúrbios cerebrais e neurodegeneração; Estudos de miRNAs no campo da regulação comportamental 6-8 estão em um estado muito menos avançada, e injeção estereotáxica de miRNA-expressando partículas lentivírus seguidos por testes comportamentais podem ser úteis para tais fins. Um método muito mais trabalhoso para induzir sobre ou sub-expressão envolve a engenharia genética knock-in ou camundongos knockout. Sistemas genéticos podem ainda permitir o controlo condicional e temporal sobre a expressão (por exemplo, Cre-Lox, sistemas Tet), mas estes dificilmente oferecem a especificidade espacial do procedimento de injecção e existe quase sempre uma certa quantidade de fugas. Além disso, os procedimentos de engenharia não necessitam de cirurgia e pode ser usado em laboratórios com relativamente boa reprodutibilidade, no entanto, são lentos e exigem muito mais recursos humanos e financeiros. Além disso, o controlo temporal da sub-expressão em ratinhos injectados sobre ou é muito mais preciso em comparação com ratinhos geneticamente modificados.
Protocolo
1. Preparação lentivírus
- Cultivar células HEK-293FT a 90% de confluência.
- No dia da transfecção meio celular alteração DMEM isento de soro suplementado com glutamina 1 mM e 50 mg / ml de penicilina-estreptomicina.
- Co-transfectar as células com um vector pLKO.1-Puro e com plasmídeos que codificam para o delta R8.2 e VSV-G e radicais da miRNA de interesse, utilizando 10 ul de 1 mg / mL de polietilenimina como um transportador 9.
- Recolhe lentivírus embalados às 24 horas e 48 horas pós-transfecção, filtrar através de um filtro de 0,45 um.
- Concentrar os lentivírus utilizando ultracentrifugação em 70.000 xg, por 2 horas e 15 ° C, alíquotas e armazenar a -70 ° C.
- Medida por titulação do vírus infectando células HEK-293T com preparações de virus diluídos em série (1 a 10 -6 ml de vector por poço). O título resultante (um mínimo de 1 x 10 ~ 9 partículas infecciosas por ml é recomendado) é avaliada para a expressão do gene de interesse, usando a seleção puromycin e da quantificação do vírus expressando GFP através da contagem de células fluorescentes.
Para o protocolo mais detalhado de preparação lentivírus ver 10.
2. Preparando animais para a cirurgia
- Cirurgiões vestimenta deve incluir vestido cirúrgico, luvas estéreis, gorro e máscara.
- Pesa-se o animal, depois anestesiam-lo com um IP-injecção de uma mistura de cetamina, com o volume proporcional ao peso do animal, tal como especificado para cada fármaco. Para uma mistura de cetamina / xilazina, um intervalo de doses de 80-200 mg / kg de cetamina e 7-20 mg / kg de Xilazina é geralmente usado para os ratos.
- Espere até que o animal está totalmente anestesiado, em seguida, verificar a falta de reflexo de retirada do membro posterior do animal através da extensão do membro e, em seguida, pressionando-o com o dedo.
- Injectar o animal por via subcutânea com Rimadyl, conforme especificado na caixa, para alívio da dor. Intervalo de dose típica para Rymadil é de 5-10 mg.
- Colocar o animal em uma almofada de aquecimento para manter a temperatura corporal constante e umedecer os olhos com pomada.
- Raspar a área entre as duas orelhas com uma máquina de corte.
- Higienizar a pele com betadine.
3. Exposição da Caveira e perfuração
- Colocar o animal dentro do stereotact ajustando as barras nas fendas apenas anteriores aos ouvidos do animal.
- Usar um bisturi para fazer uma incisão ântero-posterior de cerca de 1,5 cm entre as orelhas e mantê-la aberta com grampos cirúrgicos (serfines).
- Limpe a superfície do crânio com um cotonete até a interseção entre a sutura coronal e suturas sagital, ou seja, o bregma ea interseção entre as suturas coronal e lambdóide, ou seja, lambda, são visíveis.
- Saliente da ponta da seringa, realizada pelo stereotact, ao ponto bregma, em todos os três eixos. Anote as coordenadas. Este ponto seria considerado como o po de zeroint em todos os três eixos.
- Levante a seringa no eixo vertical, de modo que um movimento planar não arranhar o crânio e mover a cabeça da seringa para o local correto. Injecções de CA1 do hipocampo requerem coordena o seguinte em relação ao bregma, em mm: -2 no eixo anterior / posterior, ± 1,8 no eixo lateral / medial e -1.5 no eixo dorsal / ventral.
- Abaixe a ponta da seringa até que toque o crânio e marcar o local com um marcador. Retire a seringa para trás para evitar esfaqueamento.
- Faça um buraco raso, só no osso do crânio com uma multa perfurador. Segure o perfurador constante para que ele não iria continuar a perfurar os debaixo dos tecidos moles. Você pode evitar isso, firmando um lado com o outro e através da perfuração em pulsos curtos.
4. A injecção do lentivírus
- Retirar 0,5 ml da solução concentrada de lentivírus.
- Coloque a seringa por cima do buraco e, lentamente, abaixe-o verticalmente até que reateso a superfície do crânio. Continue a diminuir a seringa no cérebro muito lentamente. Neste passo, pode ocorrer alguma hemorragia o que não indica necessariamente uma penetração falhou. Se ocorrer sangramento contê-la com um cotonete.
- Regular a bomba digital para 0,02 ml / min (0,5 ul seria injectado em 25 min) e iniciar a infusão. A perfusão lenta permite um espalhamento eficaz do vírus no tecido e impede o fluxo de retorno. Em alguns tipos de seringas considerar a inserção da seringa para uma profundidade extra de 0,5 mm antes de se retirar para as coordenadas originais e infundindo.
- Depois de completada a infusão é aguardar mais 5 min para permitir que o material para se propagar no cérebro em vez de se retirar de volta para dentro do canal formado pela seringa.
- Retire a seringa muito lentamente e observar os fluxos de volta. Se um fluxo de retorno é observada nesta etapa, uma fracção do material injectado foi provavelmente perdida.
5. Selagem de Feridas e Recuperação
- Seal ªe enrolada com histoacryl. Certifique-se de evitar o vazamento do histoacryl nos olhos.
- Injectar a animais por via intraperitoneal (IP) com 1 ml de solução salina pré-aquecida, a fim de evitar a desidratação.
- Colocar o animal numa gaiola de recuperação que está posicionada sobre uma almofada aquecida. Assista ao animal enquanto ele se recupera de uma hora.
Em caso de perda de peso, inapetência, fraqueza / incapacidade de obter alimentos ou água, estado moribundo ou infecção, a eutanásia do animal deve ser realizada. Métodos aceitáveis para a eutanásia de roedores são os barbitúricos, anestésicos inalatórios, CO 2, CO, ou cloreto de potássio em conjunto com anestesia geral.
Após 4 a 6 semanas, avaliam a memória de navegação do animal é avaliado no labirinto aquático de Morris. Os lentivírus que normalmente infectam a maioria das células no interior da esfera de injecção.
6. Avaliação comportamental no labirinto aquático de Morris
- Treinar os animais no Morris labirinto aquático. Para a formação exata e protocolo de testes ver 11. Depois de cada ensaio, secar o animal com uma toalha seca e substituí-lo na sua gaiola e refrescar a água no tanque.
- Testar os animais no labirinto aquático de Morris, durante 3 dias consecutivos, quatro ensaios por dia. Cada dia inserir o animal no labirinto em cada uma das quatro direções do labirinto (norte, sul, leste e oeste), em uma ordem de mudança, por exemplo, o primeiro dia: leste-oeste-norte-sul, o dia dois: oeste-sul -nordeste. Limpe os animais depois de cada julgamento.
- Durante o ensaio, os ensaios controlar o animal com um sistema de rastreio, tais como o sistema de rastreamento Noldus.
- Após o ensaio de teste no dia 12, inserir o animal dentro do tanque de água, sem a plataforma, durante um minuto. Isto será usado para analisar a estratégia de pesquisa está a tomar o animal.
- Analisar os dados, tal como sugerido em 12.
Resultados
A injecção de 0,5 ml no lentivírus região CA1 do hipocampo do rato, com a taxa de fluxo indicado na secção do protocolo produz uma esfera infectada de cerca de 1 mm no eixo rostral-caudal, e cerca de 0,5 mm, no médio-lateral e a anterior eixos-posterior (Figura 3).
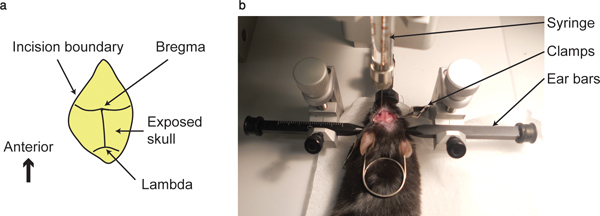
Figura 1. Ponto bregma e aparelhos de injeção. (A) É mostrado um mapa esquem...
Discussão
Injeção estereotáxica de um lentivírus é um método relativamente rápido para a avaliação in vivo, tanto para down-regulação de diferentes genes e miRNAs cima ou. A principal alternativa é um rato geneticamente modificado que é uma técnica consome muito mais trabalhoso e demorado, em seguida, a injeção direta lentivírus. Além disso, a regulação para cima, na injecção de lentivírus, ocorre a um tempo específico no ratinho adulto e não inclui qualquer possibilidade de permeabilidade durant...
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Este estudo foi apoiado pelo Edmond e Lily Safra Center for Brain Sciences (SB comunhão), The Legacy Heritage Ciências Biomédicas Programa de Parceria da Fundação Israel Science (Grant No. 378/11, a HS) e da Fundação Alemã de Israel for Scientific Pesquisa e Desenvolvimento (GIF) (Grant No. 1093-32.2/2010, a HS).
Materiais
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Rodent weigh scale | Burtons (UK) | 115-455 | |
| heating pad | FIRstTechnology | DCT-25 | |
| trimming machine | Stoelting | 51465 | |
| stereotact | Stoelting | 51730 | |
| Scalpel and blades | Kent scientific | INS500348 | |
| Harland syringe | Hamilton | 7632-01 | |
| driller | Stoelting | 51449 | |
| digital pump | Harvard apparatus | 704507 | |
| Water tank and platform | Stoelting | 60135 |
| Reagents | |||
| ketamine | Vetoquinol(Lure France) | 3055503 | |
| domitor | Orion pharma | 107140-10 | |
| Rimadyl | Pfizer animal health | 24751 | |
| moisture ointment - Synthomycine 5% | Rekah Pharmaceutical | 195 | |
| histoacryl | Braun | 112101 | |
| saline | Sigma Aldrich | D8662 |
Referências
- Siegel, G., et al. A functional screen implicates microRNA-138-dependent regulation of the depalmitoylation enzyme APT1 in dendritic spine morphogenesis. Nature Cell Biology. 11, 705-716 (2009).
- Jin, P., et al. Biochemical and genetic interaction between the fragile X mental retardation protein and the microRNA pathway. Nature Neuroscience. 7, 113-117 (2004).
- Simon, D. J. The microRNA miR-1 regulates a MEF-2-dependent retrograde signal at neuromuscular junctions. Cell. 133, 903-915 (2008).
- Consiglio, A. In vivo gene therapy of metachromatic leukodystrophy by lentiviral vectors: correction of neuropathology and protection against learning impairments in affected mice. Nature Medicine. 7, 310-316 (2001).
- Jakobsson, J., Lundberg, C. Lentiviral vectors for use in the central nervous system. Molecular Therapy: The Journal of the American Society of Gene Therapy. 13, 484-493 (2006).
- Berson, A. Cholinergic-associated loss of hnRNP-A/B in Alzheimer's disease impairs cortical splicing and cognitive function in mice. EMBO Molecular Medicine. , (2012).
- Haramati, S. MicroRNA as repressors of stress-induced anxiety: the case of amygdalar miR-34. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 31, 14191-14203 (2011).
- Shaltiel, G., et al. Hippocampal microRNA-132 mediates stress-inducible cognitive deficits through its acetylcholinesterase target. Brain Structure & Function. , 10-1007 (2012).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92, 7297-7301 (1995).
- Mendenhall, A., Lesnik, J., Mukherjee, C., Antes, T., Sengupta, R. Packaging HIV- or FIV-based lentivector expression constructs & transduction of VSV-G pseudotyped viral particles. J. Vis. Exp. (62), e3171 (2012).
- Nunez, J. Morris Water Maze Experiment. J. Vis. Exp. (19), e897 (2008).
- Bromley-Brits, K., Deng, Y., Song, W. Morris water maze test for learning and memory deficits in Alzheimer's disease model mice. J. Vis. Exp. (53), e2920 (2011).
- Regev, L., Ezrielev, E., Gershon, E., Gil, S., Chen, A. Genetic approach for intracerebroventricular delivery. Proceedings of the National Academy of Sciences of the United States of America. 107, 4424-4429 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados