このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
の定位注入マイクロRNA発現マウス海馬CA1領域にレンチウイルスと行動アウトカムの評価
要約
マイクロRNAは、脳の構造と機能に重要な役割を持っている。ここでは、設計されたmiRNAの発現レンチウイルスの定位注射を使用して過剰発現海馬のmiRNAを強制する方法について説明します。このアプローチは、評価するための比較的急速な方法として役立つことができる特定の脳領域における過剰発現miRNAの効果。
要約
マイクロRNAは(miRNA)は長さ22ヌクレオチドの周りの小さな規制一本鎖RNA分子であるかもしれないことを各ターゲット多数のmRNA転写を誘導破壊および/またはこれらのターゲットの翻訳を阻害することによって薄暗い全体の遺伝子発現経路。いくつかのmiRNAは、神経構造と機能を維持するために、より高いレベルの脳機能において重要な役割を果たし、及び方法は、これらの機能を探索するためのそれらのレベルを操作するために求められている。ここでは、miRNAをコードするウイルス粒子の定位注射によってマウスにおける過剰な強制miRNAの認知影響を調べるためのインビボ方法で直接を提案する。具体的には、現在のプロトコルでは、海馬CA1哺乳類メモリの統合に貢献する地域、学習、ストレス応答への注入を含み、便利な注射部位を提供しています。座標は、デジタル制御と非常に遅い保持されるマウスブレグマとウイルス血流に従って測定される。注射後、手術創傷を密閉し、動物が回復される。対応するmRNAターゲットのサイレンサーをコードレンチウイルスはナイーブマウスに、生理食塩水及び対照として "空"のレンチウイルスベクターを注射したマウスに注射したマウスで、観察された効果に責任を特定のmiRNA /ターゲットの相互作用を巻き込むのに役立つ。一ヶ月後噴射は、動物はそれらのナビゲーション学習および記憶能力を評価するためのモリス水迷路(MWM)で検討されている。 MWMは1センチメートル水面下に沈んで小さなプラットフォームで着色水で満たされた丸いタンクである。タンクの周りに着実視覚的な手がかりは、空間ナビゲーション(音と地球の磁場にもナビゲートで動物を助けるかもしれない)を可能にします。ビデオカメラの監視は、水泳とプラットフォームを見つけ、量に時間の経路を測定することができます。マウスが最初に隠れたプラットフォームをマウントすると、強制水泳からの脱出を提供することを教えられて、それは、その後、このエスケープとfを使用するためにテストされinally、プラットフォームは削除され、マウスがその前の位置を記憶した場合のプローブテストは検討されています。複数の連続した日間のテストプラットフォームを見つけてマウントするために短い待ち時間で試験されたマウスのパフォーマンスの向上を強調し、より直接的なルートがプラットフォームまたはその場所に到達するまで繰り返される。このような改善を示すに失敗すると、その後(高架迷路内など )は、特に試験することができる障害、学習と記憶、および/ または不安を表します。このアプローチは、研究、認知および/またはストレス関連のプロセス内の特定のmiRNAと標的転写物の検証を可能にします。
概要
神経系の機能の特定のmiRNAの役割は、最近いくつかの研究でレンチウイルス注射によって挑戦されています。 miRNAは、シナプス構造1、シナプス2およびシナプスの改造やメンテナンス3を維持し、再整形するために重要であることが見出されている。これらの研究は強くmiRNAはシェイプアップや神経系、認知機能の主な出力を維持するために両方で多値調節作用を介して、従事していることを示唆している。齧歯類の脳の特定の領域へのレンチウイルス粒子の定位注入はシナプスの形態と神経活動の変化を探し、そして過剰発現転写産物4,5の機能的意義を確立するために使用されたことができます。 miRNAの発現レンチウイルスと明確に定義された脳領域における神経細胞の直接感染は老化、脳障害や神経変性の研究に関与することができ、のmiRNA研究sが行動規制6-8の領域ではるかに高度な状 態にある、との定位注入のmiRNA発現行動テストに続いてレンチウイルス粒子は、そのような目的のために有用かもしれません。過剰または発現下誘導するためのかなり骨の折れる方法は、遺伝子組み換えノックインまたはノックアウトマウスが含まれます。遺伝システムは、さらに表現を条件と時間的制御を可能にすることができる( 例えば、CRE-ロックス、テトシステム)が、これらはほとんど注射手順の空間的な特異性を提供していないし、漏出の一定量は、ほとんどの場合があります。また、エンジニアリングの手順は、手術を必要とせず、比較的良好な再現性を持つ研究室全体で使用できますが、彼らは遅くなりますとはるかに人材と財源を必要とする。また、過剰または注射したマウスで発現下の時間的制御は、遺伝子改変マウスに比べてはるかに正確です。
プロトコル
1。レンチウイルスの準備
- 90%コンフルエンスにHEK-293FT細胞を成長させる。
- 無血清DMEMにトランスフェクション変化細胞培地の日に1 mMのグルタミンおよび50 mg / mlのペニシリン - ストレプトマイシンを補充した。
- pLKO.1-Puroのベクターで、キャリア9として1 mg / mlのポリエチレンイミン10μlのを使用して、デルタR8.2およびVSV-G部分及び利息のmiRNAをコードするプラスミドを細胞に共トランスフェクション。
- 0.45μmのフィルターを通過フィルタ、24時間と48時間のトランスフェクション後にパッケージ化されたレンチウイルスを収集します。
- 2時間と15°-70℃、アリコートと店舗℃で、70,000×gでの遠心分離を使用したレンチウイルスを集中
- 希釈したウイルス製剤(ウェルあたりベクトル1〜10 -6ミリリットル)とHEK-293T細胞に感染させることにより、ウイルス力価を測定します。結果として力価(1ml当たり約1×10 9感染性粒子が推奨され、最低)がGEの発現のために評価される興味のあるね、ピューロマイシン選択を使用して、カウントを蛍光細胞を通してウイルスをGFPを発現を定量することによって。
レンチウイルスの準備の詳細なプロトコルのために10を参照してください。
2。手術のための動物の準備
- 外科医の服装は、手術ガウン、滅菌手袋、キャップとマスクを含める必要があります。
- 動物を秤量し、各薬物に指定されたように、動物の体重に比例した量で、ケタミンの混合物のIP-注射でそれを麻酔。ケタミン/キシラジン混合物については、80〜200 mg / kgでケタミンおよび7-20 mg / kgをキシラジンの用量範囲は、通常のマウスのために使用される。
- 動物は完全に麻酔になるまで待ってから、手足を延長して、指で押すことによって、動物の後肢に撤退反射の欠如のために確認してください。
- ボックスに指定されている痛みの軽減のために、、Rimadylを皮下動物を注入。 Rymadilの典型的な用量範囲は5-10 mgのです。
- 安定した体温を維持し、軟膏と目を潤すために加熱パッドに動物を配置します。
- トリミングマシンと両耳の間の領域を剃る。
- ベタジンで皮膚を消毒する。
3。スカルと掘削の露出
- 動物の耳のすぐ前方の隙間にロッドを調整することによって、stereotact内側に動物を配置します。
- 耳の間の約1.5センチ前後切開を行い、手術クランプ(serfines)とそれを開いたままにメスを使用してください。
- 冠状縫合と矢状縫合の交点まで綿棒で頭蓋骨の表面をきれいにする、すなわちブレグマとコロナとラムダ縫合の交点、すなわちラムダ、表示されます。
- すべての3つの軸で、ブレグマポイントへstereotactが保有するシリンジの先端を、指す。座標を書き留める。この点はゼロ経口としてみなされるすべての3つの軸のint。
- 平面的な動きが頭蓋骨に傷をして正しい場所に注射器ヘッドを移動させないように、縦軸に注射器を持ち上げます。内側/横軸で、前方/後方の軸で±1.8 -2腹/背軸に-1.5:海馬CA1注射以下は、mm単位でブレグマを基準とした座標を必要とする。
- それは頭蓋骨に触れるまで、シリンジの先端を下げて、マーカーでスポットをマークします。刺す避けるために戻ってシリンジを取り外し。
- だけ細かい穴あけを使用頭蓋骨に浅い穴を開けます。ので、軟部組織の下にドリルしていきませんドリラーをしっかりホールド。あなたは他のと安定さ片手でかつ短パルスで掘削することでこれを防ぐことができます。
4。レンチウイルスの注射
- 濃縮されたレンチウイルス溶液0.5mlを撤回。
- 穴のすぐ上の注射器を置き、REAまでゆっくりと垂直に下げるCHES頭蓋骨の表面。非常にゆっくりと脳に注射器を下げ続ける。このステップでは、いくつかの出血は必ずしも失敗浸透を示すものではありませんその発生する可能性があります。出血が発生した場合は綿棒でそれを掃討。
- 0.02ミリリットル/分(0.5μLを25分に注入されるであろう)にデジタルポンプを設定し、注入を開始します。スロー注入は効果的な組織の中にウイルスの拡散や逆流を防止することができます。いくつかのシリンジタイプで元の座標と注入するに後退前0.5mmの余分な深さのために注射器を挿入することを検討してください。
- 注入が完了した後に材料が注射器によって形成された道に戻って後退するのではなく脳内に広がることができるように追加の5分間待ちます。
- 非常にゆっくりとシリンジを取り外し、バックフローを監視する。逆流は、この段階で観察された場合、注入された材料の一部が失われたであろう。
5。傷のシーリングおよびリカバリ
- シール番目eはhistoacrylが巻か。目にhistoacrylの漏洩を避けるようにしてください。
- 脱水を避けるために、1mlの予熱された生理食塩水で動物の腹腔内(IP)注射する。
- 加熱されたパッドの上に配置されている回復ケージに動物を配置します。それがさらに1時間回復しながら動物を見てください。
体重減少、食欲不振、脱力/不能飼料または水を得るために、瀕死状態又は感染の場合には、動物の安楽死を行うべきである。齧歯動物の安楽死の許容方法はバルビツール酸塩、吸入麻酔薬、CO 2、CO、または全身麻酔と一緒に塩化カリウムです。
4〜6週間後、動物のナビゲーションメモリはモリス水迷路で評価されて評価します。レンチウイルスは、通常の射出球内でほとんどの細胞に感染します。
6。モリス水迷路における行動アセスメント
- Mで動物を訓練オリス水迷路。正確なトレーニングとテストのプロトコルのために11を参照してください。各試行の後、乾いたタオルで動物を乾燥、そのケージにそれを交換し、タンク内の水をリフレッシュ。
- 毎日3日間連続、4試験のためモリス水迷路の動物をテストします。 、東西·南北の二日目:西南毎日例の初日のため、変更するために迷路の4方向(北、南、東と西)のそれぞれで迷路に動物を挿入 - 北東。各試行の後に動物を拭きます。
- 試験中に試験はそのようなNoldus追跡システムなどの追跡システムで動物を追跡します。
- 12 回目のテストの試験の後、1分間のプラットフォームずに水タンクに動物を挿入します。これは、動物が取っている検索戦略を分析するために使用される。
- 12で提案されているようにデータを分析します。
結果
プロトコルの項に示されている流量でマウスの海馬のCA1領域に0.5μlのレンチウイルスの注射は、吻側尾軸で約1mm、と内側 - 外側と前方に約0.5mmの感染球を生み出す-後軸( 図3)。
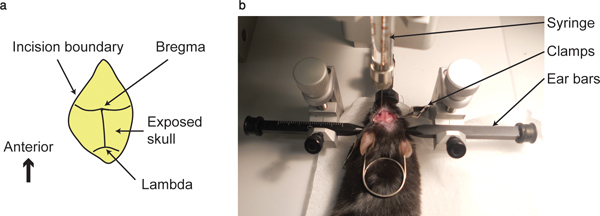
図1。ブレグマ点と噴射装置 。 ()が示されブレグマ(冠状および矢状縫合の交点)と...
ディスカッション
レンチウイルスの定位注入は、アップまたは異なる遺伝子やmiRNAのダウンレギュレーションの両方の生体内評価のための比較的迅速な方法である。主な選択肢ははるかに面倒で時間のかかる技法その後直接レンチウイルス注射である遺伝子組み換えマウスである。また、アップレギュレーションは、レンチウイルスの注射で、成体マウスで特定の時間に発生し、時間的制御を含?...
開示事項
著者は、彼らが競合する経済的利益を持っていないことを宣言します。
謝辞
この研究は、脳科学のためのエドモンドとリリー·サフラセンター(SBフェローシップ)、イスラエル科学財団(HSにグラント第11分の378、)と科学のためのドイツのイスラエル財団の遺産遺産バイオメディカル·サイエンス·パートナーシップ·プログラムによってサポートされています研究開発(GIF)(HSにグラント号1093-32.2/2010、)。
資料
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Rodent weigh scale | Burtons (UK) | 115-455 | |
| heating pad | FIRstTechnology | DCT-25 | |
| trimming machine | Stoelting | 51465 | |
| stereotact | Stoelting | 51730 | |
| Scalpel and blades | Kent scientific | INS500348 | |
| Harland syringe | Hamilton | 7632-01 | |
| driller | Stoelting | 51449 | |
| digital pump | Harvard apparatus | 704507 | |
| Water tank and platform | Stoelting | 60135 |
| Reagents | |||
| ketamine | Vetoquinol(Lure France) | 3055503 | |
| domitor | Orion pharma | 107140-10 | |
| Rimadyl | Pfizer animal health | 24751 | |
| moisture ointment - Synthomycine 5% | Rekah Pharmaceutical | 195 | |
| histoacryl | Braun | 112101 | |
| saline | Sigma Aldrich | D8662 |
参考文献
- Siegel, G., et al. A functional screen implicates microRNA-138-dependent regulation of the depalmitoylation enzyme APT1 in dendritic spine morphogenesis. Nature Cell Biology. 11, 705-716 (2009).
- Jin, P., et al. Biochemical and genetic interaction between the fragile X mental retardation protein and the microRNA pathway. Nature Neuroscience. 7, 113-117 (2004).
- Simon, D. J. The microRNA miR-1 regulates a MEF-2-dependent retrograde signal at neuromuscular junctions. Cell. 133, 903-915 (2008).
- Consiglio, A. In vivo gene therapy of metachromatic leukodystrophy by lentiviral vectors: correction of neuropathology and protection against learning impairments in affected mice. Nature Medicine. 7, 310-316 (2001).
- Jakobsson, J., Lundberg, C. Lentiviral vectors for use in the central nervous system. Molecular Therapy: The Journal of the American Society of Gene Therapy. 13, 484-493 (2006).
- Berson, A. Cholinergic-associated loss of hnRNP-A/B in Alzheimer's disease impairs cortical splicing and cognitive function in mice. EMBO Molecular Medicine. , (2012).
- Haramati, S. MicroRNA as repressors of stress-induced anxiety: the case of amygdalar miR-34. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 31, 14191-14203 (2011).
- Shaltiel, G., et al. Hippocampal microRNA-132 mediates stress-inducible cognitive deficits through its acetylcholinesterase target. Brain Structure & Function. , 10-1007 (2012).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92, 7297-7301 (1995).
- Mendenhall, A., Lesnik, J., Mukherjee, C., Antes, T., Sengupta, R. Packaging HIV- or FIV-based lentivector expression constructs & transduction of VSV-G pseudotyped viral particles. J. Vis. Exp. (62), e3171 (2012).
- Nunez, J. Morris Water Maze Experiment. J. Vis. Exp. (19), e897 (2008).
- Bromley-Brits, K., Deng, Y., Song, W. Morris water maze test for learning and memory deficits in Alzheimer's disease model mice. J. Vis. Exp. (53), e2920 (2011).
- Regev, L., Ezrielev, E., Gershon, E., Gil, S., Chen, A. Genetic approach for intracerebroventricular delivery. Proceedings of the National Academy of Sciences of the United States of America. 107, 4424-4429 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved