È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Iniezione stereotassica di microRNA-esprimono lentivirus al mouse Hippocampus CA1 regione e valutazione dei risultati Behavioral
In questo articolo
Riepilogo
I microRNA hanno un ruolo significativo nella struttura del cervello e la funzione. Qui si descrive un metodo per far rispettare miRNA ippocampale iper-espressione utilizzando l'iniezione stereotassica di lentivirus ingegnerizzati miRNA che esprimono. Questo approccio può servire come un modo relativamente rapido per valutare l' In vivo Effetti di miRNA over-espressa in regioni specifiche del cervello.
Abstract
I microRNA (miRNA) sono piccoli regolatori a singolo filamento molecole di RNA lunghi circa 22 nucleotidi che possono ogni bersaglio numerosi trascritti di mRNA e dim un'intera espressione genica percorso di distruzione che induce e / o traduzione inibizione di questi obiettivi. Molti miRNA giocano un ruolo chiave nel mantenimento struttura e la funzione neuronale e nelle funzioni cerebrali di livello superiore, e si cercano metodi per manipolare i loro livelli per esplorare queste funzioni. Qui vi presentiamo un diretto metodo in vivo per esaminare le conseguenze cognitive di miRNA vigenti in eccesso nei topi tramite iniezione stereotassica di particelle virali miRNA-codifica. In particolare, l'attuale protocollo prevede l'iniezione nella regione CA1 dell'ippocampo, che contribuisce al consolidamento dei mammiferi memoria, l'apprendimento, e le risposte allo stress, e offre un comodo sito di iniezione. Le coordinate sono misurate in base al bregma mouse e perfusione virus viene digitalmente controllata e mantenuta molto lento.Dopo l'iniezione, la ferita chirurgia è sigillato e gli animali recuperare. Lentivirus codificante silenziatori dei corrispondenti obiettivi di mRNA servono a coinvolgere l'interazione miRNA / target specifico responsabile per l'effetto osservato, con topi naive, topi iniettati con soluzione salina e topi iniettati con vettori lentivirus "vuoti" come controlli. Un mese dopo l'iniezione, gli animali sono esaminati nel labirinto ad acqua di Morris (MWM) per valutare il loro apprendimento di navigazione e capacità di memoria. Il MWM è un serbatoio rotondo riempito con acqua colorata con una piccola piattaforma sommersa 1 cm sotto la superficie dell'acqua. Costanti segnali visivi di tutto il serbatoio consentono la navigazione spaziale (il suono e il campo magnetico terrestre può anche aiutare gli animali in navigazione). Monitoraggio videocamera consente la misurazione del percorso della nuotata e il tempo per trovare e ammonterà la piattaforma. Il mouse viene prima insegnato che il montaggio della piattaforma nascosta offre una via di fuga dal nuoto forzato; viene poi testato per l'utilizzo di questa fuga e fzialmente, la piattaforma viene rimosso e test sonda esaminare se il mouse si ricorda la sua posizione precedente. Prove ripetute su più giorni consecutivi evidenziano migliori prestazioni di topi testati a latenze più brevi per trovare e montare la piattaforma, e percorsi come più diretta per raggiungere la piattaforma o la sua posizione. La mancata presentazione di tale miglioramento rappresenta apprendimento e di memoria e / o ansia, che possono poi essere testati specificamente (ad esempio nel elevated plus maze). Questo approccio consente la convalida dei miRNA specifici e le trascrizioni di destinazione nel cognitivo studiato e / o dei processi legati allo stress.
Introduzione
Il ruolo di particolari microRNA nel funzionamento del sistema nervoso è stata recentemente contestata da iniezione lentiviral in diversi studi. MiRNAs sono stati trovati ad essere cruciale per il mantenimento e ri-modellare la struttura delle sinapsi 1, 2 sinaptogenesi e rimodellamento delle sinapsi e manutenzione 3. Questi studi suggeriscono fortemente che miRNAs sono impegnate, tramite effetti regolatori pluristratificato sia nella sagomatura e nel mantenere l'uscita principale del sistema nervoso, funzione cognitiva. Iniezione stereotassica di lentivirus particelle in regioni specifiche del cervello dei roditori permette la ricerca di alterazioni nella morfologia delle sinapsi e l'attività neuronale, ed è stato utilizzato per stabilire il significato funzionale di trascrizioni over-espressa 4,5. Infezione diretta dei neuroni di aree cerebrali ben definite con i miRNA che esprimono lentivirus può essere implicato in studi di invecchiamento, disturbi cerebrali e neurodegenerazione; Studi di miRNAs nel regno del regolamento comportamentale 6-8 sono in uno stato molto meno avanzato, e l'iniezione stereotassica di miRNA che esprimono particelle lentivirus seguiti da test comportamentali può essere utile a tale scopo. Un metodo molto più laborioso per indurre sovra-o sotto-espressione comporta geneticamente knock-in o topi knockout. Sistemi genetici possono permettere ulteriormente per controllo condizionale e temporale sulla espressione (ad es Cre-Lox, sistemi Tet), ma questi difficilmente offrono la specificità spaziale della procedura di iniezione e non vi è quasi sempre una certa quantità di leakiness. Inoltre, le procedure di ingegneria non richiedono intervento chirurgico e può essere impiegato in laboratori con relativamente buona riproducibilità, tuttavia, essi sono più lenti e richiedono molto più manodopera e risorse finanziarie. Inoltre, il controllo temporale del sotto-espressione in topi iniettati sovra o è molto più preciso rispetto ai topi geneticamente ingegnerizzati.
Protocollo
1. Lentivirus Preparazione
- Crescere le cellule HEK-293FT al 90% di confluenza.
- Il giorno del cambiamento transfezione cellulare per mezzo privo di siero DMEM supplementato con 1 mM di glutammina e 50 mg / ml di penicillina-streptomicina.
- Co-trasfezione delle cellule con un vettore pLKO.1-Puro e con plasmidi codificanti per il delta R8.2 e VSV-G porzioni e il miRNA di interesse, utilizzando 10 ml di 1 mg / ml polyethylenimine come un vettore 9.
- Raccogliere lentivirus confezionati in 24 ore e 48 ore dopo la trasfezione, filtro attraverso il filtro di 0,45 micron.
- Concentrare i lentivirus con ultracentrifugazione a 70.000 xg, per 2 ore e 15 ° C, aliquota e conservare a -70 ° C.
- Virus Misura titolo di infettare le cellule HEK-293T con preparazioni di virus diluito in serie (da 1 a 10 -6 ml di vettore per pozzetto). Il titolo risultante (un minimo di ~ 1 × 10 9 particelle infettive per ml è raccomandato) viene valutata per l'espressione del gene di interesse, utilizzando la selezione puromicina e quantificando GFP che esprimono i virus attraverso il conteggio delle cellule fluorescenti.
Per il protocollo più dettagliata di preparazione lentivirus vedi 10.
2. Preparazione Animali di Chirurgia
- Chirurghi abito dovrebbe includere camice chirurgico, guanti sterili, cappuccio e maschera.
- Pesare l'animale, poi anestetizzare con un IP-iniezione di una miscela di ketamina, con il volume proporzionale al peso animale come specificato per ogni farmaco. Per una miscela di ketamina / Xilazina, una dose di 80-200 mg / kg di ketamina e 7-20 mg / kg xylazina è di solito utilizzato per i topi.
- Attendere fino a quando l'animale è completamente anestetizzato, quindi controllare per mancanza di ritiro riflesso nel dell'arto posteriore dell'animale, estendendo l'arto e poi premendo con il dito.
- Iniettare l'animale per via sottocutanea con Rimadyl, come specificato sulla confezione, per alleviare il dolore. Range tipico dosaggio per Rymadil è 5-10 mg.
- Posto l'animale su una piastra elettrica per mantenere una temperatura corporea costante e inumidire gli occhi con unguento.
- Radere l'area tra le due orecchie con una macchina di rifilatura.
- Disinfettare la cute con Betadine.
3. L'esposizione del teschio e Perforazioni
- Posto l'animale all'interno del stereotact regolando le aste in fessure appena anteriormente al orecchio dell'animale.
- Utilizzare un bisturi per fare un'incisione anteriore-posteriore di circa 1,5 cm tra le orecchie e tenerla aperta con fascette di chirurgia (serfines).
- Pulire la superficie del cranio con un tampone di cotone fino all'incrocio tra la sutura coronale e suture sagittali; cioè il bregma e l'intersezione tra le suture coronale e lambdoidea; cioè lambda, sono visibili.
- Puntare la punta della siringa, tenuto dal stereotact, al punto bregma, in tutti e tre gli assi. Annotare le coordinate. Questo punto sarebbe considerato quale zero Point in tutti e tre gli assi.
- Sollevare la siringa in verticale in modo che un movimento planare non graffiare il cranio e muovere la testa siringa nella posizione corretta. Iniezioni CA1 ippocampali richiedono le seguenti coordinate rispetto al bregma in mm: -2 sull'asse anteriore / posteriore, ± 1,8 a all'asse laterale / mediale e -1.5 sull'asse dorsale / ventrale.
- Abbassare la punta della siringa fino a toccare il cranio e segnare il punto con un pennarello. Rimuovere la siringa indietro per evitare accoltellamento.
- Praticare un foro poco profondo, solo nelle ossa cranio con un bel trapano. Tenere il trapano costante in modo che non avrebbe continuato a forare la parte inferiore dei tessuti molli. È possibile evitare questo stabilizzando una mano con l'altra e con la perforazione in brevi impulsi.
4. Iniezione della Lentivirus
- Prelevare 0,5 ml della soluzione concentrata lentivirus.
- Posizionare la siringa sopra il foro e lentamente abbassare verticalmente fino Reaches la superficie del cranio. Continuare ad abbassare la siringa nel cervello molto lentamente. A questo punto qualche sanguinamento può verificarsi che non indica necessariamente una penetrazione fallito. Se si verifica sanguinamento asciugare il tutto con un tampone di cotone.
- Impostare la pompa digitale a 0,02 ml / min (0,5 microlitri verrebbe iniettato in 25 min) e iniziare l'infusione. Lenta infusione permette efficace la diffusione del virus nei tessuti e previene il riflusso. In alcuni tipi di siringa prendere in considerazione l'inserimento della siringa per una maggiore profondità di 0,5 mm prima di ritirarsi alle coordinate originali e infondere.
- Dopo completato l'infusione attesa delle ulteriori 5 minuti per consentire al materiale di diffondere nel cervello anziché ritirandosi nel canale formato dalla siringa.
- Rimuovere la siringa molto lentamente e guardare per i flussi di ritorno. Se si osserva un flusso indietro a questo punto, una frazione del materiale iniettato era probabilmente persa.
5. Ferita di tenuta e di recupero
- Seal The avvolto con Histoacryl. Essere sicuri di evitare perdite di Histoacryl negli occhi.
- Iniettare la via intraperitoneale animale (IP) con 1 ml di soluzione fisiologica pre-riscaldato, per evitare la disidratazione.
- Posizionare l'animale in una gabbia di recupero che è posizionato su un pad riscaldato. Guarda l'animale mentre recupera per un'altra ora.
In caso di perdita di peso, inappetenza, dovrebbe essere eseguita debolezza / incapacità di ottenere mangimi o acqua, stato moribondo o infezione, eutanasia dell'animale. Metodi accettabili per l'eutanasia di roditori sono barbiturici, anestetici inalatori, CO 2, CO, o il cloruro di potassio in combinazione con l'anestesia generale.
Dopo 4 a 6 settimane, valutare la memoria di navigazione dell'animale è valutata nel labirinto ad acqua di Morris. Il lentivirus di solito infettare maggior parte delle cellule all'interno della sfera di iniezione.
6. La valutazione del comportamento nel labirinto ad acqua di Morris
- Addestrare gli animali in Mgiaggiolo Water Maze. Per la formazione esatta e protocollo di collaudo vedere 11. Dopo ogni prova, asciugare l'animale con un panno asciutto, sostituirla nella sua gabbia e rinfrescare l'acqua nel serbatoio.
- Testare gli animali nel labirinto ad acqua di Morris per 3 giorni consecutivi, 4 prove ogni giorno. Inserire ogni giorno l'animale nel labirinto in ciascuna delle 4 direzioni del labirinto (nord, sud, est e ovest) in un ordine che cambia, per esempio un giorno: est-ovest-nord-sud, giorno due: ovest-sud -nord-est. Pulire gli animali dopo ogni prova.
- Durante la prova prove in pista l'animale con un sistema di tracciamento come il sistema di inseguimento Noldus.
- Dopo il processo di test 12 °, inserire l'animale nel serbatoio dell'acqua senza la piattaforma per un minuto. Questo potrebbe essere utilizzato per analizzare la strategia di ricerca che l'animale sta prendendo.
- Analizzare i dati come suggerito in 12.
Risultati
Iniezione di 0,5 microlitri lentivirus nella regione CA1 nell'ippocampo topo, con il tasso di flusso indicato nella sezione del protocollo produce una sfera infetto di circa 1 mm nell'asse rostrale-caudale, e circa 0,5 mm in mediale-laterale e anteriore -posteriore assi (Figura 3).
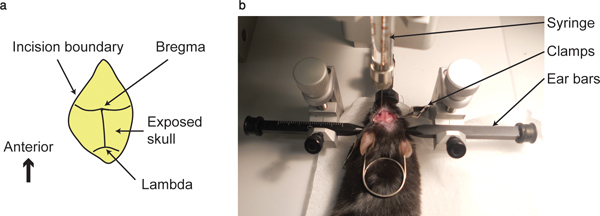
Figura 1. Punto bregma e apparato di iniezione. (A) indicata ...
Discussione
Iniezione stereotassica di lentivirus è un metodo relativamente rapido per la valutazione in vivo sia per il down-regolazione dei geni e miRNA diversi up-o. L'alternativa principale è un topo geneticamente modificato che è una tecnica consuma molto più laboriosa e poi iniezione diretta lentivirus. Inoltre, il regolamento su, a iniezione lentivirus, si verifica in un momento specifico nel topo adulto e non prevede alcuna possibilità di leakiness durante lo sviluppo, come è il caso più frequente nei to...
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari in competizione.
Riconoscimenti
Questo studio è stato sostenuto dal Edmond e Lily Safra Center for Brain Sciences (SB fellowship), The Heritage Biomedical Science Partnership Program Legacy of the Israel Science Foundation (Grant No. 378/11, per HS) e la Fondazione israeliana tedesca per Scientifica Ricerca e sviluppo (GIF) (Grant No. 1093-32.2/2010, a HS).
Materiali
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Rodent weigh scale | Burtons (UK) | 115-455 | |
| heating pad | FIRstTechnology | DCT-25 | |
| trimming machine | Stoelting | 51465 | |
| stereotact | Stoelting | 51730 | |
| Scalpel and blades | Kent scientific | INS500348 | |
| Harland syringe | Hamilton | 7632-01 | |
| driller | Stoelting | 51449 | |
| digital pump | Harvard apparatus | 704507 | |
| Water tank and platform | Stoelting | 60135 |
| Reagents | |||
| ketamine | Vetoquinol(Lure France) | 3055503 | |
| domitor | Orion pharma | 107140-10 | |
| Rimadyl | Pfizer animal health | 24751 | |
| moisture ointment - Synthomycine 5% | Rekah Pharmaceutical | 195 | |
| histoacryl | Braun | 112101 | |
| saline | Sigma Aldrich | D8662 |
Riferimenti
- Siegel, G., et al. A functional screen implicates microRNA-138-dependent regulation of the depalmitoylation enzyme APT1 in dendritic spine morphogenesis. Nature Cell Biology. 11, 705-716 (2009).
- Jin, P., et al. Biochemical and genetic interaction between the fragile X mental retardation protein and the microRNA pathway. Nature Neuroscience. 7, 113-117 (2004).
- Simon, D. J. The microRNA miR-1 regulates a MEF-2-dependent retrograde signal at neuromuscular junctions. Cell. 133, 903-915 (2008).
- Consiglio, A. In vivo gene therapy of metachromatic leukodystrophy by lentiviral vectors: correction of neuropathology and protection against learning impairments in affected mice. Nature Medicine. 7, 310-316 (2001).
- Jakobsson, J., Lundberg, C. Lentiviral vectors for use in the central nervous system. Molecular Therapy: The Journal of the American Society of Gene Therapy. 13, 484-493 (2006).
- Berson, A. Cholinergic-associated loss of hnRNP-A/B in Alzheimer's disease impairs cortical splicing and cognitive function in mice. EMBO Molecular Medicine. , (2012).
- Haramati, S. MicroRNA as repressors of stress-induced anxiety: the case of amygdalar miR-34. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 31, 14191-14203 (2011).
- Shaltiel, G., et al. Hippocampal microRNA-132 mediates stress-inducible cognitive deficits through its acetylcholinesterase target. Brain Structure & Function. , 10-1007 (2012).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92, 7297-7301 (1995).
- Mendenhall, A., Lesnik, J., Mukherjee, C., Antes, T., Sengupta, R. Packaging HIV- or FIV-based lentivector expression constructs & transduction of VSV-G pseudotyped viral particles. J. Vis. Exp. (62), e3171 (2012).
- Nunez, J. Morris Water Maze Experiment. J. Vis. Exp. (19), e897 (2008).
- Bromley-Brits, K., Deng, Y., Song, W. Morris water maze test for learning and memory deficits in Alzheimer's disease model mice. J. Vis. Exp. (53), e2920 (2011).
- Regev, L., Ezrielev, E., Gershon, E., Gil, S., Chen, A. Genetic approach for intracerebroventricular delivery. Proceedings of the National Academy of Sciences of the United States of America. 107, 4424-4429 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon