Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Injection stéréotaxique de micro-ARN exprimant lentivirus à la souris hippocampe CA1 Région et l'évaluation du résultat comportemental
Dans cet article
Résumé
Les microARN ont des rôles importants dans la structure et la fonction du cerveau. Nous décrivons ici une méthode pour appliquer miRNA hippocampe surexpression par injection stéréotaxique d'un lentivirus miRNA exprimant ingénierie. Cette approche peut servir comme un moyen relativement rapide pour évaluer l' In vivo Effets des miARN surexprimés dans des régions spécifiques du cerveau.
Résumé
Les microARN (miARN) sont de petites molécules d'ARN simple brin de réglementation à travers 22 nucléotides de long qui peut chaque cible de nombreux transcrits d'ARNm et dim un gène entier voie d'expression par la destruction d'induction et / ou inhibition de la traduction de ces objectifs. Plusieurs miARN jouent un rôle clé dans le maintien de la structure et la fonction neuronale et dans les fonctions cérébrales de haut niveau, et les méthodes sont recherchés pour manipuler leurs niveaux pour explorer ces fonctions. Ici, nous présentons une méthode in vivo directe pour examiner les conséquences cognitives de miARN forcées en excès chez les souris par injection stéréotaxique de particules virales miRNA-encodage. Plus précisément, le protocole actuel consiste à injecter dans la région CA1 hippocampique, qui contribue à la consolidation des mammifères de la mémoire, l'apprentissage, et les réactions au stress, et offre un site d'injection pratique. Les coordonnées sont mesurées selon le bregma de la souris et de la perfusion du virus est contrôlée et maintenue très lent numériquement.Après l'injection, la plaie de la chirurgie est scellé et les animaux récupérer. Les lentivirus codant silencieux des ARNm cibles correspondantes servent à impliquer l'interaction des miARN / cible spécifique responsable de l'effet observé, avec des souris naïves, des souris injectées avec une solution saline et des souris injectées avec des vecteurs de lentivirus «vides» comme témoins. Un mois après l'injection, les animaux sont examinés dans le labyrinthe d'eau de Morris (MWM) pour évaluer leur apprentissage de la navigation et des capacités de mémoire. Le MWM est un réservoir rond rempli d'eau colorée avec une petite plate-forme immergée 1 cm en dessous de la surface de l'eau. Des repères visuels d'équilibre autour de la cuve pour permettre la navigation spatiale (sonore et le champ magnétique de la terre peut aussi aider les animaux dans la navigation). surveillance par caméra vidéo permet de mesurer le chemin de baignade et le temps de trouver et le montant de la plate-forme. La souris est d'abord enseigné que le montage de la plate-forme cachée offre une évasion de la baignade forcée, il est ensuite testé pour l'utilisation de cette évasion et fnfin, la plateforme est enlevé et les tests de sonde examiner si la souris se souvient de son emplacement précédent. Des tests répétés sur plusieurs jours consécutifs soulignent une amélioration des performances des souris testées à des latences plus courtes pour trouver et monter la plate-forme, et les routes plus directes que pour atteindre la plate-forme ou son emplacement. Le défaut de montrer cette amélioration représente une déficience apprentissage et la mémoire et / ou de l'anxiété, qui peut ensuite être testé spécifiquement (par exemple dans le labyrinthe surélevé). Cette approche permet la validation des miARN spécifiques et les transcriptions des cibles dans le développement cognitif étudié et / ou des processus liés au stress.
Introduction
Le rôle des miARN particulier dans le fonctionnement du système nerveux a récemment été contestée par injection lentiviral dans plusieurs études. MiRNAs ont été trouvés à être crucial pour le maintien et remodeler la structure synapse 1, synaptogénèse 2 et le remodelage et la maintenance 3 synapse. Ces études suggèrent fortement que les miARN sont engagés, via des effets régulateurs multileveled à la fois dans la formation et dans le maintien de la sortie principale du système nerveux, les fonctions cognitives. Injection stéréotaxique de particules lentivirus dans des régions spécifiques du cerveau des rongeurs permet la recherche de modifications de la morphologie synapse et l'activité neuronale, et a été utilisée pour établir la signification fonctionnelle des transcriptions surexprimés 4,5. L'infection directe des neurones dans les zones du cerveau bien définis avec des miRNA exprimant lentivirus peut être impliqué dans des études sur le vieillissement, les troubles cérébraux et les maladies neurodégénératives, les études de miRNAs dans le domaine de la régulation comportementale 6-8 sont dans un état beaucoup moins avancé, et l'injection stéréotaxique de miRNA exprimant particules de lentivirus suivies par des tests de comportement peut être utile à de telles fins. Une méthode beaucoup plus laborieux pour induire sur-ou sous-expression implique génétiquement knock-in ou souris knock-out. Systèmes génétiques peuvent en outre permettre un contrôle conditionnel et temporelle de l'expression (par exemple, Cre-Lox, les systèmes Tet), mais ceux-ci difficilement offrir la spécificité spatiale de la procédure d'injection et il ya presque toujours une certaine quantité de perméabilité. En outre, les procédures techniques ne nécessitent pas d'intervention chirurgicale et peuvent être utilisés dans des laboratoires avec relativement bonne reproductibilité, mais ils sont plus lents et exigent beaucoup plus de ressources humaines et financières. En outre, le contrôle temporel de la sous-expression chez les souris injectées sur-ou est beaucoup plus précis par rapport à des souris génétiquement modifiées.
Protocole
1. Préparation lentivirus
- Cultiver des cellules HEK-293FT à 90% de confluence.
- Le jour de milieu de cellules de changement de transfection de DMEM sans sérum supplémenté avec 1 mM de glutamine et 50 mg / ml de pénicilline-streptomycine.
- Co-transfection des cellules avec un vecteur pLKO.1-Puro et avec des plasmides codant pour la delta R8.2 et VSV-G fractions et le miRNA d'intérêt, en utilisant 10 pi de 1 mg / ml polyéthylénimine comme support 9.
- Recueillir lentivirus emballés à 24 h et 48 h post-transfection, filtre à travers un filtre de 0,45 um.
- Concentrer les lentivirus utilisant ultracentrifugation à 70.000 xg, pendant 2 heures et 15 ° C, aliquote et conserver à -70 ° C.
- Mesure titre de virus en infectant des cellules HEK-293T avec les préparations de virus dilués en série (1 à 10 -6 ml de vecteur par puits). Le titre obtenu (un minimum de ~ 1 × 10 9 particules infectieuses par ml est recommandée) est évalué pour l'expression du gene d'intérêt, en utilisant la sélection à la puromycine et en quantifiant exprimant la GFP virus par comptage des cellules fluorescentes.
Pour le protocole plus détaillé de la préparation des lentivirus voir 10.
2. Préparation pour la chirurgie Animaux
- Chirurgiens costume devrait inclure casaque, gants stériles, bonnet et masque.
- Peser l'animal, puis anesthésier avec un IP-injection d'un mélange kétamine, le volume proportionnel au poids de l'animal tel que spécifié pour chaque médicament. Pour un mélange kétamine / xylazine, une gamme de doses de 80-200 mg / kg de kétamine et de 7-20 mg / kg de xylazine est habituellement utilisé pour les souris.
- Attendez jusqu'à ce que l'animal est complètement anesthésié, puis vérifier par manque de réflexe de retrait de la patte arrière de l'animal par l'extension de la jambe, puis en appuyant avec votre doigt.
- Injecter l'animal sous-cutanée avec Rimadyl, comme indiqué sur la boîte, pour le soulagement de la douleur. Intervalle de dose typique pour Rymadil est de 5-10 mg.
- Placez l'animal sur un coussin chauffant pour maintenir une température corporelle constante et humidifier les yeux avec de l'huile.
- Raser la zone entre les deux oreilles d'une machine à déborder.
- Désinfectez la peau avec de la bétadine.
3. L'exposition de la Skull and Forage
- Placez l'animal à l'intérieur du stereotact en réglant les tiges dans les crevasses juste en avant de l'oreille de l'animal.
- Utiliser un scalpel pour faire une incision antéro-postérieur d'environ 1,5 cm entre les oreilles et le garder ouvert avec des pinces de chirurgie (serfines).
- Nettoyer la surface du crâne avec un coton-tige jusqu'à l'intersection entre la suture coronale et sagittale sutures, c'est à dire le bregma et l'intersection entre les sutures coronale et lambdoid, c'est-lambda, sont visibles.
- Pointer le bout de la seringue, détenu par l'stereotact, au point bregma, à chacun des trois axes. Notez les coordonnées. Ce point sera considéré comme le zéro point dans les trois axes.
- Soulevez la seringue dans l'axe vertical de sorte qu'un mouvement plan ne serait pas gratter le crâne et déplacer la tête de la seringue à l'emplacement correct. Injections de CA1 hippocampiques exigent coordonne la suivante par rapport au bregma en mm: -2 sur l'axe antérieur / postérieur, ± 1,8 à l'axe latéral / médial et -1,5 à l'axe dorsal / ventral.
- Abaissez le bout de la seringue jusqu'à ce qu'il touche le crâne et marquer l'endroit avec un marqueur. Retirez la seringue en arrière pour éviter coups de couteau.
- Percez un trou peu profond, que dans l'os du crâne à l'aide d'une amende foreur. Maintenez le foreur stable de sorte qu'il ne continuerait pas à percer le dessous des tissus mous. Vous pouvez éviter cela en stabilisant une main avec l'autre et en forant à impulsions courtes.
4. L'injection de la Lentivirus
- Prélever 0,5 ml de la solution concentrée de lentivirus.
- Placez la seringue au-dessus du trou et abaissez lentement à la verticale jusqu'à ce qu'il REAches de la surface du crâne. Continuer à abaisser la seringue dans le cerveau très lentement. À cette étape du saignement peut se produire qui ne signifie pas nécessairement une pénétration échoué. En cas de saignement éponger avec un coton-tige.
- Régler la pompe numérique à 0,02 ml / min (0,5 pi serait injecté dans 25 min) et démarrer la perfusion. Perfusion lente permet une diffusion efficace du virus dans les tissus et empêche le reflux. Dans certains types de seringues envisager d'insérer la seringue pour une profondeur supplémentaire de 0,5 mm avant de se replier aux coordonnées originales et de la perfusion.
- Après la perfusion est terminée attendre 5 min supplémentaire pour permettre à la matière de se propager dans le cerveau au lieu de se retirer en arrière dans le canal formé par la seringue.
- Retirez la seringue très lentement et surveillez les flux de retour. Si un flux de retour est observé à cette étape, une fraction de la matière injectée était probablement perdue.
5. étanchéité de la plaie et de récupération
- Seal èmee enroulé avec histoacryl. Soyez sûr d'éviter la fuite de la histoacryl dans les yeux.
- Injecter par voie intrapéritonéale des animaux (IP) avec 1 ml de sérum physiologique préchauffé, pour éviter la déshydratation.
- Placer l'animal dans une cage de récupération qui est positionnée sur un tapis chauffant. Regardez l'animal pendant qu'il récupère pendant une heure supplémentaire.
En cas de perte de poids, manque d'appétit, faiblesse / incapacité d'obtenir des aliments ou de l'eau, état moribond ou d'une infection, l'euthanasie de l'animal doit être effectuée. Méthodes acceptables pour l'euthanasie des rongeurs sont les barbituriques, anesthésiques inhalés, CO 2, CO, ou chlorure de potassium en association avec une anesthésie générale.
Après 4 à 6 semaines, d'évaluer la mémoire de navigation de l'animal est évaluée dans le labyrinthe d'eau de Morris. Le lentivirus habituellement infecter la plupart des cellules à l'intérieur de la sphère d'injection.
6. L'évaluation comportementale dans la piscine de Morris
- Former les animaux dans le Morris Water Maze. Pour la formation exacte et le protocole d'essais, voir 11. Après chaque essai, sécher l'animal avec une serviette sèche, remplacez-le dans sa cage et rafraîchir l'eau dans le réservoir.
- Testez les animaux dans le labyrinthe d'eau de Morris pendant 3 jours consécutifs, 4 essais chaque jour. Chaque jour, insérer l'animal dans le labyrinthe dans chacune des 4 directions du labyrinthe (nord, sud, est et ouest) dans un ordre changeant, par exemple le premier jour: est-ouest-nord-sud, deux jours: ouest-sud -nord-est. Essuyez les animaux après chaque essai.
- Pendant l'essai, les essais de suivre l'animal avec un système de suivi telle que le système de suivi Noldus.
- Après l'essai de 12 e de test, insérez l'animal dans le réservoir d'eau sans la plate-forme pendant une minute. Ce serait utilisé pour analyser la stratégie de recherche de l'animal prend.
- Analyser les données comme suggéré dans 12.
Résultats
L'injection de 0,5 lentivirus pi dans la région CA1 de l'hippocampe de souris, avec le débit indiqué dans la section de protocole génère une sphère infecté d'environ 1 mm dans l'axe rostrale-caudale, et environ 0,5 mm de la médiane-latérale et la partie antérieure -postérieur axes (Figure 3).
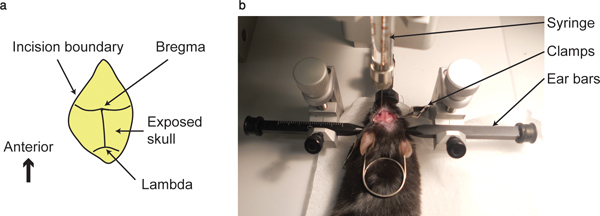
Figure 1. Point Bregma et un appareil d&...
Discussion
Injection stéréotaxique d'un lentivirus est une méthode relativement rapide pour l'évaluation in vivo à la fois pour la régulation des gènes différents et miARN haut ou. La principale alternative est une souris génétiquement modifiée qui est une technique consommant beaucoup plus laborieux et puis injection de lentivirus direct. En outre, la réglementation en place, en injection de lentivirus, survient à un moment spécifique chez la souris adulte et ne comprend pas toute possibilité de d?...
Déclarations de divulgation
Les auteurs déclarent qu'ils n'ont aucun intérêt financier concurrents.
Remerciements
Cette étude a été soutenue par le Centre Edmond Safra et Lily pour Brain Sciences (SB bourse), The Heritage biomédicale Programme de partenariat des sciences héritage de la Fondation Israël Sciences (Grant No. 378/11, le SH) et la Fondation allemande pour la recherche scientifique israélienne Recherche et Développement (GIF) (Grant No. 1093-32.2/2010, le SH).
matériels
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Rodent weigh scale | Burtons (UK) | 115-455 | |
| heating pad | FIRstTechnology | DCT-25 | |
| trimming machine | Stoelting | 51465 | |
| stereotact | Stoelting | 51730 | |
| Scalpel and blades | Kent scientific | INS500348 | |
| Harland syringe | Hamilton | 7632-01 | |
| driller | Stoelting | 51449 | |
| digital pump | Harvard apparatus | 704507 | |
| Water tank and platform | Stoelting | 60135 |
| Reagents | |||
| ketamine | Vetoquinol(Lure France) | 3055503 | |
| domitor | Orion pharma | 107140-10 | |
| Rimadyl | Pfizer animal health | 24751 | |
| moisture ointment - Synthomycine 5% | Rekah Pharmaceutical | 195 | |
| histoacryl | Braun | 112101 | |
| saline | Sigma Aldrich | D8662 |
Références
- Siegel, G., et al. A functional screen implicates microRNA-138-dependent regulation of the depalmitoylation enzyme APT1 in dendritic spine morphogenesis. Nature Cell Biology. 11, 705-716 (2009).
- Jin, P., et al. Biochemical and genetic interaction between the fragile X mental retardation protein and the microRNA pathway. Nature Neuroscience. 7, 113-117 (2004).
- Simon, D. J. The microRNA miR-1 regulates a MEF-2-dependent retrograde signal at neuromuscular junctions. Cell. 133, 903-915 (2008).
- Consiglio, A. In vivo gene therapy of metachromatic leukodystrophy by lentiviral vectors: correction of neuropathology and protection against learning impairments in affected mice. Nature Medicine. 7, 310-316 (2001).
- Jakobsson, J., Lundberg, C. Lentiviral vectors for use in the central nervous system. Molecular Therapy: The Journal of the American Society of Gene Therapy. 13, 484-493 (2006).
- Berson, A. Cholinergic-associated loss of hnRNP-A/B in Alzheimer's disease impairs cortical splicing and cognitive function in mice. EMBO Molecular Medicine. , (2012).
- Haramati, S. MicroRNA as repressors of stress-induced anxiety: the case of amygdalar miR-34. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 31, 14191-14203 (2011).
- Shaltiel, G., et al. Hippocampal microRNA-132 mediates stress-inducible cognitive deficits through its acetylcholinesterase target. Brain Structure & Function. , 10-1007 (2012).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92, 7297-7301 (1995).
- Mendenhall, A., Lesnik, J., Mukherjee, C., Antes, T., Sengupta, R. Packaging HIV- or FIV-based lentivector expression constructs & transduction of VSV-G pseudotyped viral particles. J. Vis. Exp. (62), e3171 (2012).
- Nunez, J. Morris Water Maze Experiment. J. Vis. Exp. (19), e897 (2008).
- Bromley-Brits, K., Deng, Y., Song, W. Morris water maze test for learning and memory deficits in Alzheimer's disease model mice. J. Vis. Exp. (53), e2920 (2011).
- Regev, L., Ezrielev, E., Gershon, E., Gil, S., Chen, A. Genetic approach for intracerebroventricular delivery. Proceedings of the National Academy of Sciences of the United States of America. 107, 4424-4429 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon