Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Inyección estereotáxica de un vector viral para la manipulación genética condicional en la médula espinal de ratón
En este artículo
Resumen
Los vectores virales permiten la manipulación dirigida de genes. Se demuestra un método para la expresión génica condicional o ablación en la médula espinal de ratón, usando inyección estereotáxica de un vector viral en el asta dorsal, un sitio prominente de contacto sináptico entre las vías aferentes somatosensoriales y las neuronas del sistema nervioso central.
Resumen
Inyección intraparenquimatosa de un vector viral permite la manipulación génica condicional en distintas poblaciones de neuronas o regiones particulares del sistema nervioso central. Se demuestra una técnica de inyección estereotáxica que permite la expresión del gen objetivo o el silenciamiento en el cuerno dorsal de la médula espinal de ratón. El procedimiento quirúrgico es breve. Se requiere laminectomía de una sola vértebra, proporcionando para la recuperación rápida del animal y de la motilidad irreprochable de la columna vertebral. Inyección controlada de un volumen pequeño vector suspensión a baja velocidad y el uso de una microjeringa con cánula de cristal biselado minimizar la lesión del tejido. La respuesta inmune local al vector depende de las propiedades intrínsecas del virus empleados, en nuestra experiencia, es menor y de corta duración cuando un recombinante de virus adeno-asociado se utiliza. Un gen informador tal como la proteína verde fluorescente mejorada facilita la distribución de seguimiento espacial del vector, y la eficacia y la especificidad celularficidad de la transfección.
Introducción
Las tecnologías avanzadas de manipulación de genes en el ratón condicional permitir que los enfoques multifacéticos para la exploración de las vías sinápticas y las conexiones funcionales en el sistema nervioso central. Los transgenes pueden ser reguladas por efectores de moléculas pequeñas tales como doxiciclina que actúan sobre un transactivador controlado por tetraciclina, que puede ser diseñado para funcionar como un represor o un activador de la transcripción de genes, o tamoxifeno reconociendo un ligando mutado dominio de unión del receptor de estrógeno 1 . Modificación irreversible transgén se consigue comúnmente por el ácido desoxirribonucleico (ADN) recombinasas. Cre (recombinación causas) y FLP (enzima flipasa recombinación) catalizan la escisión, la inversión o translocación de fragmentos de ADN que están flanqueadas por loxP (locus de cruce sobre x, P1) o frontales (objetivo flipasa reconocimiento) los sitios, respectivamente 1. Las aplicaciones incluyen la activación de genes o el silenciamiento y inducible por ácido ribonucleico (ARN) interferencia 2. Expresión condicional de reporteros fluorescentes o enzimáticos, tales como β-galactosidasa o fosfatasa alcalina se puede utilizar para etiquetar las neuronas y examinar su organización tópica y conectividad 3. Proyectos a gran escala de mutagénesis en América del Norte ( http://www.norcomm.org/index.htm ) y Europa ( http://www.knockoutmouse.org/about/eucomm ) están produciendo bibliotecas de clones de embriones de ratón con células madre objetivos condicionales de genes y trampas que eventualmente se cubren todo el genoma del ratón. Los ratones generados a partir de estos clones se pueden cruzar con un número creciente de líneas de ratón que expresan recombinasas de ADN bajo promotores o loci específicos para una población particular de neuronas para la manipulación selectiva de genes ( http://nagy.mshri.on.ca/cre_new/index . php ).
Sin embargo, la restricción de manipulación génica para diferentes poblaciones de neuronas o regiones particulares de interés no puede lograrse mediante modificación genética dirigida solo si un promotor específico para la población de neuronas de interés no se conoce o no se expresan por todas las neuronas en la región de interés. En la médula espinal, los diseños experimentales pueden requerir restricción espacial de la manipulación genética de uno o dos segmentos craneocaudal. Inyección estereotáxica de un vector viral que expresa Cre o Flp permite limitar la recombinación de genes para las regiones en la médula espinal de ratones en los que los fragmentos de ADN están flanqueados por sitios FRT o loxP, los llamados alelos floxed o flrted. A diferencia de la reordenación del ADN constitutiva, que sería el resultado de cruzamiento de los animales con ratones que expresan recombinasa, esta estrategia también proporciona un control temporal sobre la activación de genes o el silenciamiento. Los vectores virales que codifican floxed o coqueteó transgenes ofrecen una opción inversa de la manipulación genética en ratones que expresan el corresponding aguas abajo de un promotor de recombinasa específica de neuronas. Varios vectores recombinantes con afinidad a las neuronas están disponibles 4. De alta capacidad (gutless) adenovirus, virus adeno-asociados, virus del herpes simple y lentivirus son comúnmente utilizados vectores neurotrópicos. Selección del virus apropiado para una pregunta de investigación es una parte crucial del diseño experimental. Tamaño del transgén, vía de administración, la especificidad de la infección a las neuronas frente a las células gliales, infección de eficacia, los efectos secundarios inflamatorios y tóxicos necesitan ser considerados 4.
Aquí se describe la inyección estereotáxica de un vector viral en el asta dorsal de la médula espinal, una técnica que se emplea para la regulación génica condicional en nuestra investigación sobre la neurobiología del dolor. El cuerno dorsal recibe impulsos aferentes primarios de neuronas somatosensoriales incluyendo las neuronas nociceptivas. Interneuronas locales procesar la información antes de transmitirla neuronas de proyección deel cuerno dorsal al cerebro 5. Se demuestra que la infección de las neuronas del asta dorsal a nivel espinal segmentaria L4 con un neurotrópico recombinante adeno-associated virus (rAAV) que expresa aumento de proteína verde fluorescente (EGFP) bajo un promotor de citomegalovirus constitutivamente activo.
Protocolo
El procedimiento quirúrgico descrito ha sido aprobado por el Cuidado de Animales institucional y el empleo Comisión (IACUC) de la Universidad de Columbia.
1. Preparación de equipos y suspensión de partículas de virus
- Limpiar y desinfectar el equipo, esterilizar los instrumentos quirúrgicos y los picos de primera categoría V que se utilizan para fijar L1 vértebra.
- Tire y pipetas de cristal biselado. Nosotros usamos pipetas que tienen un diámetro de punta de 40 micras y están biselados en un ángulo de 20 °. Esterilice las pipetas de vidrio.
- Establecer el marco estereotáxico, montar el inyector microjeringa sobre el manipulador y conectar el inyector al controlador.
- Conecte una de las pipetas de vidrio a la microjeringa utilizando el kit de conexión de compresión.
- Retire el émbolo de la microjeringa y llene la jeringa con aceite mineral. Oil Red O (1 - (2,5-dimetil-4-(2,5-dimethylphenylazo) fenilazo)-2-naftol) se puede añadir al aceite mineral para aumentar su visibility. Vuelva a insertar el émbolo y empujar a todo el camino hasta la punta. Con cuidado, evitar la creación de una burbuja de aire.
- Preparar la suspensión de partículas de virus en una cabina de bioseguridad. Descongelar el virus congelado en hielo y, justo antes de su uso, diluir con agua estéril salina tamponada con fosfato a la concentración de partículas deseado.
- Inserte la microjeringa en el soporte del inyector.
- Verter de 5 l de la suspensión de virus en una hoja de plástico, por ejemplo Parafilm. Baje la punta de la pipeta de vidrio en la gota y tire del émbolo para llenar la microjeringa. Crear una pequeña burbuja de aire en la punta de la pipeta para evitar que se obstruya.
2. Laminectomía
- Prepare el área de la cirugía, limpiando banco y almohada eléctrica con desinfectante.
- Se anestesia el ratón. Usamos anestesia por inhalación con isoflurano (3% durante inducción, 2% -3% durante el mantenimiento).
- Coloque lubricante en cada ojo para proteger los ojos se sequen durante laoperación.
- Afeitar el pelo de la espalda baja para el cuello del ratón y desinfectar la piel con alternancia de toallitas de un antiséptico tópico como la clorhexidina o povidona yodada y 70% de etanol. Aislar el sitio preparado asépticamente con paño quirúrgico y se infiltran en el sitio de la incisión con bupivacaína (0,25%, diluido 1:10 con solución salina fisiológica).
- Incisión en la piel en el extremo caudal de la caja torácica a lo largo de la línea media (2-3 cm) y separar la fascia que cubre la columna vertebral.
- Debido a que la médula espinal deja de crecer antes durante el desarrollo postnatal de la columna vertebral, segmento vertebral L4 se encuentra debajo de la primera vértebra lumbar (L1). Vértebra L1 se encuentra caudal a la vértebra que sostiene el último par de costillas. Identificar y exponer vértebra L1 mediante la eliminación de los pequeños músculos de la columna vertebral y los ligamentos adheridos a la superficie dorsal.
- Levante ligeramente y mantén presionado L1 vértebra con una pinza Adson. Use unas pinzas laminectomía dedicados a eliminar el dorsal Portion de la vértebra (columna vertebral y de la lámina) y exponer la médula espinal. Evitar daños en la médula espinal.
- Transferir el ratón sobre la placa de calentamiento en el marco estereotáxico. Controlar la temperatura del ratón durante la operación posterior.
3. Inyección
- Fijar vértebra L1 con puntas de primera clase V. Las espigas deben estabilizar la columna vertebral de modo que la vértebra no se mueve durante la respiración.
- Llevar la microjeringa más cerca de modo que la punta de la pipeta está por encima del sitio de laminectomía. Baje el émbolo hasta que vea la suspensión de virus que sale de la pipeta. Retire la gota con una punta de algodón estéril.
- Coloque la punta de la pipeta en la parte rostral más de la médula espinal expuesta. Centro de la pipeta por encima del surco mediano posterior, a continuación, mover la punta 500 m lateralmente. Baje la punta a la superficie de la médula y punción de la duramadre o, si usted está trabajando con una pipeta de vidrio unbeveled, use una cánula de acero biselado para perforar el dura. Baje la punta de la pipeta de vidrio 300 micras en la médula espinal.
- Inyectar 1 l de suspensión de virus a una tasa de 200 NL / min.
- Al final de la inyección, espere al menos 2 min antes de retraer lentamente la pipeta.
- Repetir los pasos desde 3,3 hasta 3,5 en la porción caudal más-de la médula espinal expuesta para conseguir una distribución completa del vector viral en L4 segmento espinal. Los dos sitios de inyección se encuentran rostral y caudal del segmento L4 para evitar el daño tisular en la región diana.
4. Cierre de la herida
- Release vértebra L1 de las abrazaderas de primera clase V y quitar el ratón del marco estereotáxico.
- Sutura de la fascia con vicryl 5.0. La fascia cerrado proporciona cobertura para el sitio de laminectomía.
- Cierre la piel con suturas de nylon o grapas quirúrgicas.
5. Cuidado Postoperatorio
- Transferir el ratón en una jaula de recuperación con ropa de cama blanda, nonparticular. Colócalo en tél laterales para respirar cómodo. Supervisar el animal hasta que esté completamente alerta, ambulante y empieza a beber.
- Nos proporcionar analgesia posquirúrgica durante 72 h con inyecciones subcutáneas diarias de carprofeno (5,0 mg / kg).
- Monitorear la recuperación postquirúrgica mediante la inspección diaria durante los primeros 3 días, luego cada dos días o 3 días a la semana hasta que el experimento está completo.
- Eliminar las suturas de la piel o las grapas 7 a 10 días después de la operación, cuando la curación de heridas es completa.
- Sacrificar al animal después de la finalización del experimento.
Resultados
El éxito de los rendimientos de transfección de expresión génica robusto en las neuronas del asta dorsal de inyección (Figura 1), evitando que el cuerno dorsal del lado contralateral, el cuerno ventral y los ganglios de la raíz dorsal.
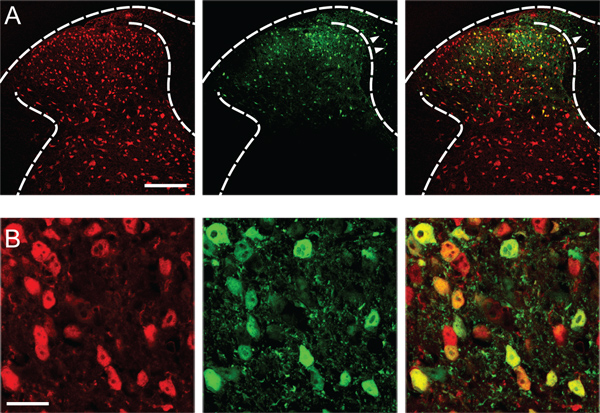
Figura 1. Transfección de neuronas del asta dorsal. (A) Expresión de la EGFP reportero fluorescente (verde) en el cuerno izquierdo dorsal de la m?...
Discusión
La inyección del vector estereotáxica permite dirigir las neuronas de médula espinal para aplicaciones tales como mapeo de la red neuronal basada en virus transsynaptic propagación 6,7 o disección optogenético 8, guiado de los axones durante la regeneración de lesiones 9,10, o la terapia génica para la prevención o el tratamiento de la neurodegeneración 11, 12. Los vectores virales han sido utilizados para la manipulación de genes en la médula espinal para estudiar...
Divulgaciones
Los autores declaran que no tienen intereses en conflicto financieros.
Agradecimientos
Damos las gracias a A. Bakhos Tannous, Ph.D., Director de Desarrollo y Producción del vector en el Centro de Neurociencia del Hospital General de Massachusetts en Charlestown, Massachusetts, para que nos proporciona el vector rAAV-EGFP, Whang y Juan de asistencia técnica. Este trabajo recibió el apoyo de subvención R01 NS050408 (a JS) del Instituto Nacional de Trastornos Neurológicos y Accidentes Cerebrovasculares.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del Material | Empresa | Número de catálogo | |
| Placa base Espinal | David Kopf Instruments | 912 | |
| Pequeños animales instrumento estereotáxico | David Kopf Instruments | 900 | |
| Gas Ratón anestesia cabeza titular | David Kopf Instruments | 923-B | |
| Soportes ajustables de base | David Kopf Instruments | 982 | |
| V muesca picos | David Kopf Instruments | 987 | |
| Temperatura pequeño sistema de control de animales | David Kopf Instruments | TCAT-2LV | |
| Adson fórceps | Herramientas Artes Ciencias | 11006-12 | |
| Fórceps laminectomía | Herramientas Artes Ciencias | 11223-20 | |
| UltraMicroPump (uno) con SYS-Micro4 Controller | World Precision Instruments | UMP3-1 | |
| Microjeringa 65RN | Hamilton | 7633-01 | |
| RN accesorio de compresión, 1 mm | Hamilton | 55750-01 | |
| Vidrio borosilicato capilares | World Precision Instruments | 1B100F-4 | |
| Microgrinder | Narishige | EG-44 |
Referencias
- Lewandoski, M. Conditional control of gene expression in the mouse. Nature Reviews Genetics. 2, 743-755 (2001).
- Couto, L. B., High, K. A. Viral vector-mediated RNA interference. Curr. Opin. Pharmacol. 10, 534-542 (2010).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57, 634-660 (2008).
- Davidson, B. L., Breakefield, X. O. Viral vectors for gene delivery to the nervous system. Nature Reviews Neuroscience. 4, 353-364 (2003).
- Todd, A. J. Neuronal circuitry for pain processing in the dorsal horn. Nature Reviews Neuroscience. 11, 823-836 (2010).
- Wall, N. R., Wickersham, I. R., Cetin, A., De La Parra, M., Callaway, E. M. Monosynaptic circuit tracing in vivo through Cre-dependent targeting and complementation of modified rabies virus. Proceedings of the National Academy of Sciences of the United States of America. 107, 21848-21853 (2010).
- Lo, L., Anderson, D. J. A Cre-dependent, anterograde transsynaptic viral tracer for mapping output pathways of genetically marked neurons. Neuron. 72, 938-950 (2011).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nature Methods. 8, 745-752 (2011).
- Tang, X. Q., Heron, P., Mashburn, C., Smith, G. M. Targeting sensory axon regeneration in adult spinal cord. J. Neurosci. 27, 6068-6078 (2007).
- Cameron, A. A., Smith, G. M., Randall, D. C., Brown, D. R., Rabchevsky, A. G. Genetic manipulation of intraspinal plasticity after spinal cord injury alters the severity of autonomic dysreflexia. J. Neurosci. 26, 2923-2932 (2006).
- Passini, M. A., et al. CNS-targeted gene therapy improves survival and motor function in a mouse model of spinal muscular atrophy. The Journal of Clinical Investigation. 120, 1253-1264 (2010).
- Lutz, C. M., et al. Postsymptomatic restoration of SMN rescues the disease phenotype in a mouse model of severe spinal muscular atrophy. The Journal of Clinical Investigation. 121, 3029-3041 (2011).
- Chen, S. L., et al. dsAAV type 2-mediated gene transfer of MORS196A-EGFP into spinal cord as a pain management paradigm. Proc. Natl. Acad. Sci. U.S.A. 104, 20096-20101 (2007).
- South, S. M., et al. A conditional deletion of the NR1 subunit of the NMDA receptor in adult spinal cord dorsal horn reduces NMDA currents and injury-induced pain. J. Neurosci. 23, 5031-5040 (2003).
- Tappe, A., et al. Synaptic scaffolding protein Homer1a protects against chronic inflammatory pain. Nat. Med. 12, 677-681 (2006).
- Colle, M. A., et al. Efficient intracerebral delivery of AAV5 vector encoding human ARSA in non-human primate. Human Molecular Genetics. 19, 147-158 (2010).
- Carbajal, K. S., Weinger, J. G., Whitman, L. M., Schaumburg, C. S., Lane, T. E. Surgical Transplantation of Mouse Neural Stem Cells into the Spinal Cords of Mice Infected with Neurotropic Mouse Hepatitis Virus. J. Vis. Exp. (53), e2834 (2011).
- Snyder, B. R., et al. Comparison of adeno-associated viral vector serotypes for spinal cord and motor neuron gene delivery. Hum. Gene Ther. 22, 1129-1135 (2011).
- Towne, C., Pertin, M., Beggah, A. T., Aebischer, P., Decosterd, I. Recombinant adeno-associated virus serotype 6 (rAAV2/6)-mediated gene transfer to nociceptive neurons through different routes of delivery. Mol. Pain. 5, 52 (2009).
- Kaplitt, M. G., et al. Long-term gene expression and phenotypic correction using adeno-associated virus vectors in the mammalian. 8, 148-154 (1994).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados