Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Stereotaktische Injektion eines viralen Vektors für Conditional Gene Manipulation im Maus-Rückenmark
In diesem Artikel
Zusammenfassung
Virale Vektoren können für gezielte Genmanipulation. Wir demonstrieren, ein Verfahren zur bedingten Genexpression oder Ablation im Rückenmark der Maus, stereotaktische Injektion unter Verwendung eines viralen Vektors in der dorsalen Horn, ein bekannter Ort der synaptischen Kontakt zwischen primären somatosensorischen Afferenzen und Neuronen des zentralen Nervensystems.
Zusammenfassung
Intraparenchymalen Injektion eines viralen Vektors ermöglicht bedingten Genmanipulation in unterschiedliche Populationen von Neuronen oder bestimmte Bereiche des zentralen Nervensystems. Wir demonstrieren eine stereotaktische Injektion Technik, gezielt Genexpression oder Silencing im dorsalen Horn des Rückenmarks Maus ermöglicht. Der chirurgische Eingriff ist kurz. Es erfordert Laminektomie eines einzelnen Wirbel, bietet für eine schnelle Wiederherstellung des Tieres und ungestörte Beweglichkeit der Wirbelsäule. Kontrollierte Injektion eines kleinen Vektor Suspensionsvolumen bei niedriger Drehzahl und die Verwendung eines Mikrospritze mit abgeschrägten Glaskanüle minimieren Gewebeläsion. Die lokale Immunantwort auf den Vektor, hängt von den spezifischen Eigenschaften des Virus eingesetzt; in unserer Erfahrung ist es kleinen und kurzlebigen wenn ein rekombinantes Adeno-assoziierten Virus verwendet wird. Ein Reportergen wie verstärkt grün fluoreszierende Protein erleichtert die Beobachtung räumliche Verteilung des Vektors oder der Wirksamkeit und zellulären Spezificity der Transfektion.
Einleitung
Fortgeschrittenen Technologien bedingter Genmanipulation in der Maus zu ermöglichen vielfältige Ansätze zur Exploration von synaptischen Bahnen und funktionelle Verbindungen im zentralen Nervensystem. Transgene können durch niedermolekulare Effektoren wie Doxycyclin Einwirken auf ein Tetracyclin-gesteuerten Transaktivator, die für den Einsatz als Repressor oder Aktivator der Gentranskription, oder Tamoxifen Erkennen eines mutierten Ligandenbindungsdomäne des Östrogenrezeptors 1 funktionieren kann geregelt werden . Irreversible Modifikation Transgen wird üblicherweise von Desoxyribonukleinsäure (DNA) Rekombinasen erreicht. Cre (Ursachen Rekombination) und Flp (Flippase Rekombinationsenzyms) katalysieren die Exzision, Inversion oder Translokation von DNA-Fragmenten, die von loxP (locus der Kreuzung x über, P1) oder Frt (Flippase Anerkennung target) Seiten bzw. 1 flankiert werden. Zu den Anwendungen gehören Gen-Aktivierung oder Inaktivierung und induzierbare Ribonukleinsäure (RNA) Störungen 2. Bedingungsausdruck von fluoreszierenden oder enzymatischen Reporter wie β-Galactosidase oder alkalischer Phosphatase verwendet werden, um Neuronen beschriften und prüft ihre topische Organisation und Konnektivität 3 werden. Large-scale Mutagenese-Projekte in Nordamerika ( http://www.norcomm.org/index.htm ) und Europa ( http://www.knockoutmouse.org/about/eucomm ) produzieren Bibliotheken embryonalen Stammzellen der Maus Zellklone mit bedingten Gen-Targets und Fallen, die letztlich auf das gesamte Maus-Genom. Mäuse aus diesen Klonen erzeugt werden, können mit einer wachsenden Zahl von Maus Linien gekreuzt werden, daß DNA-Rekombinasen exprimieren unter Promotoren oder Loci für eine bestimmte Population von Neuronen zur selektiven Genmanipulation ( http://nagy.mshri.on.ca/cre_new/index . php ).
Allerdings kann die Beschränkung auf Genmanipulation unterschiedliche Populationen von Neuronen oder bestimmten Regionen von Interesse nicht durch genetische Targeting allein, wenn ein Promotor spezifisch für die Neuronenpopulation von Interesse nicht bekannt ist und nicht von allen Neuronen in der Region exprimiert erreicht werden von Interesse. Im Rückenmark können experimentellen Designs erfordern räumlichen Beschränkung der Genmanipulation ein oder zwei kraniokaudalen Segmente. Stereotaktische Injektion eines viralen Vektors, Cre oder Flp drückt ermöglicht Begrenzen Genrekombination in Regionen im Rückenmark von Mäusen, in denen DNA-Fragmente von loxP-oder FRT-Stellen flankiert sind, so genannte floxed oder flrted Allelen. Anders als konstitutive DNA-Umlagerung, die würde aus Kreuzungen der Tiere mit Rekombinase exprimierenden Mäusen führen, diese Strategie auch zeitliche Kontrolle über Gen-Aktivierung oder Inaktivierung. Virale Vektoren kodieren gefloxten oder geflirtet Transgene bieten eine umgekehrte Möglichkeit Genmanipulation in Mäusen, die corresponding Rekombinase stromabwärts eines Neuron-spezifischen Promotors. Mehrere rekombinante Vektoren mit Affinität zu Neuronen sind 4. Hochleistungs-(gutless) Adenovirus, Adeno-assoziiertes Virus, Herpes simplex-Virus und Lentivirus-Vektoren werden üblicherweise neurotropen verwendet. Die Auswahl des geeigneten Virus für eine Fragestellung ist ein wichtiger Teil des experimentellen Designs. Größe des Transgens, Lieferroute, Spezifität der Infektion mit Neuronen, um Gliazellen, Infektion Wirksamkeit, entzündlichen und toxische Nebenwirkungen müssen berücksichtigt werden 4 entgegengesetzt.
Hier beschreiben wir die stereotaktische Injektion eines viralen Vektors in der dorsalen Horn des Rückenmarks, eine Technik, die wir verwenden zur bedingten Genregulation in unserer Forschung über die Neurobiologie von Schmerz. Das Hinterhorn erhält afferenten Input von primären somatosensorischen Neuronen einschließlich nozizeptiven Neuronen. Lokale Interneurone verarbeiten die Informationen vor der Projektion Neuronen vermitteln sie ausdas Hinterhorn des Gehirns 5. Wir demonstrieren die Infektion von Dorsalhorn spinalen Neuronen an Segmentebene L4 mit einem neurotropen rekombinanten Adeno-assoziierten Virus (rAAV), das verstärkt grün fluoreszierende Protein (EGFP) drückt unter einem konstitutiv aktiven CMV-Promotors.
Protokoll
Das chirurgische Verfahren beschrieben wurde vom Institutional Animal Care und Use Committee (IACUC) der Columbia University genehmigt worden.
Ein. Vorbereitung der Ausrüstung und Virus-Suspension
- Reinigen und desinfizieren Sie das Gerät, sterilisieren die chirurgischen Instrumente und die V-Kerbe Spikes, die verwendet werden, um Wirbel L1 beheben werden.
- Ziehen und Kegel Glaspipetten. Wir verwenden Pipetten, die einen Durchmesser der Spitze von 40 um aufweisen und in einem Winkel von 20 ° abgeschrägt. Sterilisieren Sie die Glas-Pipetten.
- Richten Sie den stereotaktischen Rahmen, montieren Sie die Mikrospritze Injektor auf dem Manipulator und verbinden Sie den Injektor mit dem Controller.
- Bringen Sie einen der Glaspipetten der Mikrospritze mit der Klemmverschraubung Kit.
- Entfernen Sie den Kolben aus der Mikroliterspritze und füllen Sie die Spritze mit Mineralöl. Oil Red O (1 - (2,5-Dimethyl-4-(2,5-dimethylphenylazo) phenylazo)-2-naphthol), zu dem Mineralöl zugegeben werden, um seine v erhöhenisibility. Setzen Sie den Kolben und schieben Sie es den ganzen Weg bis zur Spitze. Sorgfältig vermeiden damit eine Luftblase erzeugt.
- Bereiten Sie die Viruspartikel Suspension in einer biologischen Sicherheitswerkbank. Auftauen des gefrorenen Virus auf Eis und kurz vor Gebrauch verdünnte mit steriler phosphatgepufferter Kochsalzlösung auf die gewünschte Teilchengröße Konzentration.
- Legen Sie die Mikrospritze in die Halterung an der Einspritzdüse.
- Pipette 5 ul der Virus-Suspension auf eine kleine Kunststoff-Folie, zB Parafilm. Senken Sie das Glas Pipettenspitze in dem Tropfen und ziehen Sie den Kolben, um die Mikrospritze füllen. Erstellen Sie eine kleine Luftblase an der Pipettenspitze, um ein Verstopfen zu verhindern.
2. Laminektomie
- Bereiten Sie den OP-Bereich durch Abwischen Bank und Heizkissen mit Desinfektionsmittel.
- Anesthetize der Maus. Wir verwenden Inhalationsnarkose mit Isofluran (3% während der Induktion, 2% -3% bei Wartungsarbeiten).
- Zeigen Schmiermittel auf jedes Auge, um die Augen vor dem Austrocknen während der Schutz derBetrieb.
- Rasur das Fell von den unteren Rücken, um den Hals des Maus und desinfizieren die Haut mit wechselnden Tücher einer Antiseptikum wie Chlorhexidin oder PVP-Jod und 70% Ethanol. Isolierung des aseptisch vorbereitete Stelle mit Operationstuch und infiltrieren die Einschnittstelle mit Bupivacain (0,25%, 1:10 mit physiologischer Kochsalzlösung).
- Einzuschneiden die Schale am caudalen Ende des Brustkorbs entlang der Mittellinie (2-3 cm) und trennen die Faszie Abdecken der Wirbelsäule.
- Weil das Rückenmark aufhört zu wachsen früher während der postnatalen Entwicklung außer der Wirbelsäule liegt spinale Segment L4 unterhalb der ersten Lendenwirbel (L1). Wirbel L1 befindet kaudal des Wirbels, der die letzte Paar Rippen hält. Identifizieren und aufzudecken Wirbel L1, indem die kleinen Rückenmuskeln und Bänder an seiner dorsalen Oberfläche.
- Leicht anheben und halten Wirbel L1 mit einer Adson Pinzette. Verwenden Sie einen dedizierten Laminektomie Zangen, um den dorsalen Portio entfernenn des Wirbels (Wirbelsäule und Lamina) und setzen das Rückenmark. Vermeiden Sie Schäden am Rückenmark.
- Übertragen Sie die Maus auf der Heizplatte in der stereotaktischen Rahmen. Überwachen Sie die Temperatur der Maus im späteren Betrieb.
3. Injektion
- Fix Wirbel L1 mit V-Kerbe Spikes. Die Spitzen müssen stabilisieren die Wirbelsäule, so dass der Wirbel nicht während der Atmung bewegen.
- Bringen Sie die Mikrospritze näher, so dass die Pipettenspitze oberhalb des Laminektomie Website ist. Senken Sie den Kolben, bis Sie die Virussuspension Verlassen der Pipette zu sehen. Nehmen Sie die Tropfen mit einem sterilen Wattestäbchen.
- Positionieren der Pipettenspitze am rostralen äußersten Teil der freiliegenden Rückenmarks. Zentrieren Sie die Pipette über den hinteren Mittelfurche, dann bewegen Sie die Spitze 500 um seitlich. Senken Sie die Spitze an der Oberfläche des Rückenmarks und Punktion der Dura mater oder, wenn Sie mit einem unbeveled Glaspipette arbeiten, verwenden eine abgeschrägte Stahlkanüle zu durchstechen die dura. Senken Sie die Spitze der Glaspipette 300 um in das Rückenmark.
- Inject 1 ul Virussuspension mit einer Rate von 200 nl / min.
- Am Ende der Einspritzung, warten Sie mindestens 2 Minuten vor langsam Zurückziehen der Pipette.
- Wiederholen Schritte 3.3 bis 3,5 bei der kaudalen äußersten Teil der freiliegenden Rückenmarks zur vollständigen Verteilung des viralen Vektors in Wirbelsegment L4 erreichen. Die beiden Injektionsstellen befinden rostralen und kaudal des L4-Segment zu Gewebeschäden in der Zielregion zu vermeiden.
4. Wundverschluss
- Release Wirbel L1 aus den V-Kerbe Klemmen und entfernen Sie die Maus aus dem stereotaktischen Rahmen.
- Naht der Faszie mit 5,0 Vicryl. Die geschlossene Blende bietet Versicherungsschutz für die Laminektomie Ort.
- Schließen Sie die Haut mit Nylon-Fäden oder chirurgische Klammern.
5. Postoperative Pflege
- Übertragen Sie die Maus, um eine Erholung Käfig mit weichen, nonparticular Betten. Legen Sie sie auf ter Seite für bequeme Atmung. Überwachen das Tier, bis sie vollständig wach, ambulant ist und fängt an zu trinken.
- Wir bieten postoperativen Analgesie für 72 Stunden mit täglichen subkutanen Injektionen von Carprofen (5,0 mg / kg).
- Überwachung postoperativen Erholung durch tägliche Inspektion für die ersten 3 Tage, dann jeden zweiten Tag oder 3 Tage pro Woche, bis das Experiment abgeschlossen ist.
- Entfernen Sie die Haut Nähte oder Klammern 7 bis 10 Tage nach der Operation, wenn die Wundheilung abgeschlossen ist.
- Euthanize das Tier nach Beendigung des Experiments.
Ergebnisse
Erfolgreiche Transfektion ergibt robuste Genexpression in Nervenzellen des eingespritzten Dorsalhorn (Abbildung 1), Schonung der dorsalen Horn von der Gegenseite, Vorderhorn und der Spinalganglien.
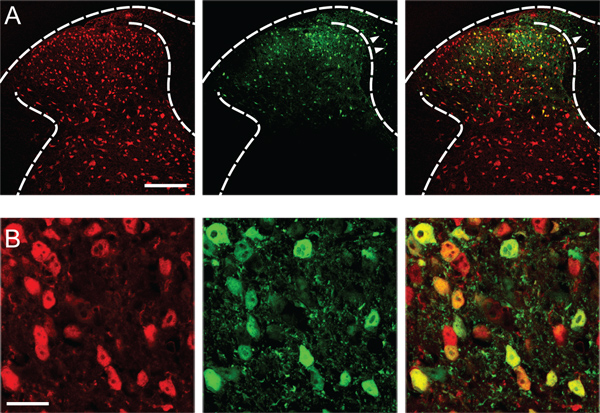
Abbildung 1. Transfektion von Hinterhorn-Neuronen. (A) Expression des fluoreszierenden Reporter eGFP (grün) in der linken Hinterhorn des L4 Rückenmark, zwei Wochen nach der stereotaktisch...
Diskussion
Stereotaktische Injektion ermöglicht Targeting-Vektor Rückenmarksneuronen für Anwendungen wie neuronale Netzwerk-Mapping basierend auf transsynaptische Virusverschleppung 6,7 oder optogenetische Dissektion 8, Axon Führung während der Regenerierung vor Verletzungen 9,10 oder Gentherapie zur Prävention oder Behandlung von Neurodegeneration 11, 12. Virale Vektoren sind für Genmanipulation worden im Rückenmark verwendet, um zu untersuchen somatosensorischen, Motor und vege...
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen haben.
Danksagungen
Wir danken Bakhos A. Tannous, Ph.D., Direktor des Vector Entwicklung und Produktion in der Neuroscience Center of Massachusetts General Hospital in Charlestown, Massachusetts, für die Bereitstellung der rAAV-EGFP Vektor, und John Whang für technische Unterstützung. Diese Arbeit wurde von grant R01 NS050408 (JS) aus dem National Institute of Neurological Disorders and Stroke unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Material Name | Firma | Katalog-Nummer | |
| Spinal Grundplatte | David Kopf Instruments | 912 | |
| Kleintier stereotaktischen Instrument | David Kopf Instruments | 900 | |
| Maus Gas Anästhesie Kopfhalter | David Kopf Instruments | 923-B | |
| Verstellbare Basis mounts | David Kopf Instruments | 982 | |
| V-Kerbe Spikes | David Kopf Instruments | 987 | |
| Kleintier-Temperaturregelung | David Kopf Instruments | TCAT-2LV | |
| Adson Pinzette | Fine Science Tools | 11006-12 | |
| Laminektomie Zangen | Fine Science Tools | 11223-20 | |
| UltraMicroPump (ein) mit SYS-Micro4-Controller | World Precision Instruments | UMP3-1 | |
| Mikroliterspritze, 65RN | Hamilton | 7633-01 | |
| RN Klemmverschraubung, 1 mm | Hamilton | 55750-01 | |
| Borosilikatglas Kapillaren | World Precision Instruments | 1B100F-4 | |
| Microgrinder | Narishige | EG-44 |
Referenzen
- Lewandoski, M. Conditional control of gene expression in the mouse. Nature Reviews Genetics. 2, 743-755 (2001).
- Couto, L. B., High, K. A. Viral vector-mediated RNA interference. Curr. Opin. Pharmacol. 10, 534-542 (2010).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57, 634-660 (2008).
- Davidson, B. L., Breakefield, X. O. Viral vectors for gene delivery to the nervous system. Nature Reviews Neuroscience. 4, 353-364 (2003).
- Todd, A. J. Neuronal circuitry for pain processing in the dorsal horn. Nature Reviews Neuroscience. 11, 823-836 (2010).
- Wall, N. R., Wickersham, I. R., Cetin, A., De La Parra, M., Callaway, E. M. Monosynaptic circuit tracing in vivo through Cre-dependent targeting and complementation of modified rabies virus. Proceedings of the National Academy of Sciences of the United States of America. 107, 21848-21853 (2010).
- Lo, L., Anderson, D. J. A Cre-dependent, anterograde transsynaptic viral tracer for mapping output pathways of genetically marked neurons. Neuron. 72, 938-950 (2011).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nature Methods. 8, 745-752 (2011).
- Tang, X. Q., Heron, P., Mashburn, C., Smith, G. M. Targeting sensory axon regeneration in adult spinal cord. J. Neurosci. 27, 6068-6078 (2007).
- Cameron, A. A., Smith, G. M., Randall, D. C., Brown, D. R., Rabchevsky, A. G. Genetic manipulation of intraspinal plasticity after spinal cord injury alters the severity of autonomic dysreflexia. J. Neurosci. 26, 2923-2932 (2006).
- Passini, M. A., et al. CNS-targeted gene therapy improves survival and motor function in a mouse model of spinal muscular atrophy. The Journal of Clinical Investigation. 120, 1253-1264 (2010).
- Lutz, C. M., et al. Postsymptomatic restoration of SMN rescues the disease phenotype in a mouse model of severe spinal muscular atrophy. The Journal of Clinical Investigation. 121, 3029-3041 (2011).
- Chen, S. L., et al. dsAAV type 2-mediated gene transfer of MORS196A-EGFP into spinal cord as a pain management paradigm. Proc. Natl. Acad. Sci. U.S.A. 104, 20096-20101 (2007).
- South, S. M., et al. A conditional deletion of the NR1 subunit of the NMDA receptor in adult spinal cord dorsal horn reduces NMDA currents and injury-induced pain. J. Neurosci. 23, 5031-5040 (2003).
- Tappe, A., et al. Synaptic scaffolding protein Homer1a protects against chronic inflammatory pain. Nat. Med. 12, 677-681 (2006).
- Colle, M. A., et al. Efficient intracerebral delivery of AAV5 vector encoding human ARSA in non-human primate. Human Molecular Genetics. 19, 147-158 (2010).
- Carbajal, K. S., Weinger, J. G., Whitman, L. M., Schaumburg, C. S., Lane, T. E. Surgical Transplantation of Mouse Neural Stem Cells into the Spinal Cords of Mice Infected with Neurotropic Mouse Hepatitis Virus. J. Vis. Exp. (53), e2834 (2011).
- Snyder, B. R., et al. Comparison of adeno-associated viral vector serotypes for spinal cord and motor neuron gene delivery. Hum. Gene Ther. 22, 1129-1135 (2011).
- Towne, C., Pertin, M., Beggah, A. T., Aebischer, P., Decosterd, I. Recombinant adeno-associated virus serotype 6 (rAAV2/6)-mediated gene transfer to nociceptive neurons through different routes of delivery. Mol. Pain. 5, 52 (2009).
- Kaplitt, M. G., et al. Long-term gene expression and phenotypic correction using adeno-associated virus vectors in the mammalian. 8, 148-154 (1994).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten