Method Article
El tomate / GFP-FLP / FRT Método para imágenes en vivo del mosaico adultos
En este artículo
Resumen
El método de tomate / GFP-FLP / FRT implica la visualización de las células fotorreceptoras de mosaico en Drosophila que viven. Se puede utilizar para seguir destinos celulares de los fotorreceptores individuales en la retina durante días o semanas. Este método es ideal para los estudios de degeneración de la retina y enfermedades neurodegenerativas o el desarrollo de las células fotorreceptoras.
Resumen
El ojo de Drosophila se utiliza ampliamente como un modelo para estudios de desarrollo y la degeneración neuronal. Con la potente técnica de recombinación mitótica, elegantes pantallas genéticos basados en el análisis clonal han llevado a la identificación de las vías de señalización implicadas en el desarrollo del ojo y de los fotorreceptores (PR) la diferenciación en las fases larvarias. Se describe aquí el método de tomate / GFP-FLP / FRT, que puede ser usado para una rápida análisis clonal en el ojo de vida adultos de Drosophila. Células fotorreceptoras fluorescentes son imágenes con la técnica de neutralización córnea, en las retinas con clones de mosaico generados por recombinación mediada por flipasa. Este método tiene varias ventajas importantes sobre seccionamiento histológico clásico de la retina: que puede ser utilizado para la selección de alto rendimiento y ha demostrado ser un método eficaz para la identificación de los factores que regulan la supervivencia y la función de PR. Puede ser utilizado para los análisis cinéticos de PR degeneración en la misma anim de estarAl lo largo de varias semanas, para demostrar el requisito de genes específicos para la supervivencia o la función de PR en la mosca adulta. Este método también es útil para abordar los aspectos de autonomía de células mutantes en desarrollo, tales como aquellos en los que se ve afectado el establecimiento de la polaridad celular plana.
Introducción
La retina Drosophila se compone de cerca de 800 unidades ommatidial (Figura 1A), que se organizan con precisión, con un eje claramente definido de polaridad (Figura 1B). Cada unidad contiene 20 celdas: ocho células fotorreceptoras (RP) y 12 células accesorias, incluyendo las células de cono, las células de pigmento y células de cerdas 1,2. Dos clases de PR se distinguen sobre la base del tipo de la rodopsina (Rh) que expresan. Los seis RP exteriores (R1-6) expresan Th1 y están dispuestas en un patrón de trapecio (Figura 1C). En el centro del trapecio, los dos RP interiores (R7/R8) expresan cuatro tipos posibles de la rodopsina (RH3, RH4, Rh5 o RH6) y están organizados de tal manera que R7 se encuentra en la parte superior del R8 3.
Más de 2.500 genes están implicados en la morfogénesis del ojo de Drosophila 4, que ha demostrado ser un modelo muy potente para el estudio de un amplio grupo de procesos, incluyendo deve ojorrollo, PR reclutamiento, la diferenciación, la polaridad celular planar, la morfogénesis, la supervivencia, la apoptosis y la transducción visual 5-9.
Los investigadores que trabajan en el ojo de Drosophila han, durante muchos años, desarrolló técnicas para obtener imágenes de la retina y la realización de cribados genéticos sistemáticos. La forma más fácil de la imagen de la retina adulta es mirar a la córnea en un animal inmovilizado (Figura 1A). La estructura de la córnea se puede visualizar con precisión por microscopía electrónica de barrido y se utilizó en una pantalla genética a gran escala por el consorcio URCFG ( http://www.bruinfly.ucla.edu ) 10. Este es un enfoque muy eficaz para la visualización de los cambios globales morfológicos en la estructura de la córnea, tales como la rugosidad de ojo o brillo, a menudo inducidos por mutaciones en los genes que controlan los primeros pasos en el desarrollo o la viabilidad celular. Sin embargo, la visualización global de la córnea no es dofficient para identificar los factores que regulan la morfogénesis rhabdomere PR o PR para adultos viabilidad y función. Estos análisis requieren una investigación más a fondo de la integridad de relaciones públicas, basado en la microscopía de contraste de fase de secciones tangenciales resina semi-delgadas de la retina 11-13. Esta técnica es adecuada para análisis de mosaico, en la que los RP mutantes se pueden identificar por su falta de 14,15 pigmento rojo.
Clones mutantes mosaico también pueden ser visualizados en las disecciones de todo el montaje de la pupa o adulto retina, sobre la base de la falta de la proteína verde fluorescente de la señal (GFP) en la microscopía de fluorescencia 16,17. Estas dos técnicas son muy útiles, pero ambos son mano de obra y consume mucho tiempo y por lo tanto no son adecuados para el cribado a gran escala. Nosotros y otros han desarrollado el uso de técnicas de neutralización córnea para la obtención de imágenes de los RP que producen proteínas fluorescentes 18,19, para facilitar el análisis de PR rápida. Con esta técnica, mutantelos clones se pueden identificar sobre la base de la autofluorescencia del pigmento rojo (w +) en mosaico adultos clones de Drosophila. Sin embargo, este método no proporciona la resolución de una sola célula requerido para hacer frente a la autonomía de células emite 19. Hemos superado este problema mediante el desarrollo del método de tomate / GFP-FLP / FRT, que combina la proyección de imagen de las proteínas fluorescentes por neutralización córnea con la recombinación mitótica 20. Este método permite que el alto rendimiento, la identificación rápida y precisa de los RP mutantes en los clones en mosaico, con una resolución de una sola célula ( http://www.ens-lyon.fr/LBMC/ApoDrosoDatabase/ ). Es adecuado para su uso en los análisis cinéticos, para la siguiente RP individuales durante un período de semanas en Drosophila vivir. Se describe aquí el método de tomate / GFP-FLP / FRT y consejos para su uso en los análisis simples y cinéticos de los ojos de mosaico.
Protocolo
1. Cruzar con líneas de tomate / GFP-FLP / FRT
La generación de moscas portadoras del clon mutante requiere un solo cruce entre una línea mutante FRT-libros y el correspondiente tomate / GFP-FLP / FRT vuela línea.
Este trabajo utiliza la colección BruinFly de mutaciones recombinadas-FRT ( http://www.bruinfly.ucla.edu ). Cuatro líneas de tomate / GFP-FLP / FRT se pueden utilizar, llevando FRT Th1-tdtomatoninaC en cada brazos de la segunda y tercera cromosomas combinados con fuente de flipasa (ey-FLP) y la expresión de GFP en todos los RP exteriores (Th1-Gal4 UAS -GFP) 20:
- Brazo 2L: línea # 43345, P {ry [+ T7.2] = rh1-GAL4} 1, P {ry [T7.2 +] = ey-FLP.N} 2, w [*], p {w [+ mC] = ninaE-tdTomato-ninaC} {2L P ry [+ T7.2] = neoFRT} 40A, P {w [+ mC] = UAS-GFP-ninaC} 3
- Brazo 2R: línea # 43346, P {ry [+ T7.2] = rh1-GAL4} 1, P {ry [+ T7.2] = ey-FLP.N} 2, w [*], p {ry [+ T7.2] = neoFRT} 42D P{W [+ mC] = ninaE-tdTomato-ninaC} 2R, P {w [+ mC] = UAS-GFP-ninaC} 3
- Brazo 3L: la línea # 43347, P {ry [+ T7.2] = rh1-GAL4} 1, P {ry [T7.2 +] = ey-FLP.N} 2, w [*], p {w [+ mC] = UAS-GFP-ninaC} 2, P {w [+ mC] = ninaE-tdTomato-3L ninaC} P {[T7.2 +] ry = neoFRT} 80B/TM6B, Tb [1]
- Brazo 3R: línea # 43348, P {ry [+ T7.2] = rh1-GAL4} 1, P {ry [T7.2 +] = ey-FLP.N} 2, w [*], p {w [+ mC] = UAS-GFP-ninaC} 2, P {ry [+ T7.2] = neoFRT} 82B P {w [+ mC] = ninaE-tdTomato-ninaC} 3R/TM6B, Tb [1]
Estas cuatro líneas están disponibles en el centro stock Bloomington Drosophila. Ellos proporcionan una fuente de FLP en el ojo en desarrollo para la generación de clones mitóticas 21. La de tipo salvaje cromosoma lleva una secuencia FRT y un rh1-tdTomato ninaC constructo que codifica la proteína fluorescente roja tdTomato, como un marcador de tipo salvaje y RP exteriores heterocigotos. En esta construcción, los últimos 41 aminoácidos de la isoforma P174 de la ninaC (ni la inactivación ni de activación C) gen fue de APdependido en marco a la C-terminal de la secuencia de tdTomato. La cola C-terminal de la isoforma P174 ninaC es responsable de la localización de la proteína rhabdomeral 22 y permite la visualización mejor en vivo de los RP fluorescentes rojas mediante la técnica de neutralización córnea. El promotor RH1 es la mínima 234 pb (-152 82) promotor RH1. El verde de GFP marcador fluorescente se expresa por todos los RP exteriores, debido a la presencia de la RH1-Gal4 (promotor 3kb) y UAS-GFP ninaC constructos. Cruces entre una acción mosca que porta una mutación en el cromosoma x FRT (FRT-x) y las líneas de tomate / GFP-FLP / FRT produce una progenie con el siguiente genotipo (ejemplo de mutación en 2L): RH1-Gal4, EY-FLP ; FRT40A, rh1-tdTomato ninaC / FRT40A-x; UAS-GFP ninaC. En estas moscas, las células mutantes homocigotos son generados por recombinación mitótica en el disco ojo en desarrollo y se dividen para generar un clon de RP mutantes homocigotos (Figura 2A). Homocélulas mutantes zygous pueden identificarse porque expresan sólo la proteína fluorescente verde (GFP), mientras que la de tipo salvaje que rodea y células heterocigotos expresan tanto tdTomato y GFP (Figuras 2B y B ").
2. Preparación de Drosophila para la visualización de fotorreceptores
Para PR visualización mediante la técnica de neutralización córnea, inmovilizar moscas en placas de agarosa.
- Prepare una botella de lavado llena con agua destilada 4 ° C y colocarlo en hielo.
- Disolver agarosa regular en agua (1.2-1.5% de agarosa en 100 ml de agua) por calentamiento en un horno de microondas. Colocar el matraz en un baño de agua a 55 ° C y dejar que la solución de agarosa se enfríe a esta temperatura. Mantener la agarosa a 55 ° C hasta su uso.
- Anestesie las moscas con CO 2 durante al menos 1 min.
- Vierta la solución de agarosa caliente (a 55 ° C) en una cápsula de Petri (35 x 10 mm, 1,37 x 0,39 in) y coloque inmediatamentetamente la anestesiado Drosophila en la agarosa. Para los principiantes, a partir de 10 moscas por placa de Petri es razonable. Más grande placa de Petri (60 x 15 mm, 2,362 x 0,59 in) también se puede utilizar.
- Bajo un microscopio de disección, orientar la Drosophila en su lado con una pinza, empuje un ala en la agarosa, de modo que el ala y la mitad del cuerpo están incrustados en la agarosa (figuras 3A-3A ""). Pegar la otra ala sobre la superficie de la agarosa. Nota: Si las moscas no se incrustan con suficiente profundidad en la agarosa, la marcha tendrá la libertad de mover la cabeza durante la exploración de la PR, y esto dará lugar a imágenes borrosas. La orientación del ojo también se verá afectado. Puede ser difícil para hundir la Drosophila en la agarosa, ya sea debido a la concentración de la agarosa o su temperatura. Es más fácil de incrustar moscas en agarosa más concentrada, pero si la agarosa está demasiado concentrada, la mosca puede hundirse. Si la agarosa es demasiado frío, puede ser difficult incrustar la marcha, pero una temperatura demasiado alta puede dañar la córnea.
- Coloque la placa de Petri en el hielo y dejar que la agarosa se solidifique.
- Con unas pinzas, orientar la cabeza de tal manera que un ojo está expuesto al objetivo de inmersión (Figura 3A 'y 3A ""). Generalmente, un ojo puede ser considerado para ser bien orientado bajo el microscopio de disección cuando el pseudopupil (visualizado como un punto negro) está en el centro del ojo. Una orientación óptima del ojo maximiza la anchura del campo ommatidial en el que los BP se centran. El objetivo de la etapa de orientación es para encontrar la región del ojo con el más amplio campo de RP se centraron, por lo general en el centro del ojo. Este paso también es útil para eliminar cualquier piernas o aristae que cubre el ojo y la prevención de su visualización.
- Cubra la marcha con agua helada y dejar la placa de Petri en hielo hasta su visualización. Agua enfriada con hielo mantiene las moscas anestesiadas.
3. VisualizandoLos fotorreceptores bajo el microscopio
Para la visualización de los RP a través de la córnea, este protocolo utiliza un microscopio vertical equipado con un objetivo de agua con una larga distancia de trabajo (W N-Achroplan 40X/0.75).
- Coloque la placa de Petri cubierta con agua helada sobre un portaobjetos de cristal en la platina del microscopio (Figuras 3 antes de Cristo). La placa de Petri se puede pegar a la placa de vidrio, por lo que es posible moverlo sobre sin problemas con los tornillos micrométricos.
- Hunda el objetivo de inmersión en el agua de la placa de Petri (Figuras 3B'-3C). Coloque la cabeza de la mosca bajo el haz de excitación (comenzar con el filtro de las buenas prácticas agrarias, por ejemplo). Mueva la platina hacia arriba y abajo hasta que el haz converge en el ojo. Cuando el ojo está en el nivel adecuado, tiende a reflejar la luz de excitación.
- Mire a través del ocular de fluorescencia. Cuando el ojo está posicionado en el centro del campo de vista, se centran por debajo de lacórnea para visualizar los fotorreceptores fluorescentes.
Nota 1: Al mirar a través del ocular, puede ser incómodo para distinguir las partes del cuerpo de la mosca, sobre todo la parte distal del abdomen y la cabeza, por ejemplo. En tales casos, se debe mirar directamente a la etapa de volver a colocar la Drosophila.
Nota 2: fluorescencia Clásica o microscopía confocal se pueden utilizar. La microscopía confocal proporciona imágenes con menos fondo y un campo más amplio de los RP enfocadas que la microscopía clásica. Un ejemplo de configuración es un LSM510 microscopio confocal (Zeiss) con un objetivo 40X agua. Los mejores resultados se pueden obtener mediante la apertura de la del agujero de alfiler del microscopio confocal más ancha que generalmente se recomienda para el objetivo. Por ejemplo, utilice un valor de 204, en lugar del predeterminado 98 para la apertura del agujero de alfiler.
Nota 3: Los niveles más altos de W + pigmentación del ojo a reducir la fluorescencia de fondo.
4. El curso temporal de visualización de las células fotorreceptoras
Es necesario tener cuidado cuando se sigue el destino de un PR individuo dentro del mismo ojo durante un periodo de tiempo.
- Reducir la temperatura de la agarosa a 45 ° C, para maximizar la supervivencia de Drosophila. La agarosa se solidifica muy rápidamente a esta temperatura. Sólo uno de Drosophila se debe utilizar por placa de Petri, para asegurar que las moscas no se mezclan durante las observaciones.
- Colocar sistemáticamente las moscas en el mismo lado, para la visualización del mismo ojo. Esto se puede lograr mediante la adopción de la mosca anestesiado de su vial por un ala y la colocación de la Drosophila en la agarosa. Siempre orientar el ojo de la misma manera, si es posible, por lo que es fácil encontrar PR clones que han sido vistos antes.
- Identificar los clones sobre la base de su forma bajo el microscopio confocal. El campo de visión es a menudo situado al lado del clon de interés. En DoCH casos, el ojo debe ser reorientado bajo el agua, para centrar el campo de visión en el clon de interés, basado en la polaridad del ojo (Figura 4).
5. La recuperación de moscas después de Visualización
- Eliminar el agua de la placa de Petri.
- Tire suavemente de la Drosophila de la agarosa con fórceps.
- Secar la Drosophila en un tejido.
- Devuelva la Drosophila a un vial, asegurándose de que no quede atrapado en la comida. Se permite la marcha para venir a 25 ° C.
Resultados
El método de tomate / GFP-FLP / FRT se puede utilizar para estudiar el efecto de una mutación o de la expresión ectópica en el desarrollo y la supervivencia de los RP en la retina de Drosophila. Es rápido, por lo que es ideal para fines de selección, tal como ha demostrado recientemente 20. La presencia de los RP mutantes junto a los RP de tipo salvaje en el mismo ojo hace que sea fácil de detectar defectos asociados con RP mutantes y para abordar la problemática de la autonomía de la célula.
Los defectos en el desarrollo observado en nuestro análisis afectados varios procesos, incluyendo el reclutamiento de relaciones públicas, la morfogénesis y polaridad celular plana (PCP) establecimiento (Figura 5). Seven in absentia se requiere para PR contratación, especialmente para R7 uno de los PR interior. La pérdida de los Siete en los resultados de rebeldía en la pérdida de la PR interior y algunos RP exteriores (Figura 5A). Cabeza Granulado (GRH) participa en el establecimiento de PCP y algunos ommatidia son inverted en GRH clones mutantes (Figura 5B). Este método permite la identificación de los RP mutantes en ommatidia mosaico, lo que facilita la identificación de los RP en la que se requiere que el gen para la correcta adquisición de la PCP. Hemos demostrado que se requiere grh para la correcta adquisición de PCP de precursores R3 20. De hecho, se observó que, en el omatidios invertida, R4, que se origina a partir del precursor anormalmente R3, siempre era mutante. Crumbs (CRBS) es una proteína de la membrana apical necesaria para la morfogénesis rhabdomere 23. La pérdida de los OC en los resultados de mutantes CRBS 11A22 en RP irregulares, más grandes o más pequeñas (Figura 5C).
Este método también se puede utilizar para seguir el destino de los RP individuales durante la edad adulta (Figura 6). Es ideal para estudios de neurodegeneración, porque un grupo de RP mutantes homocigotos puede ser visto y el mismo grupo se puede encontrar en el mismo ojo de lavolar misma durante un período de días o semanas. Por tanto, es posible determinar que los RP sobreviven y que están condenados a morir, porque cada clon tiene una forma única que se puede reconocer cuando el ojo se coloca bajo el microscopio de fluorescencia. Como se polariza la retina, es posible orientar la retina para encontrar el mismo clon de nuevo, sobre la base de su forma. Se utilizó este método para mostrar que FATP k10307 mutación induce la degeneración progresiva PR en la edad adulta (Figura 6, 24). Este método de visualización también puede ser utilizado para analizar la autonomía de células. En FATP k10307 retina mosaico, la pérdida de relaciones públicas fue restringido a FATP RP mutantes, los RP de tipo salvaje no verse afectado. El requisito de FATP para la viabilidad de relaciones públicas es, por tanto, de células autónomas. También pudimos rescatar el PR mutante FATP por reexpresión de tipo salvaje FATP con un conductor rh1-Gal4 y una construcción UAS-FATP (Figura 7). Laposibilidad de llevar a cabo tales experimentos de rescate es una de las ventajas del método de tomate / GFP-FLP / FRT sobre el análisis clonal basado en secciones histológicas de la retina incrustado en resina. De hecho, la detección de clones con el método de tomate / GFP-FLP / FRT no se ve afectada por el uso de P (UAS, w +) construcciones transgénicas, mientras que la pigmentación roja asociada con el gen de mini-blanco (w +) cubre el ojo con pigmento rojo , enmascarando clones en mosaico en cortes histológicos.
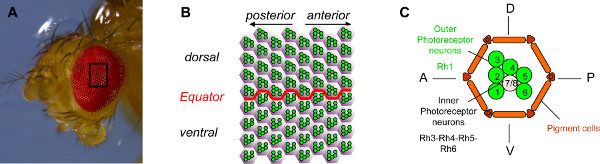
Figura 1. Organización del ojo de Drosophila. (A) La fotografía de un ojo Drosophila tomada con un microscopio estereoscópico. El ojo de Drosophila se compone de aproximadamente 800 omatidios. (B) Diagrama esquemático de un campo de 64 omatidios en el centro del ojo. Los seis neuronas fotorreceptoras exterior (RP) de cada ommatidium,se muestra en verde, se organizan en un trapecio estereotipada que apunta a los polos cercanos de los ojos. Ellos en consecuencia apuntan en direcciones opuestas en el ventral y la parte dorsal del ojo y son imagen especular de acuerdo a la frontera entre las dos partes, que se llama la línea ecuatorial. (C) Diagrama esquemático de un ommatidium. Cada ommatidium contiene ocho RP. RP R1 a R6, que se muestra en verde, son los RP exteriores. Ellos expresan la molécula rhodopsin1 fotosensible (Th1) y son el equivalente de los bastones de mamíferos. Los RP interiores, R7 y R8, se muestran en gris (R7 se sienta encima de R8). Los RP interiores expresan rodopsina 3, 4, 5 ó 6 y son el equivalente de las células cono de mamíferos. Para simplificar, sólo el rhabdomere, la parte sensible a la luz de las relaciones públicas, se muestra para cada RP. Haga clic aquí para ver más grande la figura .
Figura 2. Generar y visualizar clones PR mosaico en el ojo de Drosophila con el método de tomate / GFP-FLP / FRT. (A) Representación esquemática de la generación de clones en mosaico en el método de tomate / GFP-FLP / FRT. Clones de mosaico se generan por recombinación mitótica, debido a la expresión de la flipasa (bajo el control del promotor sin ojos) durante el desarrollo del ojo y las secuencias de FRT. Después de la recombinación de la secuencia FRT y la división celular, mutante homocigótico, homocigotos de tipo salvaje y las células heterocigotas se puede generar a partir de una célula heterocigotos. Estas células se dividen de nuevo para formar clones en mosaico de RP en el ojo adulto. La identificación de las células mutantes se ve facilitada por la inserción de una construcción que expresa la proteína fluorescente de color rojo tdTomato en el cromosoma de tipo salvaje, a la etiqueta de tipo salvaje y las células heterocigotas. (B-B'') Visualización de los clones PR mosaico con tmétodo que él Tomate / GFP-FLP / FRT. El método de tomate / GFP-FLP / FRT combina recombinación mitótica, la neutralización córnea y microscopía confocal. Todos los RP expresan la proteína verde fluorescente GFP, lo que facilita la visualización de los BPs utilizando neutralización córnea y microscopía confocal (B). RP se pueden visualizar en un nivel de una sola célula. Clones de mosaico mutantes se generan por recombinación mitótica y se pueden identificar por la ausencia de la tdTomato proteína fluorescente roja (B '). En consecuencia, en las imágenes fusionadas, los RP homocigotos muestran en verde, mientras que los de tipo salvaje y heterocigotos RP son de color amarillo (B''). Haga clic aquí para ver más grande la figura .
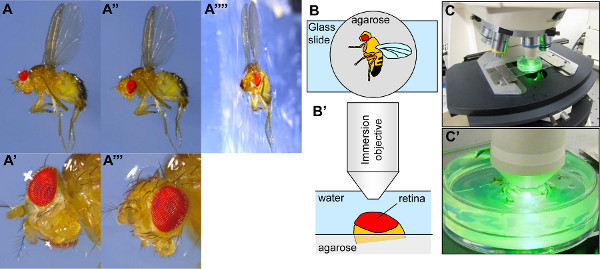
Figura 3. Configuración de la Drosophila para VISUALIZACde iones por neutralización córnea. (A-A'''') Fotografías de un Drosophila inmovilizados en un plato lleno de agarosa. En el panel A'''', un trozo de agarosa que contiene la marcha se ha reducido para tomar una fotografía de perfil. La Drosophila es-incrustado en el medio de agarosa, con el ala derecha dentro de la agarosa y la banda izquierda pegado en la superficie de agarosa (A, A'', A''''). Cuando la Drosophila está incrustado en la agarosa, la cabeza es frecuentemente mal posicionada para la visualización del ojo (A, A '). Por consiguiente, la cabeza debe ser reorientado con fórceps tales que la media del ojo está apuntando hacia arriba (A'', A'' ') (B-B.') Diagrama esquemático que muestra un Drosophila inmoviliza sobre una placa de agarosa y el posicionamiento de la Drosophila bajo el objetivo del microscopio. (C-C ') Fotografías de la configuración de la Drosophila en la etapa de lamicroscopio bajo su objetivo. Haga clic aquí para ver más grande la figura .
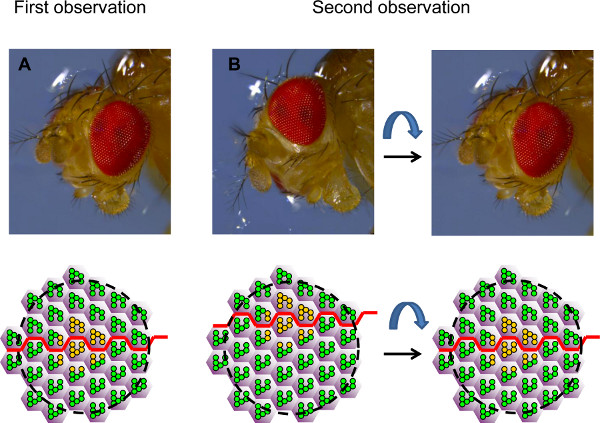
Figura 4. Orientación del ojo para el análisis de tiempo-por supuesto. La figura muestra fotografías de una cabeza de Drosophila en dos orientaciones diferentes y los campos correspondientes de ommatidia vistos por neutralización córnea, representados en forma de diagramas esquemáticos. (A) Durante la primera observación, se coloca el ojo de tal manera que un clon de RP de tipo salvaje o heterocigotos (en amarillo) es visto en el centro del campo, en el plano del ecuador (línea roja). (b) durante la segunda observación, el ojo a menudo no es exactamente la misma orientación. Por lo tanto, el mismo grupo de RP se puede encontrar de nuevo, pero no es posible ver elmismo campo exacto (a la izquierda). El ojo debe ser reorientada para el mismo campo para ser visto de nuevo. La posición del ecuador puede ser utilizado como una guía. En este ejemplo, se sabe que el campo observado es demasiado ventral y que, por tanto, el ojo debe estar activado ventralmente para colocar el ecuador en el centro del campo observado de nuevo, como en la primera observación.
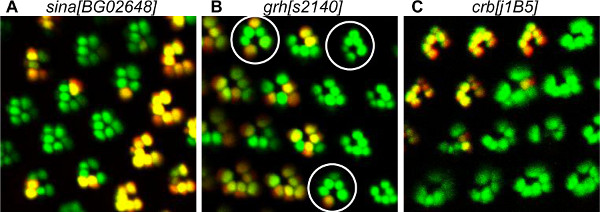
Figura 5. Ejemplos de defectos en el desarrollo de relaciones públicas detectadas por el método de tomate / GFP-FLP / FRT. (A) La visualización de sina [BG02648] RP mutantes de mosaico, que muestra la pérdida de RP interiores. En el ommatidia mutante, los RP exteriores están agrupados juntos debido a la ausencia del interno PR R7. De hecho, sina se sabe que se requiere para PR reclutamiento interno. (B) La visualización de grh mosaico [S2140] RP mutantes muestran defectos de polaridad. El mosaico mutante ommatidia, surrundada por un círculo, se apunta en la dirección opuesta a la de tipo salvaje ommatidia, lo que indica una inversión dorso-ventral. Un estudio detallado con el método de tomate / GFP-FLP / FRT mostró que grh se requería en el precursor de R3 para la correcta adquisición de polaridad ommatidium 20. (C) Visualización del CRB [j1B5] RP mutantes mosaico, mostrando RP homocigotos mutantes deformes. Crb se sabe que son necesarios para la morfogénesis rhabdomere.
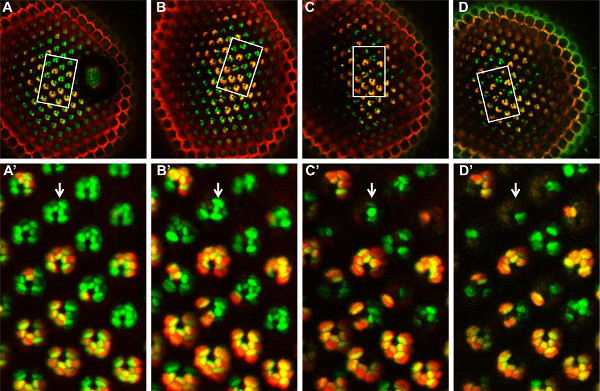
Figura 6. Análisis de tiempo-curso de FATP mosaico [k10307] RP mutantes con el método de tomate / GFP-FLP / FRT, de más de 14 días. A FATP mosaico [k10307] retina mutante se observó en el día 1 (A, A '), el día 4 ( B, B '), el día 8 (C, C') y el día 14 (D, D ') después de la eclosión. El mismo grupo de RP mosaico puede ser fundacionesD en cada punto de tiempo, en el campo observado (rectángulo blanco, A, B, C, D). En este campo de la RP (A ', B', C ', D'), los RP mutantes homocigotos están etiquetados en verde, mientras que los RP de tipo salvaje heterocigotos y homocigotos están etiquetadas en amarillo. A partir del día 4 (B ') en adelante, el RP homocigotos mutantes comienzan a desaparecer, lo que indica que el FATP [k10307] mutación induce una degeneración progresiva de estos RP. Haga clic aquí para ver más grande la figura .
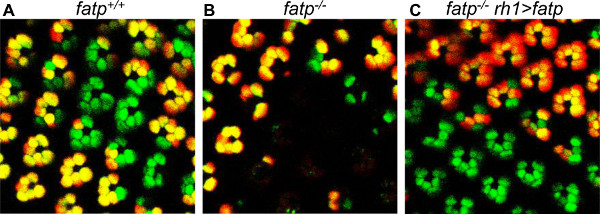
Figura 7. Rescate de FATP [k10307] RP mutantes con un mini blanco y llevando FATP expresan construir. Los RP mosaico se visualizan con el método de tomate / GFP-FLP / FRT en las moscas de 15 días de edad. (A) La visualización de control de mosaico RP. (B) Visualization de mosaico FATP RP mutantes, que muestran la pérdida de RP mutantes. (C) La visualización de mosaico FATP RP mutantes en un FATP mosca reexpresión en PR exterior (rh1> FATP). Los RP mutantes son rescatados. La presencia de un gen de mini-blanco y la pigmentación del ojo rojo asociado en RH1> condiciones FATP no altera de tomate o la fluorescencia de GFP o la detección clonal.
Discusión
El ojo de Drosophila ha sido ampliamente utilizado para descifrar las vías de señalización que regulan el desarrollo, la proliferación y la supervivencia. A principios de 1990, se llevaron a cabo un gran número de pantallas genéticos para identificar los caminos necesarios durante las fases iniciales del desarrollo de PR 25-27. La eficiencia de pantallas genéticos se incrementó en gran medida por la técnica de recombinación mitótica, que hace que sea posible para probar mutaciones de pérdida de función en los clones de mosaico 21. Por lo tanto, el papel de las mutaciones letales embrionarias podría ser probado sistemáticamente en los clones mutantes homocigotos en los ojos de moscas que eran heterocigotos de otro modo. La mayoría de las pruebas de detección de mosaico se han centrado en el RP reclutamiento temprano, la diferenciación, la proyección axonal o la morfogénesis que ocurre en el desarrollo de larvas o pupas 10,25-31. Hasta la fecha, sólo una pantalla de mosaico ha investigado los mecanismos que regulan la función de relaciones públicas de adultos, mediante el control de la respuesta visual a través electroretinogram recordings 32. Con el método de tomate / GFP-FLP / FRT y la posibilidad de realizar análisis de evolución en el tiempo en que viven los animales mutantes, hemos diseñado un nuevo método para la identificación de los factores que regulan adulto PR viabilidad y funcionar 20,24.
El método de tomate / GFP-FLP / FRT tiene varias ventajas importantes sobre el seccionamiento histológico clásico de ojos incrustados de resina. En primer lugar, este método es mucho más rápido, más barato y más fácil de realizar que el método histológico, siempre que un microscopio de fluorescencia equipado con un objetivo de inmersión en agua apropiado está disponible (consulte la Tabla de reactivos y equipos). En segundo lugar, el método de tomate / GFP-FLP / FRT puede ser utilizado en conjunción con la expresión del transgen, tales como la expresión de P (UAS, w +), que lleva un transgén de mini-blanco. En contraste con las secciones histológicas, en la que w + se utiliza para la detección clonal, en el sistema de tomate / GFP-FLP / FRT, P (UAS, w +) no interfiere con D clonaletection basado en proteína fluorescente de tomate. El uso de P (UAS-FATP, w +) moscas transgénicas, hemos sido capaces de visualizar el rescate de los RP mutantes FATP (Figura 7). En tercer lugar, una trampa clave de todos los tipos de análisis clonal, incluyendo la basada en tomate / GFP-FLP / FRT, es la ambigüedad del genotipo de los RP perdidos. De hecho, puede no estar claro si un PR está ausente debido a la falta de una función de gen específico o debido a un efecto no autónomo de células, en particular en la frontera del clon mutante. El método de tomate / GFP-FLP / FRT evita este problema de la degeneración de lo que es posible seguir de tipo salvaje y mutantes RP en el mismo animal durante periodos de varias semanas. Hemos sido capaces de seguir el destino de los RP individuales por cinética análisis sobre diferentes FATP moscas mutantes (Figura 6). El mismo clon se puede reconocer en un animal dado en momentos diferentes, debido a la forma precisa de los alrededores de los clones de tipo salvaje. Hemos sido capaces de demostrar sin ambigüedadesmente que todos los RP que faltan eran mutantes para FATP, lo que indica que la función de los mutantes FATP en RP es autónomo de la célula. Por lo tanto, mediante el control de la pérdida de RP en un análisis cinético, es posible determinar el genotipo de los RP en modelos de degeneración de inicio adulto. Finalmente, el método de tomate / GFP-FLP / FRT ha demostrado ser muy eficaz para la identificación de los factores que regulan el establecimiento de PCP 20. La posibilidad de marcar un gran número de omatidios mosaico para un fenotipo polaridad y sin la necesidad de secciones, facilita la rápida determinación de la PR requisito para el establecimiento de la PCP. Sin embargo, análisis más fino de la integridad PR requeriría seccionamiento tradicional seguido de contraste de fase o microscopías electrónicas.
En conclusión, el método de tomate / GFP-FLP / FRT abre nuevas posibilidades para la detección de mosaico eficiente para identificar los factores que regulan los procesos de desarrollo de relaciones públicas y funciones de relaciones públicas para adultos, tales como la relaciónrespuesta ual y viabilidad.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
PLATIM y Droso-Tools instalaciones del UMS3444 Biosciences, Lyon, Francia. La investigación del BM fue apoyado por becas de la Fundación pour la Recherche Medicale del CNRS (ATIP) y la ANR-12-BSV1-0019-01. PD fue apoyada por Retina Francia asociación y la Escuela Normal Superior de Lyon (Francia). CL fue apoyada por La Ligue Nationale contre le Cancer Association.
Materiales
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Agarose | Euromedex | D5-E | Regular agarose is used to immobilize the flies |
| Petri dish | BD Falcon | 353001 | 35 x 10 mm, 1.37 x 0.39 inch |
| Cold-ice water | To maintain the flies anesthetized | ||
| Equipment | |||
| Dissecting microscope | Dutcher | SMZ645 | |
| Water Bath | Julabo | 9550102 | To keep the agarose solution at warm temperature |
| 40X Water objective | Zeiss | 420967-9900-000 | Water dipping objective for the confocal microscope |
Referencias
- Hardie, R. C., Ottoson, D. . Sensory physiology 5. 5, 1-79 (1985).
- Wolff, T., Ready, D. F. Cell death in normal and rough eye mutants of Drosophila. Development. 113, 825-839 (1991).
- Rister, J., Desplan, C. The retinal mosaics of opsin expression in invertebrates and vertebrates. Dev Neurobiol. 71, 1212-1226 (2011).
- Halder, G., Callaerts, P., Gehring, W. J. Induction of ectopic eyes by targeted expression of the eyeless gene in Drosophila. Science. 267, 1788-1792 (1995).
- Mollereau, B., Domingos, P. M. Photoreceptor differentiation in Drosophila: from immature neurons to functional photoreceptors. Dev Dyn. 232, 585-592 (2005).
- Mollereau, B. Cell death: what can we learn from flies? Editorial for the special review issue on Drosophila apoptosis. Apoptosis. 14, 929-934 (2009).
- Charlton-Perkins, M., Brown, N. L., Cook, T. A. The lens in focus: a comparison of lens development in Drosophila and vertebrates. Mol Genet Genomics. 286, 189-213 (2011).
- Jenny, A. Planar cell polarity signaling in the Drosophila eye. Curr Top Dev Biol. 93, 189-227 (2010).
- Montell, C. Drosophila visual transduction. Trends Neurosci. 35, 356-363 (2012).
- Chen, J., et al. Discovery-based science education: functional genomic dissection in Drosophila by undergraduate researchers. PLoS Biol. 3, e59 (2005).
- Tomlinson, A., Ready, D. F. Neuronal differentiation in the Drosophila ommatidium. Dev Biol. 120, 366-376 (1987).
- Mendes, C. S., et al. ER stress protects from retinal degeneration. Embo J. 28, 1296-1307 (2009).
- Jenny, A. Preparation of adult Drosophila eyes for thin sectioning and microscopic analysis. J Vis Exp. , (2011).
- Mollereau, B., et al. Two-step process for photoreceptor formation in Drosophila. Nature. 412, 911-913 (2001).
- Domingos, P. M., et al. Spalt transcription factors are required for R3/R4 specification and establishment of planar cell polarity in the Drosophila eye. Development. 131, 5695-5702 (2004).
- Mendes, C. S., et al. Cytochrome c-d regulates developmental apoptosis in the Drosophila retina. EMBO Rep. 7, 933-939 (2006).
- Domingos, P. M., et al. Regulation of R7 and R8 differentiation by the spalt genes. Dev Biol. 273, 121-133 (2004).
- Mollereau, B., et al. A green fluorescent protein enhancer trap screen in Drosophila photoreceptor cells. Mech Dev. 93, 151-160 (2000).
- Pichaud, F., Desplan, C. A new visualization approach for identifying mutations that affect differentiation and organization of the Drosophila ommatidia. Development. 128, 815-826 (2001).
- Gambis, A., Dourlen, P., Steller, H., Mollereau, B. Two-color in vivo imaging of photoreceptor apoptosis and development in Drosophila. Dev Biol. 351, 128-134 (2011).
- Golic, K. G. Site-specific recombination between homologous chromosomes in Drosophila. Science. 252, 958-961 (1991).
- Porter, J. A., Hicks, J. L., Williams, D. S., Montell, C. Differential localizations of and requirements for the two Drosophila ninaC kinase/myosins in photoreceptor cells. J Cell Biol. 116, 683-693 (1992).
- Johnson, K., Grawe, F., Grzeschik, N., Knust, E. Drosophila crumbs is required to inhibit light-induced photoreceptor degeneration. Curr Biol. 12, 1675-1680 (2002).
- Dourlen, P., et al. Drosophila fatty acid transport protein regulates rhodopsin-1 metabolism and is required for photoreceptor neuron survival. PLoS Genet. 8, e1002833 (2012).
- Mlodzik, M., Hiromi, Y., Weber, U., Goodman, C. S., Rubin, G. M. The Drosophila seven-up gene, a member of the steroid receptor gene superfamily, controls photoreceptor cell fates. Cell. 60, 211-224 (1990).
- Gaul, U., Chang, H., Choi, T., Karim, F., Rubin, G. M. Identification of ras targets using a genetic approach. Ciba Found Symp. 176, 85-92 (1993).
- Wassarman, D. A., Therrien, M., Rubin, G. M. The Ras signaling pathway in Drosophila. Curr Opin Genet Dev. 5, 44-50 (1995).
- Janody, F., et al. A mosaic genetic screen reveals distinct roles for trithorax and polycomb group genes in Drosophila eye development. Genetics. 166, 187-200 (2004).
- Legent, K., Steinhauer, J., Richard, M., Treisman, J. E. A screen for X-linked mutations affecting Drosophila photoreceptor differentiation identifies Casein kinase 1alpha as an essential negative regulator of wingless signaling. Genetics. 190, 601-616 (2012).
- Newsome, T. P., Asling, B., Dickson, B. J. Analysis of Drosophila photoreceptor axon guidance in eye-specific mosaics. Development. 127, 851-860 (2000).
- Berger, J., et al. Systematic identification of genes that regulate neuronal wiring in the Drosophila visual system. PLoS Genet. 4, e1000085 (2008).
- Bayat, V., et al. Mutations in the mitochondrial methionyl-tRNA synthetase cause a neurodegenerative phenotype in flies and a recessive ataxia (ARSAL) in humans. PLoS Biol. 10, e1001288 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados