Method Article
Die Tomate / GFP-FLP / FRT Verfahren zur Live-Imaging von Mosaic Erwachsene
In diesem Artikel
Zusammenfassung
Die Tomate / GFP-FLP / FRT Verfahren beinhaltet die Visualisierung Mosaik Photorezeptorzellen in lebenden Drosophila. Es kann benutzt werden, um einzelne Schicksale Photorezeptorzelle in der Netzhaut für Tage oder Wochen folgen werden. Diese Methode ist ideal für die Untersuchung der Netzhautdegeneration und neurodegenerative Erkrankungen oder Photorezeptorzelle Entwicklung.
Zusammenfassung
Die Drosophila Auge wird weithin als ein Modell für die Untersuchung der Entwicklung und neuronaler Degeneration verwendet. Mit dem leistungsfähigen mitotische Rekombination Technik haben elegante genetischen Bildschirme auf Basis von klonalen Analyse zur Identifizierung von Signalwegen in der Entwicklung des Auges und Photorezeptor (PR) Differenzierung auf Larvenstadien beteiligt geführt. Wir beschreiben hier die Tomate / GFP-FLP / FRT-Methode, die für eine schnelle klonalen Analyse im Auge des lebenden erwachsenen Drosophila verwendet werden kann. Fluoreszenzphotorezeptorzellen sind mit der Hornhaut Neutralisierungstechnik abgebildet, auf der Netzhaut mit Mosaik-Klone durch flipase-vermittelte Rekombination erzeugt. Dieses Verfahren hat mehrere wesentliche Vorteile gegenüber der klassischen histologischen Schnitte der Netzhaut: Sie kann für die Hochdurchsatz-Screening verwendet werden und hat eine effektive Methode für die Identifizierung der Faktoren, die Regulierung PR Überleben und die Funktion bewährt. Es kann für kinetische Analysen von PR-Degeneration in der gleichen Lebens anim verwendet werdenal über mehrere Wochen, um die Anforderungen für spezifische Gene, die für das Überleben oder die PR-Funktion in der erwachsenen Fliege zu demonstrieren. Dieses Verfahren ist auch für die Adressierung Zelle Autonomieprobleme in Entwicklungs Mutanten, wie solche, bei denen die Einrichtung von planaren Zellpolarität ist betroffen.
Einleitung
Die Drosophila Retina von etwa 800 Ommatidien Einheiten (1A), die genau organisiert sind, mit einer klar definierten Achse Polarität (1B) besteht. Jede Einheit enthält 20 Zellen: acht Photorezeptorzellen (PRs) und 12 akzessorischen Zellen, einschließlich Kegelzellen, Pigmentzellen und Borstenzellen 1,2. Zwei Klassen von PR werden auf der Grundlage des Typs von Rhodopsin (Rh) drücken sie aus. Die sechs äußeren PRS (R1-6) auszudrücken Rh1 und in einer Trapezmuster (1C) angeordnet sind. In der Mitte des Trapez, die beiden inneren PRs (R7/R8) ausdrücken vier möglichen Arten von Rhodopsin (Rh3, Rh4, Rh5 oder Rh6) und werden so organisiert, dass R7 liegt oben auf 3 R8.
Mehr als 2.500 Gene in der Morphogenese von Drosophila Auge 4, die ein sehr leistungsfähiges Modell für Untersuchungen von einer großen Gruppe von Prozessen, einschließlich Augen Ent erwiesen beteiligtwicklung, PR Rekrutierung, Differenzierung, planaren Zellpolarität, Morphogenese, Überleben, Apoptose und optische Übertragungs 5-9.
Forscher des Drosophila Auge haben, über viele Jahre entwickelten Techniken zur Abbildung der Netzhaut und die Durchführung von systematischen genetischen Bildschirme. Der einfachste Weg, um die Bild erwachsenen Netzhaut an der Hornhaut in einer immobilisierten Tier (Fig. 1A) zu suchen. Die Struktur der Hornhaut präzise durch Rasterelektronenmikroskopie sichtbar gemacht werden und in einem Großbildschirm durch den genetischen URCFG Konsortium verwendet ( http://www.bruinfly.ucla.edu ) 10. Dies ist eine sehr effektive Methode zur Visualisierung globalen morphologischen Veränderungen der Hornhautstruktur, wie Augen Rauheit oder Glanz, die durch Mutationen in Genen, die frühen Schritte in der Entwicklung oder die Lebensfähigkeit der Zellen induziert. Jedoch globalen Visualisierung der Hornhaut nicht sufficient, die Faktoren zu regulieren PR rhabdomere Morphogenese oder Erwachsener PR Lebensfähigkeit und Funktion zu identifizieren. Solche Analysen erfordern eine gründliche Untersuchung der PR Integrität, auf Basis von Phasenkontrastmikroskopie von tangentialen semi-dünnen Harz Abschnitte der Netzhaut 11-13. Diese Technik ist geeignet für Mosaik Analysen, bei dem mutierten PRs durch ihren Mangel an rotem Pigment 14,15 identifiziert werden.
Mosaik mutierten Klone können auch in Whole-mount Sezieren des Puppen oder Erwachsener Retina sichtbar gemacht werden, auf der Grundlage ihres Mangels des grün fluoreszierenden Proteins (GFP)-Signal auf der Fluoreszenzmikroskopie 16,17. Diese beiden Techniken sind sehr nützlich, aber beide sind arbeits-und zeitaufwendig und sind daher nicht geeignet für große Screening. Wir und andere haben die Verwendung von Neutralisationstechniken Hornhaut für die Abbildung PRs Herstellung fluoreszierender Proteine 18,19 entwickelt, um rasche Erleichterung PR analysiert. Mit dieser Technik MutanteKlone können auf der Basis der Autofluoreszenz von roten (w +) Pigment in Mosaik erwachsenen Drosophila Klone identifiziert werden. Allerdings ist diese Methode nicht die Einzelzellauflösung benötigt, um Zell Autonomie Adresse gibt 19. Wir überwanden dieses Problem durch die Entwicklung der Tomate / GFP-FLP / FRT-Methode, die die Abbildung der Fluoreszenzproteine durch Neutralisation mit Hornhaut mitotische Rekombination 20 verbindet. Dieses Verfahren ermöglicht die Hochdurchsatz-, schnelle und genaue Identifizierung von mutierten PRs in Mosaik-Klone, bei Single-Cell-Auflösung ( http://www.ens-lyon.fr/LBMC/ApoDrosoDatabase/ ). Es ist geeignet für die Verwendung in kinetische Analysen für folgende Einzel PRs über einen Zeitraum von Wochen in lebenden Drosophila. Wir beschreiben hier die Tomate / GFP-FLP / FRT Verfahren und Tipps für den Einsatz in einfachen, kinetische Analysen von Mosaik Augen.
Protokoll
1. Kreuzung mit Tomate / GFP-FLP / FRT-Linien
Die Erzeugung von Fliegen, die das mutierte Klon erfordert eine einzige Kreuzung zwischen einem FRT-tragenden Mutanten-Linie und die entsprechende Tomate / GFP-FLP / FRT Linie fliegen.
Diese Arbeit verwendet die BruinFly Sammlung von FRT-rekombiniert Mutationen ( http://www.bruinfly.ucla.edu ). Vier Tomaten / GFP-FLP / FRT-Linien verwendet werden, die Durchführung FRT Rh1-tdtomatoninaC auf jedem Arme des 2. und 3. Chromosomen kombiniert mit Quelle flipase (ey-FLP) und die Expression von GFP in allen Außen PRs (Rh1 Gal4-UAS -GFP) 20:
- 2L Arm: Zeile # 43345, P {ry [+ t7.2] = rh1-GAL4} 1, P {ry [+ t7.2] = ey-FLP.N} 2, w [*], P {w [+ mC] = ninaE-tdTomato-ninaC} P {ry 2L [+ t7.2] = neoFRT} 40A, P {w [+ mC] = UAS-GFP-ninaC} 3
- 2R Arm: Zeile # 43346, P {ry [+ t7.2] = rh1-GAL4} 1, P {ry [+ t7.2] = ey-FLP.N} 2, w [*], P {ry [+ t7.2] = neoFRT} P 42D{W [+ mC] = ninaE-tdTomato-ninaC} 2R, P {w [+ mC] = UAS-GFP-ninaC} 3
- 3L Arm: Zeile # 43347, P {ry [+ t7.2] = rh1-GAL4} 1, P {ry [+ t7.2] = ey-FLP.N} 2, w [*], P {w [+ mC] = UAS-GFP-ninaC} 2, P {w [+ mC] = ninaE-tdTomato-ninaC} P {ry 3L [+ t7.2] = neoFRT} 80B/TM6B, Tb [1]
- 3R Arm: Zeile # 43348, P {ry [+ t7.2] = rh1-GAL4} 1, P {ry [+ t7.2] = ey-FLP.N} 2, w [*], P {w [+ mC] = UAS-GFP-ninaC} 2, P {ry [+ t7.2] = neoFRT 82B} P {w [+ mC] = ninaE-tdTomato-ninaC} 3R/TM6B, Tb [1]
Diese vier Linien sind an der Bloomington Drosophila Stock Center zur Verfügung. Sie lieferten eine Quelle von FLP in den Entwicklungs Auge für die Erzeugung von mitotischen 21 Klone. Die Wildtyp-Chromosom trägt eine FRT-Sequenz und ein rh1-tdTomato ninaC konstruieren das rot fluoreszierende Protein tdTomato codiert, als Marker für die Wildtyp-und heterozygoten Außen PRs. In diesem Konstrukt sind die letzten 41 Aminosäuren des P174-Isoform des ninaC (weder Inaktivierung oder Aktivierung C) Gen apin-frame mit dem C-Terminus der Sequenz tdTomato hängt. Die C-terminalen Schwanz des P174 ninaC Isoform des rhabdomeral Lokalisation des Proteins und 22 ermöglicht eine bessere Visualisierung von lebenden roten Fluoreszenz PRs mit der Hornhaut Neutralisierung Technik verantwortlich. Die rh1 Promotor ist der minimal 234 bp (-152 +82) rh1 Promotors. Das grün fluoreszierende GFP-Marker wird von allen äußeren PRs ausgedrückt, aufgrund der Anwesenheit des Gal4-RH1 (3 kb-Promotor) und UAS-GFP ninaC konstruiert. Kreuzungen zwischen einer Fliege Lager, die eine Mutation x auf der FRT-Chromosom (FRT-x) und die Tomate / GFP-FLP / FRT Linien ergibt einen Nachkommen mit den folgenden Genotyp (Beispiel Mutation auf 2L): rh1-Gal4, ey-FLP ; FRT40A, rh1-tdTomato ninaC / FRT40A-x; UAS-GFP ninaC. In diesen entfernt werden homozygot mutierten Zellen durch mitotische Rekombination in der Entwicklung Augen Scheibe erzeugt und zu teilen, um einen Klon von homozygoten mutanten PRS (2A) zu erzeugen. Homozygous mutierten Zellen identifiziert werden können, weil sie ausdrücken, nur das grün fluoreszierende Protein (GFP), während die umliegenden Wildtyp-und heterozygoten Zellen exprimieren sowohl tdTomato und GFP (2B und B ").
2. Vorbereitung für Drosophila Photorezeptor-Visualisierung
Für PR-Visualisierung durch Neutralisation der Hornhaut-Technik, zu immobilisieren Fliegen auf Agarose-Platten.
- Bereiten Sie eine Waschflasche mit 4 ° C destilliertem Wasser gefüllt und auf Eis.
- Auflösen regelmäßigen Agarose in Wasser (1,2-1,5% Agarose in 100 ml Wasser) durch Erhitzen in der Mikrowelle. Der Kolben wird in einem Wasserbad bei 55 ° C und damit die Agarose-Lösung auf dieser Temperatur zu kühlen. Halten der Agarose bei 55 ° C bis zur Verwendung.
- Anesthetize die Fliegen mit CO 2 für mindestens 1 min.
- Gießen Sie die warmen Agarose-Lösung (bei 55 ° C) in eine Petrischale (35 x 10 mm, 1,37 x 0,39 in) und legen sofortsofort Die Einsatz betäubt Drosophila auf die Agarose. Für Anfänger ab 10 Fliegen pro Petrischale ist vernünftig. Größer Petrischale (60 x 15 mm, 2,362 x 0,59 in) können ebenfalls verwendet werden.
- Unter einem Binokular, orientieren die Drosophila auf seiner Seite mit einer Pinzette, drücken einen Flügel in die Agarose, so dass die Flügel und die Hälfte des Körpers in der Agarose (Fig. 3A-3A "") eingebettet ist. Kleben Sie den anderen Flügel auf die Oberfläche der Agarose. Hinweis: Wenn die Fliegen nicht tief genug in der Agarose eingebettet, wird die Fliege frei, den Kopf während der Bildgebung des PR-bewegen zu können, und dies wird in unscharfe Bilder ergeben. Die Ausrichtung des Auges wird auch gestört werden. Es kann schwierig sein, die Drosophila in die Agarose zu stürzen, entweder aufgrund der Konzentration der Agarose oder dessen Temperatur. Es ist einfacher, Fliegen in konzentrierter Agarose eingebettet werden, aber wenn die Agarose zu konzentriert ist, kann die Flug sinken. Wenn die Agarose zu kühl ist, kann es sein, difficult, die Fliege einbinden, aber eine zu hohe Temperatur kann die Hornhaut beschädigen.
- Setzen Sie die Petrischale auf Eis und ermöglichen die Agarose zu verfestigen.
- Mit einer Pinzette, den Kopf zu orientieren (Abbildung 3A 'und 3A ""), so dass ein Auge auf die Immersionsobjektiv ausgesetzt. Im Allgemeinen kann ein Auge als auch unter dem Binokular ausgerichtet werden, wenn die pseudopupil (als schwarzer Fleck sichtbar) ist in der Mitte des Auges ist. Eine optimale Orientierung des Auges maximiert die Breite des Feldes, in dem Ommatidien Rezeptoren konzentriert. Das Ziel der Orientierungsschritt ist, um die Region des Auges mit dem breitesten Bereich konzentriert PRs zu finden, in der Regel in der Mitte des Auges. Dieser Schritt ist auch nützlich für die Beseitigung von Beinen oder aristae für das Auge und zur Verhinderung ihrer Visualisierung.
- Decken Sie die Fliege mit eiskaltem Wasser und lassen Sie die Petrischale auf Eis, bis die Visualisierung. Eiskaltes Wasser hält die Fliegen betäubt.
3. VisualisierungPhotorezeptoren unter der Lupe
Für die Visualisierung der PRs durch die Hornhaut, verwendet dieses Protokoll eine aufrechte Mikroskop mit einem Wasser Ziel ausgestattet mit einem großen Arbeitsabstand (W N-Achroplan 40X/0.75).
- Legen Sie die Petrischale mit eiskaltem Wasser auf einem Glasträger auf der Bühne des Mikroskops abgedeckt (Abb. 3 v. Chr.). Die Petrischale kann auf dem Glasobjektträger geklebt werden, was es ermöglicht, sie zu glatt mit der Mikrometerschrauben bewegen.
- Tauchen Sie das Immersionsobjektiv in das Wasser der Petrischale (Abbildungen 3b'-3C). Positionieren Sie den Kopf der Fliege unter dem Anregungsstrahl (Start mit dem GFP-Filter, zum Beispiel). Bewegen Sie die Bühne auf und ab, bis der Strahl konvergiert auf dem Auge. Wenn das Auge auf dem richtigen Niveau, neigt sie dazu, das Anregungslicht zu reflektieren.
- Schauen Sie durch das Okular für Fluoreszenz. Wenn das Auge in der Mitte des Sichtfeldes angeordnet ist, konzentrieren sich die folgendenHornhaut, die Photorezeptoren Fluoreszenz visualisieren.
Anmerkung 1: Beim Blick durch das Okular, kann es unruhig um die Körperteile von der Fliege, besonders im distalen Teil des Bauches und des Kopfes zu unterscheiden, zum Beispiel. In solchen Fällen sollten Sie direkt an der Bühne schauen, um den Drosophila neu zu positionieren.
Anmerkung 2: Klassische Fluoreszenz oder konfokale Mikroskopie verwendet werden. Die konfokale Mikroskopie ergibt Bilder mit weniger Hintergrund und einem breiteren Feld der fokussierten PRs als klassische Mikroskopie. Ein Beispiel Set-up ist ein LSM510 konfokalen Mikroskops (Zeiss) mit einer 40-fach Wasser Ziel. Bessere Ergebnisse können durch Öffnen der Lochblende des konfokalen Mikroskops ist in der Regel breiter als die empfohlene Ziel erhalten werden. Verwenden Sie beispielsweise einen Wert von 204, statt der standardmäßigen 98 für die Öffnung der Lochblende.
Hinweis 3: Höhere w + Pigmentierung der Augen reduzieren die Hintergrundfluoreszenz.
4. Zeit-Gänge-Visualisierung von Sehzellen
Pflege wird, wenn nach dem Schicksal eines einzelnen PR innerhalb der gleichen Auge über einen Zeitraum erforderlich.
- Verringerung der Temperatur der Agarose auf 45 ° C, um das Überleben Drosophila maximieren. Die Agarose erstarrt sehr schnell bei dieser Temperatur. Nur eine Drosophila sollte pro Petrischale verwendet werden, um sicherzustellen, dass die Fliegen nicht während der Beobachtung gemischt.
- Systematisch die Position entfernt auf der gleichen Seite zur Betrachtung desselben Auges. Dies kann durch die betäubten Fliegen aus seinem Fläschchen mit einem Flügel und Platzieren des Drosophila auf Agarose erreicht werden. Immer orientieren das Auge in der gleichen Weise, wenn möglich, so dass es leicht zu PR-Klone, die vor angesehen haben, zu finden.
- Identifizierung der Klone auf der Grundlage ihrer Form unter dem konfokalen Mikroskop. Das Sichtfeld wird oft neben dem Klon von Interesse. In such Fällen sollte das Auge unter Wasser neu ausgerichtet werden, um das Sichtfeld auf dem Klon von Interesse zu zentrieren, auf der Grundlage der Polarität des Auges (Abbildung 4).
5. Wiederherstellen Fliegen nach Visualisierung
- Entfernen Sie das Wasser aus der Petrischale.
- Ziehen Sie vorsichtig die Drosophila aus dem Agarose mit einer Pinzette.
- Trocknen Sie die Drosophila auf einem Gewebe.
- Liefert die Drosophila in ein Fläschchen, so dass sie nicht in der Lebensmittel stecken. Erlaubt die Fliege zu Runde bei 25 ° C kommen
Ergebnisse
Die Tomate / GFP-FLP / FRT-Methode kann verwendet werden, um die Wirkung einer Mutation oder einer Eileiter Ausdruck auf die Entwicklung und das Überleben der PRs im Drosophila Netzhaut zu untersuchen. Es ist schnell, wodurch es ideal für Screening-Zwecke, wie kürzlich gezeigt, 20. Die Anwesenheit von Mutanten-PRs neben Wildtyp-PRs in gleicher Augen macht es leicht, Mängel mit mutierten PRs verbunden zu erkennen und die Zelle Autonomie Problem zu beheben.
Die in unserer Analyse beobachtet Entwicklungsstörungen betroffen verschiedene Prozesse, einschließlich PR Rekrutierung, Morphogenese und planare Zellpolarität (PCP) Einrichtung (Abbildung 5). Seven in absentia für PR Rekrutierung erforderlich, insbesondere für R7 eine der inneren PR. Der Verlust von Seven in absentia zum Verlust der inneren PR und einige Außen PRs (5A). Körnig Kopf (GRH) in PCP Gründung beteiligt und einige Facettenaugen sind invin GRH mutierten Klone (5B) ausgeübt wird. Dieses Verfahren macht es möglich, die Mutante PRs in Mosaik Ommatidia identifizieren, erleichtert die Identifizierung der PRs in dem das Gen für die korrekte Erfassung von PCP erforderlich. Wir haben gezeigt, dass GRH ist für die korrekte Übernahme von PCP in R3 Vorstufen 20 erforderlich. Tatsächlich beobachteten wir, dass in der umgekehrten Ommatidia, R4, die von der abnormal R3 Vorstufe stammt, war immer Mutante. Crumbs (CRB) ist ein für rhabdomere Morphogenese 23 erforderlich apikalen Membran-Protein. Der Verlust von CRBS in den CRBS 11A22 Mutante ergibt unregelmäßig größere oder kleinere PRS (Fig. 5C).
Diese Methode kann auch verwendet werden, um das Schicksal der einzelnen PRs im Erwachsenenalter (Abbildung 6) zu folgen. Es ist ideal für Neurodegeneration Studien, weil eine Gruppe von homozygot mutierten PRs angesehen werden kann und derselben Gruppe können in der gleichen Auge die gefunden werdengleichen fliegen über einen Zeitraum von Tagen oder Wochen. Daher ist es möglich zu bestimmen, welche PRs überleben und das Scheitern verurteilt zu sterben, weil jeder Klon hat eine einzigartige Form, die aktiviert ist, wenn das Auge im Fluoreszenzmikroskop positioniert werden. Da die Netzhaut ist polarisiert, ist es möglich, die Netzhaut zu orientieren, um den gleichen Klon auf der Grundlage seiner Form wieder zu finden. Wir haben dieses Verfahren, um zu zeigen, dass FATP k10307 Mutation induziert progressive Degeneration PR im Erwachsenenalter (Abbildung 6, 24). Diese Visualisierungsverfahren kann auch verwendet werden, um Zell Autonomie zu analysieren. In FATP k10307 Mosaik Netzhaut wurde PR Verlust beschränkt Mutante PRs FATP, die Wildtyp-PRs als unberührt. Das Erfordernis der FATP für PR Rentabilität ist daher Zelle autonom. Wir waren auch in der Lage, die FATP Mutante PR reexpressing von Wildtyp-FATP mit einem rh1 Gal4-Treiber und einem FH-FATP Konstrukt (Abbildung 7) zu retten. DieMöglichkeit der Durchführung eines solchen Rettungsversuchen ist einer der Vorteile der Tomate / GFP-FLP / FRT-Verfahren über klonale Analyse basierend auf histologischen Schnitten von in Harz eingebetteten Netzhaut. Tatsächlich ist klonalen Detektion mit Tomaten / GFP-FLP / FRT-Verfahren nicht durch die Verwendung von P beeinflusst (UAS, w +) transgene Konstrukte, während die rote Pigmentierung mit dem Mini-white-Gen (w +) zugeordnet deckt das Auge mit rotem Pigment , Maskierung Mosaik-Klone in histologischen Schnitten.
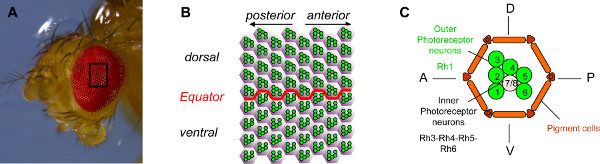
Fig. 1 ist. Organisation der Drosophila Auge. (A) Fotografie einer Drosophila Auge mit einem Stereomikroskop gemacht. Die Drosophila Auge wird von etwa 800 Ommatidien zusammen. (B) Schematische Darstellung eines Feldes von 64 Facettenaugen in der Mitte des Auges. Die sechs äußeren Photorezeptorneuronen (PRs) jedes Ommatidium,grün dargestellt, werden in eine stereotype Trapez, die auf die nächste Pole des Auges weist organisiert. Sie weisen daher in entgegengesetzten Richtungen in den ventralen und dorsalen Teil des Auges und sind spiegelbildlich entsprechend der Grenze zwischen den zwei Teilen, das heißt der Äquator. (C) Schematische Darstellung eines Ommatidium. Jeder Ommatidium enthält acht PRs. PRs R1 bis R6, grün dargestellt, sind die äußeren PRs. Sie bringen die lichtempfindliche Molekül rhodopsin1 (Rh1) und sind das Äquivalent von Säugetierzellen Stange. Die inneren PRs, R7 und R8, sind grau dargestellt (R7 sitzt oben auf R8). Die inneren PRs auszudrücken Rhodopsin 3, 4, 5 oder 6 und das Äquivalent von Säugerzellen Konus. Der Einfachheit halber wird nur die rhabdomere, die lichtempfindliche Teil der PR, PR für jeden angezeigt. Klicken Sie hier, um eine größere Abbildung anzuzeigen .

2. Generierung und Visualisierung von PR-Mosaik Klone in der Drosophila-Auge mit der Tomate / GFP-FLP / FRT-Methode. (A) Schematische Darstellung der Erzeugung von Mosaik-Klone in der Tomate / GFP-FLP / FRT-Methode. Mosaik-Klone werden durch mitotische Rekombination erzeugt, die aufgrund der Expression des flipase (unter der Kontrolle des augenlosen Promotor) während der Augenentwicklung und den FRT-Sequenzen. Nach Rekombination der FRT-Sequenz und Zellteilung, homozygote Mutante, homozygote Wildtyp-und heterozygoten Zellen können von einem heterozygoten Zellen erzeugt werden. Diese Zellen teilen sich erneut, um Mosaik Klone von PRs im erwachsenen Auge bilden. Die Identifizierung von mutierten Zellen wird durch das Einfügen ein Konstrukt der rot fluoreszierendes Protein exprimieren tdTomato in den Wildtyp-Chromosom, zu Wildtyp-und heterozygoten Zellen zu markieren erleichtert. (B-B'') Visualisierung von PR-Mosaik Klone mit ter Tomate / GFP-FLP / FRT-Methode. Die Tomate / GFP-FLP / FRT Methode kombiniert mitotische Rekombination, Hornhaut Neutralisation und der konfokalen Mikroskopie. Alle PRs exprimieren das grün fluoreszierende Protein GFP, das die Visualisierung der PRs mit Hornhaut Neutralisation und der konfokalen Mikroskopie (B) zu erleichtern. PRs können auf Einzelzellebene sichtbar gemacht werden. Mutante Mosaik Klone werden durch mitotische Rekombination erzeugt und kann durch das Fehlen der roten fluoreszierenden Protein tdTomato (B ') identifiziert werden. Daher am fusionierten Bilder erscheinen homozygot PRs in grün, während Wildtyp-und heterozygoten PRs sind gelb (B''). Klicken Sie hier, um eine größere Abbildung anzuzeigen .
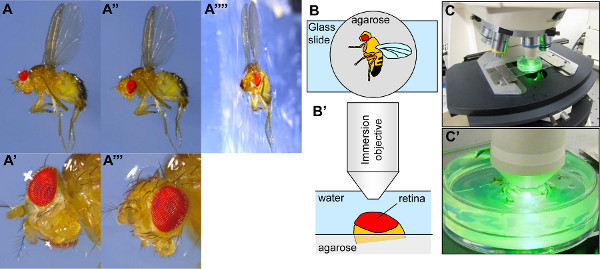
3. Einrichten des Drosophila für visualizatIonen durch Neutralisation der Hornhaut. (A-A'''') Fotografien von Drosophila auf einem Teller mit Agarose gefüllt immobilisiert. In Feld A'''', ein Stück, das die Agarose-fly wurde geschnitten, um ein Profil Foto machen. Die Drosophila in der Agarose eingebettete Halb, mit dem rechten Flügel in der Agarose und der linke Flügel auf dem Agarose-Fläche (A, A'', A'''') geklebt. Wenn die Drosophila in der Agarose eingebettet, wird sein Kopf häufig schlecht für die Visualisierung des Auges (A, A ') angeordnet ist. Der Kopf muß daher mit der Zange, so daß die Mitte des Auges nach oben (A'', A'' ') neu ausgerichtet wird. (B-B') schematische Darstellung eines Drosophila auf einem Agarose-Platte und der Positionierung des immobilisierten Drosophila unter dem Objektiv des Mikroskops. (C-C ') Fotografien von der Einstellung des Drosophila auf der Stufe derMikroskop unter ihrem Ziel. Klicken Sie hier, um eine größere Abbildung anzuzeigen .
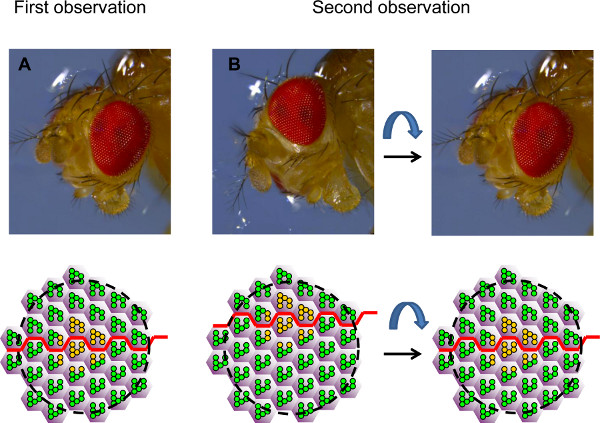
4. Orientierung des Auges für Zeitverlauf Analyse. Die Abbildung zeigt Fotografien einer Drosophila Kopf in zwei verschiedenen Orientierungen und die entsprechenden Felder des Facettenaugen Hornhaut durch Neutralisation betrachtet wird, wie schematische vertreten. (A) Während der ersten Beobachtung wird das Auge platziert so dass ein Klon von heterozygoten oder Wildtyp-PRs (gelb) wird in der Mitte des Feldes in der zweiten Beobachtung angesehen, auf der Ebene des Äquators (rote Linie). (B), das Auge ist oft nicht genau die gleiche Orientierung. So kann die gleiche Gruppe von PRs wieder gefunden werden, aber es ist nicht möglich, sehen diegenau die gleiche Feld (auf der linken Seite). Das Auge muss für das gleiche Feld wieder betrachtet werden neu ausgerichtet werden. Die Position des Äquators kann als Leitfaden verwendet werden. In diesem Beispiel weiß man, dass der beobachtete Bereich zu ventralen und daß das Auge muss also ventral gedreht werden, um den Äquator in der Mitte des beobachteten Feldes wieder zu setzen, wie in der ersten Beobachtung.
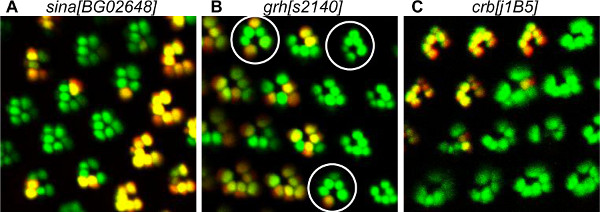
5. Beispiele für PR-Entwicklungsfehler von der Tomate / GFP-FLP / FRT-Methode festgestellt. (A) Visualisierung von Mosaik sina [BG02648] Mutante PRs, die den Verlust der inneren PRs. In der Mutante Ommatidia sind der äußere PRs zusammen durch das Fehlen der inneren PR R7 geclustert. Tatsächlich ist bekannt, sina für innere PR Rekrutierung erforderlich. (B) Visualisierung von Mosaik GRH [S2140] Mutante PRs zeigt Polarität Fehler. Das Mosaik-Mutante Facettenaugen, surrdurch einen Kreis ounded, in der entgegengesetzten Richtung von Wildtyp-Facettenaugen zeigen, was auf eine dorso-ventrale Inversion. Eine detaillierte Studie mit der Tomate / GFP-FLP / FRT-Methode zeigte, dass GRH wurde in der R3 Vorstufe für die korrekte Erfassung der Polarität Ommatidium 20 erforderlich. (C) Visualisierung von Mosaik CRB [j1B5] Mutante PRs, zeigt verformt homozygot mutierten PRs. CRB ist bekannt, für rhabdomere Morphogenese erforderlich.
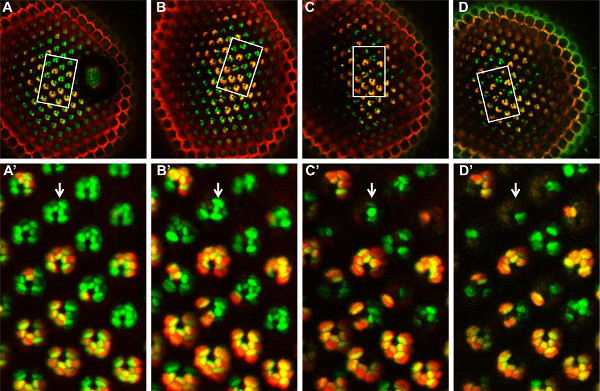
6. Zeit-Gänge-Analyse Mosaik FATP [k10307] Mutante PRs mit der Tomate / GFP-FLP / FRT-Methode, über 14 Tage. Ein Mosaik FATP [k10307] Mutante Netzhaut am Tag 1 (A, A ') beobachtet, Tag 4 ( B, B '), Tag 8 (C, C') und Tag 14 (D, D ') nach dem Schlüpfen. Die gleiche Gruppe von Mosaik PRs können Stiftungen seind zu jedem Zeitpunkt, in dem beobachteten Bereich (weißes Rechteck, A, B, C, D). In diesem Bereich der PRs (A ', B', C ', D'), sind homozygot mutierten PRs in grün markiert, während heterozygote und homozygote Wildtyp-PRs sind gelb markiert. Von Tag 4 (B ') ab, beginnen die homozygote Mutante PRs zu verschwinden, was darauf hinweist, dass die FATP [k10307] Mutation verursacht eine fortschreitende Degeneration dieser PRs. Klicken Sie hier, um eine größere Abbildung anzuzeigen .
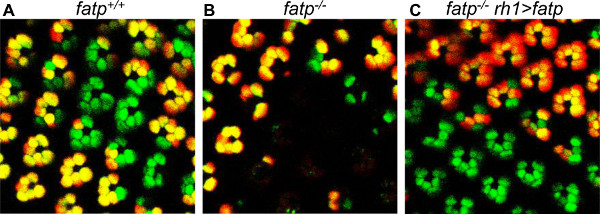
Abbildung 7. Rettung von FATP [k10307] Mutante PRs mit einem Mini-weiß-Trage FATP-exprimierenden zu konstruieren. Die Mosaik PRs werden mit der Tomate / GFP-FLP / FRT-Methode in 15 Tage alten Fliegen visualisiert. (A) Visualisierung von Mosaiksteuer PRs. (B) Visualisierung Mosaik FATP Mutante PRs, die den Verlust der Mutante PRs. (C) Visualisierung von Mosaik FATP Mutante PRs in eine Fliege reexpressing FATP in Außen PR (rh1> FATP). Die mutierten PRs sind gerettet. Die Anwesenheit eines Mini-white-Gen und dem zugehörigen roten Augen Pigmentierung RH1> FATP Bedingungen nicht verändern Tomate oder GFP-Fluoreszenz oder klonalen Erkennung.
Diskussion
Die Drosophila Auge wurde vielfach verwendet, um die Signalwege regulieren Entwicklung, Proliferation und das Überleben zu entziffern. In den frühen 1990er Jahren wurde eine große Anzahl von genetischen Screens durchgeführt, um die in den ersten Phasen der Entwicklung PR 25-27 erforderlich Wege zu identifizieren. Die Effizienz von genetischen Screens wurde durch die mitotische Rekombination Technik, die es ermöglicht, Verluste von Funktionsmutationen in Mosaik Klone 21 zu testen ist erhöht. Daher könnte die Rolle von embryonalen letalen Mutationen systematisch in homozygoten mutierten Klonen in den Augen entfernt, die sonst heterozygot waren getestet werden. Die meisten Mosaik-Screenings auf die frühe PR Rekrutierung, Differenzierung, axonalen Projektions oder Morphogenese in der sich entwickelnden Larven oder Puppen 10,25-31 auftretenden konzentriert. Bisher hat nur ein Mosaik-Bildschirm die Mechanismen, die Erwachsenen PR-Funktion untersucht, durch die Überwachung der visuellen Antwort über electroretinogram 32 Aufnahmen. Mit der Tomate / GFP-FLP / FRT-Methode und die Möglichkeit der Durchführung der Zeitverlaufsanalyse in lebenden mutierten Tiere, haben wir eine neue Methode für die Ermittlung der Faktoren, die Regulierung Erwachsenen PR Fähigkeit entwickelt und funktionieren 20,24.
Die Tomate / GFP-FLP / FRT Verfahren hat mehrere wesentliche Vorteile gegenüber der klassischen histologischen Schnitte von in Harz eingebetteten Augen. Erstens ist diese Methode viel schneller, billiger und einfacher durchzuführen als die histologische Verfahren, sofern ein Fluoreszenzmikroskop mit einer entsprechenden Wassertauchziel ausgestattet ist (siehe Tabelle der Reagenzien und Geräte). Zweitens kann der Tomate / GFP-FLP / FRT-Methode in Verbindung mit Transgenexpression verwendet werden, wie die Expression von P (UAS, w +), der ein Mini-white-Transgen. Im Gegensatz zur histologischen Schnitten, wobei w + für klonale Erkennung verwendet, in der Tomate / GFP-FLP / FRT-System P (UAS, w +) nicht mit klonaler d interferierenetection basierend auf Tomaten fluoreszierenden Proteins. Mit P (UAS-FATP, w +) transgenen Fliegen, waren wir in der Lage, die Rettung von FATP Mutante PRs (Abbildung 7) zu visualisieren. Drittens, ein Schlüsselfallstrick für alle Arten von klonalen Analysen auch auf Basis von Tomaten / GFP-FLP / FRT ist die Mehrdeutigkeit der Genotyp des PRs verloren. Tatsächlich kann es unklar sein, ob ein PR fehlt, weil der Mangel an einem bestimmten Gen-Funktion, oder weil einer Zelle nicht autonomen Wirkung, insbesondere am Rand des mutierten Klons. Die Tomate / GFP-FLP / FRT-Methode umgeht dieses Problem für Degeneration, indem es möglich zu Wildtyp-und Mutanten-PRs im gleichen Tier über Zeiträume von mehreren Wochen folgen. Wir waren in der Lage, das Schicksal einzelner PRs durch kinetische Analysen auf verschiedenen FATP mutierten Fliegen (Abbildung 6) zu folgen. Das gleiche Klon kann in einem bestimmten Tier zu verschiedenen Zeitpunkten aufgrund der genauen Form der umgebenden Wildtyp-Klonen erkannt werden. Wir konnten zeigen, eindeutigelich, dass alle fehlenden PRs waren mutierten für FATP, die anzeigt, dass die Rolle der FATP Mutanten in PRs ist zellautonome. Somit kann durch Überwachen des Verlusts der PRs in eine kinetische Analyse ist es möglich, den Genotyp PRs in Modellen von Altersdiabetes Degeneration. Schließlich hat die Tomate / GFP-FLP / FRT sehr leistungsfähige Methode für die Identifizierung von Faktoren, das die Einrichtung von PCP 20 bewährt. Die Möglichkeit, erzielte eine große Anzahl von Mosaik Ommatidia eine Polarität Phänotyp ohne Abschnitte, ermöglicht eine schnelle Bestimmung der PR-Anforderung für die Errichtung von PCP. Dennoch wäre eine feinere Analyse der PR Integrität traditionelle Schnitte, gefolgt von Phasen-Kontrast-Mikroskopie oder elektronische erfordern.
Abschließend öffnet sich die Tomate / GFP-FLP / FRT-Methode neue Möglichkeiten für effiziente Mosaik-Screening, um Faktoren Regel PR Entwicklungsprozesse und Erwachsenen PR-Funktionen, wie zB die über identifizierensexuellen Reaktion und Lebensfähigkeit.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Platim und Droso-Werkzeuge Einrichtungen des UMS3444 Biosciences, Lyon, Frankreich. BM-Forschung wurde durch Zuschüsse von der Fondation pour la Recherche unterstützt Médicale vom CNRS (ATIP) und der ANR-12-BSV1-0019-01. PD wurde von Retina Frankreich Verband und der Ecole Normale Supérieure in Lyon (Frankreich) gestützt. CL wurde von La Ligue Nationale contre le Cancer Association unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Agarose | Euromedex | D5-E | Regular agarose is used to immobilize the flies |
| Petri dish | BD Falcon | 353001 | 35 x 10 mm, 1.37 x 0.39 inch |
| Cold-ice water | To maintain the flies anesthetized | ||
| Equipment | |||
| Dissecting microscope | Dutcher | SMZ645 | |
| Water Bath | Julabo | 9550102 | To keep the agarose solution at warm temperature |
| 40X Water objective | Zeiss | 420967-9900-000 | Water dipping objective for the confocal microscope |
Referenzen
- Hardie, R. C., Ottoson, D. . Sensory physiology 5. 5, 1-79 (1985).
- Wolff, T., Ready, D. F. Cell death in normal and rough eye mutants of Drosophila. Development. 113, 825-839 (1991).
- Rister, J., Desplan, C. The retinal mosaics of opsin expression in invertebrates and vertebrates. Dev Neurobiol. 71, 1212-1226 (2011).
- Halder, G., Callaerts, P., Gehring, W. J. Induction of ectopic eyes by targeted expression of the eyeless gene in Drosophila. Science. 267, 1788-1792 (1995).
- Mollereau, B., Domingos, P. M. Photoreceptor differentiation in Drosophila: from immature neurons to functional photoreceptors. Dev Dyn. 232, 585-592 (2005).
- Mollereau, B. Cell death: what can we learn from flies? Editorial for the special review issue on Drosophila apoptosis. Apoptosis. 14, 929-934 (2009).
- Charlton-Perkins, M., Brown, N. L., Cook, T. A. The lens in focus: a comparison of lens development in Drosophila and vertebrates. Mol Genet Genomics. 286, 189-213 (2011).
- Jenny, A. Planar cell polarity signaling in the Drosophila eye. Curr Top Dev Biol. 93, 189-227 (2010).
- Montell, C. Drosophila visual transduction. Trends Neurosci. 35, 356-363 (2012).
- Chen, J., et al. Discovery-based science education: functional genomic dissection in Drosophila by undergraduate researchers. PLoS Biol. 3, e59 (2005).
- Tomlinson, A., Ready, D. F. Neuronal differentiation in the Drosophila ommatidium. Dev Biol. 120, 366-376 (1987).
- Mendes, C. S., et al. ER stress protects from retinal degeneration. Embo J. 28, 1296-1307 (2009).
- Jenny, A. Preparation of adult Drosophila eyes for thin sectioning and microscopic analysis. J Vis Exp. , (2011).
- Mollereau, B., et al. Two-step process for photoreceptor formation in Drosophila. Nature. 412, 911-913 (2001).
- Domingos, P. M., et al. Spalt transcription factors are required for R3/R4 specification and establishment of planar cell polarity in the Drosophila eye. Development. 131, 5695-5702 (2004).
- Mendes, C. S., et al. Cytochrome c-d regulates developmental apoptosis in the Drosophila retina. EMBO Rep. 7, 933-939 (2006).
- Domingos, P. M., et al. Regulation of R7 and R8 differentiation by the spalt genes. Dev Biol. 273, 121-133 (2004).
- Mollereau, B., et al. A green fluorescent protein enhancer trap screen in Drosophila photoreceptor cells. Mech Dev. 93, 151-160 (2000).
- Pichaud, F., Desplan, C. A new visualization approach for identifying mutations that affect differentiation and organization of the Drosophila ommatidia. Development. 128, 815-826 (2001).
- Gambis, A., Dourlen, P., Steller, H., Mollereau, B. Two-color in vivo imaging of photoreceptor apoptosis and development in Drosophila. Dev Biol. 351, 128-134 (2011).
- Golic, K. G. Site-specific recombination between homologous chromosomes in Drosophila. Science. 252, 958-961 (1991).
- Porter, J. A., Hicks, J. L., Williams, D. S., Montell, C. Differential localizations of and requirements for the two Drosophila ninaC kinase/myosins in photoreceptor cells. J Cell Biol. 116, 683-693 (1992).
- Johnson, K., Grawe, F., Grzeschik, N., Knust, E. Drosophila crumbs is required to inhibit light-induced photoreceptor degeneration. Curr Biol. 12, 1675-1680 (2002).
- Dourlen, P., et al. Drosophila fatty acid transport protein regulates rhodopsin-1 metabolism and is required for photoreceptor neuron survival. PLoS Genet. 8, e1002833 (2012).
- Mlodzik, M., Hiromi, Y., Weber, U., Goodman, C. S., Rubin, G. M. The Drosophila seven-up gene, a member of the steroid receptor gene superfamily, controls photoreceptor cell fates. Cell. 60, 211-224 (1990).
- Gaul, U., Chang, H., Choi, T., Karim, F., Rubin, G. M. Identification of ras targets using a genetic approach. Ciba Found Symp. 176, 85-92 (1993).
- Wassarman, D. A., Therrien, M., Rubin, G. M. The Ras signaling pathway in Drosophila. Curr Opin Genet Dev. 5, 44-50 (1995).
- Janody, F., et al. A mosaic genetic screen reveals distinct roles for trithorax and polycomb group genes in Drosophila eye development. Genetics. 166, 187-200 (2004).
- Legent, K., Steinhauer, J., Richard, M., Treisman, J. E. A screen for X-linked mutations affecting Drosophila photoreceptor differentiation identifies Casein kinase 1alpha as an essential negative regulator of wingless signaling. Genetics. 190, 601-616 (2012).
- Newsome, T. P., Asling, B., Dickson, B. J. Analysis of Drosophila photoreceptor axon guidance in eye-specific mosaics. Development. 127, 851-860 (2000).
- Berger, J., et al. Systematic identification of genes that regulate neuronal wiring in the Drosophila visual system. PLoS Genet. 4, e1000085 (2008).
- Bayat, V., et al. Mutations in the mitochondrial methionyl-tRNA synthetase cause a neurodegenerative phenotype in flies and a recessive ataxia (ARSAL) in humans. PLoS Biol. 10, e1001288 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten