Method Article
Le / GFP-FLP Méthode tomate / FRT pour l'imagerie en direct de mosaïque adulte
Dans cet article
Résumé
La méthode de tomate / GFP-FLP / FRT implique visualiser les cellules photoréceptrices de la mosaïque à vivre la drosophile. Il peut être utilisé pour suivre le destin des cellules individuelles des photorécepteurs dans la rétine pendant des jours ou des semaines. Ce procédé est idéal pour l'étude de la dégénérescence rétinienne et les maladies neurodégénératives ou le développement des cellules de photorécepteur.
Résumé
L'œil de Drosophile est largement utilisé comme un modèle pour les études sur le développement et la dégénérescence neuronale. Avec la technique de recombinaison mitotique puissant, cribles génétiques élégantes sur la base de l'analyse clonale ont conduit à l'identification des voies de signalisation impliquées dans le développement de l'œil et photorécepteur (PR) à la différenciation des stades larvaires. Nous décrivons ici la méthode de tomate / GFP-FLP / FRT, qui peut être utilisé pour l'analyse clonale rapide dans l'oeil de la vie adulte Drosophila. Cellules photoréceptrices fluorescentes sont imagés avec la technique de neutralisation cornée, sur la rétine avec des clones mosaïque générés par recombinaison de flipase médiation. Cette méthode a plusieurs avantages importants par rapport sectionnement histologique classique de la rétine: il peut être utilisé pour le criblage à haut débit et a prouvé une méthode efficace pour identifier les facteurs qui régulent la survie et la fonction PR. Il peut être utilisé pour des analyses cinétiques de la dégénérescence de PR dans la même anim vivanteal sur plusieurs semaines, afin de démontrer la nécessité de gènes spécifiques pour la survie de PR ou de la fonction dans la mouche adulte. Cette méthode est également utile pour résoudre les problèmes d'autonomie de la cellule dans des mutants de développement, telles que celles dans lesquelles l'établissement de la polarité cellulaire planaire est affectée.
Introduction
La rétine est constituée de Drosophila environ 800 unités ommatidial (Figure 1A), qui sont organisés précisément, avec un axe clairement définie de polarité (figure 1B). Chaque unité contient 20 cellules: huit cellules photoréceptrices (PR) et 12 cellules accessoires, y compris des cônes, les cellules pigmentaires et poils cellules 1,2. Deux classes de PR se distinguent sur la base du type de la rhodopsine (Rh) qu'elles expriment. Les six PN externes (R1-6) expriment Rh1 et sont disposés dans une configuration de trapèze (figure 1C). Dans le centre du trapèze, les deux PR intérieurs (R7/R8) expriment quatre types possibles de la rhodopsine (RH3, RH4, RH5 ou rh6) et sont organisées de telle sorte que R7 se trouve au sommet de la R8 3.
Plus de 2500 gènes sont impliqués dans la morphogenèse de l'œil de Drosophile 4, qui s'est avéré un modèle très puissant pour les études d'un large panel de processus, y compris déve oeilment, le recrutement de PR, la différenciation, la polarité cellulaire plane, la morphogenèse, la survie, l'apoptose et la transduction visuelle 5-9.
Les chercheurs qui travaillent sur l'œil de drosophile ont, depuis de nombreuses années, développé des techniques pour l'imagerie de la rétine et la réalisation d'écrans génétiques systématiques. La meilleure façon de l'image de la rétine adulte est de regarder la cornée chez un animal immobilisé (figure 1A). La structure de la cornée peut être visualisée avec précision par microscopie électronique à balayage, et a été utilisé dans un criblage génétique à grande échelle par le consortium URCFG ( http://www.bruinfly.ucla.edu ) 10. Il s'agit d'une approche très efficace pour visualiser les changements globaux morphologiques dans la structure de la cornée, telles que la rugosité des yeux ou brillant, souvent induites par des mutations dans les gènes qui contrôlent les étapes précoces du développement ou de la viabilité cellulaire. Cependant, la visualisation globale de la cornée n'est pas sufficient d'identifier les facteurs de régulation PR rhabdomere morphogenèse ou PR adulte viabilité et la fonction. Ces analyses nécessitent une enquête approfondie plus de l'intégrité de PR, basé sur la microscopie à contraste de phase de sections de résine semi-fines tangentielles de la rétine 11-13. Cette technique est appropriée pour les analyses de mosaïque, dans lequel PR mutants peuvent être identifiés par leur manque de pigment rouge 14,15.
Clones mutants mosaïque peuvent également être visualisés dans les dissections l'ensemble du montage de la pupe ou adulte rétine, sur la base de leur manque de la protéine fluorescente verte de signal (GFP) sur la microscopie à fluorescence 16,17. Ces deux techniques sont très utiles, mais les deux sont travail et beaucoup de temps et ne conviennent donc pas pour le dépistage à grande échelle. Nous et d'autres avons développé l'utilisation de techniques cornée de neutralisation pour l'imagerie des PN produisant des protéines fluorescentes 18,19, pour faciliter l'analyse des PR rapide. Avec cette technique, mutantclones peuvent être identifiés sur la base de l'auto-fluorescence du rouge (w +) pigment en mosaïque adultes clones drosophile. Cependant, cette méthode ne fournit pas la seule cellule de résolution nécessaire pour aborder l'autonomie de la cellule émet 19. Nous avons surmonté ce problème en développant la méthode de tomate / GFP-FLP / FRT, qui combine l'imagerie des protéines fluorescentes par cornée neutralisation par recombinaison mitotique 20. Cette méthode permet le haut-débit, une identification rapide et précise des PN mutantes dans des clones de mosaïque, à seule cellule de résolution ( http://www.ens-lyon.fr/LBMC/ApoDrosoDatabase/ ). Il est adapté pour une utilisation dans des analyses cinétiques, pour la suite PR individuels sur une période de quelques semaines à vivre la drosophile. Nous décrivons ici la méthode et des conseils de tomate / GFP-FLP / FRT pour son utilisation dans des analyses simples, cinétiques de yeux mosaïque.
Protocole
Une. Croisement avec les lignes de tomate / GFP-FLP / FRT
La génération de mouches portant le clone mutant nécessite un croisement entre une lignée mutante FRT-porter et la tomate / GFP-FLP / FRT correspondant volez ligne.
Ce travail a utilisé la collection BruinFly de mutations FRT-recombinés ( http://www.bruinfly.ucla.edu ). Quatre lignes de tomate / GFP-FLP / FRT peuvent être utilisés, portant FRT Rh1-tdtomatoninaC sur chaque bras de la 2e et 3e chromosomes combinés avec une source de flipase (ey-FLP) et l'expression de la GFP dans tous les PR extérieures (Rh1-Gal4 SAMU -GFP) 20:
- 2L bras: ligne # 43345, P {ry [+ T7.2] = rh1-GAL4} 1, P {ry [+ T7.2] = ey-FLP.N} 2, w [*]; P {w [+ mC] = ninaE-tdTomato-ninaC} P {2L ry [+ T7.2] = neoFRT} 40A; P {w [+ mC] = UAS-GFP-ninaC} 3
- 2R bras: ligne # 43346, P {ry [+ T7.2] = rh1-GAL4} 1, P {ry [+ T7.2] = ey-FLP.N} 2, w [*]; P {ry [+ T7.2] = neoFRT} 42D P{W [+ mC] = ninaE-tdTomato-ninaC} 2R; P {w [+ mC] = UAS-GFP-ninaC} 3
- 3L bras: ligne # 43347, P {ry [+ T7.2] = rh1-GAL4} 1, P {ry [+ T7.2] = ey-FLP.N} 2, w [*]; P {w [+ mC] = UAS-GFP-ninaC} 2; P {w [+ mC] = ninaE-tdTomato-ninaC} P {3L ry [+ T7.2] = neoFRT} 80B/TM6B, Tb [1]
- 3R bras: ligne # 43348, P {ry [+ T7.2] = rh1-GAL4} 1, P {ry [+ T7.2] = ey-FLP.N} 2, w [*]; P {w [+ mC] = UAS-GFP-ninaC} 2; P {ry [+ T7.2] = neoFRT} P {w 82B [+ mC] = ninaE-tdTomato-ninaC} 3R/TM6B, Tb [1]
Ces quatre lignes sont disponibles au centre d'actions Bloomington drosophile. Ils ont fourni une source de FLP dans le développement de l'œil pour la génération de clones mitotiques 21. Le chromosome de type sauvage effectue une séquence FRT et un rh1-tdTomato ninaC codant pour le rouge fluorescent tdTomato de protéine, comme un marqueur de type sauvage et PR extérieures hétérozygotes. Dans cette construction, les derniers 41 acides aminés de l'isoforme p174 de la ninaC (ni activation ni inactivation C) gène était apen suspension dans le cadre à l'extrémité C-terminale de la séquence d'tdTomato. La queue C-terminale de l'isoforme p174 ninaC est responsable de la localisation de la protéine rhabdomeral 22 et permet la visualisation en temps réel des PN mieux fluorescents rouges par la technique de neutralisation cornée. Le promoteur de rh1 est le minimum 234 pb (-152 82) du promoteur rh1. Le vert fluorescent marqueur GFP est exprimée par tous les PR extérieures, en raison de la présence de la rh1-Gal4 (promoteur de 3 kb) et UAS-GFP ninaC construit. Les croisements entre une mouche stock portant une mutation x sur le chromosome FRT (FRT-x) et les lignes de tomate / GFP-FLP / FRT donne une descendance avec le génotype (exemple de mutation sur 2L): rh1-Gal4, ey-FLP ; FRT40A, rh1-tdTomato ninaC / FRT40A-x; UAS-GFP ninaC. Dans ces mouches, les cellules mutantes homozygotes sont générés par recombinaison mitotique dans le disque de l'oeil et le développement se divisent pour générer un clone du PN mutantes homozygotes (figure 2A). Homozygous cellules mutantes peuvent être identifiés, car elles expriment seulement la protéine fluorescente verte (GFP), tandis que le type sauvage et les cellules hétérozygotes entourant expriment à la fois la GFP et tdTomato (figures 2B et B ").
2. Préparer la drosophile pour photorécepteur Visualisation
Pour PR visualisation par la technique de neutralisation cornée, immobiliser les mouches sur des plaques d'agarose.
- Préparer une bouteille de lavage remplie avec de l'eau distillée à 4 ° C et le placer sur la glace.
- Dissoudre dans de l'eau ordinaire agarose (1.2 à 1.5% d'agarose dans 100 ml d'eau) par chauffage dans un four micro-ondes. Placer la fiole dans un bain d'eau à 55 ° C et de permettre à la solution d'agarose à refroidir à cette température. Maintenir l'agarose à 55 ° C jusqu'à utilisation.
- Anesthésier les mouches avec du CO 2 pendant au moins 1 min.
- Verser la solution de gélose à chaud (à 55 ° C) dans une boîte de Pétri (35 x 10 mm, 1,37 x 0,39) et placer immédiatementdiatement la anesthésiés Drosophila sur l'agarose. Pour les débutants, à partir de 10 mouches par boîte de Pétri est raisonnable. Augmenter la boîte de Pétri (60 x 15 mm, 2,362 x 0,59 in) peut également être utilisé.
- Sous un microscope de dissection, orienter la drosophile sur le côté avec une pince, pousser une aile dans la gélose, de sorte que l'aile et la moitié du corps sont intégrés dans la gélose (figures 3A-3A ""). Collez l'autre aile sur la surface de la gélose. Note: Si les mouches ne sont pas intégrées assez profondément dans la gélose, la mouche sera libre de se déplacer sa tête lors de l'imagerie de la PR, et cela se traduira par des images floues. L'orientation de l'oeil sera également perturbé. Il peut être difficile de plonger la drosophile dans l'agarose, en raison soit de la concentration de l'agarose ou de sa température. Il est plus facile d'intégrer des mouches dans agarose plus concentré, mais si l'agarose est trop concentré, la mouche peut couler. Si l'agarose est trop cool, il peut être difficult à intégrer la volée, mais une température trop élevée peut endommager la cornée.
- Mettez la boîte de Pétri sur de la glace et laisser la gélose se solidifier.
- Avec une pince, d'orienter la tête de telle sorte que l'œil est exposé à l'objectif à immersion (figure 3A 'et 3A ""). Généralement, un oeil peut être considérée comme bien orienté sous le microscope de dissection lorsque le pseudopupil (visualisé comme une tache noire) est dans le milieu de l'œil. Une orientation optimale de l'oeil maximise la largeur de la zone dans laquelle ommatidial PN sont concentrés. Le but de l'étape d'orientation est de trouver la zone de l'oeil avec le plus grand champ de PN porté, habituellement au centre de l'oeil. Cette étape est également utile pour éliminer toutes les pattes ou aristae couvrant l'oeil et empêcher sa visualisation.
- Couvrir la mouche avec de l'eau glacée et laisser la boîte de Pétri sur la glace jusqu'à ce que la visualisation. eau glacée conserve vol anesthésiés.
3. VisualisationPhotorécepteurs sous le microscope
Pour la visualisation des PN à travers la cornée, ce protocole utilise un microscope droit équipé d'un objectif de l'eau avec une longue distance de travail (W N-Achroplan 40X/0.75).
- Placez la boîte de Pétri couverte avec de l'eau glacée sur une lame de verre sur la platine du microscope (figures 3 BC). La boîte de Pétri peut être collée à la lame de verre, ce qui permet de le déplacer sans à-coup avec environ les vis micrométriques.
- Plonger l'objectif à immersion dans l'eau de la boîte de Pétri (Figures 3B'-3C '). Positionner la tête de la mouche sous le faisceau d'excitation (commencer par le filtre de la GFP, par exemple). Déplacez la scène de haut en bas jusqu'à ce que le faisceau converge sur l'oeil. Lorsque l'oeil est au bon niveau, il a tendance à refléter la lumière d'excitation.
- Regardez à travers l'oculaire pour la fluorescence. Lorsque l'oeil est placé au centre du champ de vision, au-dessous de la concentrercornée de visualiser les photorécepteurs fluorescentes.
Note 1: Lorsque l'on regarde à travers l'oculaire, il peut être difficile de distinguer les parties du corps de la mouche, en particulier la partie distale de l'abdomen et de la tête, par exemple. Dans ce cas, vous devriez regarder directement à l'étape de repositionner la drosophile.
Note 2: fluorescence ou microscopie confocale classique peuvent être utilisés. La microscopie confocale donne des images avec moins de fond et un champ plus vaste de PR ciblées que la microscopie classique. Un exemple mis en place est un microscope confocal LSM510 (Zeiss) avec un objectif de 40X eau. De meilleurs résultats peuvent être obtenus en ouvrant le trou d'épingle du microscope confocal plus large que ce qui est habituellement recommandé pour l'objectif. Par exemple, utilisez une valeur de 204, plutôt que la valeur par défaut 98 pour l'ouverture du sténopé.
Note 3: Des niveaux plus élevés de w + pigmentation de l'œil à réduire la fluorescence de fond.
4. Temps plats Visualisation des cellules photoréceptrices
Soins est nécessaire lorsque l'on suit le destin d'un individu PR dans le même oeil sur une période de temps.
- Réduire la température de l'agarose à 45 ° C, afin de maximiser la survie chez la drosophile. L'agarose se solidifie très rapidement à cette température. Un seul Drosophila doit être utilisé par boîte de Petri, afin de s'assurer que les mouches ne sont pas mélangés pendant les observations.
- Positionner systématiquement à vol d'un même côté, pour l'affichage du même oeil. Ceci peut être obtenu en prenant la volée à partir de son flacon anesthésié par une aile et à placer la drosophile sur de l'agarose. Toujours orienter l'œil de la même manière, si possible, le rendant facile à trouver clones de relations publiques qui ont été vus avant.
- Identifier les clones sur la base de leur forme sous le microscope confocal. Le champ de vision est souvent situé à côté du clone d'intérêt. Dans such cas, l'oeil doit être réorientée sous l'eau, pour centrer le champ de vision sur le clone d'intérêt, sur la base de la polarité de l'oeil (figure 4).
5. Récupérer mouches après visualisation
- Enlever l'eau à partir de la boîte de Pétri.
- Tirez doucement sur le Drosophila sur la gélose avec une pince.
- Sécher la drosophile sur un tissu.
- Retour à la drosophile un flacon, en s'assurant qu'il ne reste pas coincé dans la nourriture. A permis à la mouche à venir ronde à 25 ° C.
Résultats
La méthode de tomate / GFP-FLP / FRT peut être utilisé pour étudier l'effet d'une mutation ou d'expression ectopique sur le développement et la survie des PN dans la rétine chez la drosophile. Il est rapide, ce qui est idéal pour des fins de dépistage, comme l'a récemment démontré 20. La présence de PR mutantes côté de PR de type sauvage dans le même œil, il est facile de détecter les défauts liés à PR mutantes et d'aborder la question de l'autonomie de la cellule.
Les anomalies du développement observées dans notre analyse ont affecté divers processus, y compris le recrutement de PR, la morphogenèse et la polarité cellulaire planaire (PCP) établissement (figure 5). Seven par contumace est requis pour le recrutement de PR, en particulier pour R7 un des PR intérieure. La perte des Sept dans les résultats contumace à la perte de la PR intérieur et quelques PR extérieures (figure 5A). Tête grenue (de GRH) est impliqué dans l'établissement de la PCP et des ommatidia sont inverted en GRH clones mutants (figure 5B). Cette méthode permet d'identifier les PR mutantes dans ommatidia mosaïque, facilitant l'identification des PR dans lequel le gène est nécessaire pour l'acquisition correcte de PCP. Nous avons montré que GRH est requis pour l'acquisition correcte de PCP en précurseurs R3 20. En effet, nous avons observé que, dans le ommatidies inversé, R4, qui provient anormalement à partir du précurseur R3, a toujours été mutant. Crumbs (CRC) est une protéine de la membrane apicale nécessaire pour la morphogenèse rhabdomere 23. La perte de CEM dans les résultats mutantes crbs 11A22 en situation irrégulière, PR plus ou moins (figure 5C).
Cette méthode peut également être utilisée pour suivre le sort des PN simples à l'âge adulte (figure 6). Il est idéal pour les études de la neurodégénérescence, car un groupe de PR mutantes homozygotes peut être consulté et même groupe peut être trouvé dans le même œil de l'même voler sur une période de plusieurs jours ou semaines. Il est donc possible de déterminer qui les PR survivre et qui sont condamnés à mourir, parce que chaque clone a une forme unique qui peut être reconnue lorsque l'œil est placé sous le microscope à fluorescence. Comme la rétine est polarisée, il est possible d'orienter la rétine de trouver le même clone à nouveau, sur la base de sa forme. Nous avons utilisé cette méthode pour montrer que FATP k10307 mutation induit une dégénérescence progressive de PR à l'âge adulte (figure 6, 24). Cette méthode de visualisation peut également être utilisé pour analyser l'autonomie de la cellule. En FATP k10307 rétine mosaïque, la perte de PR a été limité à FATP PR mutantes, les PR de type sauvage n'étant pas affecté. L'obligation de FATP pour PR viabilité cellulaire est donc autonome. Nous avons également été en mesure de sauver la PR mutant FATP par Par réécriture de type sauvage FATP avec un pilote rh1-Gal4 et une construction UAS-FATP (figure 7). Lapossibilité d'effectuer de telles expériences de récupération est l'un des avantages du procédé de tomate / GFP-FLP / FRT sur l'analyse clonale sur la base de coupes histologiques de la rétine à la résine incorporée. En effet, la détection de clones par la méthode de tomate / GFP-FLP / FRT n'est pas affectée par l'utilisation de P (UAS, w +) constructions transgéniques, alors que la pigmentation rouge associée avec le gène mini-white (w +) recouvre l'œil avec un pigment rouge , masquant clones de mosaïque dans les coupes histologiques.
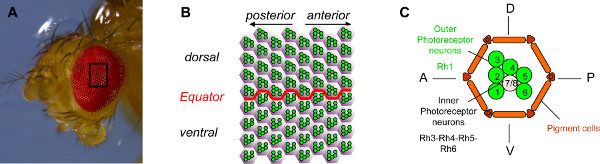
Figure 1. Organisation de l'œil chez la drosophile. (A) Photographie d'un œil de Drosophile prise avec un microscope stéréoscopique. L'œil de Drosophile est composé d'environ 800 ommatidia. (B) Schéma d'un champ de 64 ommatidia dans le milieu de l'œil. Les six neurones photorécepteurs extérieure (PRS) de chaque ommatidie,en vert, sont organisés en un trapèze stéréotypée qui pointe vers les pôles les plus proches de l'œil. Ils indiquent par conséquent dans des directions opposées dans le ventral et dorsal de la partie de l'oeil et sont l'image miroir en fonction de la frontière entre les deux parties, qui est appelé l'équateur (C). Schéma de principe d'un ommatidie. Chaque ommatidie contient huit PR. PR R1 à R6, en vert, sont les PR extérieures. Ils expriment la molécule rhodopsin1 photosensible (Rh1) et sont l'équivalent de cellules de tige de mammifères. Les PR intérieurs, R7 et R8, sont affichées en gris (R7 se trouve au sommet de la R8). Les PR intérieurs expriment rhodopsine 3, 4, 5 ou 6, et sont l'équivalent de cellules de cône de mammifères. Pour plus de simplicité, seul le rhabdomere, la partie sensible à la lumière de la PR, est indiqué pour chaque PR. Cliquez ici pour agrandir la figure .

Figure 2. Génération et visualisation de clones de PR de mosaïque dans l'œil de drosophile avec la méthode de tomate / GFP-FLP / FRT. (A) Schéma de la génération de clones mosaïque dans la méthode de tomate / GFP-FLP / FRT. Clones de mosaïque sont générés par recombinaison mitotique, en raison de l'expression de la flipase (sous le contrôle du promoteur eyeless) au cours du développement de l'œil et les séquences FRT. Après la recombinaison de la séquence FRT et la division cellulaire, mutant homozygote de type sauvage homozygote et hétérozygote cellules peut être généré à partir d'une cellule hétérozygote. Ces cellules se divisent à nouveau pour former des clones mosaïque de PR dans les yeux des adultes. L'identification des cellules mutantes est facilitée par l'insertion d'une construction exprimant le rouge fluorescent tdTomato de protéines dans le chromosome de type sauvage, d'étiqueter de type sauvage et les cellules hétérozygotes. (B-B'') Visualisation des clones de PR de mosaïque avec tméthode qu'il tomate / GFP-FLP / FRT. La méthode de tomate / GFP-FLP / FRT combine recombinaison mitotique, cornée neutralisation et la microscopie confocale. Tous les PN expriment la GFP de la protéine fluorescente verte, ce qui facilite la visualisation des PN en utilisant la cornée neutralisation et la microscopie confocale (B). PR peuvent être visualisées au niveau d'une seule cellule. Clones de mosaïque mutants sont générés par recombinaison mitotique et peuvent être identifiés par l'absence de la tdTomato de la protéine fluorescente rouge (B '). En conséquence, sur les images fusionnées, PR homozygotes apparaissent en vert, alors que de type sauvage et hétérozygotes PR sont jaunes (B''). Cliquez ici pour agrandir la figure .
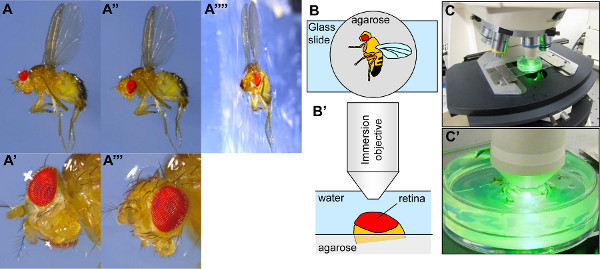
Figure 3. Mise en place de la drosophile pour visualizations par neutralisation cornée. (A-A'''') Photographies d'une drosophile immobilisées sur un plateau rempli d'agarose. Dans le panneau A'''', un morceau d'agarose contenant la volée a été coupé pour prendre une photo de profil. La drosophile est demi-noyé dans la gélose, avec l'aile droite au sein de l'agarose et l'aile gauche collé sur la surface de la gélose (A, A'', A''''). Lorsque la drosophile est noyé dans l'agarose, sa tête est souvent mal positionné pour la visualisation de l'œil (A, A '). La tête doit donc être réorienté avec une pince de sorte que le milieu de l'œil est orientée vers le haut (A'', A'' '). (B-B') Schéma montrant une drosophile immobilisé sur une plaque d'agarose et le positionnement de la Drosophila sous l'objectif du microscope. (C-C ') Photographies de la fixation de la drosophile à l'étape de lamicroscope sous son objectif. Cliquez ici pour agrandir la figure .
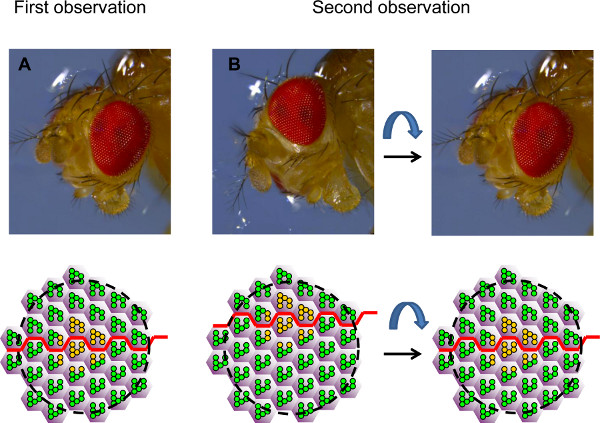
Figure 4. Orientation de l'œil pour l'analyse temps-cours. L'illustration montre des photographies d'une tête de Drosophila dans deux orientations différentes et les champs correspondants de ommatidia vus par cornée neutralisation, représentés sous forme de diagrammes schématiques. (A) Au cours de la première observation, l'œil est placé tels qu'un clone de PR de type sauvage ou hétérozygote (en jaune) est considérée dans le milieu du terrain, au niveau de l'équateur (ligne rouge). (B) Au cours de la deuxième observation, l'œil est souvent pas exactement la même orientation. Ainsi, le même groupe de PN peut être trouvée à nouveau, mais il n'est pas possible de voir l'exactement le même champ (sur la gauche). L'oeil doit être réorientée pour le même champ à visualiser à nouveau. La position de l'équateur peut être utilisé comme un guide. Dans cet exemple, nous savons que le champ observé est trop ventrale et que l'œil doit donc être mis sur le ventre de placer l'équateur au milieu du champ observé encore, comme dans la première observation.
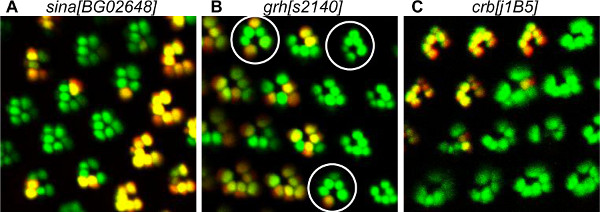
Figure 5. Exemples de défauts de relations publiques de développement détectées par la méthode de tomate / GFP-FLP / FRT. (A) Visualisation de mosaïque sina [BG02648] PR mutantes, montrant la perte de PR intérieurs. Dans le mutant ommatidies, PN externes sont regroupés en raison de l'absence de l'intérieur PR R7. En effet, sina est connu pour être exigé pour le recrutement de PR intérieure. (B) Visualisation de GRH mosaïque [s2140] PR mutantes présentant des défauts de polarité. La mosaïque mutant ommatidia, surrondé par un cercle, sont pointant dans la direction opposée à partir du type sauvage ommatidies, ce qui indique une inversion dorso-ventral. Une étude détaillée de la méthode de tomate / GFP-FLP / FRT a montré que GRH a été nécessaire dans le précurseur R3 pour l'acquisition correcte de ommatidie polarité 20. (C) Visualisation des CRB [j1B5] PR mutantes mosaïque, montrant PR mutantes homozygotes déformés. Crb est connu pour être nécessaire à la morphogenèse rhabdomere.
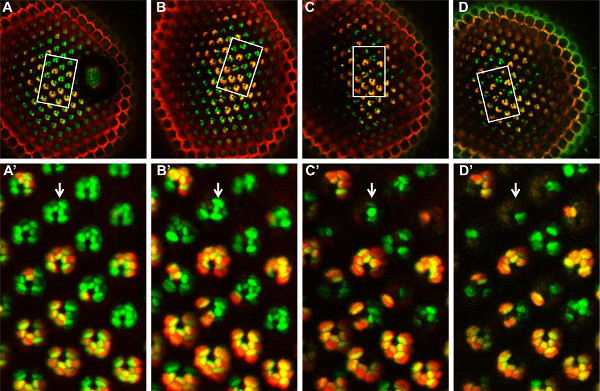
Figure 6. Analyse temps-cours de FATP mosaïque [k10307] PR mutantes avec la méthode de tomate / GFP-FLP / FRT, plus de 14 jours. A FATP mosaïque [k10307] rétine mutant est observée au jour 1 (A, A '), 4 jours ( B, B '), jour 8 (C, C') et 14 jours (D, D ') après l'éclosion. Le même groupe de PR de mosaïque peut être fond, à chaque point de temps, dans le champ observé (rectangle blanc, A, B, C, D). Dans ce domaine de la PR (A ', B', C ', D'), PR mutantes homozygotes sont marqués en vert, tandis que les PR de type sauvage et hétérozygotes homozygotes sont marqués en jaune. De jour 4 (B ') en avant, les PR mutantes homozygotes commencent à disparaître, ce qui indique que la FATP [k10307] mutation induit une dégénérescence progressive de ces PN. Cliquez ici pour agrandir la figure .
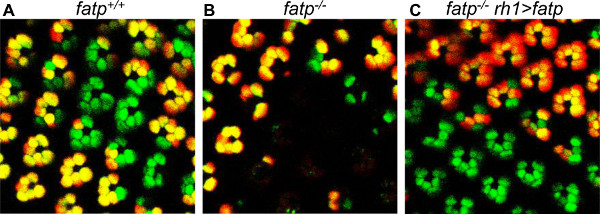
Figure 7. Sauvetage de FATP [k10307] PR mutantes avec un mini-blanc portant FATP exprimant construire. Les PR de mosaïque sont visualisés avec la méthode de tomate / GFP-FLP / FRT en 15 jours d'âge des mouches. (A) Visualisation de contrôle mosaïque PR. (B) Visualization de mosaïque FATP PR mutantes, montrant la perte de PR mutantes. (C) Visualisation de la mosaïque FATP PR mutantes dans une mouche Par réécriture FATP dans PR extérieure (rh1> FATP). Les PR mutantes sont sauvés. La présence d'un gène mini-white, et la pigmentation des yeux rouges associé à rh1> conditions de FATP ne modifie pas la tomate ou de la fluorescence de la GFP ou de la détection des clones.
Discussion
L'œil de Drosophila a été largement utilisée pour déchiffrer les voies de signalisation régulant le développement, la prolifération et la survie. Au début des années 1990, un grand nombre d'écrans génétiques ont été menées pour identifier les voies nécessaires pendant les phases initiales du développement de PR 25-27. L'efficacité des cribles génétiques a été fortement augmentée par la technique de recombinaison mitotique, ce qui permet de tester des mutations perte de fonction dans les clones de la mosaïque 21. Par conséquent, le rôle des mutations létales embryonnaires pourrait être systématiquement testée dans des clones mutants homozygotes dans les yeux des mouches qui étaient autrement hétérozygote. La plupart des projections de mosaïque ont mis l'accent sur le recrutement de PR précoce, la différenciation, la projection axonale ou la morphogenèse survenant dans le développement des larves ou des pupes 10,25-31. À ce jour, un seul écran mosaïque a étudié les mécanismes de régulation de la fonction de PR adulte, par le suivi de la réponse visuelle via electroretinogramme Enregistrements 32. Avec la méthode de tomate / GFP-FLP / FRT et la possibilité d'effectuer une analyse en fonction du temps dans la vie des animaux mutants, nous avons conçu une nouvelle méthode pour identifier les facteurs de régulation adulte PR viabilité et fonctionner 20,24.
La méthode de tomate / GFP-FLP / FRT présente plusieurs avantages importants sur le sectionnement histologique classique de yeux de résine intégré. Tout d'abord, cette méthode est beaucoup plus rapide, moins cher et plus facile à réaliser que la méthode histologique, à condition que d'un microscope à fluorescence équipé d'un objectif à immersion appropriée est disponible (voir le tableau des réactifs et de l'équipement). Deuxièmement, la méthode de tomate / GFP-FLP / FRT peut être utilisé en conjonction avec l'expression du transgène, tel que l'expression de P (UAS, w +), la réalisation d'une mini-white transgène. Contrairement aux coupes histologiques, dans laquelle w + est utilisé pour la détection des clones, dans le système de tomate / GFP-FLP / FRT, P (SAMU, w +) n'interfère pas avec d clonaleétection sur la base de tomate protéine fluorescente. Utilisation P (UAS-FATP, w +) des mouches transgéniques, nous avons pu visualiser la rescousse de PR mutantes FATP (figure 7). Troisièmement, un piège clé de tous les types d'analyse clonale, y compris celle fondée sur la tomate / GFP-FLP / FRT, est l'ambiguïté du génotype de PR perdus. En effet, il peut être difficile de déterminer si un PR est absent en raison de l'absence d'une fonction spécifique du gène ou en raison d'un effet non autonome cellulaire, en particulier à la frontière du clone mutant. La méthode de tomate / GFP-FLP / FRT contourne ce problème de la dégénérescence en permettant de suivre de type sauvage et mutant PR chez le même animal sur des périodes de plusieurs semaines. Nous avons pu suivre le sort des PN individuelles par cinétique des analyses sur différents FATP mouches mutantes (Figure 6). Le même clone peut être reconnue dans un animal donné à des moments différents, en raison de la forme précise des clones de type sauvage environnantes. Nous avons pu montrer sans ambiguïtément que tous les PR étaient manquantes mutant pour FATP, ce qui indique que le rôle de mutants FATP dans PN est cellule-autonome. Ainsi, en contrôlant la perte de PN dans une analyse cinétique, il est possible de déterminer le génotype de PN dans les modèles de la dégénérescence âge adulte. Enfin, la méthode de tomate / GFP-FLP / FRT s'est avéré très puissant pour l'identification des facteurs régissant la création de PCP 20. La possibilité de marquer un grand nombre de ommatidia mosaïque pour un phénotype de polarité sans la nécessité pour les sections, facilite la détermination rapide de la condition de relations publiques pour la mise en place de la PCP. Néanmoins, l'analyse plus fine de l'intégrité de la PR, il faudrait découpe traditionnelle suivie par contraste de phase ou microscopies électroniques.
En conclusion, la méthode de tomate / GFP-FLP / FRT ouvre de nouvelles possibilités pour le dépistage mosaïque efficace pour identifier les facteurs qui régulent les processus de développement et de relations publiques des fonctions de relations publiques des adultes, tels que la visréponse manuel et la viabilité.
Déclarations de divulgation
Les auteurs ont rien à révéler.
Remerciements
PLATIM et Droso-Outils installations de la UMS3444 Biosciences, Lyon, France. La recherche de BM a été soutenue par des subventions de la Fondation pour la Recherche Médicale du CNRS (ATIP) et l'ANR-12-BSV1-0019-01. PD a été soutenue par Retina France association et de l'Ecole Normale Supérieure de Lyon (France). CL a été soutenue par la Ligue Nationale contre le Cancer association.
matériels
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Agarose | Euromedex | D5-E | Regular agarose is used to immobilize the flies |
| Petri dish | BD Falcon | 353001 | 35 x 10 mm, 1.37 x 0.39 inch |
| Cold-ice water | To maintain the flies anesthetized | ||
| Equipment | |||
| Dissecting microscope | Dutcher | SMZ645 | |
| Water Bath | Julabo | 9550102 | To keep the agarose solution at warm temperature |
| 40X Water objective | Zeiss | 420967-9900-000 | Water dipping objective for the confocal microscope |
Références
- Hardie, R. C. Sensory physiology 5. Ottoson, D. 5, 1-79 (1985).
- Wolff, T., Ready, D. F. Cell death in normal and rough eye mutants of Drosophila. Development. 113, 825-839 (1991).
- Rister, J., Desplan, C. The retinal mosaics of opsin expression in invertebrates and vertebrates. Dev Neurobiol. 71, 1212-1226 (2011).
- Halder, G., Callaerts, P., Gehring, W. J. Induction of ectopic eyes by targeted expression of the eyeless gene in Drosophila. Science. 267, 1788-1792 (1995).
- Mollereau, B., Domingos, P. M. Photoreceptor differentiation in Drosophila: from immature neurons to functional photoreceptors. Dev Dyn. 232, 585-592 (2005).
- Mollereau, B. Cell death: what can we learn from flies? Editorial for the special review issue on Drosophila apoptosis. Apoptosis. 14, 929-934 (2009).
- Charlton-Perkins, M., Brown, N. L., Cook, T. A. The lens in focus: a comparison of lens development in Drosophila and vertebrates. Mol Genet Genomics. 286, 189-213 (2011).
- Jenny, A. Planar cell polarity signaling in the Drosophila eye. Curr Top Dev Biol. 93, 189-227 (2010).
- Montell, C. Drosophila visual transduction. Trends Neurosci. 35, 356-363 (2012).
- Chen, J., et al. Discovery-based science education: functional genomic dissection in Drosophila by undergraduate researchers. PLoS Biol. 3, e59(2005).
- Tomlinson, A., Ready, D. F. Neuronal differentiation in the Drosophila ommatidium. Dev Biol. 120, 366-376 (1987).
- Mendes, C. S., et al. ER stress protects from retinal degeneration. Embo J. 28, 1296-1307 (2009).
- Jenny, A. Preparation of adult Drosophila eyes for thin sectioning and microscopic analysis. J Vis Exp. , (2011).
- Mollereau, B., et al. Two-step process for photoreceptor formation in Drosophila. Nature. 412, 911-913 (2001).
- Domingos, P. M., et al. Spalt transcription factors are required for R3/R4 specification and establishment of planar cell polarity in the Drosophila eye. Development. 131, 5695-5702 (2004).
- Mendes, C. S., et al. Cytochrome c-d regulates developmental apoptosis in the Drosophila retina. EMBO Rep. 7, 933-939 (2006).
- Domingos, P. M., et al. Regulation of R7 and R8 differentiation by the spalt genes. Dev Biol. 273, 121-133 (2004).
- Mollereau, B., et al. A green fluorescent protein enhancer trap screen in Drosophila photoreceptor cells. Mech Dev. 93, 151-160 (2000).
- Pichaud, F., Desplan, C. A new visualization approach for identifying mutations that affect differentiation and organization of the Drosophila ommatidia. Development. 128, 815-826 (2001).
- Gambis, A., Dourlen, P., Steller, H., Mollereau, B. Two-color in vivo imaging of photoreceptor apoptosis and development in Drosophila. Dev Biol. 351, 128-134 (2011).
- Golic, K. G. Site-specific recombination between homologous chromosomes in Drosophila. Science. 252, 958-961 (1991).
- Porter, J. A., Hicks, J. L., Williams, D. S., Montell, C. Differential localizations of and requirements for the two Drosophila ninaC kinase/myosins in photoreceptor cells. J Cell Biol. 116, 683-693 (1992).
- Johnson, K., Grawe, F., Grzeschik, N., Knust, E. Drosophila crumbs is required to inhibit light-induced photoreceptor degeneration. Curr Biol. 12, 1675-1680 (2002).
- Dourlen, P., et al. Drosophila fatty acid transport protein regulates rhodopsin-1 metabolism and is required for photoreceptor neuron survival. PLoS Genet. 8, e1002833(2012).
- Mlodzik, M., Hiromi, Y., Weber, U., Goodman, C. S., Rubin, G. M. The Drosophila seven-up gene, a member of the steroid receptor gene superfamily, controls photoreceptor cell fates. Cell. 60, 211-224 (1990).
- Gaul, U., Chang, H., Choi, T., Karim, F., Rubin, G. M. Identification of ras targets using a genetic approach. Ciba Found Symp. 176, 85-92 (1993).
- Wassarman, D. A., Therrien, M., Rubin, G. M. The Ras signaling pathway in Drosophila. Curr Opin Genet Dev. 5, 44-50 (1995).
- Janody, F., et al. A mosaic genetic screen reveals distinct roles for trithorax and polycomb group genes in Drosophila eye development. Genetics. 166, 187-200 (2004).
- Legent, K., Steinhauer, J., Richard, M., Treisman, J. E. A screen for X-linked mutations affecting Drosophila photoreceptor differentiation identifies Casein kinase 1alpha as an essential negative regulator of wingless signaling. Genetics. 190, 601-616 (2012).
- Newsome, T. P., Asling, B., Dickson, B. J. Analysis of Drosophila photoreceptor axon guidance in eye-specific mosaics. Development. 127, 851-860 (2000).
- Berger, J., et al. Systematic identification of genes that regulate neuronal wiring in the Drosophila visual system. PLoS Genet. 4, e1000085(2008).
- Bayat, V., et al. Mutations in the mitochondrial methionyl-tRNA synthetase cause a neurodegenerative phenotype in flies and a recessive ataxia (ARSAL) in humans. PLoS Biol. 10, e1001288(2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon