Method Article
Томатный / GFP-ФЛП / FRT Метод живых изображений мозаики взрослых
В этой статье
Резюме
Метод Томатный / GFP-ФЛП / FRT включает визуализацию мозаичные клетки фоторецептора в живых дрозофилы. Он может быть использован, чтобы следовать индивидуальные судьбы фоторецепторов клеток в сетчатке в течение нескольких дней или недель. Этот метод идеально подходит для исследований дегенерации сетчатки и нейродегенеративных заболеваний или развития фоторецепторов клеток.
Аннотация
Дрозофилы глаз широко используется как модель для изучения развития и дегенерации нейронов. С мощной техники митотический рекомбинации, элегантные генетические экраны на основе клонального анализа привели к идентификации сигнальных путей, участвующих в развитии глаза и фоторецепторов (PR) дифференциация на личиночной стадии. Мы опишем здесь метод томатный / GFP-FLP / FRT, который может быть использован для быстрого клонального анализа в глазу живых взрослых дрозофилы. Флуоресцентные клетки фоторецепторов изображаются с техникой роговицы нейтрализации, на сетчатке с мозаичными клонов, порождаемых flipase опосредованной рекомбинации. Этот метод имеет несколько основных преимуществ по сравнению с классической гистологического срезов сетчатки: он может быть использован для высокопроизводительного скрининга и оказалась эффективным способ идентификации факторов, регулирующих выживание PR и функции. Он может быть использован для кинетических анализов PR дегенерации в том же гостиной Анимдр. в течение нескольких недель, чтобы продемонстрировать потребность в специфических генов для выживания PR или функции во взрослой мухи. Этот метод также полезен для решения вопросов автономии клеток у мутантов развития, таких, как те, в которых зависит установление плоской полярности клеток.
Введение
Drosophila сетчатка состоит из около 800 омматидий единиц (рис. 1А), которые точно организованных, с четко определенной оси полярности (рис. 1В). Каждый блок содержит 20 клетки: восемь клетки фоторецепторов (ССБ) и 12 вспомогательных клеток, в том числе колбочек, пигментных клеток и щетины ячеек 1,2. Два класса PR отличаются на основе типа родопсина (Rh) они выражают. Шесть внешние ОР (R1-6) выражать RH1 и расположены в трапеции шаблон (рисунок 1С). В центре трапеции, две внутренние ОР (R7/R8) выразить четыре возможные типы родопсина (RH3, RH4, RH5 или Rh6) и организованы таким образом, что R7 лежит на верхней части R8 3.
Более 2500 гены вовлечены в морфогенезе Drosophila глаз 4, которая оказалась очень мощную модель для изучения широкого панели процессов, в том числе глаз развитию, PR вербовка, дифференциация, плоская клеточной полярности, морфогенез, выживание, апоптоз и визуальный трансдукции 5-9.
Исследователи, работающие на глаз дрозофилы есть, на протяжении многих лет, разработка методов визуализации сетчатки и проведения систематических генетические экраны. Самый простой способ изображения взрослый сетчатка смотреть на роговице в иммобилизованной животного (рис. 1А). Структура роговицы могут быть визуализированы именно сканирующей электронной микроскопии и был использован в генетическом скрининге крупномасштабного по URCFG консорциума ( http://www.bruinfly.ucla.edu ) 10. Это очень эффективный подход для визуализации глобальных морфологические изменения в роговицы структуры, такие как шероховатость глаз или блеска, часто вызванные мутациями в генах, контролирующих первые шаги в развитии или жизнеспособности клеток. Тем не менее, глобальная визуализация роговицы не суfficient, чтобы определить факторы, регулирующие PR рабдомера морфогенез или взрослого PR жизнеспособность и функцию. Такой анализ требует более тщательного расследования целостности PR, основанный на фазово-контрастной микроскопии касательных полу-тонких полимерных участков сетчатки 11-13. Этот метод подходит для мозаичных анализов, в которых мутантные ОР могут быть идентифицированы по их отсутствия красного пигмента 14,15.
Мозаика мутантные клоны также могут быть визуализированы в целом монтажа Препарируя куколки или взрослой сетчатке, на основании их отсутствия зеленого флуоресцентного белка (GFP) сигнала на флуоресцентной микроскопии 16,17. Эти две технологии очень полезны, но оба труда и времени и, следовательно, не подходит для крупномасштабного скрининга. Мы и другие разработали использование методов роговицы нейтрализации для визуализации ОР производящих флуоресцентные белки 18,19, для облегчения быстрого PR анализов. С помощью этой техники, мутантаклоны могут быть идентифицированы на основе флуоресценции красного (W +) пигмента в мозаичных взрослых Drosophila клонов. Однако этот способ не обеспечивает решение одной клетки необходимы для решения автономию клеток выдает 19. Мы преодолели эту проблему, разработав метод Томатный / GFP-ФЛП / FRT, которая сочетает в визуализации флуоресцентных белков по роговицы нейтрализации митотической рекомбинации 20. Этот метод позволяет с высокой пропускной способностью, быстро и точно идентифицировать мутантных ОР в мозаичных клонов, с разрешением одноклеточных ( http://www.ens-lyon.fr/LBMC/ApoDrosoDatabase/ ). Это подходит для использования в кинетических анализов, для следующих отдельных ОР в течение недели в живых дрозофилы. Мы описываем здесь метод Томатный / GFP-ФЛП / FRT и советы для его использования в простых, кинетических анализов мозаичных глазами.
протокол
1. Пересечение с Томатный / GFP-ФЛП / FRT Lines
Поколение мух, несущих мутантный клон требует одного нечто среднее между FRT-несущий мутантной линии и соответствующие томатный / GFP-FLP / FRT летать линии.
Эта работа использовал коллекцию BruinFly из FRT-рекомбинированных мутаций ( http://www.bruinfly.ucla.edu ). Четыре Томатный / GFP-ФЛП / FRT линии могут быть использованы, неся FRT Rh1-tdtomatoninaC на каждом оружия 2-го и 3-го хромосом в сочетании с источником flipase (эй-ФЛП) и экспрессии GFP во всех внешних ОР (Rh1-Gal4 БАС -GFP) 20:
- 2L рука: строка # 43345, Р {ры [+ t7.2] = RH1-GAL4} 1, Р {ры [+ t7.2] = EY-FLP.N} 2, ж [*], р {ш [+ MC] = ninaE-tdTomato-ninaC} 2L P {ры [+ t7.2] = neoFRT} 40A, P {W [+ MC] = UAS-GFP-ninaC} 3
- 2R рука: строка # 43346, Р {ры [+ t7.2] = RH1-GAL4} 1, Р {ры [+ t7.2] = EY-FLP.N} 2, ж [*], р {ры [+ t7.2] = neoFRT} 42D P{Ш [+ MC] = ninaE-tdTomato-ninaC} 2R, P {W [+ MC] = UAS-GFP-ninaC} 3
- 3L рука: строка # 43347, Р {ры [+ t7.2] = RH1-GAL4} 1, Р {ры [+ t7.2] = EY-FLP.N} 2, ж [*], р {ш [+ MC] = UAS-GFP-ninaC} 2, P {W [+ MC] = ninaE-tdTomato-ninaC} 3L P {ры [+ t7.2] = neoFRT} 80B/TM6B, Tb [1]
- 3R рука: строка # 43348, Р {ры [+ t7.2] = RH1-GAL4} 1, Р {ры [+ t7.2] = EY-FLP.N} 2, ж [*], р {ш [+ MC] = UAS-GFP-ninaC} 2, P {ры [+ t7.2] = neoFRT} 82B P {W [+ MC] = ninaE-tdTomato-ninaC} 3R/TM6B, Tb [1]
Эти четыре строки доступны на фондовом центре Блумингтон дрозофилы. Они предоставили источник ФЛП в развивающемся глазу для генерации митоза клонов 21. Дикого типа хромосома несет последовательность FRT и RH1-tdTomato ninaC конструкцией, кодирующей красный флуоресцентный tdTomato белка, в качестве маркера для дикого типа и гетерозиготных внешних ОР. В этой конструкции, последние 41 аминокислот P174 изоформы ninaC (ни инактивации ни активации C) ген был арзатрачиваемая в рамке на С-конце последовательности tdTomato. С-концевой хвост изоформы p174 ninaC отвечает за rhabdomeral локализации белка 22 и позволяет лучше живой визуализации красных флуоресцентных ОР с использованием техники роговица нейтрализации. RH1 промоутер является минимальным 234 б.п. (-152 +82) RH1 промоутер. Зеленый флуоресцентный маркер GFP выражается всех внешних ОР, в связи с наличием RH1-Gal4 (3kb промотора) и UAS-GFP ninaC конструкций. Кресты между мухой складе, несущего мутацию х на хромосоме FRT (FRT-х) и линий Томатный / GFP-ФЛП / FRT дает потомство со следующим генотипа (например, мутации на 2L): RH1-Gal4, эй-ФЛП ; FRT40A, RH1-tdTomato ninaC / FRT40A-х; UAS-GFP ninaC. В этих мух, гомозиготных мутантных клеток генерируются митотической рекомбинации в развивающихся глаз диска и разделить для создания клона гомозиготных мутантных ОР (рис. 2A). Гомикzygous мутантные клетки могут быть идентифицированы, поскольку они выражают только зеленый флуоресцентный белок (GFP), в то время как окружающие дикого типа и гетерозиготные клетки выразить как tdTomato и GFP (Цифры 2B и B ").
2. Подготовка дрозофилы для фоторецепторов визуализации
Для заменяемого визуализации с помощью метода роговицы нейтрализации, обездвижить мух на геле пластин.
- Подготовьте мыть бутылку с 4 ° C дистиллированной водой и поместите его на льду.
- Растворить регулярного агарозы в воде (1,2-1,5% агарозном в 100 мл воды) нагреванием в микроволновой печи. Колбу помещают на водяную баню при 55 ° С и позволить раствор агарозы остыть до этой температуры. Хранить агарозы при 55 ° С до использования.
- Обезболить мух CO 2 в течение не менее 1 мин.
- Налейте теплую агарозном решение (при 55 ° С) в чашку Петри (35 х 10 мм, 1,37 х 0,39 в) и поместите немедленноленно наркозом дрозофилы на агарозы. Для начинающих, начиная с 10 мух в чашки Петри является разумным. Bigger чашку Петри (60 х 15 мм, 2,362 х 0,59), также могут быть использованы.
- Под микроскопом рассекает, ориентировать дрозофилы на боку с пинцетом, нажмите одно крыло в агарозы, таким образом, что крыло и половина тела кроются в агарозы (3А-3А ""). Палка другое крыло на поверхность агарозы. Примечание: Если мухи не внедряются достаточно глубоко в агарозы, муха будет свободно двигать головой во время съемки в PR, и это приведет к нечетких изображений. Ориентация глаза также будет нарушена. Это может быть трудно погрузить в Drosophila агарозы, или из-за концентрации агарозы или ее температуры. Легче вставлять мух в более концентрированном агарозы, но если агарозы слишком сосредоточены, муха может тонуть. Если агарозы слишком круто, это может быть диfficult вставлять муху, но слишком высокая температура может повредить роговицу.
- Поместите чашку Петри на льду и позволить агарозном затвердеть.
- С щипцов, ориентировать голову таким образом, что один глаз подвергается воздействию иммерсионного объектива (рис. 3А »и 3A" "). Как правило, глаз может считаться хорошо ориентированных под микроскопом рассекает когда pseudopupil (представленных в виде черного пятна) находится в середине глаза. Оптимальным глаза максимизирует ширину омматидий области, в которой ОР сосредоточены. Цель этапа ориентации, чтобы найти область глаза с самым широким области сосредоточены ОР, как правило, в центре глаза. Этот шаг также полезна для удаления любых ноги или aristae покрывающую глаз и предотвращения его визуализацию.
- Накройте муху с ледяной водой и не оставляют чашки Петри на льду до визуализации. Ледяной воды держит мух наркозом.
3. ВизуализацияФоторецепторы под микроскопом
Для визуализации ОР через роговицу, этот протокол использует прямой микроскоп, оснащенный водяной объективом с большим рабочим расстоянием (W N-Achroplan 40X/0.75).
- Поместите чашку Петри, покрытую ледяной воде на предметное стекло на столик микроскопа (рис. 3 до н.э.). Чашку Петри может быть приклеен к стеклу, что делает возможным, чтобы переместить его о гладко с помощью винтов микрометра.
- Окунитесь погружение цели в воду чашки Петри (рис. 3B'-3C "). Расположите головку лету под пучком возбуждения (начать с GFP фильтра, например). Переместить сцену вверх и вниз, пока луч не сходится на глаз. Когда глаз находится на должном уровне, это как правило, отражает свет возбуждения.
- Посмотрите в окуляр для флуоресценции. Когда глаз находится в центре поля зрения, фокус нижероговицы визуализировать люминесцентные фоторецепторы.
Примечание 1: Если взглянуть в окуляр, это может быть непросто отличить части тела лету, в частности дистальной части брюшной полости и головы, например. В таких случаях, вы должны смотреть прямо на сцену, чтобы изменить положение дрозофилы.
Примечание 2: могут быть использованы Классическая флуоресценции или конфокальной микроскопии. Конфокальной микроскопии дает изображения с меньшим фоном и более широкой области сфокусированных ОР чем классической микроскопии. Пример настройки является LSM510 конфокальной микроскопии (Zeiss) с водой Объектив 40х. Лучшие результаты могут быть получены путем открытия точечным отверстием конфокальной микроскопии шире, чем обычно рекомендуется для цели. Например, используйте значение 204, а не по умолчанию 98 для апертуры обскуры.
Примечание 3: Более высокие уровни W + пигментации глаз уменьшить фоновой флуоресценции.
4. Время-Конечно Визуализация клетки фоторецепторов
Уход необходим при следующих судьбу отдельного PR в том же глаз в течение определенного периода времени.
- Снизить температуру агарозы до 45 ° С, чтобы максимизировать Drosophila выживание. Агарозном затвердевает очень быстро при этой температуре. Только один дрозофилы следует использовать в чашке Петри, чтобы гарантировать, что мухи не перепутали во время наблюдений.
- Систематическое положение мух на той же стороне, для просмотра того же глаза. Это может быть достигнуто путем принятия анестезированных муху от его флакона одним крылом и размещение дрозофилы на агарозе. Всегда ориентироваться в глаза так же, если это возможно, что позволяет легко найти PR клонов, которые были просматривают раньше.
- Определить клонов на основе их формы под конфокальной микроскопии. Поле зрения часто находится рядом с клоном интерес. В суCH случаи, глаз должен быть переориентированы под водой, в центр поля зрения на клон интерес, на основе полярности глаза (рис. 4).
5. Восстановление Мухи после визуализации
- Удаление воды из чашки Петри.
- Осторожно потяните дрозофилы из агарозы с щипцами.
- Высушите дрозофилы на ткани.
- Верните дрозофилы во флакон, гарантируя, что он не застрять в еде. Разрешено муха опомниться при 25 ° С
Результаты
Метод Томатный / GFP-ФЛП / FRT могут быть использованы для изучения влияния мутации или внематочной выражения на развитие и выживание реципиентов в сетчатке Drosophila. Это быстро, что делает его идеальным для целей скрининга, как недавно продемонстрировали 20. Наличие мутантных ОР рядом с ОР дикого типа в том же глаз позволяет легко выявлять дефекты, связанные с мутантных ОР и для решения вопроса об автономии клеток.
Дефекты развития, наблюдаемые в нашем анализе влияние различных процессов, в том числе набора PR, морфогенеза и планарной клеточной полярности (РСР) создание (рис. 5). Семь заочно требуется для PR вербовки, особенно для R7 одного внутреннего PR. Потеря Seven заочно приводит к утрате внутренней PR и некоторых внешних ОР (рис. 5А). Зернистая голова (GRH) участвует в PCP создания и некоторые омматидии являются инвerted в GRH мутантных клонов (рис. 5б). Этот метод позволяет выявить мутантные ОР в мозаичной омматидиев, облегчая идентификацию ОР, в котором ген, необходимых для правильного приобретения PCP. Мы показали, что GRH требуется для правильного приобретения PCP в R3 прекурсоров 20. Действительно, мы наблюдали, что в перевернутом омматидиев, R4, который происходит аномально из предшественника R3, всегда мутант. Крошки (ЦРБ) является верхушечный мембранный белок необходим для рабдомера морфогенеза 23. Потеря ЦРБ в ЦРБ 11A22 мутантных приводит к неправильной, больших или меньших ОР (рис. 5, в).
Этот метод также может быть использован для проследить судьбу отдельных ОР во взрослом возрасте (рис. 6). Это идеальное место для нейродегенерацию исследований, потому что группа гомозиготных мутантных ОР можно просматривать и та же группа может быть найден в том же глазже летать над период дней или недель. Таким образом, можно определить, какие ОР выжить и которые обречены на смерть, потому что каждый клон имеет уникальную форму, которая может быть признана, когда глаз находится под флуоресцентным микроскопом. Как сетчатка поляризован, можно ориентировать на сетчатку, чтобы найти один и тот же клон снова, на основе его формы. Мы использовали этот метод, чтобы показать, что fatp k10307 мутация вызывает прогрессирующей дегенерации PR в зрелом возрасте (рис. 6, 24). Этот метод визуализации могут быть также использованы для анализа автономию клеток. В fatp k10307 мозаики сетчатки, потеря PR был ограничен fatp мутантные ОР, ОР дикого типа не поддаваясь влиянию. Требование fatp для PR жизнеспособности Поэтому клеток автономными. Мы также смогли спасти fatp мутантный PR по reexpressing дикого типа fatp с водителем RH1-Gal4 и UAS-fatp конструкции (рис. 7).возможность проведения таких экспериментов спасательные является одним из преимуществ способа томатный / GFP-FLP / FRT над клонального анализа, основанного на гистологических срезах смолы встраиваемый сетчатки. Действительно, клональная обнаружения с помощью метода Томатный / GFP-ФЛП / FRT не зависит от использования P (UAS, W +) трансгенные конструкции, в то время как красный пигментация связана с мини-белого гена (Ж +) охватывает глаз с красного пигмента , маскируя мозаичные клоны в гистологических срезах.
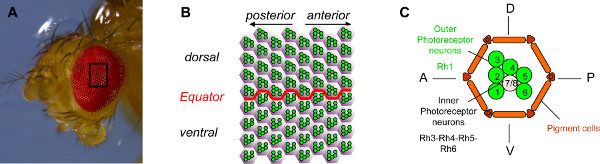
Рисунок 1. Организация глаза дрозофилы. (A) фотографию глаз Drosophila полученный с помощью стереомикроскопа. Drosophila глаз состоит примерно из 800 омматидиев. (B) схематическое изображение области 64 омматидиев в середине глаза. Шесть внешний фоторецепторов нейронов (PRS) каждого омматидия,показаны зеленым, организованы в стереотипных трапеции, которая указывает на ближайших полюсов глаза. Следовательно Они указывают в противоположных направлениях в брюшной и спинной части глаза и зеркальное отражение в соответствии с границы между двумя частями, которое называется экватор. (С) Принципиальная схема омматидия. Каждый омматидий содержит восемь ОР. ОР R1-R6, показаны зеленым, являются внешние ОР. Они выражают rhodopsin1 светочувствительный молекулы (Rh1) и являются эквивалентом млекопитающих палочек. Внутренние PR, R7 и R8, показаны серым (R7 находится в верхней части R8). Внутренние ОР выразить родопсина 3, 4, 5 или 6 и эквивалент млекопитающих колбочек. Для простоты, только рабдомер, светочувствительный часть PR, показана для каждой PR. Нажмите здесь, чтобы увеличить рисунок .
Рисунок 2. Создание и визуализации мозаичные PR клонов в глаза дрозофилы с методом Томатный / GFP-ФЛП / FRT. (А) схема генерации мозаичных клонов в методе Томатный / GFP-ФЛП / FRT. Мозаика клоны генерируются митотической рекомбинации, в связи с выражением flipase (под контролем безглазую промоутер) во время развития глаз и последовательностей FRT. После рекомбинации последовательности FRT и деление клеток, гомозиготных мутантов, гомозиготных мышей дикого типа и гетерозиготных клеток могут быть получены из гетерозиготной клетки. Эти клетки снова делятся, чтобы сформировать мозаичные клоны ОР в взрослого глаза. Идентификация мутантных клеток способствует вставки конструкцию, выражающую красный флуоресцентный tdTomato белка в дикого типа хромосоме, маркировать дикого типа и гетерозиготных клеток. (В-В'') Визуализация мозаичных PR клонов с тМетод, который он Томатный / GFP-ФЛП / FRT. Метод Томатный / GFP-ФЛП / FRT сочетает митотической рекомбинации, роговицы нейтрализации и конфокальной микроскопии. Все ОР выразить зеленый флуоресцентный GFP белка, которые облегчают визуализацию ОР с использованием роговицы нейтрализации и конфокальной микроскопии (B). ОР могут быть визуализированы на уровне одноклеточного. Мутантные клоны мозаики генерируются митотической рекомбинации и могут быть идентифицированы по отсутствию красного флуоресцентного белка tdTomato (В '). Следовательно, на присоединяемых изображений, гомозиготные ОР появляются в зеленый, в то время как дикого типа и гетерозиготные ОР желтый (Б''). Нажмите здесь, чтобы увеличить рисунок .
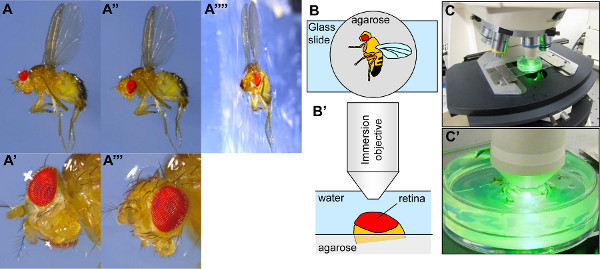
Рисунок 3. Настройка дрозофилы для visualizatиона роговицы нейтрализации. (-А'''') Фотографии с дрозофилы иммобилизованные на тарелку, наполненную агарозы. В панели А'''', кусок агарозы, содержащий муху была сокращена взять профиль фотографию. Drosophila наполовину встроен в агарозы, с правым крылом в агарозы и левое крыло застряли на агарозном поверхности (A, A'',''''). Когда дрозофилы встроен в агарозы, его голова часто плохо подходит для визуализации глаза (А, А '). Таким образом, головка должна быть переориентирована щипцами таким образом, что средний глаза направлена вверх ('','' '). (B-B') показана схема, представляющая Drosophila иммобилизованный на агарозном пластиной и позиционирования дрозофилы под объектив микроскопа. (С-С ') Фотографии от настройки дрозофилы на стадиимикроскоп под своей цели. Нажмите здесь, чтобы увеличить рисунок .
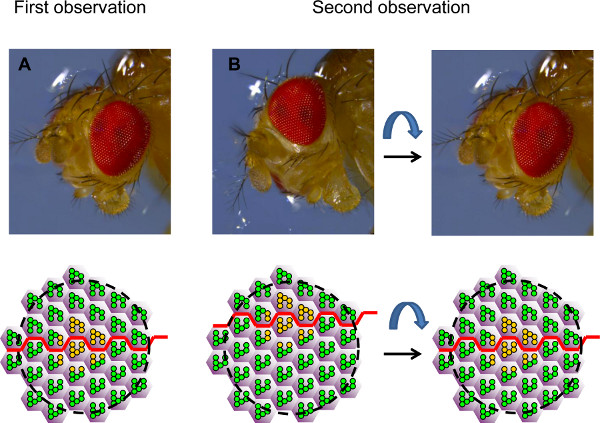
Рисунок 4. Ориентация глаза для анализа временных курса. На рисунке показаны фотографии голове дрозофилы в двух разных ориентаций и соответствующих полях омматидиев просмотренных роговицы нейтрализации, представленных в виде принципиальных схем. (А) В течение первого наблюдения, глаз помещается таким образом, что клон ОР гетерозиготных или дикого типа (желтым цветом) рассматривается в середине поля, на уровне экватора (красная линия). (Б) Во время второго наблюдения, глаз часто не точно одинаковую ориентацию. Таким образом, та же группа ОР можно найти снова, но это не возможно, чтобы посмотретьточно такой же поле (слева). Глаз должен быть переориентирован на том же поле, чтобы рассматриваться снова. Положение экватора могут быть использованы в качестве ориентира. В этом примере мы знаем, что наблюдаемое поле слишком брюшной и что поэтому глаз должен быть включен вентрально на место экватор в середине наблюдаемой области снова, как и в первом наблюдения.
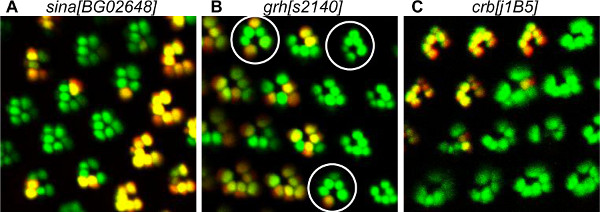
Рисунок 5. Примеры дефектов развития PR обнаруженных методом Томатный / GFP-ФЛП / FRT. (А) Визуализация мозаичных Сина [BG02648] мутантных ОР, показывая потерю внутренних ОР. В мутантного омматидиев, внешние ОР сгруппированы вместе в связи с отсутствием внутреннего PR R7. Действительно, сина, как известно, необходим для внутреннего набора PR. (В) Визуализация мозаики GRH [s2140] мутантные ОР показывающие полярности дефекты. Мозаика мутант омматидии, SURRСкругленные кругом, указывают в противоположном направлении от дикого типа омматидиев, что указывает на спинно-вентральной инверсии. Детальное изучение с помощью метода Томатный / GFP-ФЛП / FRT показали, что GRH требовалось в предшественнике R3 для правильного приобретения омматидия полярности 20. (С) Визуализация мозаичных CRB [j1B5] мутантных ОР, показывая деформированные гомозиготных мутантных ОР. Crb, как известно, необходим для рабдомера формообразования.
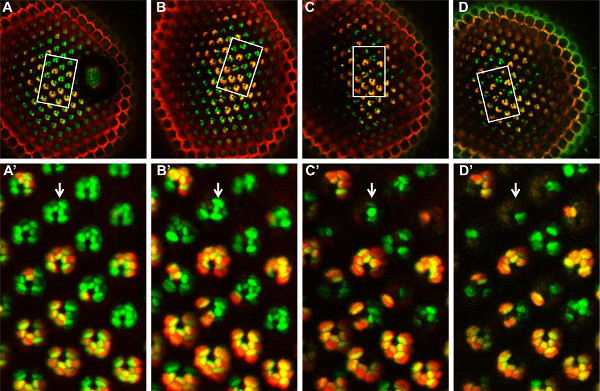
Рисунок 6. Время-Конечно анализ мозаики fatp [k10307] мутантные ОР с методом Томатный / GFP-ФЛП / FRT, в течение 14 дней. Мозаика fatp [k10307] мутант сетчатки наблюдается в 1 день (а, а '), 4 день ( В, В '), день 8 (С, С) и 14 дней (D, D') после вылупления. Та же группа мозаичных ОР может быть осног в каждой временной точке, в наблюдаемой области (белый прямоугольник, A, B, C, D). В этом поле ОР (А ', В', С ', D'), гомозиготные мутантные ОР помечены зеленым цветом, тогда как гетерозиготные и гомозиготные ОР дикого типа помечены желтым цветом. С самого первого дня 4 (B ') и далее, гомозиготные мутантные ОР начинают исчезать, указывая, что fatp [k10307] мутация вызывает прогрессирующей дегенерации этих ОР. Нажмите здесь, чтобы увеличить рисунок .
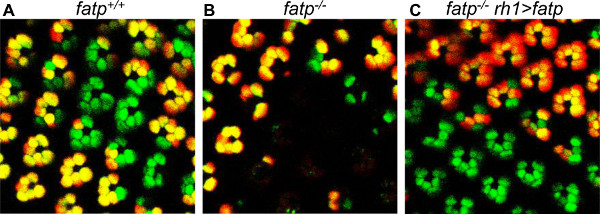
Рисунок 7. Спасательные из fatp [k10307] мутантные ОР с мини-бело-проведение fatp-выражения построить. Мозаичные ОР визуализируются с помощью метода Томатный / GFP-ФЛП / FRT в 15-дневных мух. (A) Визуализация мозаики контроля ОР. (B) Вisualization мозаичных fatp мутантных ОР, показывая потерю мутантных ОР. (С) Визуализация мозаики fatp мутантные ОР в лету reexpressing fatp в космическом PR (RH1> fatp). Мутант ОР спасены. Наличие гена мини-белого и связанного с красной пигментации глаз в RH1> условия fatp не изменяет Помидор или GFP флуоресценции или клональную обнаружения.
Обсуждение
Дрозофилы глаз широко используется расшифровать сигнальные пути, регулирующие разработку, распространение и выживание. В начале 1990-х, большое количество генетических экранов проводились для выявления путей, необходимых на начальных этапах развития PR 25-27. Эффективность генетических экранов было значительно увеличился на митотического техники рекомбинации, что позволяет протестировать с потерей функции мутации в мозаичных клонов 21. Таким образом, роль эмбриональных летальных мутаций может быть систематически протестированы в гомозиготных мутантных клонов в глазах мух, которые в противном случае гетерозиготным. Большинство мозаичные показы были сосредоточены на ранней набора PR, дифференциации аксонов проекции или формообразования, происходящих в развивающихся личинок или куколок 10,25-31. На сегодняшний день только один мозаика экран исследовал механизмы, регулирующие функцию взрослых PR, путем мониторинга визуальный ответ через electroretinОГР А ММЫ записи 32. С помощью метода Томатный / GFP-ФЛП / FRT и возможность проведения анализа время курса в живых мутантов животных, мы разработали новый метод выявления факторов, регулирующих взрослых PR жизнеспособность и функционировать 20,24.
Метод Томатный / GFP-ФЛП / FRT имеет несколько основных преимуществ по сравнению с классической гистологического срезов смоляных встраиваемый глазами. Во-первых, этот метод гораздо быстрее, дешевле и легче выполнять, чем гистологического метода, при условии, что флуоресцентный микроскоп оснащен соответствующим воды погружения цели доступно (см. таблицу реагентов и оборудования). Во-вторых, метод томатный / GFP-FLP / FRT может быть использован в сочетании с экспрессии трансгена, такой как выражение P (БАС, W +), проведение мини-белый трансген. В отличие от гистологических срезов, в которых W + используется для клонального обнаружения, в системе Томатный / GFP-ФЛП / FRT, P (БАС, W +) не мешает клонального гetection на основе помидоров флуоресцентного белка. Использование P (БАС-fatp, W +) трансгенных мух, мы были в состоянии представить себе спасение fatp мутантных ОР (рис. 7). В-третьих, одним из ключевых ловушка всех видов клонального анализа, включая, что на основе помидоров / GFP-ФЛП / FRT, является неоднозначность генотипа утраченных ОР. Действительно, это может быть неясно, является ли PR отсутствует из-за отсутствия определенной функции гена или из-за клеточной неавтономной эффект, особенно на границе мутантного клона. Метод Томатный / GFP-ФЛП / FRT обходит эту проблему для дегенерации, делая возможным следовать дикого типа и мутантных ОР в том же животного в течение периода от нескольких недель. Мы смогли проследить судьбу отдельных ОР кинетическими анализирует на разных fatp мутантных мух (рис. 6). То же клон может быть признано в данной животного в разное время, в связи с точной форму окружающих клонов дикого типа. Мы смогли показать однозначнойлы, что все недостающие ОР были мутантные по fatp, указывая, что роль fatp мутантов в ОР клеточноподобно автономными. Таким образом, путем мониторинга потерю ОР в кинетического анализа, можно определить генотип ССБ в моделях взрослом возрасте дегенерации. Наконец, метод Томатный / GFP-ФЛП / FRT оказалось очень мощным для идентификации факторов, регулирующих создание PCP 20. Возможность забил большое количество мозаики омматидиев для фенотипа полярности без необходимости секций, облегчает быстрое определение требованием PR для установления PCP. Тем не менее, тонкий анализ целостности PR потребует традиционный секционирования затем поэтапного отличие или электронных микроскопии.
В заключение, метод Томатный / GFP-ФЛП / FRT открывает новые возможности для эффективного мозаики скрининга для выявления факторов, регулирующих PR процессы развития и взрослых PR функции, такие как по отношениюответ UAL и жизнеспособность.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
PLATIM и Droso-Tools средства на UMS3444 Biosciences, Лионе, Франция. Исследования BM была поддержана грантами от Fondation Pour La Recherche Medicale из CNRS (ATIP) и ANR-12-BSV1-0019-01. PD поддержали Retina Франции ассоциации и Высшей нормальной школе в Лионе (Франция). CL поддержали La Ligue Nationale Контр ле рака ассоциации.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Agarose | Euromedex | D5-E | Regular agarose is used to immobilize the flies |
| Petri dish | BD Falcon | 353001 | 35 x 10 mm, 1.37 x 0.39 inch |
| Cold-ice water | To maintain the flies anesthetized | ||
| Equipment | |||
| Dissecting microscope | Dutcher | SMZ645 | |
| Water Bath | Julabo | 9550102 | To keep the agarose solution at warm temperature |
| 40X Water objective | Zeiss | 420967-9900-000 | Water dipping objective for the confocal microscope |
Ссылки
- Hardie, R. C., Ottoson, D. . Sensory physiology 5. 5, 1-79 (1985).
- Wolff, T., Ready, D. F. Cell death in normal and rough eye mutants of Drosophila. Development. 113, 825-839 (1991).
- Rister, J., Desplan, C. The retinal mosaics of opsin expression in invertebrates and vertebrates. Dev Neurobiol. 71, 1212-1226 (2011).
- Halder, G., Callaerts, P., Gehring, W. J. Induction of ectopic eyes by targeted expression of the eyeless gene in Drosophila. Science. 267, 1788-1792 (1995).
- Mollereau, B., Domingos, P. M. Photoreceptor differentiation in Drosophila: from immature neurons to functional photoreceptors. Dev Dyn. 232, 585-592 (2005).
- Mollereau, B. Cell death: what can we learn from flies? Editorial for the special review issue on Drosophila apoptosis. Apoptosis. 14, 929-934 (2009).
- Charlton-Perkins, M., Brown, N. L., Cook, T. A. The lens in focus: a comparison of lens development in Drosophila and vertebrates. Mol Genet Genomics. 286, 189-213 (2011).
- Jenny, A. Planar cell polarity signaling in the Drosophila eye. Curr Top Dev Biol. 93, 189-227 (2010).
- Montell, C. Drosophila visual transduction. Trends Neurosci. 35, 356-363 (2012).
- Chen, J., et al. Discovery-based science education: functional genomic dissection in Drosophila by undergraduate researchers. PLoS Biol. 3, e59 (2005).
- Tomlinson, A., Ready, D. F. Neuronal differentiation in the Drosophila ommatidium. Dev Biol. 120, 366-376 (1987).
- Mendes, C. S., et al. ER stress protects from retinal degeneration. Embo J. 28, 1296-1307 (2009).
- Jenny, A. Preparation of adult Drosophila eyes for thin sectioning and microscopic analysis. J Vis Exp. , (2011).
- Mollereau, B., et al. Two-step process for photoreceptor formation in Drosophila. Nature. 412, 911-913 (2001).
- Domingos, P. M., et al. Spalt transcription factors are required for R3/R4 specification and establishment of planar cell polarity in the Drosophila eye. Development. 131, 5695-5702 (2004).
- Mendes, C. S., et al. Cytochrome c-d regulates developmental apoptosis in the Drosophila retina. EMBO Rep. 7, 933-939 (2006).
- Domingos, P. M., et al. Regulation of R7 and R8 differentiation by the spalt genes. Dev Biol. 273, 121-133 (2004).
- Mollereau, B., et al. A green fluorescent protein enhancer trap screen in Drosophila photoreceptor cells. Mech Dev. 93, 151-160 (2000).
- Pichaud, F., Desplan, C. A new visualization approach for identifying mutations that affect differentiation and organization of the Drosophila ommatidia. Development. 128, 815-826 (2001).
- Gambis, A., Dourlen, P., Steller, H., Mollereau, B. Two-color in vivo imaging of photoreceptor apoptosis and development in Drosophila. Dev Biol. 351, 128-134 (2011).
- Golic, K. G. Site-specific recombination between homologous chromosomes in Drosophila. Science. 252, 958-961 (1991).
- Porter, J. A., Hicks, J. L., Williams, D. S., Montell, C. Differential localizations of and requirements for the two Drosophila ninaC kinase/myosins in photoreceptor cells. J Cell Biol. 116, 683-693 (1992).
- Johnson, K., Grawe, F., Grzeschik, N., Knust, E. Drosophila crumbs is required to inhibit light-induced photoreceptor degeneration. Curr Biol. 12, 1675-1680 (2002).
- Dourlen, P., et al. Drosophila fatty acid transport protein regulates rhodopsin-1 metabolism and is required for photoreceptor neuron survival. PLoS Genet. 8, e1002833 (2012).
- Mlodzik, M., Hiromi, Y., Weber, U., Goodman, C. S., Rubin, G. M. The Drosophila seven-up gene, a member of the steroid receptor gene superfamily, controls photoreceptor cell fates. Cell. 60, 211-224 (1990).
- Gaul, U., Chang, H., Choi, T., Karim, F., Rubin, G. M. Identification of ras targets using a genetic approach. Ciba Found Symp. 176, 85-92 (1993).
- Wassarman, D. A., Therrien, M., Rubin, G. M. The Ras signaling pathway in Drosophila. Curr Opin Genet Dev. 5, 44-50 (1995).
- Janody, F., et al. A mosaic genetic screen reveals distinct roles for trithorax and polycomb group genes in Drosophila eye development. Genetics. 166, 187-200 (2004).
- Legent, K., Steinhauer, J., Richard, M., Treisman, J. E. A screen for X-linked mutations affecting Drosophila photoreceptor differentiation identifies Casein kinase 1alpha as an essential negative regulator of wingless signaling. Genetics. 190, 601-616 (2012).
- Newsome, T. P., Asling, B., Dickson, B. J. Analysis of Drosophila photoreceptor axon guidance in eye-specific mosaics. Development. 127, 851-860 (2000).
- Berger, J., et al. Systematic identification of genes that regulate neuronal wiring in the Drosophila visual system. PLoS Genet. 4, e1000085 (2008).
- Bayat, V., et al. Mutations in the mitochondrial methionyl-tRNA synthetase cause a neurodegenerative phenotype in flies and a recessive ataxia (ARSAL) in humans. PLoS Biol. 10, e1001288 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены