Method Article
モザイク大人のライブイメージングのためのトマト/ GFP-FLP / FRT方法
要約
トマト/ GFP-FLP / FRT法は、ショウジョウバエの生活にモザイク視細胞を可視化することを含む。これは、数日または数週間の網膜における光受容体の個々の細胞の運命を追跡するために使用することができる。この方法は、網膜変性および神経変性疾患または光受容細胞の発生の研究に最適です。
要約
ショウジョウバエの眼は、開発し、神経変性の研究のためのモデルとして広く使用されている。強力な有糸分裂組換え技術により、クローンの分析に基づいて、優雅な遺伝子スクリーニングは、幼虫期における眼の発達と感光体(PR)の分化に関与するシグナル伝達経路の同定につながっている。ここでは生体成体ショウジョウバエの眼における急速なクローンの分析のために使用することができるトマト/ GFP-FLP / FRT法を記載している。蛍光光受容細胞はflipase媒介組換えによって生成されたモザイククローンを網膜上で、角膜中和法で撮像する。この方法は、網膜の古典的な組織学的切片上のいくつかの主要な利点を有する:それはハイスループットスクリーニングのために使用することができ、PRの生存および機能を調節する因子を同定するための有効な方法を証明している。なお、同一の生体アニムにPR変性の動態分析のために使用することができるら、数週間にわたって、大人のハエにおける広報生存または機能のための特定の遺伝子のための要件を実証すること。この方法はまた、このような平面細胞極性の確立が影響しているもののような発達の変異体において、細胞自律性の問題に対処するために有用である。
概要
ショウジョウバエの網膜は、極性の明確に定義された軸( 図1B)と正確に編成されている約800個眼単位( 図1A)、から構成されている。 8光受容細胞(PRS)と錐体細胞、色素細胞や毛細胞1,2を含む12アクセサリー細胞、各ユニットは20セルが含まれています。 PRの2つのクラスは、それらが発現するロドプシン(Rhの)のタイプに基づいて区別される。 6外側のPR(R1-6)体Rh1を発現し、台形パターン( 図1C)に配置されている。台形の中央に、2の内側のPR(R7/R8)は、ロドプシンの4つの可能なタイプ(RH3、RH4、RH5またはRH6)を発現し、R7はR8の3の上に位置するように編成されています。
2,500以上の遺伝子が目のDEVE含むプロセスのワイドパネルの研究のための非常に強力なモデルを証明しているショウジョウバエの眼4の形態形成に関与しているlopment、広報採用、分化、平面内細胞極性、形態形成、生存、アポトーシスおよび視覚伝達5-9。
ショウジョウバエの眼に取り組んで研究者たちは、何年にもわたって、網膜を画像化し、体系的な遺伝子スクリーニングを実施するための技術を開発した。イメージする最も簡単な方法は、大人の網膜は、固定化された動物( 図1A)で角膜を見ることです。角膜の構造は電子顕微鏡を走査することによって正確に可視化することができるとURCFGコンソーシアム(によって大規模遺伝子スクリーニングに使用したhttp://www.bruinfly.ucla.edu )10。これは、多くの場合、開発や細胞生存率の初期段階を制御する遺伝子の変異により誘導されたような目の粗さや光沢などの角膜構造の世界的な形態学的変化を、可視化するための非常に有効なアプローチである。しかし、角膜の世界的な可視化は、SUはありません広報感桿分体の形態形成や成人のPR生存率および機能を調節する因子を同定するfficient。このような分析は、網膜11から13の接線半薄い樹脂切片の位相差顕微鏡に基づいた広報の整合性をより徹底的な調査を必要とする。この技術は、変異体のPRに赤色顔料14,15の欠如により同定することができるモザイクの分析に適している。
モザイク変異体クローンはまた、蛍光顕微鏡16,17上に緑色蛍光タンパク質(GFP)信号の欠如に基づいて、蛹または成体網膜の全載解剖で可視化することができる。これら2つの技術が非常に有用であるが、どちらも労力と時間がかかり、したがって、大規模なスクリーニングには適していない。我々は、他の迅速なPR分析を容易にするために、蛍光タンパク質を産生18,19のPRのイメージングのための角膜中和技術の使用を開発した。この技術では、変異体クローンは、モザイク成体ショウジョウバエクローンにおける顔料(+ w)の赤色の自己蛍光に基づいて同定することができる。しかし、この方法は、細胞自律性に対処するために必要な単一細胞の解像度が19を発行提供しない。私たちは、有糸分裂組換え20と角膜中和による蛍光タンパク質のイメージングを組み合わせたトマト/ GFP-FLP / FRT法を開発することにより、この問題を克服した。この方法は、単細胞解像度(で、高スループット、モザイククローンにおける突然変異のPRの迅速かつ正確な同定を可能にするhttp://www.ens-lyon.fr/LBMC/ApoDrosoDatabase/ )。これは、 ショウジョウバエ生体内週間の期間にわたって個々のPRを以下のために、動力学的分析において使用するのに適している。私たちは、モザイクの目の簡単な運動の分析での使用のためにここトマト/ GFP-FLP / FRT方法とヒントを説明します。
プロトコル
1。トマト/ GFP-FLP / FRTラインと交差
変異体クローンを運ぶハエの発生はFRT-運ぶ変異体のラインとそれに対応するトマト/ GFP-FLP / FRTとの間に単一のクロスが必要な行を飛ぶ。
この作品は、FRT組換え変異のBruinFlyコレクション(利用http://www.bruinfly.ucla.eduを )。四トマト/ GFP-FLP / FRTラインは(体Rh1-GAL4 UASすべて外側のPRにflipaseのソース(EY-FLP)とGFPの発現と組み合わせ、各第二の腕と3染色体上のFRT体Rh1-tdtomatoninaCを運んで、使用することができます-GFP)20:
- 2Lアーム:ライン#43345、P {RYの[+ t7.2] = RH1-GAL4} 1、P {RYの[+ t7.2] = EY-FLP.N} 2、W [*]、P {W [+ mCの] = ninaE-tdTomato-ninaC} 2L P {RYの[+ t7.2] = neoFRT} 40A、P {W [+ mCの] = UAS-GFP-ninaC} 3
- 2Rアーム:ライン#43346、P {RYの[+ t7.2] = RH1-GAL4} 1、P {RYの[+ t7.2] = EY-FLP.N} 2、[*] W、P {RY [+のt7.2] = neoFRT} 42D P{W [+ mCの] = ninaE-tdTomato-ninaC} 2R、P {W [+ mCの] = UAS-GFP-ninaC} 3
- 3Lアーム:ライン#43347、P {RYの[+ t7.2] = RH1-GAL4} 1、P {RYの[+ t7.2] = EY-FLP.N} 2、W [*]、P {W [+ mCの] = UAS-GFP-ninaC} 2、P {W [+ mCの] = ninaE-tdTomato-ninaC} 3L P {RYの[+ t7.2] = neoFRT} 80B/TM6B、Tbの[1]
- 3Rアーム:ライン#43348、P {RYの[+ t7.2] = RH1-GAL4} 1、P {RYの[+ t7.2] = EY-FLP.N} 2、W [*]、P {W [+ mCの] = UAS-GFP-ninaC} 2、P {RYの[+ t7.2] [+ mCの] = ninaE-tdTomato-ninaC} 3R/TM6B、TbのW = neoFRT} 82B、P {[1]
これらの4行は、ブルーミントンショウジョウバエストックセンターでご利用いただけます。彼らは、有糸分裂クローン21の生成のために開発し、目にFLPの原因を提供した。野生型染色体はFRT配列を運び、RH1-tdTomato ninaCは、野生型およびヘテロ接合外側PRのためのマーカーとして赤色蛍光タンパク質tdTomatoをコードする構築物。この構築では、ninaC(いずれも不活性化や活性化C)遺伝子のP174アイソフォームの最後の41個のアミノ酸は、APだったインフレームtdTomato配列のC末端に保留。 P174のninaCアイソフォームのC末端テールは、タンパク質22のrhabdomeralローカライズを担当し、角膜の中和技術を用いた赤色蛍光のPRのよりよい生活の可視化を可能にします。 RH1プロモーターは、最小限の234塩基対(-152 +82)RH1プロモーターである。緑色蛍光マーカーGFPは原因RH1-GAL4(3キロバイトプロモーター)とUAS-GFP ninaC構築物の存在のために、すべての外側のPRで表される。 FRT染色体(FRT-X)に突然変異xとトマト/ GFP-FLP / FRTラインを運ぶフライ株の間の交配では、次の遺伝子型(2L上の変異の一例)との子孫が得られます。RH1-GAL4、EY-FLP ; FRT40A、RH1-tdTomato ninaC / FRT40A-X; UAS-GFP ninaC。これらのハエでは、ホモ接合変異体の細胞をホモ接合変異のPR( 図2A)のクローンを生成するために、開発の目のディスクと分裂に分裂組換えによって生成されます。ホモ周囲の野生型およびヘテロ接合性細胞は、tdTomatoとGFP( 図2BおよびB ")の両方を発現するのに対し、これらは、唯一の緑色蛍光タンパク質(GFP)を発現するためzygous突然変異細胞を同定することができる。
2。感光体可視化のためのショウジョウバエの準備
角膜中和法によるPRの可視化のために、アガロースプレート上にハエを固定化。
- 4℃の蒸留水で満たされた洗浄ボトルを用意し、氷の上に置きます。
- 電子レンジで加熱することにより、水中での正規アガロース(水100ミリリットル中に1.2から1.5パーセントアガロース)を溶解。 55℃の水浴中にフラスコを置き、アガロース溶液をこの温度まで冷却する。使用するまで55℃でアガロースを保管してください。
- 少なくとも1分間、CO 2とのハエを麻酔。
- ペトリ皿(35×10ミリメートル、1.37 X 0.39)に(55℃)温かいアガロース溶液を注ぎ、直ちにを配置アガロース上に麻酔をかけたショウジョウバエを ately。初心者のための、ペトリ皿当たり10ハエで始まることは合理的である。大きなペトリ皿(60×15mmのはx 0.59で2.362)を用いることもできる。
- 解剖顕微鏡下で、ピンセットで横にショウジョウバエの向きをアガロースに1羽を押して、本体の翼と半数をアガロース( 図3A-3A "")内に埋め込 まれているようにする。アガロースの表面に他の翼を貼り付けます。注:ハエをアガロース中に十分深く埋め込まれていない場合は、ハエがPRの撮像中に頭を自由に移動することになり、これは、ファジィ画像になります。眼の向きも妨害されるであろう。それは、アガロースの濃度またはその温度のいずれかに、アガロースにショウジョウバエを突入することが困難な場合がある。それは、より高濃度のアガロースでハエを埋め込むことが簡単ですが、アガロースがあまりにも集中すると、ハエが沈むことがあります。アガロースがあまりにもクールであれば、それはディかもしれハエを埋め込むことfficultが、温度が高すぎると、角膜を損傷する恐れがあります。
- 氷の上でペトリ皿に入れ、アガロースを固化することができます。
- 鉗子で、片目が液浸対物レンズに露出されるように、ヘッド( 図3A 'および3Aを"")配向。一般に、眼は、(黒いスポットとして可視)pseudopupilが眼の中央にある場合だけでなく、解剖顕微鏡下で配向していると考えてもよい。目の最適な向きは、PRのがフォーカスされている個眼フィールドの幅を最大化します。配向工程の目的は、通常、目の中心に、焦点を当てたのPRの最も広い分野で目の領域を見つけることである。このステップは、任意の足を除去するためか、目をカバーし、その可視化を防止aristaの複数形にも便利です。
- 氷のように冷たい水でハエをカバーし、可視化するまで氷上にペトリ皿のままにしておきます。氷のように冷たい水を麻酔ハエを保持します。
3。可視化顕微鏡下での光受容体
角膜を通してのPRを可視化するために、このプロトコルは、長作動距離(W N-Achroplan 40X/0.75)と水の目標を装備した正立顕微鏡を使用しています。
- 顕微鏡( 図3、BC)のステージ上をスライドガラス上の氷のように冷たい水で覆われたペトリ皿を置きます。ペトリ皿により、マイクロメータネジで約円滑に移動すること、スライドガラスに接着することができる。
- ペトリ皿( 図3B'-3C ')の水に浸対物プランジ。 (例えば、GFPフィルターで始まる)励起ビームの下でハエの頭の位置を決めます。ビームが目の上に収束するまで上下にステージを移動します。眼が適切なレベルである場合には、励起光を反射する傾向がある。
- 蛍光用接眼レンズに目を通す。眼が視野の中心に位置しているときには、下方に集中する蛍光光受容体を可視化する角膜。
注1:接眼レンズを通して見るとき、それは、例えば、ハエの身体部分、特に腹部の遠位部と頭部を区別する不安であってもよい。このようなケースでは、 ショウジョウバエの位置を変更するための段階を直接見なければならない。
注2:古典的な蛍光または共焦点顕微鏡を使用することができる。共焦点顕微鏡は、古典的な顕微鏡よりも少ない背景と集中のPRのより広い視野の画像を提供します。たとえばセットアップが40Xの水を目的としたLSM510共焦点顕微鏡(Zeiss)である。良い結果は通常、客観的に推奨されているよりも広い共焦点顕微鏡のピンホールを開くことによって得ることができる。例えば、むしろ、ピンホールの開口部のデフォルト98よりも、204の値を使用します。
注3:W +アイの色素沈着より高いレベルのバックグラウンド蛍光を軽減。
4。視細胞の経時可視化
一定の期間にわたって同じ眼内の個々のPRの運命を、以下の場合には注意が必要です。
- ショウジョウバエの生存率を最大化するために、45℃にアガロースの温度を下げる。アガロースは、この温度で非常に迅速に固化する。唯一の1 ショウジョウバエはハエが観測中に混ざっていないことを保証するために、ペトリ皿ごとに使用する必要があります。
- 体系的に同じ眼の表示のため、同じ側にハエを配置。これはつの翼によってそのバイアルから麻酔したハエをとり、アガロース上にショウジョウバエを配置することによって達成することができる。可能な場合は常に、それが簡単に以前に視聴されたPRのクローンを発見すること、同じように目を向けます。
- 共焦点顕微鏡下でその形状に基づいてクローンを同定する。視野は多くの場合、関心のあるクローンの隣に位置しています。 SU中chのケースは、眼は、眼の極性( 図4)に基づいて、関心対象のクローン上の視野の中心を、水中で再配向されるべきである。
5。可視化した後のリカバリハエ
- ペトリ皿から水を除去する。
- 優しく鉗子でアガロースからショウジョウバエを引き出します。
- 組織上でショウジョウバエを乾かします。
- それは食べ物にはまり込むしないことを保証し、バイアルにショウジョウバエを返します。ハエは25℃でのラウンドにさせ
結果
トマト/ GFP-FLP / FRT方法は、突然変異又はショウジョウバエ網膜内のPRの発達および生存における異所性発現の効果を研究するために使用することができる。最近では20を示されているように、スクリーニングの目的に最適です、迅速である。同じ目における野生型PRSは隣の変異体のPRの存在が、変異のPRに関連した欠陥を検出するために、細胞の自律性の問題に対処することが容易になります。
我々の分析で観察された発達障害は、PRの募集、形態形成および平面内細胞極性(PCP)の確立( 図5)を含む、様々なプロセスに影響を与えた。 欠席セブン特に内側のPRのR7 1のために、PRの募集に必要です。インナーPRの損失および一部外側のPR( 図5A)での不在の結果セブンの損失。 粒子の粗いヘッド(GRH)は 、PCPの確立に関与しているといくつかの個眼はINVですGRH変異体クローン( 図5B)にerted。この方法は、遺伝子が正しいPCPの取得のために必要とされるのPRの識別を容易にする、モザイク個眼における変異体のPRを識別することが可能となる。我々は、GRHは、R3の前駆体20中のPCPを正しく取得するために必要であることを示している。確かに、我々は反転個眼では、R3の前駆体から異常に起因するR4は、常にミュータントだったことを観察した。パン粉(CRBSは)感桿分体の形態形成に必要な23頂端膜タンパク質である。不規則な、大きくても小さくてのPR( 図5C)でのCRBS 11A22ミュータント結果CRBSの損失。
この方法はまた、成人期( 図6)の間に単一のPRの運命を追跡するために使用することができる。ホモ接合変異体のPRのグループを見ることができ、同じグループが同じ目に記載されていますので、神経変性の研究に最適です数日から数週間の期間にわたって同じフライ。各クローンは、眼を蛍光顕微鏡の下に配置されたときに認識することができるユニークな形状を有しているので、死ぬ運命にある生き残るがどのPRを決定することが可能である。網膜が偏光されるように、その形状に基づいて、再度同じクローンを見つけるために、網膜を配向することができる。私たちは、FATP k10307変異が成人期における進行性のPR変性( 図6、24) を誘導することを示すために、このメソッドを使用していました。この視覚化の方法はまた、細胞自律性を分析するために使用することができる。 FATP k10307モザイク網膜では、PRの損失は、野生型のPRが影響を受けない、変異体のPRをFATPに限定されていた。広報生存にFATPの要件は、細胞自律的である。またRH1-GAL4ドライバーとUAS-FATP構築物( 図7)と野生型FATPを reexpressingによってFATP変異体のPRを救出することができました。ザ·例えば、レスキュー実験を実施する可能性は、樹脂包埋網膜の組織切片に基づいて、クローン解析を超えるトマト/ GFP-FLP / FRT方法の利点の一つである。 (+ W)ミニ白遺伝子に関連する赤い色素沈着が赤色顔料で目を覆っているのに対し、実際のところ、トマト/ GFP-FLP / FRT法によるクローンの検出は、P(UAS、W +)トランスジェニック構築物の使用に影響されない、組織切片にモザイククローンをマスキング。
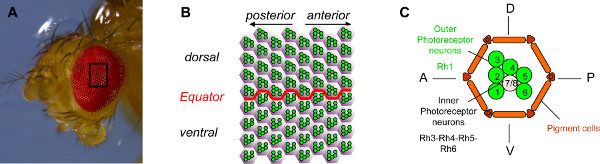
図1。 ショウジョウバエの眼の組織。 (A)実体顕微鏡で撮影したショウジョウバエの眼の写真。 ショウジョウバエの眼は、約800個眼で構成されている。(B)は 、目の途中で64個眼の視野の模式図。各個眼の6外側の光受容ニューロン(PRS)、緑色で示され、目の最も近い極を指すステレオタイプ台形に整理されています。それらは、結果的に赤道と呼ばれる二つの部分間の境界に記載の鏡像を腹側と背側の眼の部分に反対方向に指している。個眼の(C)模式図。それぞれ個眼は8のPRが含まれています。緑色で示したR6のPRのR1は、外側のPRである。これらは、感光性分子rhodopsin1(体Rh1)を発現し、哺乳類の桿体細胞に相当します。インナーのPR、R7およびR8は、(R7はR8の上に座って)グレーで表示されています。内側のPRはロドプシン3、4、5または6を発現し、哺乳類の錐体細胞と同等である。簡単にするために、唯一感桿分体、PRの感光部分は、それぞれのPRのために示されている。 大きな画像を見るにはここをクリックしてください 。

図2。生成とトマト/ GFP-FLP / FRT法でショウジョウバエの眼にモザイクPRクローンを可視化する。トマト/ GFP-FLP / FRT方法におけるモザイククローンの発生の(A)概略図。モザイクのクローンが原因の目の開発とFRT配列の間に(アイレスプロモーターの制御下)flipaseの発現に、有糸分裂組換えによって生成されます。 FRT配列および細胞分裂の組換え後に、ホモ接合変異体、ホモ接合性野生型およびヘテロ接合性細胞は、ヘテロ接合性細胞から生成することができる。これらの細胞は、大人の目の中のPRのモザイクのクローンを形成するために、再び分割します。変異細胞の同定は、野生型およびヘテロ接合性の細胞を標識するために、野生型の染色体に赤色蛍光タンパク質tdTomatoを発現する構築物を挿入することによって促進される。(B-B'')のtモザイクPRクローンの可視化彼トマト/ GFP-FLP / FRT方法。トマト/ GFP-FLP / FRT法が有糸分裂組換え、角膜中和し、共焦点顕微鏡を組み合わせたものです。すべてのPRは、角膜中和し、共焦点顕微鏡(B)を用いてのPRの可視化を容易にする緑色蛍光タンパク質GFPを発現する。 PRは、単一細胞レベルで可視化することができる。変異体モザイククローンは、有糸分裂組換えによって生成され、赤色蛍光タンパク質tdTomato(B ')の不存在によって同定することができる。野生型およびヘテロ接合のPRが(B'')を黄色であるのに対し、その結果、マージされた画像に、ホモ接合PRSは、緑色で表示されます。 大きな画像を見るにはここをクリックしてください 。
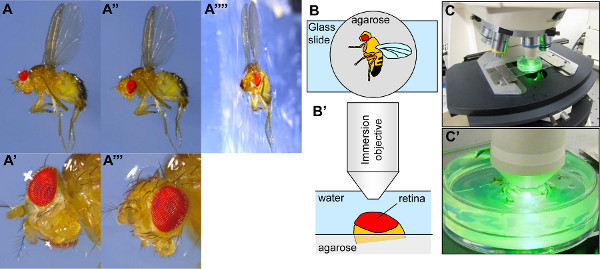
図3。 visualizatためのショウジョウバエの設定角膜中和によるイオン。アガロースで満たされたプレート上に固定化されたショウジョウバエの(-A'''')写真。パネルA''''では、ハエを含むアガロース片は、プロファイルの写真を取るためにカットされています。 ショウジョウバエは、アガロース内右翼、アガロース表面に付着した左翼(A、A''、'''')で、アガロース中に半埋め込 まれています。 ショウジョウバエアガロースに埋め込 まれている場合、その頭部は、しばしば不十分な眼(A、A ')を可視化するために配置される。ヘッドは、したがって、アイの中央には、(A''、A'' ')上を向いているようにピンセットでreorientatedされなければならない。(B-B') ショウジョウバエを示す模式図では、アガロースプレートの位置に固定化された顕微鏡の対物の下でショウジョウバエを舞台に、ショウジョウバエの設定。(C-C ')写真その目的の下に顕微鏡。 大きな画像を見るにはここをクリックしてください 。
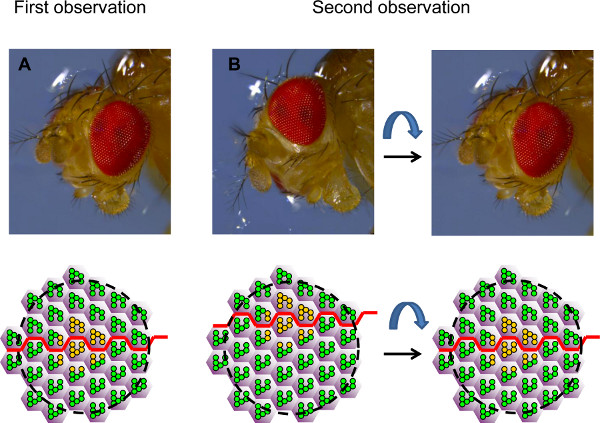
図4。経時的分析のための目の向き。図は概略図として表現角膜中和して表示2の異なる向きと個眼の対応するフィールド、 ショウジョウバエの頭部の写真を示す。最初の観察中に、(A)、目が配置されているこのような(黄色)またはヘテロ接合性野生型のPRのクローンは赤道(赤線)のレベルで、フィールドの中央に見られること。(B)第2の観察の間、眼は正確ではないことが多い同じ向き。このように、PRの同じグループを再び見つけることができますが、それは表示することはできません(左の)正確に同じフィールド。目が再び表示できるように、同じフィールドの再配向する必要があります。赤道の位置をガイドとして使用することができる。この例では、観測されたフィールドがあまりにも腹で、目がそのため最初の観測のように、再び観察フィールドの中央に赤道を配置するために腹側にオンにする必要がありますことを知っている。
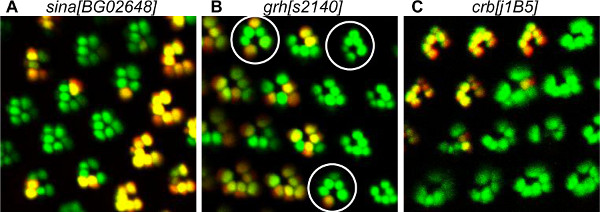
図5。トマト/ GFP-FLP / FRT法により検出されたPRを現像欠陥の例。 (A)内部のPRの損失を示すモザイクシーナ[BG02648]変異型のPRの可視化、。ミュータント個眼では、外側のPRは、内側のPR R7が存在しないために一緒にクラスタ化される。実際、シナ内側PRの動員に必要であることが知られている。モザイクGRHの(B)の可視化[S2140]極性欠損を示す変異体のPR。モザイクミュータント個眼、SURR丸でounded、背腹反転を示す、野生型の個眼から反対方向に向いている。トマト/ GFP-FLP / FRT法による詳細な研究は、GRHは、個眼の極性20の正しい取得のためのR3前駆体に必要とされたことを示した。モザイクCRB [j1B5]変異型のPRS(C)の可視化を、変形したホモ接合変異のPRを示した。 CRBは感桿分体の形態形成に必要であることが知られている。
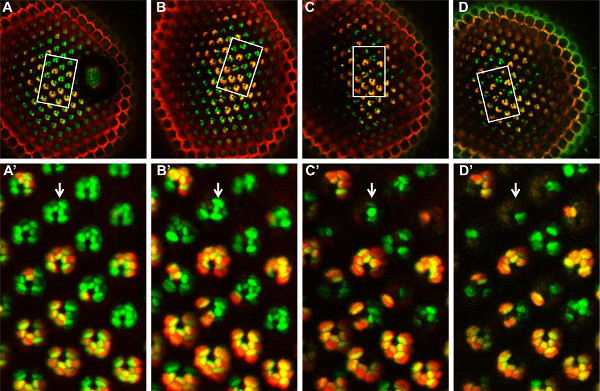
図6。モザイクFATPの時間経過分析は[k10307]トマト/ GFP-FLP / FRT法による変異体のPRは、14日間かけてモザイクFATPは[k10307]変異型網膜は、1日目(A、A ')で観測され、4日目( B、B ')、8日目(C、C')及び孵化後14日目(D、D ')。モザイクのPRの同じグループが財団ことができます各時点でのdは、観察されたフィールド内の(白い長方形、A、B、C、D)。ヘテロ接合およびホモ接合野生型のPRが黄色で標識される一方のPR(A '、B'、C '、D')のこの分野において、ホモ接合変異体のPRは、緑色で標識される。 4日目(B ')以降から、ホモ接合変異PRSはFATPは[k10307]変異は、これらのPRの進行性変性を誘導することを示し、消え始める。 大きな画像を見るにはここをクリックしてください 。
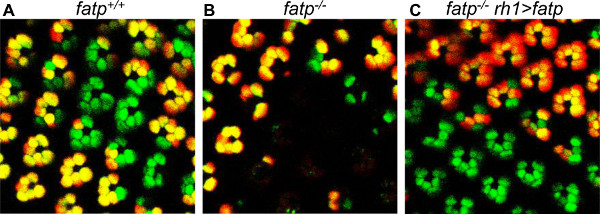
図7。モザイクコントロールのミニホワイト運ぶFATP発現構築。モザイクのPRを15日齢のハエにおけるトマト/ GFP-FLP / FRT方法で可視化されています。(A)の可視化とFATPの救出は、[k10307]変異型のPRのPR。 (B)V変異体のPRの損失モザイク。(C)可視化を示すモザイクFATP変異体のPRのisualization FATP外側のPR(RH1> FATP)フライreexpressing FATPにおける変異のPR。変異型のPRが救出されています。ミニ白遺伝子の存在とRH1> FATP条件の関連する赤目色素沈着がトマトやGFP蛍光またはクローンの検出を変更しません。
ディスカッション
ショウジョウバエの眼が広く発生、増殖および生存を調節するシグナル伝達経路を解読するために使用されている。 1990年代初頭に、遺伝子スクリーニング多数のPR現像25-27の初期段階中に必要な経路を同定するために実施した。遺伝子スクリーニングの効率は、モザイククローン21内の機能喪失変異を試験することができる有糸分裂組換え技術により大幅に増加した。したがって、胚致死突然変異の役割は、体系的にそうでないヘテロ接合ハエの目にはホモ接合変異体のクローンでテストすることができた。ほとんどのモザイクの上映は、早期のPR募集、分化、軸索突起や開発幼虫や蛹10,25-31で発生する形態形成に焦点を当てている。今日まで、唯一のモザイク画面がelectroretinを介して視覚的反応を監視することによって、成体PR機能の調節のメカニズムを調べているogramは32をレコーディング。トマト/ GFP-FLP / FRT方法及び突然変異動物の生体内での時間経過解析を実行する可能性により、我々は成体PRの生存を調節する因子を同定するための新規な方法を設計し20,24として機能している。
トマト/ GFP-FLP / FRT法は樹脂包埋目の古典的な組織学的切片上のいくつかの主要な利点があります。まず、この方法は、はるかに速く安く、組織学的方法より実行しやすい、( 試薬および器具の表を参照)、適切な水浸漬を目的とした蛍光顕微鏡が使用可能であることを条件とする。第二に、トマト/ GFP-FLP / FRT方法は、ミニ白色導入遺伝子を有する、例えば、(+ wはUAS)Pの表現として、導入遺伝子発現と組み合わせて使用することができる。トマト/ GFP-FLP / FRT系、Pでのw +は、クローン検出のために使用される組織切片、とは対照的に(UAS、+ w)はクローンdで干渉しないトマト蛍光タンパク質に基づくetection。 (+ W UAS-FATP)Pを用いてトランスジェニックハエは、FATP変異型のPR( 図7)の救助を視覚化することができました。第三に、トマト/ GFP-FLP / FRTに基づいて、失われたのPRの遺伝子型の曖昧さであることを含めてクローン解析のすべてのタイプのキー落とし穴。確かに、それはPRがあるため、特定の遺伝子の機能の欠如のため、または、特に変異体クローンの境界で細胞非自律的な効果の存在しないかどうかは不明である。トマト/ GFP-FLP / FRTの方法によれば、数週間の期間にわたって同じ動物で、野生型と変異型のPRに従うことによって、変性のために、この問題を回避しています。我々は運動することで、個々のPRの運命を追跡することができました別のFATP変異ハエ( 図6)で分析する。同じクローンが原因周囲の野生型クローンの正確な形状で、異なる時間に与えられた動物において認識することができる。我々は明確な示すことができた不足しているすべてのPRはPRを内FATP変異体の役割は細胞自律的であることを示す、FATPを突然変異体であったことをLY。したがって、速度論的解析におけるPRの損失を監視することによって、それが成人発症変性のモデルでのPRの遺伝子型を決定することが可能である。最後に、トマト/ GFP-FLP / FRT法は、PCP 20の設立を規制する因子の同定のための非常に強力なことが証明された。のセクションを必要とせずに、極性表現型のモザイク個眼多数の得点の可能性は、PCPの確立のためのPRの要求の急速な決定を容易にする。それにもかかわらず、PRの整合性の細かい分析は、位相差電子顕微鏡法に続いて、伝統的な切片が必要となる。
結論として、トマト/ GFP-FLP / FRT法は、VISなどのPR発生過程および成体の広報機能の調節因子を同定するための効率的なモザイクのスクリーニングのための新しい可能性を開きますUAL応答および生存性。
開示事項
著者らは、開示することは何もありません。
謝辞
UMS3444バイオサイエンスのPLATIMとDroso - ツールの施設、リヨン、フランス。 BMの研究は財団からの補助金によって支えられてはCNRS(ATIP)からLAルシェルシュMédicaleを注ぎ、ANR-12-BSV1-0019から01。 PDは網膜フランス協会とリヨン高等師範学校(フランス)によってサポートされていました。 CLはラ·リーグ国立コントルル癌学会によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Agarose | Euromedex | D5-E | Regular agarose is used to immobilize the flies |
| Petri dish | BD Falcon | 353001 | 35 x 10 mm, 1.37 x 0.39 inch |
| Cold-ice water | To maintain the flies anesthetized | ||
| Equipment | |||
| Dissecting microscope | Dutcher | SMZ645 | |
| Water Bath | Julabo | 9550102 | To keep the agarose solution at warm temperature |
| 40X Water objective | Zeiss | 420967-9900-000 | Water dipping objective for the confocal microscope |
参考文献
- Hardie, R. C., Ottoson, D. . Sensory physiology 5. 5, 1-79 (1985).
- Wolff, T., Ready, D. F. Cell death in normal and rough eye mutants of Drosophila. Development. 113, 825-839 (1991).
- Rister, J., Desplan, C. The retinal mosaics of opsin expression in invertebrates and vertebrates. Dev Neurobiol. 71, 1212-1226 (2011).
- Halder, G., Callaerts, P., Gehring, W. J. Induction of ectopic eyes by targeted expression of the eyeless gene in Drosophila. Science. 267, 1788-1792 (1995).
- Mollereau, B., Domingos, P. M. Photoreceptor differentiation in Drosophila: from immature neurons to functional photoreceptors. Dev Dyn. 232, 585-592 (2005).
- Mollereau, B. Cell death: what can we learn from flies? Editorial for the special review issue on Drosophila apoptosis. Apoptosis. 14, 929-934 (2009).
- Charlton-Perkins, M., Brown, N. L., Cook, T. A. The lens in focus: a comparison of lens development in Drosophila and vertebrates. Mol Genet Genomics. 286, 189-213 (2011).
- Jenny, A. Planar cell polarity signaling in the Drosophila eye. Curr Top Dev Biol. 93, 189-227 (2010).
- Montell, C. Drosophila visual transduction. Trends Neurosci. 35, 356-363 (2012).
- Chen, J., et al. Discovery-based science education: functional genomic dissection in Drosophila by undergraduate researchers. PLoS Biol. 3, e59 (2005).
- Tomlinson, A., Ready, D. F. Neuronal differentiation in the Drosophila ommatidium. Dev Biol. 120, 366-376 (1987).
- Mendes, C. S., et al. ER stress protects from retinal degeneration. Embo J. 28, 1296-1307 (2009).
- Jenny, A. Preparation of adult Drosophila eyes for thin sectioning and microscopic analysis. J Vis Exp. , (2011).
- Mollereau, B., et al. Two-step process for photoreceptor formation in Drosophila. Nature. 412, 911-913 (2001).
- Domingos, P. M., et al. Spalt transcription factors are required for R3/R4 specification and establishment of planar cell polarity in the Drosophila eye. Development. 131, 5695-5702 (2004).
- Mendes, C. S., et al. Cytochrome c-d regulates developmental apoptosis in the Drosophila retina. EMBO Rep. 7, 933-939 (2006).
- Domingos, P. M., et al. Regulation of R7 and R8 differentiation by the spalt genes. Dev Biol. 273, 121-133 (2004).
- Mollereau, B., et al. A green fluorescent protein enhancer trap screen in Drosophila photoreceptor cells. Mech Dev. 93, 151-160 (2000).
- Pichaud, F., Desplan, C. A new visualization approach for identifying mutations that affect differentiation and organization of the Drosophila ommatidia. Development. 128, 815-826 (2001).
- Gambis, A., Dourlen, P., Steller, H., Mollereau, B. Two-color in vivo imaging of photoreceptor apoptosis and development in Drosophila. Dev Biol. 351, 128-134 (2011).
- Golic, K. G. Site-specific recombination between homologous chromosomes in Drosophila. Science. 252, 958-961 (1991).
- Porter, J. A., Hicks, J. L., Williams, D. S., Montell, C. Differential localizations of and requirements for the two Drosophila ninaC kinase/myosins in photoreceptor cells. J Cell Biol. 116, 683-693 (1992).
- Johnson, K., Grawe, F., Grzeschik, N., Knust, E. Drosophila crumbs is required to inhibit light-induced photoreceptor degeneration. Curr Biol. 12, 1675-1680 (2002).
- Dourlen, P., et al. Drosophila fatty acid transport protein regulates rhodopsin-1 metabolism and is required for photoreceptor neuron survival. PLoS Genet. 8, e1002833 (2012).
- Mlodzik, M., Hiromi, Y., Weber, U., Goodman, C. S., Rubin, G. M. The Drosophila seven-up gene, a member of the steroid receptor gene superfamily, controls photoreceptor cell fates. Cell. 60, 211-224 (1990).
- Gaul, U., Chang, H., Choi, T., Karim, F., Rubin, G. M. Identification of ras targets using a genetic approach. Ciba Found Symp. 176, 85-92 (1993).
- Wassarman, D. A., Therrien, M., Rubin, G. M. The Ras signaling pathway in Drosophila. Curr Opin Genet Dev. 5, 44-50 (1995).
- Janody, F., et al. A mosaic genetic screen reveals distinct roles for trithorax and polycomb group genes in Drosophila eye development. Genetics. 166, 187-200 (2004).
- Legent, K., Steinhauer, J., Richard, M., Treisman, J. E. A screen for X-linked mutations affecting Drosophila photoreceptor differentiation identifies Casein kinase 1alpha as an essential negative regulator of wingless signaling. Genetics. 190, 601-616 (2012).
- Newsome, T. P., Asling, B., Dickson, B. J. Analysis of Drosophila photoreceptor axon guidance in eye-specific mosaics. Development. 127, 851-860 (2000).
- Berger, J., et al. Systematic identification of genes that regulate neuronal wiring in the Drosophila visual system. PLoS Genet. 4, e1000085 (2008).
- Bayat, V., et al. Mutations in the mitochondrial methionyl-tRNA synthetase cause a neurodegenerative phenotype in flies and a recessive ataxia (ARSAL) in humans. PLoS Biol. 10, e1001288 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved