Method Article
Los centrosomas de imagen en Fly Testículos
En este artículo
Resumen
Obtención de imágenes de las proteínas de Drosophila centrosomales durante la espermatogénesis es un método poderoso para identificar nuevas proteínas críticas para la biología del centrosoma, así como para dilucidar la función particular de los jugadores conocidos en este proceso.
Resumen
Los centrosomas se conservan orgánulos a base de microtúbulos cuya estructura y el cambio de forma espectacular durante todo el ciclo celular y la diferenciación celular de función. Los centrosomas son esenciales para determinar el eje de la división celular durante la mitosis y para nuclear cilios durante la interfase. La identidad de las proteínas que median estos cambios dinámicos sigue siendo sólo parcialmente conocida, y la función de muchas de las proteínas que han sido implicados en estos procesos es todavía rudimentaria. Trabajos recientes han demostrado que la Drosophila espermatogénesis proporciona un sistema eficaz para identificar nuevas proteínas críticas para la función del centrosoma y la formación, así como para comprender mejor la función particular de los jugadores conocidos en los procesos relacionados con el centrosoma. Drosophila es un organismo establecido modelo genético donde los mutantes en los genes centrosomales se pueden obtener fácilmente y analizar fácilmente. Por otra parte, los recientes avances en la sensibilidad y la resolución de la microscopía de luz y ladesarrollo de robustos marcadores centrosomales etiquetados genéticamente han transformado la capacidad de utilizar testículos de Drosophila como un sistema de modelo simple y accesible para estudiar los centrosomas. Este artículo describe el uso de marcadores centrosomal genéticamente etiquetados-para realizar cribados genéticos para los nuevos mutantes centrosomal y para obtener una perspectiva de la función específica de los genes recientemente identificados.
Introducción
Testículos de Drosophila son un sistema de órgano adecuado para estudiar una variedad de procesos celulares y de desarrollo y se han revisado ampliamente en los años 1-9. Este manuscrito se centra en el uso de los testículos de Drosophila para estudiar el centrosoma, un orgánulo celular conservada. Al igual que en otros sistemas, el centrosoma de los testículos función de Drosophila en la mitosis, meiosis, y ciliogenesis 10. Los centrosomas se componen de un par de estructuras a base de microtúbulos conocidos como centriolos rodeados por una red compleja de proteínas que se refiere al material como pericentriolar (PCM). El par de centríolos se compone de un centríolo madre mayor y un centríolo hija menor. A medida que la célula progresa hacia la mitosis, ambos centriolos se separan, por duplicado, y adquirir una gran cantidad de PCM que finalmente forman dos centrosomas distintas. El centrosoma que contiene el centríolo madre original se conoce como el centrosoma madre y el CentrOsome que contiene el centríolo hija original se conoce como el centrosoma hija.
Testículos de Drosophila son ideales para el estudio de las bases moleculares de la biología del centrosoma por microscopía de fluorescencia para una variedad de razones.
- La mayoría de las proteínas de Drosophila que se requieren para la biología del centrosoma en los testículos se conservan entre los eucariotas, lo que sugiere que visión relevante a la biología del centrosoma en los seres humanos y otras especies puede ser adquirida mediante el estudio de la centrosoma en Drosophila testículos 1,11-14.
- Realización de análisis de mutantes en Drosophila proporciona una ventaja significativa ya que, a diferencia de muchos otros modelos, las mutaciones centrosomal en Drosophila no son embriones letal, lo que permite el análisis genético clásico de la función del centrosoma. Esta característica única de Drosophila es debido a la presencia de la contribución maternal que persiste durante las etapas críticas de desarro embrionario. pment 1,11-14. Por lo tanto, se puede a) mutaciones de estudio que eliminan completamente la formación del centrosoma y b) estudiar el destino de un centrosoma normal que se forma en el embrión temprano por la contribución materna en un contexto mutante después de la contribución materna se ha agotado (el principio del método se describe en 11).
- Transgenes funcionales con etiquetas fluorescentes codificadas genéticamente que etiquetan el centrosoma están disponibles. Muchas de estas líneas uso propio promotor de la proteína para conducir la transcripción del transgén con el fin de evitar una fuerte sobreexpresión. Esto es particularmente importante porque la sobreexpresión de proteínas a menudo resulta en artefactos que interfieren con el análisis de la función del centrosoma 1,11.
- El centríolo y centrosoma son excepcionalmente largos a lo largo de Drosophila espermatogénesis, permitiendo de este modo para el análisis rápido y fácil de la centrosoma mediante formación de imágenes.
- Pasos consecutivos en la espermatogénesis y centrosoma biology están organizados cronológicamente a lo largo de los testículos, a partir de la punta testículos con los centrosomas de las células madre de esperma y terminando en la parte inferior de los testículos con una reducción en el tamaño del centrosoma y la actividad en las células espermáticas maduras (Figuras 1 y 2). Esto permite una fácil identificación y el análisis de la función del centrosoma durante las diferentes etapas de desarrollo de los espermatozoides.
- Los testículos son fácilmente disecados de larvas macho, pupas y adultos 27.
- Durante la espermatogénesis, el centrosoma y sus centríolos proceder a través de composición múltiple, estructural y funcional de los estados para que funcionen en la mitosis, meiosis, y la formación de los cilios. Durante estos procesos, los ensambla centrosoma, duplicados, migra, anclajes a partes específicas de la célula, madura, divide y crea un cilio. Además, el centriolo de la espermátide madura da lugar a un precursor centriolar llamado el PCL 1. También en el espermátide maduro, el centrosoma se somete a un proceso de called reducción centrosoma mediante la cual pierde muchos componentes de la PCM y el centriolo (Figuras 1 y 2). Por lo tanto, los estudios en los testículos permiten uno para atender múltiples aspectos de la vida centrosoma como la retención del centrosoma en las células madre, la duplicación centríolo, estabilidad centríolo, elongación centríolo, separación centríolo y la segregación, la contratación PCM, ciliogenesis, formación de PCL, la reducción del centrosoma, y astral nucleación de microtúbulos entre otros.
- Por último, los estudios de la biología del centrosoma son ayudados por las demás características bien conocidas de Drosophila que han hecho un organismo modelo preferido para estudios biológicos. Estos incluyen un tiempo de generación corto, la facilidad de la genética, así como mutagénesis aleatoria y dirigida al sitio.
En conjunto, las características arriba indicadas de Drosophila testículos proporciona un modelo en el que el centrosoma se puede estudiar por imágenes de fácil, rápida y detallada. Las técnicas descritasen este trabajo se han aplicado a investigar muchos aspectos de la biología del centrosoma, incluyendo la formación centríolo 11, duplicación centríolo 15, el reclutamiento PCM 16, regulación centrosoma 17 y ciliogenesis 18. Estas técnicas también se han aplicado para estudiar el centrosoma en otras áreas de la biología, tales como la regulación meiótica 19, conjunto de husillo 20, y la actividad del centrosoma en la división de células madre asimétrica 21 entre muchos otros.
Imágenes de los testículos en los arranques centrosoma con la obtención de las moscas que expresan proteínas centrosomal genéticamente etiquetados y aislar los testículos de larvas macho, pupas o moscas adultas. Estas moscas son disponibles a partir de varios grupos de investigación 1,11,15,22-25. Los testículos contienen larvas de todas las etapas de la espermatogénesis antes de la meiosis y son útiles en el análisis de las mutaciones que son letales en la pupa o adulto. Sin embargo, pupa Tarde o jóvenes adult testículos son las más robustas y contienen todos los pre-y post-meióticas etapas de la espermatogénesis, con lo que serían preferibles para su análisis. Dado que el número de células de esperma disminuye a medida que las edades de la mosca, el uso de los testículos adultos también es apropiado para el estudio de la centrosoma en el contexto del envejecimiento. 26. Un método de aislamiento testículo de moscas adultas se ha descrito previamente 27.
Imágenes de centrosomas y su función en los testículos de Drosophila se puede lograr a través de tres vías relacionadas que se presentan aquí (Figura 3). La selección de la pista que es el más apropiado depende de la naturaleza de la pregunta del investigador está abordando.
Track A implica imágenes de los testículos en vivo. Es el más rápido de los tres temas, pero sólo se puede aplicar cuando las muestras no necesitan ser preservados y no es necesario si la inmunotinción. En la pista A, los testículos están montados (intacta, traspasado o corte) en las diapositivasy cuidadosamente aplastado bajo un cubreobjetos para formar una sola capa de células fácilmente identificables. Las células se visualizaron utilizando tanto microscopía de contraste de fases y microscopía de fluorescencia. El uso de contraste de fase es particularmente importante para el análisis de los testículos de Drosophila porque revela información celular que no es visible con otras formas de iluminación transmitida y por lo tanto permite la identificación rápida de diferentes etapas de desarrollo de los espermatozoides 28,29. Sin embargo, la pista A tiene dos desventajas principales. En primer lugar, la integridad morfológica de las células se compromete a menudo una vez se rompen los testículos. En segundo lugar, las células no fijadas a veces se mueven dentro de la muestra, por lo que la obtención de imágenes de múltiples capas confocal dentro de una región determinada difícil. Para promover el análisis de tipos de células específicas, testículos pueden ser perforados o cortados con el fin de dirigir la forma en que las rupturas de testículo de tal modo que el aplastamiento bajo el cubreobjetos mínimamente afecta a la morfología del tipo celular de interés.
Track B implica la fijación química de los testículos. Esta pista requiere una cantidad intermedia de tiempo para la preparación de la muestra y tiene la ventaja de que las muestras fijadas se pueden guardar para su posterior análisis. Además, la fijación sirve para hacer estructuras celulares más rígida, lo que minimiza el movimiento de la muestra durante la formación de imágenes. Sin embargo, la microscopía de contraste de fase se convierte en mucho menos informativo después de la fijación química, por lo que algunas etapas de desarrollo difíciles de identificar espermatozoides.
Pista C es la más intensiva de tiempo, pero tiene la ventaja añadida de que las estructuras celulares son fijos y inmunotiñeron, lo que permite la visualización de las proteínas que no están disponibles con las etiquetas de genética apropiadas. Hay muchos anticuerpos disponibles comercialmente y de varios grupos de investigación para la inmunotinción centrosomas y estructuras relacionadas centrosoma en los testículos de Drosophila.
Protocolo
1. Pista A. Preparación de testículos en directo
- Preparar PBS disolviendo 8,0 g de NaCl, 0,2 g de KCl, 1,44 g de Na 2 HPO 4, 0,24 g de KH 2 PO 4 en 800 ml de agua destilada y ajustar el pH a 7,4. Llevar el volumen a 1 L y esterilizar en autoclave.
- Aislar testículos como se ha descrito previamente 27.
- Prepare el buffer de tinción DAPI diluyendo 1 mg / ml a 1 mg / ml en PBS. Use papel de aluminio para proteger el tubo de la luz y se almacena a -20 ° C.
- Después de aislar los testículos, sumergir el espécimen en 6 l de tampón de tinción DAPI en la parte superior de un portaobjetos de microscopio de vidrio cargados positivamente durante 10 min. Testículos adhieren bien a las disponibles comercialmente diapositivas cargados positivamente, lo que permite una fácil manipulación de la muestra. Diapositivas cargados positivamente son modificados de forma covalente para impartir una carga positiva estática a la superficie de vidrio. Similar al recubrimiento polilisina, esto promueve la interacción de la Wi testículosth la superficie de la diapositiva.
- Lavar el exceso de DAPI mediante la sustitución del tampón de tinción dos veces con 6 l de PBS. Use un pedazo de papel de filtro para absorber y expulsar el el buffer después de cada paso de lavado. Tenga cuidado de no eliminar accidentalmente los testículos junto con el tampón durante cada lavado.
- Añadir 6 l de PBS a la muestra. La cantidad de tampón usada se debe ajustar para el tamaño del cubreobjetos. Los volúmenes previstos en este protocolo son para un mm cubreobjetos de 18 x 18. Opcional: Es aconsejable para perforar los testículos cerca de la ubicación relativa del tipo de célula de interés. Esto asegurará que hay una presión mínima en estas células durante la etapa de aplastamiento, manteniendo de ese modo su integridad estructural. Perforación de los testículos se puede realizar utilizando un fuerte, escalpelo limpio.
- Colocar con cuidado un cubreobjetos en la parte superior de la muestra.
- Selle los bordes del cubreobjetos utilizando el esmalte de uñas transparente para asegurar que el tampón no se evapore de la muestra en vivo, mientras que imenvejecimiento.
- Use un marcador para designar la posición de los testículos para la facilidad de colocar la muestra en el portaobjetos y proceder a la obtención de imágenes.
- Lavar el exceso de tampón de tinción DAPI mediante la sustitución de la memoria intermedia dos veces con 6 l de PBS. Use un pedazo de papel de filtro para absorber y expulsar el el buffer después de cada paso de lavado. Tenga cuidado de no eliminar accidentalmente la muestra junto con el tampón durante cada lavado.
2. Track B. Preparación de Testículos fijos
- Prepare el buffer Fix diluyendo una solución de formaldehído de stock del 37% en PBS a una concentración final de 3,7% de formaldehído en PBS 1x
- Prepare el buffer de tinción DAPI diluyendo 1 mg / ml DAPI acciones a 1 g / ml en PBS.
- Sumergir los testículos en un 6 l gota de PBS en la parte superior de un portaobjetos de microscopio de vidrio cargados positivamente.
- Orientar manualmente los testículos en forma lineal o según lo recomendado.
- Use un pedazo de papel de filtro para absorber la PBS y reemplazarlo con 6 l de Fixtampón durante 5 min.
- Use un pedazo de papel de filtro para absorber la del búfer Fix y sumergir la muestra en 6 l de tampón de tinción DAPI durante 10 minutos.
- Colocar con cuidado un cubreobjetos de 18 mm x 18 en la parte superior de la muestra.
- Selle los bordes del cubreobjetos utilizando el esmalte de uñas transparente para asegurar que el tampón no se evapore de la muestra mientras que las imágenes.
- Use un marcador para designar la posición de los testículos para la facilidad de colocar la muestra en el portaobjetos y proceder a la obtención de imágenes.
3. Track C. Preparación de inmunotiñeron Testículos
Siliconación Cubreobjetos: Sumergir múltiples cubreobjetos de 18 x 18 mm en una pequeña bandeja que contiene solución siliconado y se incuba durante 1 min a temperatura ambiente en una campana de humos. Asegúrese de que los cubreobjetos están completamente expuestas y no se apilan en la parte superior de cada otra.
- Colocar la muestra en un 5 l gota de PBS sobre el cubre siliconada. Oriente eltestículos como se desee y perforar los testículos con un bisturí afilado. Colocar suavemente un portaobjetos de microscopio de vidrio cargados positivamente sobre el cubreobjetos, permitiendo que el PBS para ser uniformemente dispersa entre el cubreobjetos y el portaobjetos. Use un pequeño trozo de papel de filtro para absorber el exceso de amortiguación entre el cubreobjetos y portaobjetos. Como se quita el tampón por el papel de filtro, el aumento de la presión se aplastar los testículos. Muchas muestras deben ser preparadas de forma simultánea, ya que algunos pueden ser perdidos o dañados en el transcurso del protocolo. Un grabador de vidrio se puede utilizar para etiquetar los portaobjetos si se prepararon diferentes tipos de muestras simultáneamente.
- Lavar el cubreobjetos de 3x durante 1 min cada uno en agua, seguido de 3x durante 1 min cada uno en etanol al 70%, y un lavado final durante 1 min en agua. Permitir los cubreobjetos siliconados se sequen al aire en una campana de humos.
- Suelta las diapositivas en nitrógeno líquido y se permiten las muestras se congelen durante 5-10 min.
- Retire los portaobjetos de la liquid de nitrógeno utilizando un gran fórceps. Utilice un bisturí para eliminar rápidamente el cubreobjetos. La muestra debe permanecer en la diapositiva. Tenga cuidado de no manchar la muestra durante este proceso deslizando el cubreobjetos lo largo de la diapositiva.
- Incubar los portaobjetos en metanol preenfriado en un frasco de Coplin de tinción de vidrio a -20 ° C durante 15 min.
- Transfiera los portaobjetos a una cubeta de tinción Coplin de vidrio que contiene acetona previamente enfriado a -20 ° C durante 30 segundos.
- Lavar los portaobjetos durante 1 min en PBS a temperatura ambiente usando una tinción vaso de Coplin de vidrio.
- Preparar PBST-B completándolo PBS con 0,1% de Triton-X100 al 1% y albúmina de suero bovino (BSA). 5% de suero normal de la misma especie hospedadora que el anticuerpo secundario (de la etapa 3.14) puede ser utilizado en lugar de BSA para reducir el ruido de fondo producido a partir de anticuerpo secundario unión no específica.
- Incubar los portaobjetos durante 10 minutos en PBST-B en un frasco de vidrio para tinción Coplin para bloquear los sitios no específicos.
- Llenar los pozos dela cámara de humedad con agua. Humedad dentro de la cámara reducirá al mínimo la evaporación de soluciones de anticuerpo de la muestra durante los pasos de incubación.
- Preparar PBST-BR completándolo PBST-B con 100 g / ml de RNasa A. RNasa A degrada el ARN en la muestra y también sirve como un agente de bloqueo adicional al absorber fuertemente a la superficie de vidrio.
- Coloque una pieza de aproximadamente 1x1 cm de Parafilm en la parte superior de la muestra para separar la solución de anticuerpo de manera uniforme y proteger la solución de anticuerpos de evaporación. Cierre de la cámara de humedad e incubar la muestra en el anticuerpo primario durante 1 hora a temperatura ambiente.
- Retire los portaobjetos de la SAFT-B. Utilice un trozo de papel de filtro para secar la zona de la corredera alrededor de la muestra, usando precaución para no secar el espécimen mismo. Por último, colocar la placa en la cámara de humedad con el espécimen hacia arriba
- Añadir suavemente 100 l de anticuerpo primario diluido en PBST-BR en la parte superior de la especificaciónimen (1:200 es generalmente una buena concentración de partida de anticuerpos no caracterizados).
- Cubra la muestra con un aproximadamente 1 x 1 cm unidad de Parafilm y cerrar la cámara de humedad. Incubar la muestra en anticuerpo secundario durante 1 hora a temperatura ambiente.
- Abra la cámara de la humedad y el uso de fórceps para quitar suavemente el Parafilm de la diapositiva. Incubar los portaobjetos durante 5 minutos en PBST en una jarra de Coplin tinción de vidrio a temperatura ambiente para lavar. Repita este proceso para un total de tres lavados.
- Retire los portaobjetos de la SAFT-B y colocarlos en la cámara de humedad con el espécimen hacia arriba. Añadir suavemente 100 l de anticuerpo secundario diluido en PBST-BR en la parte superior de la muestra.
- Abra la cámara de la humedad y el uso de fórceps para quitar suavemente el Parafilm de la diapositiva. Una vez más, se lava la 3x espécimen durante 5 minutos cada uno en PBST en un frasco de vidrio de tinción Coplin seguido de 3x durante 5 minutos cada uno en PBS.
- Utilice un Kimwipe y papel de filtro para secar cuidadosamente la superficie de la diapositiva, teniendo cuidado de evitar tocar o secado de la muestra.
- Añadir 6 l de medio de montaje de espécimen, tapar con un cubreobjetos limpio (no recubierto con silicona), y el sello de los bordes con esmalte de uñas.
- Use un marcador para designar la posición de los testículos para la facilidad de colocar la muestra en el portaobjetos y proceder a la obtención de imágenes.
4. Imaging Notes
Imaging se puede lograr utilizando un microscopio de luz normal en posición vertical o invertida o un microscopio confocal. Es importante que el microscopio se equipa de contraste de fase, especialmente para la obtención de imágenes de los testículos en vivo especímenes (pista A). Esta característica se ha convertido recientemente disponible en microscopios confocal.
Cuando los testículos se rompen espontáneamente (pista A), la punta (tallo región celular) generalmente se mantiene intacta y es fácilmente identificable, proporcionando un buen marcador para localizar la fuente y utilizar para la orientación.
_content "> Los centríolos son estructuras relativamente pequeñas y por lo tanto, las imágenes deben tomarse usando 63X o 100X objetivos, un factor de zoom de 4-6X, y una resolución mínima de 512 x 512 píxeles cuando sea posible.Resultados
Los centrosomas se someten a múltiples transformaciones morfológicas y funcionales en el transcurso de la espermatogénesis. Esta característica de espermatogénesis hace que los testículos de un sistema útil para estudiar diversos aspectos de la biología del centrosoma. Uno de tales procesos es observado fácilmente alargamiento centrosoma. En espermatogonias, el marcador centriolar Ana1-GFP marca el 0,6 micras de largo centríolo (Figura 4a). Esta centríolo se alarga durante la espermatogénesis y alcanza una longitud de 2,5 micras de espermátidas casi maduros. Desde centríolos en Drosophila espermatozoides son excepcionalmente largos, de formación de imágenes puede ser utilizado para hacer afirmaciones cuantitativas respecto a la elongación centrosoma (Figura 4b). Análisis de la longitud del centríolo también se puede realizar en un fondo mutante y varios mutantes han sido identificados que altera el crecimiento centriolo (Figura 5). Ejemplos son siempre temprano (aly) y Cannonball (CAN), mutaciones que arrest espermatogénesis antes del inicio de la meiosis 30 pero no bloquean la elongación centríolo. En estos mutantes, centríolos de la espermatocito madura crecen a alrededor de ~ 2,4 m en comparación con centríolos de las células de control que llegan a un máximo de 1,8 m.
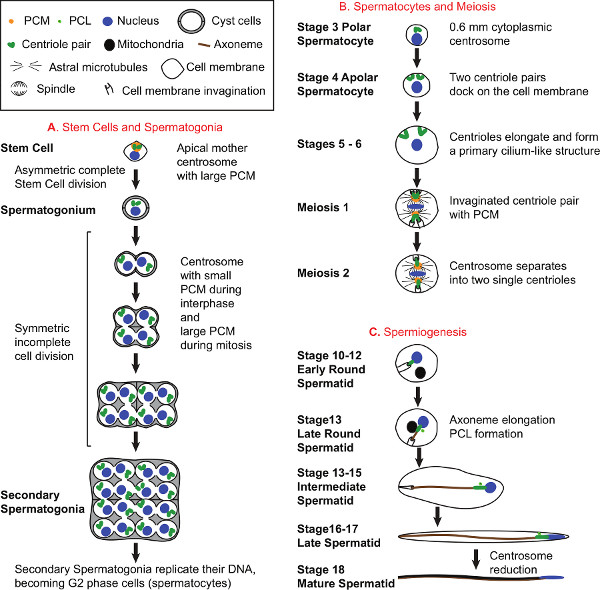
Figura 1. La espermatogénesis y Biología Centrosoma. A) El desarrollo de las células madre y espermatogonias. Todas las células de esperma se originan a partir de células madre que se encuentran en el extremo apical de los testículos. Cada célula madre se divide asimétricamente para formar una célula madre que hereda el centrosoma madre y un spermatogonium progenitor que hereda el centrosoma hija 31. Como forma Espermatogonias, se convierten rodeados de 2 células del quiste, que siguen rodeando los espermatocitos y espermátidas en toda la espermatogénesis. Espermatogonias dividir 4 veces para producir 16 Espermatogonias, cada uno con dos centriolos. B) Desarrollo de espermatocitos y meiosis. Durante el desarrollo de espermatocitos, centríolos se duplican una vez más para generar cuatro centríolos organizados en dos pares por célula y 64 centríolos por quiste. Temprana durante el desarrollo de espermatocitos, cada centríolo mueve a la membrana plasmática, muelles a ella, y se alarga para formar una estructura que se asemeja a un cilio primario 18,32-34. En maduros espermatocitos, longitud centríolo alcanza ~ 1.8 micras. Los centrosomas juegan un papel esencial en la meiosis. Durante la meiosis I, los pares de centríolos que todavía están unidos a la membrana plasmática movimiento hacia el centro de la célula y crean invaginaciones de la membrana celular en su punta distal. El PCM alrededor de los centríolos crece, nuclea microtúbulos astrales, y colocalizes con el polo del huso. Durante la transición a la meiosis II, el par de centríolos separa de manera que se presen solo un centríolot en cada polo del huso. C) Espermiogénesis. Al final de la meiosis II, los primeros redondo en espermátidas tiene un solo centríolo unido a la membrana plasmática invaginado. Una gran ronda derivado mitocondrial se encuentra cerca del núcleo y más tarde comienza a alargarse a lo largo de la creciente axonema en posteriores espermátidas redondas. Durante la espermatogénesis, las formas axonema y se alarga en el interior del citoplasma. Además aparece una nueva estructura centriolar conocido como el PCL (proximal Centriolo Like) cerca del centríolo preexistentes 1. Al final de la espermatogénesis, las células que comparten un quiste común separan unos de otros para convertirse en espermatozoides móviles totalmente madura. Los diagramas de desarrollo espermatocito (B) y Espermiogénesis (C) representan sólo una célula de los 16 espermatocitos y 64 Espermátidas, respectivamente por un quiste, y no representan las células quiste. Haga clic aquí para ver en grander figura.
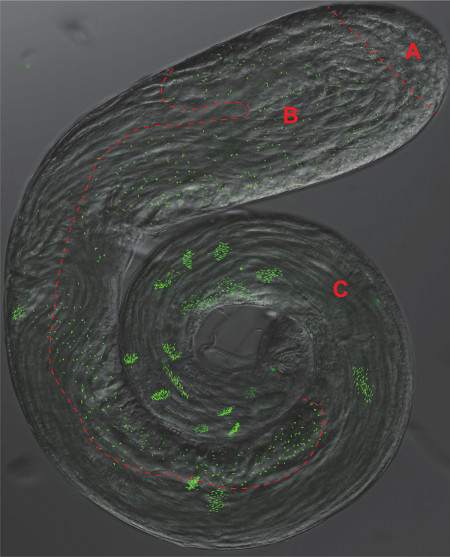
Figura 2. Los testículos Drosophila. Una superposición de un contraste de fase y fluorescencia GFP micrografía de un testículo todo el montaje que expresa el marcador pan-centriolar Ana-1-GFP. Área distinta corresponden a los paneles 1-3 de la Figura 1 están separadas por una línea roja discontinua A) Células madre y espermatogonias, B) Los espermatocitos y Meiosis, C) Espermiogénesis.
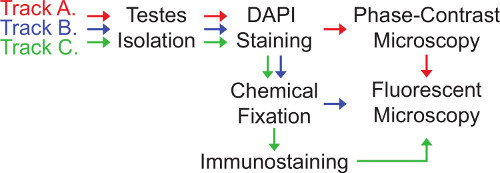
Figura 3. Pistas Hacia Imaging centrosomas en Drosophila testículos.

Figura 4. Centrosoma Alargamiento durante la espermatogénesis. A) Cada etapa muestra una imagen de contraste de fase (izquierda), imagen de fluorescencia (en el centro), y la imagen ampliada del centrosoma (derecha). La imagen de contraste de fases demuestra la etapa de célula particular, basándose en la posición y la morfología de la célula, núcleo, nucleolo, y las mitocondrias. La imagen muestra la fluorescencia de ADN teñido con DAPI (azul). La imagen muestra centrosoma centrosomas etiquetados por Asterless-GFP (Asl, imágenes superiores) y Ana1-GFP (Ana1, imagen inferior). Un círculo blanco destaca la membrana celular en las dos imágenes de contraste de fase y fluorescencia. Los círculos blancos de trazos y el círculo gris en la imagen de fluorescencia resaltar la posición del núcleo y el nucléolo, respectivamente. Amarillo flecha señala el Y-cromosomaalgunos bucles. Rojo discontinuo círculos marcan la mitocondria. Etapas 1-6 se refiere a 29 y 13 a 17 etapas se refiere a la descripción de las etapas de células en el 32. Etapa 1: espermatocito primario. Identificada como una pequeña celda de una punta del testículo. Etapa 2a: Polar espermatocito. Identificada por la presencia de una tapa de mitocondrias en un lado del núcleo. Etapa 3: Apolar espermatocito. Identificado por su relativa tamaño mayor que el de espermatocitos primarios y la falta de una tapa de mitocondrias. Etapa 4: espermatocito primario. Identificado por la aparición de todo: de los 3 bucles del cromosoma. Etapa 5: espermatocito primario maduro. Espermatocito más grande producido en la espermatogénesis, identificado por un aumento adicional en el tamaño nuclear. Etapa 6: premeiotic espermatocito primario. Bucles del cromosoma Y se desintegran y el núcleo desaparece. Etapa 13: Cebolla Etapa espermátidas. Células redondas que contiene el núcleo del mismo tamaño y las mitocondrias. Etapa 17: Late espermátide. Identificado como un espermátide alargada que sigue siendo parte de un bundle de 64 espermátidas con núcleos que se encuentran cerca de la base de los testículos., núcleos son ligeramente más ancho que espermátidas maduras se encuentran en la vesícula seminal. Las barras de escala, 10 micras y 1 micra. B) Gráfico representa promedio y desviación estándar para cada etapa, medida por Asterless-GFP (azul) y Ana1-GFP (verde). En la Etapa 6, (verde) los promedios y las desviaciones estándar Asterless-GFP (azul) y Ana1-GFP se superponen y sólo Asterless-GFP (azul) es evidente. A partir de la etapa 13, Asterless-GFP no decorar todo el centríolo y las mediciones no fueron determinadas (ND).
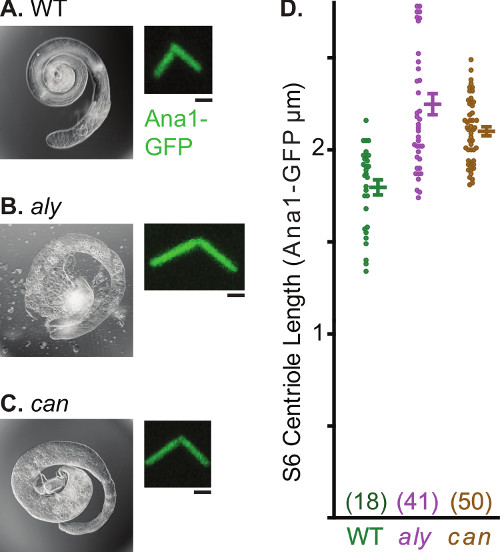
Figura 5. Anormalmente largas centríolos en la Etapa 6 espermatocitos de aly y ¿pueden los mutantes. AC) Microfotografía de luz de testículos enteros y el panel fluorescente del representante centrosoma labeled por Ana1-GFP. Tenga en cuenta la forma anormal de los testículos en aly y puede mutantes, que resulta de la falta de espermátidas como consecuencia de la detención meiótica. D) Gráfico representa la desviación media, estándar, y la distribución de datos de longitud centríolo de tipo salvaje, aly y puede . Número de la muestra para cada punto de datos está en paréntesis. Barra Escala, 1 m.
Discusión
El estudio de la biología del centrosoma en los testículos de la mosca utilizando marcadores centrosomal genéticamente etiquetados-es un método útil para evaluar la función y la actividad del centrosoma en un contexto tanto de tipo salvaje y mutante. En particular, pista A es adecuado para la detección rápida de anomalías centrosomales tales como malformación, misegregation, inestabilidad, o la longitud anormal en un esfuerzo para identificar nuevos mutantes. Además, los cilios espermátide en preparaciones en vivo conservaron la movilidad durante aproximadamente 15 min después de la disección y el uso de los testículos en vivo en la canción A también permite la motilidad de los espermatozoides para ser fácilmente dirigida. Dado que la actividad de los espermatozoides cilios móviles está directamente relacionada con la función del centrosoma, ensayos se pueden realizar para determinar los efectos de diversas mutaciones centrosomales sobre la función ciliar. Pista B se puede utilizar para las observaciones más específicas, especialmente cuando se necesitan datos estadísticos tales como para contar el número de centríolos por célula y o el número de células por quiste. Track C es más useful para observaciones detalladas que requieren tinción con anticuerpos. Los ejemplos incluyen el etiquetado de un determinado tipo de células, como las células madre, la tinción de una proteína que no tiene una etiqueta disponible, como la tubulina acetilada, o para comprobar la ausencia o mislocalization de una proteína en un mutante.
Al obtener imágenes centrosomas y estructuras relacionadas centrosoma, utilizando marcadores genéticamente con etiquetas en lugar de anticuerpos no sólo experimentalmente más fácil, pero también proporciona resultados más robustos y reproducibles. Por lo tanto, el uso de proteínas centrosomal genéticamente etiquetados-es un enfoque fiables para los análisis mecanicistas y cuantitativos que requieren un conjunto de datos de gran tamaño. Por ejemplo, el uso de marcadores centrosomales genéticamente etiquetados-ha sido particularmente valiosa para la cuantificación de la longitud del centríolos. Este análisis ha puesto de manifiesto que diversas mutaciones se pueden clasificar en dos categorías basadas en la variabilidad de longitud centríolos. Una categoría incluye mutaciones que ChanGE longitud centriolo pero no afectan a la desviación estándar 1 y la otra categoría incluye mutaciones que afectan tanto a la longitud centriolo y la desviación estándar de longitud 11. Tales datos cuantitativos pueden proporcionar información útil sobre la función de genes particulares centrosomal. Centrosomales mutantes que exhiben longitud centriolo defectuoso con un aumento en la desviación estándar puede ser debido a una desestabilización de la estructura centriolar. Sin embargo, la longitud centriolo defectuoso con un error estándar normal puede indicar que la mutación no desestabiliza el centriolo estructuralmente y es más probable que sea debido a un cambio en el mecanismo de regulación que controla la longitud centríolos. Debido a las inconsistencias en la inmunotinción, análisis cuantitativos son difíciles con el uso de marcadores de anticuerpos solo.
El centrosoma es una estructura proteica grande, compleja y muchas de sus proteínas sólo se encuentran en su interior. Usando centrosomal genéticamente con etiquetasmarcadores más bien los anticuerpos permite a uno para etiquetar consistentemente componentes internos del centrosoma cuyos epítopos pueden ser de otra manera inaccesibles para los marcadores de anticuerpos. Por ejemplo, los estudios de localización de BLD10 utilizando anticuerpos encuentra la proteína a ser enriquecido en los extremos distal y proximal de la centriolo 13, mientras que BLD10-GFP muestra una distribución más uniforme 1. Sin embargo, también es importante considerar el nivel de expresión de una proteína genéticamente-etiquetados en particular, ya que esto puede afectar a la distribución de proteínas. La localización de Sas-4-GFP y SAS-6-GFP expresada bajo su endógena se limita a los extremos proximales de la centriolo 1,16,35 Por otro lado, Sas-4-GFP y SAS-6-GFP expresado bajo el fuerte promotor de la ubiquitina se localizan a lo largo de toda la longitud de la centriolo 12,14. Otra consideración importante es el efecto de la etiqueta genética en función de la proteína. Analizar si las proteínas genéticamente etiquetados-son funcionales puede ser tested mediante la introducción de la proteína transgénica en un mutante de fondo y examinar si la proteína transgénica rescata el fenotipo mutante.
Fijación de los testículos de Drosophila se puede realizar utilizando una variedad de fijadores químicos. Aquí se describe la fijación con tanto formaldehído (Área B) y metanol-acetona (Ciclo C). Sin embargo, ya sea fijador se puede utilizar de forma intercambiable y desde diversos fijadores pueden alterar químicamente epítopos de anticuerpo nativo, la selección del fijador apropiado para la inmunotinción se debe determinar experimentalmente. Los siguientes fijadores y condiciones de incubación son comúnmente empleadas: 3,7% de formaldehído, 5 min a temperatura ambiente; metanol, 15 min a -20 ° C; acetona, 10 min a -20 ° C; metanol, 15 min a -20 ° C. seguido de acetona, 30 segundos a -20 ° C; etanol, 20 min a -20 ° C. Aunque la fijación con acetona, metanol, etanol y no requieren un paso de permeabilización extendida para la inmunotinción, WI fijaciónª formaldehído debe ser seguido por una incubación de 1 hora en PBST-B a temperatura ambiente para permeabilizar las membranas celulares y permitir el acceso del anticuerpo a epítopos intracelulares. Además, ciertos fijadores son más adecuados para antígenos particulares. Por ejemplo, las funciones de formaldehído bien para la fijación de las proteínas pequeñas, mientras que el metanol y acetona son muy adecuados para la fijación de grandes complejos moleculares 36.
La inmunotinción de Drosophila testículos se ha descrito anteriormente para la observación de estructuras de la cromatina y el citoesqueleto de microtúbulos 29,37. Aquí (Ciclo C), el procedimiento ha sido optimizado para el análisis de estructuras centrosomal contienen proteínas genéticamente etiquetados. Proporcionamos una descripción detallada de este procedimiento para guiar a las personas que no tienen experiencia en trabajar en los testículos de Drosophila. Este procedimiento también incluye modificaciones para mejorar la conservación y la morfología de los testículos, tales como mediante el uso de siliconized cubreobjetos y portaobjetos de vidrio con carga positiva.
Divulgaciones
El libre acceso a esta publicación fue apoyada por Leica Microsystems.
Agradecimientos
Este trabajo fue apoyado por una beca (R01GM098394) de los NIH y el Instituto Nacional de Ciencias Médicas Generales, así como la concesión 1.121.176 de la Fundación Nacional de Ciencia.
Materiales
| Name | Company | Catalog Number | Comments |
| DAPI | Invitrogen | D1306 | |
| Positively Charged Slides | AZER Scientific | EMS200A+ | |
| Feather Microscalpel | Electron Microscopy Sciences | 72045-30 | |
| 37% Formaldehyde or Paraformaldehyde | Fisher Scientific | BP531-500 | |
| Phosphate Buffered Saline (PBS) | Boston Bioproducts | BM-220 | |
| 18x18 mm coverslips number 1.5 | VWR | 48366 205 | |
| Nail Polish | Electron Microscopy Sciences | 72180 | |
| Sigmacote | Sigma-Aldrich | SL2-100 ml | |
| Methanol | Fisher Scientific | A412-4 | |
| Acetone | Fisher Scientific | A949-1 | |
| Triton-X100 | Sigma-Aldrich | T9284-100ML | |
| BSA | Jackson ImmunoResearch | 001-000-162 | |
| RNAse A | 5 prime | 2900142 | |
| Filter paper | Whatman | 1001-055 | |
| Glass engraver | Dremel | 290-01 | |
| TCS SP5 confocal microscope | Leica | ||
| Mounting Media | Electron Microscopy Sciences | 17985-10 | |
| Immuno Stain Moisture Chamber, Black | Electron Microscopy Sciences | 62010-37 | |
| Glass Coplin Staining Jar, Screw Cap | Electron Microscopy Sciences | 70315 |
Referencias
- Blachon, S., et al. A proximal centriole-like structure is present in Drosophila spermatids and can serve as a model to study centriole duplication. Genetics. 182, 133-144 (2009).
- Hennig, W. Spermatogenesis in Drosophila. The International journal of developmental biology. 40, 167-176 (1996).
- Fabian, L., Brill, J. A. Drosophila spermiogenesis: Big things come from little packages. Spermatogenesis. 2, 197-212 (2012).
- White-Cooper, H. Molecular mechanisms of gene regulation during Drosophila spermatogenesis. Reproduction. 139, 11-21 (2010).
- Davies, E. L., Fuller, M. T. Regulation of self-renewal and differentiation in adult stem cell lineages: lessons from the Drosophila male germ line. Cold Spring Harb Symp Quant Biol. 73, 137-145 (2008).
- Belote, J. M., Zhong, L. Duplicated proteasome subunit genes in Drosophila and their roles in spermatogenesis. Heredity. 103, 23-31 (2009).
- Xiao, X., Yang, W. X. Actin-based dynamics during spermatogenesis and its significance. Journal of Zhejiang University. Science. B. 8, 498-506 (2007).
- Hennig, W. Chromosomal proteins in the spermatogenesis of Drosophila. Chromosoma. 111, 489-494 (2003).
- Wakimoto, B. T. Doubling the rewards: testis ESTs for Drosophila gene discovery and spermatogenesis expression profile analysis. Genome research. 10, 1841-1842 (2000).
- Avidor-Reiss, T., Gopalakrishnan, J. Building a centriole. Curr Opin Cell Biol. , (2012).
- Blachon, S., et al. Drosophila asterless and vertebrate Cep152 Are orthologs essential for centriole duplication. Genetics. 180, 2081-2094 (2008).
- Basto, R., et al. Flies without Centrioles. Cell. 125, 1375-1386 (2006).
- Mottier-Pavie, V., Megraw, T. L. Drosophila bld10 is a centriolar protein that regulates centriole, basal body, and motile cilium assembly. Mol Biol Cell. 20, 2605-2614 (2009).
- Rodrigues-Martins, A., et al. DSAS-6 Organizes a Tube-like Centriole Precursor, and Its Absence Suggests Modularity in Centriole Assembly. Curr Biol. 17, 1465-1472 (2007).
- Stevens, N. R., Dobbelaere, J., Brunk, K., Franz, A., Raff, J. W. Drosophila Ana2 is a conserved centriole duplication factor. J Cell Biol. 188, 313-323 (2010).
- Gopalakrishnan, J., et al. Sas-4 provides a scaffold for cytoplasmic complexes and tethers them in a centrosome. Nat Commun. 2, 359 (2011).
- Gopalakrishnan, J., et al. Tubulin nucleotide status controls Sas-4-dependent pericentriolar material recruitment. Nat Cell Biol. 14, 865-873 (2012).
- Riparbelli, M. G., Callaini, G., Megraw, T. L. Assembly and persistence of primary cilia in dividing Drosophila spermatocytes. Dev Cell. 23, 425-432 (2012).
- Maines, J. Z., Wasserman, S. A. Post-transcriptional regulation of the meiotic Cdc25 protein Twine by the Dazl orthologue Boule. Nat Cell Biol. 1, 171-174 (1999).
- Herrmann, S., Amorim, I., Sunkel, C. E. The POLO kinase is required at multiple stages during spermatogenesis in Drosophila melanogaster. Chromosoma. 107, 440-451 (1998).
- Yamashita, Y. M., Jones, D. L., Fuller, M. T. Orientation of asymmetric stem cell division by the APC tumor suppressor and centrosome. Science. 301, 1547-1550 (2003).
- Dix, C. I., Raff, J. W. Drosophila Spd-2 Recruits PCM to the Sperm Centriole, but Is Dispensable for Centriole Duplication. Curr Biol. , (2007).
- Stevens, N. R., Dobbelaere, J., Wainman, A., Gergely, F., Raff, J. W. Ana3 is a conserved protein required for the structural integrity of centrioles and basal bodies. J Cell Biol. 187, 355-363 (2009).
- Giansanti, M. G., Bucciarelli, E., Bonaccorsi, S., Gatti, M. Drosophila SPD-2 Is an Essential Centriole Component Required for PCM Recruitment and Astral-Microtubule Nucleation. Curr Biol. , (2008).
- Januschke, J., Llamazares, S., Reina, J., Gonzalez, C. Drosophila neuroblasts retain the daughter centrosome. Nat Commun. 2, 243 (2011).
- Cheng, J., et al. Centrosome misorientation reduces stem cell division during ageing. Nature. 456, 599-604 (2008).
- Zamore, P. D., Ma, S. Isolation of Drosophila melanogaster testes. J. Vis. Exp. , e2641 (2011).
- Fuller, M. T., Bate, M., Martinez-Arias, A. . The Development of Drosophila melanogaster. , 71-174 (1993).
- Cenci, G., Bonaccorsi, S., Pisano, C., Verni, F., Gatti, M. Chromatin and microtubule organization during premeiotic, meiotic and early postmeiotic stages of Drosophila melanogaster spermatogenesis. J Cell Sci. . 107 (Pt. 12), 3521-3534 (1994).
- White-Cooper, H., Schafer, M. A., Alphey, L. S., Fuller, M. T. Transcriptional and post-transcriptional control mechanisms coordinate the onset of spermatid differentiation with meiosis I in Drosophila. Development. 125, 125-134 (1998).
- Yamashita, Y. M., Mahowald, A. P., Perlin, J. R., Fuller, M. T. Asymmetric inheritance of mother versus daughter centrosome in stem cell division. Science. 315, 518-521 (2007).
- Tates, A. D. . Cytodifferentiation during Spermatogenesis in Drosophila melanogaster: An Electron Microscope Study. , (1971).
- Baker, J. D., Adhikarakunnathu, S., Kernan, M. J. Mechanosensory-defective, male-sterile unc mutants identify a novel basal body protein required for ciliogenesis in Drosophila. Development. 131, 3411-3422 (2004).
- Avidor-Reiss, T., Gopalakrishnan, J., Blachon, S., Polyanovsky, A., Schatten, H. . The Centrosome: Cell and Molecular Mechanisms of Functions and Dysfunctions in Disease. , (2012).
- Gopalakrishnan, J., et al. Self-assembling SAS-6 multimer is a core centriole building block. J Biol Chem. 285, 8759-8770 (2010).
- Hassell, J., Hand, A. R. Tissue fixation with diimidoesters as an alternative to aldehydes. I. Comparison of cross-linking and ultrastructure obtained with dimethylsuberimidate and glutaraldehyde. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 22, 223-229 (1974).
- Pisano, C., Bonaccorsi, S., Gatti, M. The kl-3 loop of the Y chromosome of Drosophila melanogaster binds a tektin-like protein. Genetics. 133, 569-579 (1993).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados