Method Article
Imaging Zentrosomen in Fly Hoden
In diesem Artikel
Zusammenfassung
Imaging von zentrosomale Proteine während der Drosophila Spermatogenese ist eine leistungsfähige Methode, um neue Proteine von entscheidender Bedeutung für die Biologie Zentrosom zu identifizieren sowie die besondere Funktion der bekannten Akteure in diesem Prozess aufzuklären.
Zusammenfassung
Zentrosomen konserviert Mikrotubuli-basierte Organellen, deren Struktur und Funktion Änderung drastisch während des Zellzyklus und der Zelldifferenzierung. Zentrosomen sind unerlässlich, um die Zellteilung während der Mitose Achse bestimmen und Zilien während der Inter Keime. Die Identität der Proteine, die diese dynamische Veränderungen vermitteln bleibt nur teilweise bekannt ist, und die Funktion von vielen der Proteine, die in diesen Prozessen in Verbindung gebracht wurden, ist immer noch rudimentär. Neuere Arbeiten haben gezeigt, dass Drosophila Spermatogenese ist ein leistungsstarkes System, um neue Proteine entscheidend für Zentrosomenfunktion und Bildung sowie zu identifizieren, um Einblick in die besondere Funktion der bekanntesten Spieler im Zentrosom bezogenen Prozesse zu gewinnen. Drosophila ist ein etablierter genetischen Modellorganismus in dem Mutanten in zentrosomale-Gene lassen sich leicht erhalten und analysiert werden. Die jüngsten Fortschritte in der Empfindlichkeit und Auflösung der Lichtmikroskopie und derEntwicklung von robusten genetisch markiert zentrosomale Marker die Möglichkeit, Drosophila Hoden als eine einfache und zugängliche Modellsystem, um zu studieren Zentrosomen verwenden verwandelt. Dieses Papier beschreibt die Verwendung von genetisch markierten zentrosomale Marker zu genetischen Bildschirme für neue zentrosomale Mutanten durchzuführen und Einblicke in die spezifische Funktion der neu identifizierten Gene zu gewinnen.
Einleitung
Drosophila Hoden eine geeignete Organsystem, eine Vielzahl von Zell-und Entwicklungsprozesse zu studieren und wurden ausgiebig über die Jahre 1-9 bewertet. Handschrift konzentriert sich auf die Verwendung von Drosophila Hoden Zentrosom, eine konservierte zelluläre Organelle zu studieren. Wie in anderen Systemen, das Zentrosom des Drosophila-Hoden-Funktion in der Mitose, Meiose und ciliogenesis 10. Zentrosomen aus einem Paar als Centriole durch einen komplexen Proteinnetzwerk bezeichnet als pericentriolar Material (PCM) umgeben bekannt Mikrotubuli-basierte Strukturen. Die Centriol Paar einer älteren Mutter Centriol und einer jüngeren Tochter Centriol besteht. Wenn die Zelle zur Mitose fortschreitet, beide Centriolen zu trennen, zu vervielfältigen, zu erwerben und eine große Menge von PCM zu bilden schließlich zwei verschiedene Zentrosomen. Das Zentrosom, die die ursprüngliche Mutter Centriol wird als Mutter und dem Zentrosom bezeichnet zentrOsome mit der Original Tochter Centriol wird als Tochter Zentrosom bezeichnet.
Drosophila Hoden sind ideal für die Untersuchung der molekularen Grundlagen von Zentrosomen Biologie durch Fluoreszenzmikroskopie für eine Vielzahl von Gründen.
- Die meisten der Drosophila-Proteine, die für die Biologie Zentrosom in den Hoden erforderlich sind, unter den Eukaryoten konserviert, was darauf hindeutet, dass Einblick relevant Zentrosom Biologie in Menschen und anderen Spezies können durch das Studium der Zentrosomen in Drosophila gewonnen werden Hoden 1,11-14.
- Darstellende Mutante Analyse in Drosophila bietet einen erheblichen Vorteil, da, im Gegensatz zu vielen anderen Modellen, zentrosomale Mutationen in Drosophila sind nicht embryonalen tödlich, so dass für klassische genetische Analyse von Zentrosom-Funktion. Diese einzigartige Funktion von Drosophila ist aufgrund der Anwesenheit der mütterlichen Beitrag, der während der kritischen Phasen der embryonalen entwi weiterhin bestehtpment. 1,11-14. So kann man a) Studie Mutationen, die Zentrosom Bildung vollständig zu beseitigen und b) zu studieren, das Schicksal eines normalen Zentrosom, das im frühen Embryo durch mütterliche Beitrag in einer mutierten Zusammenhang wurde gebildet, nachdem die mütterlichen Beitrag erschöpft ist (Prinzip der Methode in 11) beschrieben.
- Funktionelle Transgene mit genetisch kodierten Fluoreszenzmarkern, die die Zentrosomen zu beschriften sind. Viele dieser Linien verwenden eigenen Promotor des Proteins, die Transkription des Transgens, um starke Überexpression verhindern zu fahren. Dies ist besonders wichtig, da die Überexpression von Proteinen häufig zu Artefakten, die mit der Analyse der Zentrosomenfunktion 1,11 stören.
- Das Zentrosom Centriol und sind einzigartig in ganz lange Drosophila Spermatogenese, so dass für eine schnelle und einfache Analyse des Zentrosom durch Bildgebung.
- Aufeinanderfolgenden Schritten in Spermatogenese und Zentrosom biology sind chronologisch entlang der Hoden organisiert, beginnend an der Spitze mit den Hoden Zentrosomen der Spermien-Stammzellen und endet an der Unterseite der Hoden mit verminderter Zentrosom Größe und Aktivität in reifen Samenzellen (Abbildungen 1 und 2). Dies ermöglicht eine einfache Identifizierung und Analyse von Zentrosom-Funktion während der verschiedenen Stadien der Entwicklung der Spermien.
- Hoden werden leicht von männlichen Larven, Puppen und Erwachsene 27 seziert.
- Während der Spermatogenese, das Zentrosom und seine Centriolen gehen durch mehrere kompositorische, strukturelle und funktionelle Staaten in der Mitose, Meiose und Bildung Cilium funktionieren. Während dieser Prozesse, die Zentrosom montiert, Dubletten, wandert, Anker auf bestimmte Teile der Zelle reift, dividieren, und schafft eine Wimper. Außerdem die Centriol der reifen Spermatiden führt zu einer centriolar Vorläufer namens der PCL ein. Auch in den reifen Spermatiden, das Zentrosom läuft einen Prozess cALLED Zentrosom Reduzierung wobei er verliert viele Komponenten des PCM und die Centriol (Abbildungen 1 und 2). So haben Studien in den Hoden erlauben es, mehrere Aspekte des Lebens wie Zentrosom Zentrosom Einlagerungen in den Stammzellen, Centriol Vervielfältigung, Centriol Stabilität, Centriol Dehnung, Centriol Trennung und Segregation, PCM Rekrutierung, ciliogenesis, PCL Bildung, Zentrosom Reduktion und Adresse astralen Mikrotubuli-Nukleation unter anderem.
- Schließlich sind Studien Zentrosom Biologie von den anderen bekannten Eigenschaften von Drosophila, die es zu einem bevorzugten Modellorganismus für biologische Studien gemacht haben unterstützt. Dazu gehören eine kurze Generationszeit, einfache Genetik, sowie zufällige und gerichtete Mutagenese.
Zusammen bilden die oben genannten Eigenschaften von Drosophila Hoden bietet ein Modell, wo das Zentrosom kann durch einfache, schnelle und detaillierte Bildgebung untersucht werden. Die beschriebenen Technikenin diesem Papier wurden angewendet, um viele Aspekte der Biologie einschließlich Zentrosom Centriol Bildung 11, 15 Centriol Vervielfältigung, PCM Einstellung 16, Zentrosom Regulierung 17 und 18 ciliogenesis zu untersuchen. Diese Techniken wurden auch angewendet, um das Zentrosom in anderen Bereichen der Biologie wie meiotischen Regelung 19 Spindelanordnung 20 und Zentrosom Aktivität in asymmetrischen Stammzellteilung 21 unter vielen anderen zu studieren.
Imaging der Hoden in den Zentrosom beginnt mit Erhalt Fliegen, die genetisch-markierten Proteine zu exprimieren zentrosomale und Isolierung der Hoden von männlichen Larven, Puppen oder Erwachsenen-Fliegen. Diese Fliegen sind von verschiedenen Forschungsgruppen 1,11,15,22-25. Die Larven Hoden enthalten alle Stadien der Spermatogenese vor der Meiose und sind nützlich bei der Analyse von Mutationen, die in der Puppe oder Erwachsener tödlich sind. Allerdings Spätpuppen oder junge adult Hoden sind die robustesten und enthalten alle Pre-und Post-Reifestadien der Spermatogenese, wodurch sie bevorzugt für die Analyse. Da die Anzahl der Spermien als der Fliegen Alter abnimmt, ist auch die Verwendung von adulten Hoden für die Untersuchung der Zentrosomen in Zusammenhang mit Alterung. 26 geeignet. Ein Verfahren zur Isolation von Hoden erwachsenen Fliegen ist bereits beschrieben worden 27.
Imaging von Zentrosomen und deren Funktion in Drosophila Hoden kann über drei verwandten Titel, die hier (Abbildung 3) dargestellt werden, erreicht werden. Auswahl, welche Spur am besten geeignet ist, hängt von der Art der Frage der Prüfer Adressierung.
Track A beinhaltet Bildgebung von Live-Hoden. Es ist die schnelle der drei Spuren kann jedoch nur angewendet, wenn Proben müssen nicht erhalten werden und wenn die Immunfärbung ist nicht erforderlich. In der Spur A werden die Hoden auf Objektträger (intakte, durchbohrt oder schneiden)und vorsichtig unter einem Deckglas gequetscht, um eine einzelne Schicht von leicht identifizierbaren Zellen zu bilden. Die Zellen werden dann unter Verwendung von sowohl Phasenkontrastmikroskopie und Fluoreszenzmikroskopie sichtbar gemacht. Die Verwendung von Phasenkontrast ist besonders wichtig für die Analyse von Drosophila Hoden, weil sie Zell Informationen, die nicht mit anderen Formen von Durchlicht sichtbar ist und ermöglicht somit eine schnelle Identifizierung der verschiedenen Stadien der Samenentwicklung 28,29 zeigt. Allerdings Track A hat zwei Nachteile. Zuerst wird die morphologische Integrität der Zellen häufig beeinträchtigt, wenn die Hoden brochen werden. Zweitens, nicht fixierten Zellen innerhalb der Probe bewegen manchmal, was die Abbildung von mehreren konfokalen Schichten innerhalb einer bestimmten Region schwierig. Um die Analyse von spezifischen Zelltypen zu fördern, kann durchstochen oder Hoden, um den Weg des Hodens Brüchen, so dass unter dem Deck Quetschen minimal beeinflußt die Morphologie der Zelltyp von Interesse direkt geschnitten werden.
Track B umfasst die chemische Fixierung der Hoden. Diese Spur ist ein Zwischenzeitaufwand für die Probenvorbereitung und hat den Vorteil, dass Festkörper können für eine spätere Analyse gespeichert werden. Darüber hinaus dient Fixierung Zellstrukturen steifer zu machen, minimiert die Bewegung der Probe während der Bildgebung. Allerdings wird Phasenkontrastmikroskopie viel weniger aussage nach chemischer Fixierung, so dass einige Stadien der Entwicklung der Spermien schwer zu identifizieren.
Spur C ist der zeitintensiv, hat aber den zusätzlichen Vorteil, dass die Zellstrukturen fixiert und immunhistochemisch, so dass für die Visualisierung von Proteinen, die nicht mit den entsprechenden genetischen Tags vorhanden sind. Es gibt viele Antikörper sowohl im Handel und von verschiedenen Forschungsgruppen für Immunfärbung Zentrosomen und Zentrosom bezogenen Strukturen in Drosophila Hoden.
Protokoll
1. Spur A. Herstellung der Live-Testes
- Vorbereitung PBS durch Auflösen von 8,0 g NaCl, 0,2 g KCl, 1,44 g Na 2 HPO 4, 0,24 g KH 2 PO 4 in 800 ml destilliertem Wasser und Einstellen des pH auf 7,4. Bringen Sie das Volumen auf 1 L und durch Autoklavieren sterilisieren.
- Isolieren Hoden, wie zuvor beschrieben 27.
- Bereiten DAPI-Färbung Puffer durch Verdünnung von 1 mg / ml Stamm 1 ug / ml in PBS. Verwenden Sie Aluminiumfolie um das Rohr aus Licht und bei -20 ° C schützen
- Nach Isolierung der Hoden, tauchen die Probe in 6 ul der DAPI-Färbung Puffer auf einer positiv geladenen Glasobjektträger für 10 min. Hoden gut an im Handel erhältlich positiv geladene Objektträger, erlaubt eine einfache Manipulation der Probe. Positiv geladene Objektträger kovalent modifiziert, um eine statische positive Ladung an der Glasoberfläche zu verleihen. Ähnlich Polylysin-Beschichtung, fördert dies die Wechselwirkung des Testes with der Oberfläche der Folie.
- Waschen Sie überschüssiges DAPI durch zweimaliges Ersetzen der Färbepuffer mit 6 ul PBS. Verwenden Sie ein Stück Filterpapier nach jedem Waschschritt Docht entfernt den Puffer. Seien Sie vorsichtig, um während jeder Wäsche nicht versehentlich entfernen Sie die Hoden zusammen mit dem Puffer.
- In 6 ul PBS auf die Probe. Die Menge des verwendeten Puffers sollte für die Größe des Deckglases eingestellt werden. Die in diesem Protokoll vorgesehenen Volumina sind für einen 18 x 18 mm Deckglas. Optional: Es ist ratsam, die Hoden in der Nähe der relativen Lage der interessierenden Zelltyp zu durchstechen. Dies wird sicherstellen, dass ein minimaler Druck auf die Zellen während der Quetsch-Schritt, wodurch ihre strukturelle Integrität beibehalten. Piercing der Hoden durchgeführt mit einem scharfen, sauberen Skalpell werden.
- Vorsichtig ein Deckglas auf der Probe.
- Seal die Ränder des Deckglases mit klarem Nagellack, um sicherzustellen, dass der Puffer nicht aus den Live-Probe zu verdampfen, während imAlterung.
- Mit einem Stift, um die Position der Hoden zur Erleichterung der Lokalisierung der Probe auf dem Objektträger zu bezeichnen und zur Bildgebung.
- Waschen Sie überschüssiges DAPI-Färbung Puffer zweimal ersetzt den Puffer mit 6 ul PBS. Verwenden Sie ein Stück Filterpapier nach jedem Waschschritt Docht entfernt den Puffer. Achten Sie darauf, bei jedem Waschgang nicht versehentlich entfernen Sie die Probe zusammen mit dem Puffer.
2. Titel B. Herstellung von Fest Hoden
- Vorbereitung Fix Puffer durch Verdünnung 37% Formaldehyd in PBS-Stammlösung bis zu einer Endkonzentration von 3,7% Formaldehyd in PBS 1x
- Bereiten DAPI-Färbung Puffer durch Verdünnung von 1 mg / ml DAPI Lager 1 ug / ml in PBS.
- Tauchen der Hoden in einem 6 ul Tropfen PBS auf einem positiv geladenen Objektträger aus Glas.
- Manuelles orientieren die Hoden in einer linearen Weise oder als sonst bevorzugt.
- Verwenden Sie ein Stück Filterpapier, um den Docht entfernt PBS und ersetzen Sie es mit 6 ul FixPuffer für 5 min.
- Verwenden Sie ein Stück Filterpapier Docht entfernt die Fix-Puffer und tauchen die Probe in 6 ul der DAPI-Färbung Puffer für 10 min.
- Vorsichtig einen 18 x 18 mm Deckglas auf der Probe.
- Seal die Ränder des Deckglases mit klarem Nagellack, um sicherzustellen, dass der Puffer nicht aus der Probe zu verdampfen, während die Abbildung.
- Mit einem Stift, um die Position der Hoden zur Erleichterung der Lokalisierung der Probe auf dem Objektträger zu bezeichnen und zur Bildgebung.
3. Titel C. Herstellung von immun Hoden
Coverslip Silizieren: Tauchen mehrere 18 x 18 mm Deckgläsern in einem kleinen Fach mit Silizieren Lösung und Inkubation für 1 min bei Raumtemperatur unter einer Abzugshaube. Stellen Sie sicher, dass die Deckgläser sind komplett freigelegt und sind nicht auf der jeweils anderen gestapelt.
- Legen Sie die Probe in einer 5 ul Tropfen PBS auf der silikonisierten Deckglas. Richten Sie dieHoden wie gewünscht und durchbohren die Hoden mit einem scharfen Skalpell. Sanft statt einer positiv geladenen Glasobjektträger über das Deckglas, so dass der PBS gleichmäßig zwischen dem Deckglas und dem Objektträger verteilt werden. Mit einem kleinen Stück Filterpapier zu Docht entfernt die überschüssige Puffer zwischen dem Deckglas und Objektträger. Als Puffer wird durch das Filterpapier entfernt wird, wird der Druckanstieg der Hoden quetschen. Viele Proben sollten gleichzeitig hergestellt werden, wie einige können verloren gehen oder beschädigt werden, im Laufe des Protokolls. Ein Glas Stecher kann verwendet werden, um die Folien zu beschriften, wenn verschiedene Arten von Proben gleichzeitig zubereitet werden.
- Für 1 min jeweils in Wasser, gefolgt von 3x 1 min jeweils in 70% Ethanol und einem letzten Waschen für 1 min in Wasser Waschen Sie die Deckgläser 3x. Lassen Sie die silikonisierten Deckgläschen an der Luft trocknen unter einer Abzugshaube.
- Lassen Sie die Folien in flüssigem Stickstoff und lassen Sie die Probe für 5-10 min einzufrieren.
- Entfernen Sie die Folien aus der liquid Stickstoff mit einer großen Pinzette. Verwenden Sie ein Skalpell, um das Deckglas schnell zu entfernen. Sollte die Probe auf dem Objektträger verbleiben. Achten Sie darauf, um die Probe während dieses Prozesses, indem das Deckglas auf dem Objektträger zu schmieren.
- Die Folien in vorgekühltes Methanol Inkubation in einem Glas Coplin Küvette bei -20 ° C für 15 min.
- Die Objektträger in einem Glasgefäß, Coplin Färbung vorgekühlt Aceton bei -20 ° C für 30 Sekunden.
- Waschen Sie die Objektträger für 1 min in PBS bei Raumtemperatur mit einem Glas Coplin Küvette.
- Vorbereitung PBST-B durch Hinzu PBS mit 0,1% Triton-X100 und 1% Rinderserumalbumin (BSA). 5% normalem Serum der gleichen Spezies wie die Wirts sekundären Antikörper (aus Schritt 3.14) anstelle des BSA verwendet, um die nichtspezifische Antikörperbindung hergestellt Sekundärhintergrundrauschen zu reduzieren.
- Die Folien Inkubation für 10 min in PBST-B in einem Glas Coplin Küvette für unspezifische Seiten zu sperren.
- Füllen Sie die Vertiefungender Feuchtekammer mit Wasser. Feuchtigkeit im Inneren der Kammer wird die Verdampfung von Antikörperlösungen von der Probe während der Inkubationsschritte minimieren.
- Vorbereitung PBST-BR durch Hinzu PBST-B mit 100 ug / ml RNase A RNase A zersetzt RNA in der Probe und dient auch als ein zusätzliches Sperrmittel durch stark absorbierende an der Glasoberfläche.
- Legen Sie ein etwa 1x1 cm großes Stück Parafilm auf der Probe, um die Antikörperlösung gleichmäßig verteilt und die Antikörperlösung schützen verdampft. Schließen der Feuchtigkeitskammer und Inkubieren der Probe in dem primären Antikörper für 1 h bei Raumtemperatur.
- Entfernen Sie die Folien aus PBST-B. Verwenden Sie ein Stück Filterpapier, um den Bereich der Folie um die Probe zu trocknen, mit Vorsicht die Probe selbst nicht zu trocken. Schließlich legen Sie die Folie in der Feuchtigkeitskammer mit der Probe nach oben
- Vorsichtig mit 100 ul des primären Antikörpers in PBST-BR auf der Oberseite des spec verdünntimen (1:200 ist in der Regel ein guter Ausgangskonzentration für nicht charakterisierte Antikörper).
- Decken Sie die Probe mit einem ca. 1 x 1 cm großes Stück Parafilm und schließen die Feuchtigkeit Kammer. Inkubieren der Probe in sekundären Antikörper für 1 h bei Raumtemperatur.
- Öffnen Sie die Feuchtigkeitskammer und verwenden Pinzette vorsichtig die Parafilm von der Folie. Die Objektträger für 5 min Inkubation in PBST in einem Glas Coplin Küvette bei Raumtemperatur zu waschen. Wiederholen Sie diesen Vorgang für insgesamt drei Waschungen.
- Entfernen Sie die Folien aus PBST-B und legen Sie sie in der feuchten Kammer mit der Probe nach oben ein. Vorsichtig mit 100 ul sekundären Antikörper in PBST-BR auf der Probe verdünnt.
- Öffnen Sie die Feuchtigkeitskammer und verwenden Pinzette vorsichtig die Parafilm von der Folie. Wieder, waschen Sie die Probe 3x für jeweils 5 min in PBST in einem Glas Coplin Küvette gefolgt von 3x 5 min jeweils in PBS.
- Verwenden Sie einen Kimwipe und Filterpapier sorgfältig trocknen die Oberfläche der Folie vorsichtig berühren oder Trocknen der Probe zu vermeiden.
- In 6 ul Montage Medien auf die Probe, decken Sie mit einem sauberen Deckglas (nicht mit Silikon beschichtet) und die Dichtung Ränder mit Nagellack.
- Mit einem Stift, um die Position der Hoden zur Erleichterung der Lokalisierung der Probe auf dem Objektträger zu bezeichnen und zur Bildgebung.
4. Imaging Hinweise
Imaging kann mit einem stehenden oder umgekehrten normalen Lichtmikroskop oder konfokalen Mikroskop erreicht werden. Es ist wichtig, dass das Mikroskop mit Phasenkontrast ausgestattet werden, insbesondere für die Abbildung von lebenden Proben Hoden (Spur A). Diese Funktion ist vor kurzem zur Verfügung stehen auf konfokalen Mikroskopen.
Wenn die Hoden brechen spontan (Track A) wird die Spitze (Stammzellbereich) in der Regel intakt gehalten und ist leicht erkennbar, die eine gute Markierung, um zunächst finden und verwenden zur Orientierung.
_content "> Centriolen sind ziemlich klein Strukturen und Bilder sollten daher mit 63X oder 100X Ziele, einen Zoomfaktor von 4-6X genommen werden, und eine Auflösung von mindestens 512 x 512 Bildpunkten, wenn möglich.Ergebnisse
Zentrosomen laufen mehrere morphologische und funktionelle Transformationen im Laufe der Spermatogenese. Diese Eigenschaft macht die Spermatogenese Hoden ein nützliches System, um verschiedene Aspekte der Biologie Zentrosom studieren. Ein solches Verfahren ist leicht beobachtet Zentrosom Dehnung. In Spermatogonien, die centriolar Marker Ana1-GFP markiert die 0,6 um lange Centriol (Abbildung 4a). Dies verlängert Centriol während der Spermatogenese und eine Länge von 2,5 um fast reife Spermatiden erreicht. Seit Centriolen in Drosophila Spermien sind einzigartig lang ist, können Bildgebung verwendet, um quantitative Aussagen über Zentrosom Dehnung (Abbildung 4b) zu machen. Analyse Zentriol Länge kann auch in einem mutierten Hintergrund ausgeführt werden und verschiedene Mutanten identifiziert, die Zentriol Wachstum (Fig. 5) zu ändern. Beispiele sind immer früh (Aly) und Kanonenkugel (können), dass Mutationen arrest Spermatogenese vor Beginn der Meiose 30 aber nicht Centriol Dehnung blockieren. In diesen Mutanten Centriolen der reifen Samenzelle wachsen, um über ~ 2,4 um im Vergleich zu Centriolen von Kontrollzellen, die ein Maximum von 1,8 um zu erreichen.
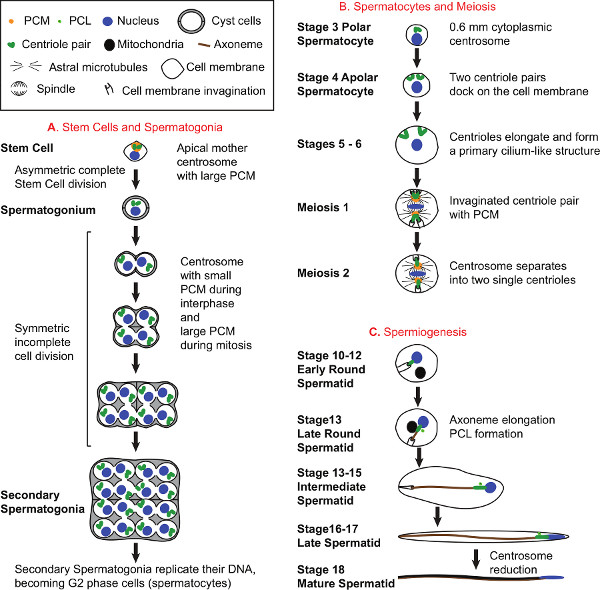
Fig. 1 ist. Spermatogenese und Zentrosom Biologie. A) Entwicklung von Stammzellen und Spermatogonien. Alle Samenzellen stammen aus Stammzellen an der apikalen Spitze der Hoden gefunden. Jede Stammzelle teilt sich asymmetrisch, um eine Stammzelle, die die Mutter Zentrosom und eine Vorläufer Spermatogonie, die die Tochter erbt erbt Zentrosom 31 bilden. Als Spermatogonien Form, werden sie von zwei Zyste Zellen, die die Spermatozyten und Spermatiden während der Spermatogenese umgeben weiterhin umgeben. Spermatogonien Kluft 4 mal 16 Spermatogonien, die jeweils zwei Centriolen. B enthalten) Entwicklung der Spermatozyten und Meiose zu produzieren. Während Spermatozyten Entwicklung, Centriolen duplizieren noch einmal auf vier Centriolen in zwei Paare pro Zelle und 64 Centriolen pro Zyste organisiert generieren. Frühe während Spermatozyten Entwicklung, bewegt sich jede Centriol an der Plasmamembran, Docks, um es, und verlängert, um eine Struktur, die eine primäre Zilien 18,32-34 ähnelt bilden. In reifen Spermatozyten, Centriol Länge erreicht ~ 1,8 um. Die Zentrosomen spielen eine wesentliche Rolle in der Meiose. Während der Meiose I, die Centriol Paare, die immer noch an der Plasmamembran Schritt in Richtung der Mitte der Zelle befestigt sind und erstellen Einstülpungen der Zellmembran an ihren distalen Spitze. Das PCM um die Centriolen wächst, Keim für Astral Mikrotubuli und kolokalisiert mit der Spindelstange. Beim Übergang in Meiose II, trennt sich das Paar Zentriol so dass nur eine einzige Zentriol ist Präsentationt bei jeder Spindelstange. C) Spermiogenese. Am Ende der Meiose II hat der Frühe Runde Spermatide eine einzige Centriol zu der eingestülpte Plasmamembran angebracht. Ein großer runder mitochondrialen Derivat wird in der Nähe des Zellkerns und später beginnt, entlang der wachsenden Axonem Später in runden Spermatiden zu verlängern. Während der Spermatogenese, die Axonem Formen und verlängert in der Zytoplasma. Darüber hinaus erscheint eine neue centriolar Struktur wie die PCL (proximale Centriole Like) bekannt, in der Nähe des bereits existierenden Centriol ein. Am Ende der Spermatogenese, Zellen, die eine gemeinsame Zyste voneinander trennen, um vollständig ausgereift beweglichen Spermien zu werden. Die Diagramme der Spermatozyten Entwicklung (B) und Spermiogenese (C) zeigen nur eine Zelle der 16 Spermatozyten und Spermatiden 64, jeweils pro Zyste und nicht die Zyste Zellen darzustellen. Klicken Sie hier zur Ansicht großr Figur.
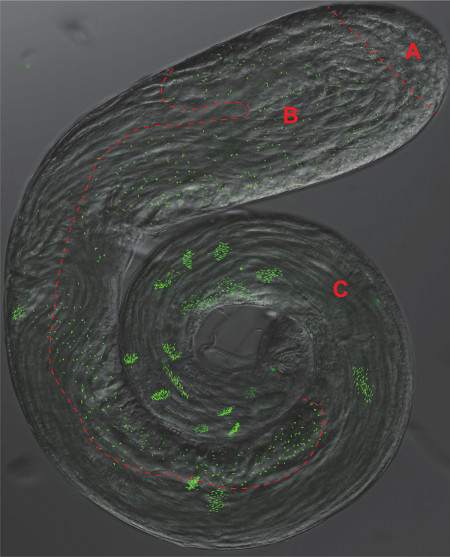
2. Die Drosophila-Testes. Die Lasche der Phasenkontrast-und GFP-Fluoreszenz-Aufnahme eines ganzen-mount Hoden die pan-centriolar Marker Ana-1-GFP-exprimierenden. Distinct Bereich entsprechend Platten 1-3 von Abbildung 1 sind durch eine gestrichelte rote Linie getrennt) Stammzellen und Spermatogonien, B) Spermatozyten und Meiose, C) Spermiogenese.
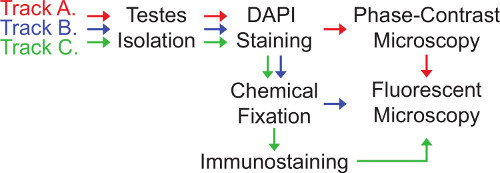
3. Gegen Tracks Imaging Zentrosomen in Drosophila Hoden.

Abbildung 4. Zentrosom Dehnung während der Spermatogenese. A) Jede Stufe zeigt ein Phasenkontrastbild (links), Fluoreszenz-Bild (Mitte) und vergrößertes Bild der Zentrosom (rechts). Das Phasenkontrastbild zeigt die besondere Zellstadium auf der Grundlage der Position und der Morphologie der Zelle, Zellkern Nukleolus und Mitochondrien. Das Fluoreszenzbild zeigt DNA mit DAPI (blau) gefärbt. Das Zentrosom Bild zeigt von Zentrosomen Asterless-GFP (Asl, Top-Bilder) und Ana1-GFP (Ana1, Bild unten) gekennzeichnet. Ein weißer Kreis unterstreicht die Zellmembran in beiden Phasenkontrast-und Fluoreszenzbilder. Die gestrichelten Kreise weiße und die graue Kreis im Fluoreszenzbild zu markieren die Position des Kerns und Nukleolus sind. Gelber Pfeil auf den Y-Chromosomeinige Schleifen. Red gestrichelten Kreise markieren die Mitochondrien. Stufen 1-6 bezieht sich auf 29 und die Stufen 13 bis 17 bezieht sich auf Beschreibung der Zellstadien in 32. Stufe 1: Primäre Spermatozyten. Als kleine Zelle eine Spitze des Hoden identifiziert. Stufe 2a: Polar Spermatozyten. Von der Gegenwart eines Mitochondrien Kappe auf einer Seite des Kerns bezeichnet. Stufe 3: Apolare Spermatozyten. Durch ihre relativ größeren Größe als die identifizierten primären Spermatozyten und das Fehlen einer Kappe Mitochondrien. Stufe 4: Primäre Spermatozyten. Alle 3 Y-Chromosom Schlaufen: durch das Auftreten von alle identifiziert. Stufe 5: Ältere Primäre Spermatozyten. Größte Spermatozyten in Spermatogenese produziert, von einem weiteren Anstieg der Kerngröße identifiziert. Stage 6: Premeiotic Primäre Spermatozyten. Y-Chromosom Schleifen zerfallen und der Kern verschwindet. Stufe 13: Zwiebel Bühne Spermatide. Runde Zelle gleich großen Zellkern und Mitochondrien enthalten. Stufe 17: Späte Spermatide. Als länglicher Spermatiden, die Teil einer bundl bleibt identifizierte von 64 Spermatiden mit Kernen gefunden in der Nähe der Basis der Hoden. sind Kerne etwas breiter als reife Spermatiden in der Samenblase gefunden. Maßstabsbalken 10 &mgr; m und 1 &mgr; m. B) Grafik zeigt Mittelwert und Standardabweichung für jede Stufe wie Asterless-GFP-(blau) und Ana1-GFP (grün) gemessen. In Phase 6, Asterless-GFP-(blau) und Ana1-GFP (grün) Mittelwerte und Standardabweichungen überlappen und nur Asterless-GFP (blau) ist offensichtlich. Schon ab Stufe 13, hat Asterless-GFP nicht die ganze Centriol dekorieren und Messungen wurden nicht bestimmt (ND).
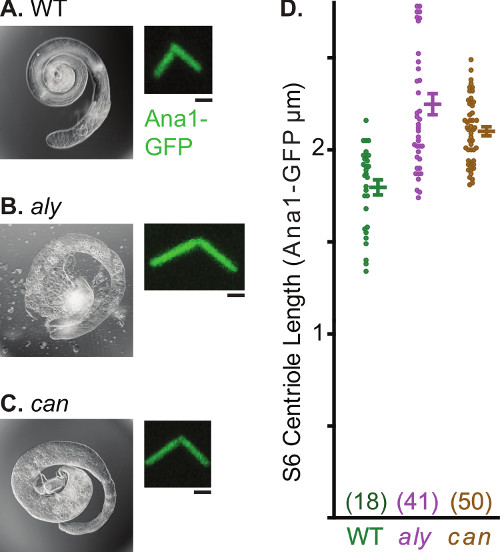
5. Ungewöhnlich lange Centriolen in Stage 6 Spermatozyten von aly und kann Mutanten. AC) Lichtmikroskopische Aufnahme von ganzen Hoden und Leuchtstoffplatte der Vertreter Zentrosom lavon Ana1-GFP Beled. Beachten Sie die abnorme Form der Hoden in aly und kann Mutanten, die aus einem Mangel an Spermatiden als Folge der Meiosehemmung. D führt) Grafik zeigt Mittelwert, Standardabweichung und Datenverteilung Centriol Länge in Wildtyp-, aly und kann . Probennummer für jeden Datenpunkt ist in Klammern. Maßstabsbalken, 1 um.
Diskussion
Studium der Biologie in Zentrosom fly Hoden mit genetisch markierten zentrosomale Marker ist eine nützliche Methode für die Bewertung der Zentrosom Funktion und Aktivität sowohl in Wildtyp-und Mutanten-Kontext. Insbesondere ist Track A geeignet für ein schnelles Screening von zentrosomale Missbildungen wie Fehlbildungen, misegregation, Instabilität, oder abnorme Länge in dem Bemühen, neue Mutanten zu identifizieren. Weiterhin Spermatiden Zilien in lebenden Präparaten bleiben beweglich etwa 15 min nach der Sektion und die Verwendung von lebenden Hoden in Spur A erlaubt auch die Beweglichkeit der Spermien, um leicht gerichtet. Da die Aktivität der Spermien beweglich Flimmerhärchen direkt an Zentrosomenfunktion Zusammenhang können Assays durchgeführt, um die Effekte von Mutationen auf verschiedenen zentrosomale Ziliarfunktion bestimmen. Spur B können für spezifische Beobachtungen vor allem, wenn die statistischen Daten, wie zum Zählen der Anzahl von Centriole pro Zelle und oder die Anzahl der Zellen pro Zyste erforderlich ist. Track C ist am Wissel für detaillierte Beobachtungen, die Färbung mit Antikörpern erforderlich. Beispiele schließen Kennzeichnung eines bestimmten Zelltyp, wie Stammzellen, Färbung eines Proteins, das nicht über einen verfügbaren tag wie acetylierte Tubulin, oder um die Abwesenheit oder Fehllokalisierung von einem Protein in einer Mutante zu überprüfen.
Bei der Abbildung Zentrosomen und Zentrosom bezogenen Strukturen, mit Hilfe von gentechnisch-markierten Marker anstatt Antikörper ist nicht nur experimentell einfacher, sondern bietet auch mehr robuste und reproduzierbare Ergebnisse. Daher ist der Einsatz von gentechnisch-markierten Proteine zentrosomale ein zuverlässiger Ansatz für mechanistische und quantitative Analysen, die eine große Datenmenge benötigen. Beispielsweise wurde die Verwendung von genetisch markiert zentrosomale Marker für die Quantifizierung von Zentriol Länge besonders wertvoll. Eine solche Analyse hat ergeben, dass verschiedene Mutationen können auf der Basis der Variabilität in Zentriol Länge in zwei Kategorien eingeteilt werden. Eine Kategorie umfasst Mutationen, die change Centriol Länge, aber keinen Einfluss auf die Standardabweichung 1 und die andere Kategorie gehören Mutationen, die sowohl Centriol Länge und die Standardabweichung in der Länge 11 beeinflussen. Solche quantitativen Daten können nützliche Einblicke in die Funktion von bestimmten Genen zentrosomale bieten. Centrosomal Mutanten, defekt Zentriol Länge mit einer Zunahme der Standardabweichung aufweisen, können aufgrund einer Destabilisierung centriolar Struktur sein. Jedoch defekt Zentriol Länge mit einer normalen Standardfehler zeigen, dass die Mutation nicht strukturell destabilisieren Zentriol und eher aufgrund einer Änderung in regulatorischen Mechanismus Steuern Zentriol Länge sein. Aufgrund von Inkonsistenzen in der Immunfärbung sind quantitative Analysen schwer bei der Verwendung von Antikörper-Marker allein.
Das Zentrosom ist eine große, komplexe proteinartigen Struktur und viele ihrer Proteine nur in seinem Inneren vorhanden. Mit genetisch-markierten zentrosomaleMarker nicht die Antikörper erlaubt es konsequent kenn internen Komponenten der Zentrosomen, deren Epitope anderweitig unzugänglich Antikörper-Marker sein. Zum Beispiel Lokalisationsstudien von BLD10 Verwendung von Antikörpern findet sich das Protein an den distalen und proximalen Enden des Zentriol 13 angereichert werden, während BLD10-GFP zeigt eine gleichmäßige Verteilung 1. Allerdings ist es auch wichtig, die Höhe der Expression eines bestimmten genetisch markierte Protein zu betrachten, da diese Proteinverteilung beeinflussen. Lokalisierung von Sas-4-GFP-und SAS-6-GFP exprimiert unter ihrer endogenen an den proximalen Enden der Centriol 1,16,35 Auf der anderen Seite beschränkt, Sas-4-GFP-und SAS-6-GFP exprimiert unter der starke Ubiquitin-Promotor sind entlang der gesamten Länge des Zentriol 12,14 lokalisiert. Eine weitere wichtige Überlegung ist die Wirkung der genetischen Tag auf Proteinfunktion. Die Analyse, ob genetisch markierten Proteine sind funktionell sein können testen durch die Einführung des transgenen Proteins in eine Mutante Hintergrund und prüft, ob die transgene Protein rettet die mutierten Phänotyp.
Fixierung von Drosophila Hoden kann unter Verwendung einer Vielzahl von chemischen Fixiermittel werden. Hier beschreiben wir Fixierung sowohl mit Formaldehyd (Track B) und Methanol-Aceton-(Track C). Jedoch kann entweder Fixiermittel austauschbar verwendet werden und da verschiedene Fixiermittel chemisch stören nativen Antikörper-Epitope, muss die Auswahl des geeigneten Fixiermittel für Immun experimentell bestimmt werden. Die folgenden Fixiermittel und Inkubationsbedingungen werden üblicherweise verwendet: 3,7% Formaldehyd, 5 min bei Raumtemperatur; Methanol, 15 min bei -20 ° C, Aceton, 10 min bei -20 ° C Methanol, 15 min bei -20 ° C. gefolgt von Aceton, 30 sec bei 20 ° C, Ethanol, 20 min bei -20 ° C. Obwohl Fixation mit Aceton, Methanol und Ethanol nicht eine erweiterte Permeabilisierung Schritt für Immunfärbung Fixierung erfordern with Formaldehyd sollte von einem 1-stündigen Inkubation in PBST-B bei Raumtemperatur, um die Zellmembranen durchlässig zu machen und damit den Zugang zu intrazellulären Antikörper-Epitope folgen. Darüber hinaus sind bestimmte Fixative besser geeignet für bestimmte Antigene. Beispielsweise Formaldehyd funktioniert gut für die Fixierung von kleinen Proteinen, während Methanol und Aceton sind für die Fixierung von großen Molekülkomplexe 36 gut geeignet.
Immunfärbung von Drosophila Hoden zuvor für die Beobachtung Chromatin-Strukturen und die Mikrotubuli-Zytoskeletts 29,37 beschrieben. Hier (Spur C) wurde das Verfahren für die Analyse von Strukturen zentrosomale genetisch markierte Proteine enthält, optimiert. Wir liefern eine detaillierte Beschreibung dieses Verfahrens, um Menschen, die Erfahrung mit Arbeiten in Drosophila Hoden führen. Dieses Verfahren umfaßt auch Modifikationen, die Erhaltung und die Morphologie der Hoden, wie unter Verwendung von s zu verbesserniliconized Deckgläser und positiv geladene Objektträger aus Glas.
Offenlegungen
Freier Zugang zu dieser Veröffentlichung wurde von Leica Microsystems unterstützt.
Danksagungen
Diese Arbeit wurde durch ein Stipendium (R01GM098394) von NIH und National Institute of General Medical Sciences sowie Gewährung von 1.121.176 National Science Foundation unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| DAPI | Invitrogen | D1306 | |
| Positively Charged Slides | AZER Scientific | EMS200A+ | |
| Feather Microscalpel | Electron Microscopy Sciences | 72045-30 | |
| 37% Formaldehyde or Paraformaldehyde | Fisher Scientific | BP531-500 | |
| Phosphate Buffered Saline (PBS) | Boston Bioproducts | BM-220 | |
| 18x18 mm coverslips number 1.5 | VWR | 48366 205 | |
| Nail Polish | Electron Microscopy Sciences | 72180 | |
| Sigmacote | Sigma-Aldrich | SL2-100 ml | |
| Methanol | Fisher Scientific | A412-4 | |
| Acetone | Fisher Scientific | A949-1 | |
| Triton-X100 | Sigma-Aldrich | T9284-100ML | |
| BSA | Jackson ImmunoResearch | 001-000-162 | |
| RNAse A | 5 prime | 2900142 | |
| Filter paper | Whatman | 1001-055 | |
| Glass engraver | Dremel | 290-01 | |
| TCS SP5 confocal microscope | Leica | ||
| Mounting Media | Electron Microscopy Sciences | 17985-10 | |
| Immuno Stain Moisture Chamber, Black | Electron Microscopy Sciences | 62010-37 | |
| Glass Coplin Staining Jar, Screw Cap | Electron Microscopy Sciences | 70315 |
Referenzen
- Blachon, S., et al. A proximal centriole-like structure is present in Drosophila spermatids and can serve as a model to study centriole duplication. Genetics. 182, 133-144 (2009).
- Hennig, W. Spermatogenesis in Drosophila. The International journal of developmental biology. 40, 167-176 (1996).
- Fabian, L., Brill, J. A. Drosophila spermiogenesis: Big things come from little packages. Spermatogenesis. 2, 197-212 (2012).
- White-Cooper, H. Molecular mechanisms of gene regulation during Drosophila spermatogenesis. Reproduction. 139, 11-21 (2010).
- Davies, E. L., Fuller, M. T. Regulation of self-renewal and differentiation in adult stem cell lineages: lessons from the Drosophila male germ line. Cold Spring Harb Symp Quant Biol. 73, 137-145 (2008).
- Belote, J. M., Zhong, L. Duplicated proteasome subunit genes in Drosophila and their roles in spermatogenesis. Heredity. 103, 23-31 (2009).
- Xiao, X., Yang, W. X. Actin-based dynamics during spermatogenesis and its significance. Journal of Zhejiang University. Science. B. 8, 498-506 (2007).
- Hennig, W. Chromosomal proteins in the spermatogenesis of Drosophila. Chromosoma. 111, 489-494 (2003).
- Wakimoto, B. T. Doubling the rewards: testis ESTs for Drosophila gene discovery and spermatogenesis expression profile analysis. Genome research. 10, 1841-1842 (2000).
- Avidor-Reiss, T., Gopalakrishnan, J. Building a centriole. Curr Opin Cell Biol. , (2012).
- Blachon, S., et al. Drosophila asterless and vertebrate Cep152 Are orthologs essential for centriole duplication. Genetics. 180, 2081-2094 (2008).
- Basto, R., et al. Flies without Centrioles. Cell. 125, 1375-1386 (2006).
- Mottier-Pavie, V., Megraw, T. L. Drosophila bld10 is a centriolar protein that regulates centriole, basal body, and motile cilium assembly. Mol Biol Cell. 20, 2605-2614 (2009).
- Rodrigues-Martins, A., et al. DSAS-6 Organizes a Tube-like Centriole Precursor, and Its Absence Suggests Modularity in Centriole Assembly. Curr Biol. 17, 1465-1472 (2007).
- Stevens, N. R., Dobbelaere, J., Brunk, K., Franz, A., Raff, J. W. Drosophila Ana2 is a conserved centriole duplication factor. J Cell Biol. 188, 313-323 (2010).
- Gopalakrishnan, J., et al. Sas-4 provides a scaffold for cytoplasmic complexes and tethers them in a centrosome. Nat Commun. 2, 359 (2011).
- Gopalakrishnan, J., et al. Tubulin nucleotide status controls Sas-4-dependent pericentriolar material recruitment. Nat Cell Biol. 14, 865-873 (2012).
- Riparbelli, M. G., Callaini, G., Megraw, T. L. Assembly and persistence of primary cilia in dividing Drosophila spermatocytes. Dev Cell. 23, 425-432 (2012).
- Maines, J. Z., Wasserman, S. A. Post-transcriptional regulation of the meiotic Cdc25 protein Twine by the Dazl orthologue Boule. Nat Cell Biol. 1, 171-174 (1999).
- Herrmann, S., Amorim, I., Sunkel, C. E. The POLO kinase is required at multiple stages during spermatogenesis in Drosophila melanogaster. Chromosoma. 107, 440-451 (1998).
- Yamashita, Y. M., Jones, D. L., Fuller, M. T. Orientation of asymmetric stem cell division by the APC tumor suppressor and centrosome. Science. 301, 1547-1550 (2003).
- Dix, C. I., Raff, J. W. Drosophila Spd-2 Recruits PCM to the Sperm Centriole, but Is Dispensable for Centriole Duplication. Curr Biol. , (2007).
- Stevens, N. R., Dobbelaere, J., Wainman, A., Gergely, F., Raff, J. W. Ana3 is a conserved protein required for the structural integrity of centrioles and basal bodies. J Cell Biol. 187, 355-363 (2009).
- Giansanti, M. G., Bucciarelli, E., Bonaccorsi, S., Gatti, M. Drosophila SPD-2 Is an Essential Centriole Component Required for PCM Recruitment and Astral-Microtubule Nucleation. Curr Biol. , (2008).
- Januschke, J., Llamazares, S., Reina, J., Gonzalez, C. Drosophila neuroblasts retain the daughter centrosome. Nat Commun. 2, 243 (2011).
- Cheng, J., et al. Centrosome misorientation reduces stem cell division during ageing. Nature. 456, 599-604 (2008).
- Zamore, P. D., Ma, S. Isolation of Drosophila melanogaster testes. J. Vis. Exp. , e2641 (2011).
- Fuller, M. T., Bate, M., Martinez-Arias, A. . The Development of Drosophila melanogaster. , 71-174 (1993).
- Cenci, G., Bonaccorsi, S., Pisano, C., Verni, F., Gatti, M. Chromatin and microtubule organization during premeiotic, meiotic and early postmeiotic stages of Drosophila melanogaster spermatogenesis. J Cell Sci. . 107 (Pt. 12), 3521-3534 (1994).
- White-Cooper, H., Schafer, M. A., Alphey, L. S., Fuller, M. T. Transcriptional and post-transcriptional control mechanisms coordinate the onset of spermatid differentiation with meiosis I in Drosophila. Development. 125, 125-134 (1998).
- Yamashita, Y. M., Mahowald, A. P., Perlin, J. R., Fuller, M. T. Asymmetric inheritance of mother versus daughter centrosome in stem cell division. Science. 315, 518-521 (2007).
- Tates, A. D. . Cytodifferentiation during Spermatogenesis in Drosophila melanogaster: An Electron Microscope Study. , (1971).
- Baker, J. D., Adhikarakunnathu, S., Kernan, M. J. Mechanosensory-defective, male-sterile unc mutants identify a novel basal body protein required for ciliogenesis in Drosophila. Development. 131, 3411-3422 (2004).
- Avidor-Reiss, T., Gopalakrishnan, J., Blachon, S., Polyanovsky, A., Schatten, H. . The Centrosome: Cell and Molecular Mechanisms of Functions and Dysfunctions in Disease. , (2012).
- Gopalakrishnan, J., et al. Self-assembling SAS-6 multimer is a core centriole building block. J Biol Chem. 285, 8759-8770 (2010).
- Hassell, J., Hand, A. R. Tissue fixation with diimidoesters as an alternative to aldehydes. I. Comparison of cross-linking and ultrastructure obtained with dimethylsuberimidate and glutaraldehyde. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 22, 223-229 (1974).
- Pisano, C., Bonaccorsi, S., Gatti, M. The kl-3 loop of the Y chromosome of Drosophila melanogaster binds a tektin-like protein. Genetics. 133, 569-579 (1993).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten