Method Article
Centrosomes d'imagerie dans Fly testicules
Dans cet article
Résumé
Imagerie de protéines centrosomales pendant la spermatogenèse chez la drosophile est une méthode puissante pour identifier de nouvelles protéines essentielles pour la biologie centrosome ainsi que d'élucider la fonction particulière de joueurs connus dans ce processus.
Résumé
Centrosomes sont conservées en fonction des organites microtubules dont la structure et le changement de façon spectaculaire au cours du cycle cellulaire et de la différenciation des cellules fonctionnelles. Centrosomes sont essentiels pour déterminer l'axe de division cellulaire au cours de la mitose et de la nucléation cils pendant l'interphase. L'identité des protéines qui interviennent dans ces changements dynamiques n'est que partiellement connue, et la fonction de la plupart des protéines qui ont été impliqués dans ces processus est encore rudimentaire. Des travaux récents ont montré que la drosophile spermatogenèse fournit un système puissant pour identifier de nouvelles protéines essentielles pour la fonction centrosome et la formation ainsi que de mieux comprendre la fonction particulière de joueurs connus dans les processus liés centrosome. Drosophile est un organisme modèle génétique établi où mutants gènes centrosomales peuvent être facilement obtenues et facilement analysés. En outre, les progrès récents dans la sensibilité et la résolution de la microscopie optique et ladéveloppement de marqueurs centrosomales génétiquement marqués robustes ont transformé la capacité d'utiliser des testicules chez la drosophile comme système modèle simple et accessible à étudier centrosomes. Cet article décrit l'utilisation de marqueurs centrosomales génétiquement marqués d'effectuer écrans génétiques pour les nouveaux mutants centrosomales et de mieux comprendre la fonction spécifique des gènes nouvellement identifiés.
Introduction
Testicules chez la drosophile sont un système d'organe approprié pour étudier une variété de processus cellulaires et de développement et ont été examinés de manière détaillée au cours des années 1-9. Ce manuscrit porte sur l'utilisation des testicules chez la drosophile pour étudier le centrosome, un organite cellulaire conservée. Comme dans d'autres systèmes, le centrosome de la fonction testiculaire chez la drosophile dans la mitose, la méiose, et ciliogenèse 10. Centrosomes sont composés d'une paire de structures à base de microtubules appelés centrioles entourées par un réseau complexe de protéines en tant que matériau dénommé péricentriolaire (PCM). La paire centriole est constitué d'un centriole mère plus âgée et une fille plus jeune centriole. Comme la cellule progresse vers la mitose, les deux centrioles se séparent, en double, et d'acquérir une grande quantité de PCM pour former finalement deux centrosomes distinctes. Le centrosome contenant le centriole mère d'origine est appelée le centrosome mère et le centrosome contenant le centriole fille d'origine est désigné sous le nom de centrosome fille.
Testicules de Drosophila sont idéales pour étudier la base moléculaire de la biologie des centrosomes par microscopie à fluorescence pour une variété de raisons.
- La plupart des protéines de Drosophila qui sont nécessaires pour la biologie des centrosomes dans les testicules sont conservés chez les eucaryotes, ce qui suggère que la connaissance pertinente pour la biologie des centrosomes chez les humains et d'autres espèces peut être obtenue en étudiant le centrosome des testicules chez la drosophile 1,11-14.
- Effectuer une analyse mutant chez la drosophile offre un avantage important puisque, contrairement à beaucoup d'autres modèles, les mutations centrosomales chez la drosophile sont pas létale embryonnaire, permettant ainsi l'analyse génétique classique de la fonction centrosome. Cette caractéristique unique de la drosophile est due à la présence de la contribution de la mère qui persiste pendant les phases critiques de déve embryonnairepement. 1,11-14. Ainsi, on peut a) des mutations de l'étude qui éliminent complètement la formation centrosome et b) étudient le sort d'un centrosome normale qui a été formé dans l'embryon précoce par apport maternelle dans un contexte mutant après la contribution de la mère a été appauvri (le principe de la méthode est décrit dans 11).
- Transgènes fonctionnels avec des étiquettes fluorescentes codées génétiquement qui étiquettent le centrosome sont disponibles. Beaucoup de ces lignes utilisent propre promoteur de la protéine de conduire la transcription du transgène afin d'éviter une forte surexpression. Cela est particulièrement important parce que la surexpression des protéines entraîne souvent des artefacts qui interfèrent avec l'analyse de la fonction des centrosomes 1,11.
- Le centriole et centrosome sont particulièrement longue tout au long de la drosophile spermatogenèse, ce qui permet une analyse rapide et facile du centrosome par imagerie.
- Étapes consécutives de la spermatogenèse et b centrosomeiologie sont organisés chronologiquement le long des testicules, à partir de la pointe du testicule avec les centrosomes des cellules souches de sperme et se terminant à la partie inférieure des testicules avec la taille réduite des centrosomes et de l'activité dans les spermatozoïdes matures (figures 1 et 2). Cela permet de faciliter l'identification et l'analyse de la fonction des centrosomes pendant différents stades de développement des spermatozoïdes.
- Les testicules sont facilement disséqués à partir de larves mâle, les nymphes et les adultes 27.
- Au cours de la spermatogenèse, le centrosome et ses centrioles passent par la composition multiple, structurelle et états fonctionnels pour fonctionner dans la mitose, méiose, et la formation de cil. Au cours de ces processus, les assemble centrosome, doublons, migre, ancres à des parties spécifiques de la cellule, mûrit, se divise et crée un cil. En outre, le centriole de la spermatide maturité donne lieu à un précurseur centriolaire nommé le PCL 1. Toujours dans la spermatide mature, le centrosome subit un processus called réduction centrosome laquelle il perd de nombreuses composantes du PCM et le centriole (figures 1 et 2). Ainsi, des études dans les testicules permettent de traiter les multiples aspects de la vie centrosome tels que la rétention centrosome dans les cellules souches, la duplication centriole, la stabilité centriole, allongement centriole, la séparation et la ségrégation centriole, le recrutement de PCM, ciliogenèse, formation PCL, la réduction du centrosome, et astral nucléation des microtubules entre autres.
- Enfin, des études de biologie centrosome sont aidés par les autres caractéristiques bien connues de la drosophile qui en ont fait un organisme modèle préféré pour des études biologiques. Ceux-ci comprennent un temps de génération court, la facilité de la génétique, de même que la mutagenèse aléatoire et dirigée sur un site.
Ensemble, les caractéristiques ci-dessus mentionnées de Drosophila testicules fournit un modèle où le centrosome peut être étudié par imagerie facile, rapide et détaillée. Les techniques décritesdans le présent document ont été appliquées pour étudier de nombreux aspects de la biologie du centrosome y compris la formation centriole 11, la duplication centriole 15, le recrutement de PCM 16, la réglementation centrosome 17, et ciliogenèse 18. Ces techniques ont également été appliquées à l'étude du centrosome dans d'autres domaines de la biologie tels que la régulation de la méiose 19, ensemble de broche 20, et l'activité des centrosomes dans la division cellulaire asymétrique 21 souches parmi beaucoup d'autres.
Imagerie des testicules dans les mises en chantier centrosome avec l'obtention de mouches qui expriment des protéines centrosomales génétiquement marqués et isoler les testicules de larves mâle, nymphes, ou les mouches adultes. Ces mouches sont disponibles auprès de plusieurs groupes de recherche 1,11,15,22-25. Les testicules larvaires contiennent tous les stades de la spermatogenèse avant la méiose et sont utiles lors de l'analyse des mutations létales dans la nymphe ou adulte. Cependant, pupe tardive ou jeune adult testicules sont les plus robustes et contiennent tous les pré-et post-méiotiques étapes de la spermatogenèse, les rendant ainsi préférable pour l'analyse. Comme le nombre de spermatozoïdes diminue avec le vieillissement de la mouche, l'utilisation de testicules adultes est également approprié pour étudier le centrosome dans le contexte du vieillissement. 26. Procédé d'isolement de testicule de mouches adultes a été décrit précédemment 27.
Imagerie de centrosomes et leur fonction dans les testicules de Drosophila peut être réalisé par l'intermédiaire de trois pistes connexes qui sont présentés ici (figure 3). Sélection de piste qui est la plus appropriée dépend de la nature de la question le chercheur s'adresse.
Une piste implique l'imagerie des testicules en direct. Elle est la plus rapide des trois pistes, mais ne peut être appliquée lorsque les échantillons n'ont pas besoin d'être conservés et lorsque immunocoloration n'est pas nécessaire. En piste A, les testicules sont montés (intact, percé ou coupé) sur des lameset soigneusement écrasé sous une lamelle couvre-objet pour former une seule couche de cellules facilement identifiables. Les cellules sont ensuite visualisés en utilisant la microscopie à contraste de phase et par microscopie fluorescente. L'utilisation de contraste de phase est particulièrement important pour l'analyse des testicules Drosophila car elle révèle des informations cellulaire qui n'est pas visible par les autres formes d'éclairage par transmission et permet ainsi une identification rapide des divers stades de développement des spermatozoïdes 28,29. Cependant, la piste A présente deux inconvénients principaux. Tout d'abord, l'intégrité morphologique des cellules est souvent compromise lorsque les testicules sont rompues. Deuxièmement, les cellules non fixées se déplacent parfois dans l'échantillon, ce qui rend l'imagerie de multiples couches de confocale dans une région déterminée difficile. Pour promouvoir l'analyse des types de cellules spécifiques, les testicules peuvent être percés ou coupés afin d'orienter la manière dont les ruptures des testicules tels que l'écrasement sous le minimum de lamelle affecte la morphologie du type cellulaire d'intérêt.
Voie B implique la fixation chimique des testicules. Cette piste nécessite une quantité intermédiaire de temps pour la préparation des échantillons et a l'avantage que les spécimens fixes peuvent être enregistrées pour une analyse ultérieure. En outre, la fixation sert à fabriquer des structures cellulaires plus rigide, ce qui réduit le mouvement de l'échantillon lors de l'imagerie. Cependant, la microscopie à contraste de phase devient beaucoup moins informatif après fixation chimique, de faire quelques étapes du développement difficile d'identifier de sperme.
Volet C est la plupart du temps-intensive, mais a l'avantage supplémentaire que les structures cellulaires sont fixes et immunocolorées, permettant la visualisation des protéines qui ne sont pas disponibles avec les étiquettes génétiques appropriées. Il existe de nombreux anticorps disponibles à la fois commercialement et de divers groupes de recherche pour immunomarquage centrosomes et des structures liées centrosome dans les testicules chez la drosophile.
Protocole
Une. Suivre A. Préparation de testicules en direct
- Préparer PBS en dissolvant 8,0 g de NaCl, 0,2 g de KCl, 1,44 g de Na 2 HPO 4, 0,24 g de KH 2 PO 4 dans 800 ml d'eau distillée et d'ajuster le pH à 7,4. Porter le volume à 1 litre et stériliser à l'autoclave.
- Isoler les testicules comme décrit précédemment 27.
- Préparer tampon de coloration DAPI en diluant 1 mg / ml actions à 1 pg / ml dans du PBS. Utiliser du papier d'aluminium pour protéger le tube de la lumière et conserver à -20 ° C.
- Après avoir isolé les testicules, plonger l'échantillon dans 6 pi de tampon de coloration DAPI sur le dessus d'une lame de microscope en verre chargée positivement pendant 10 min. Testicules adhèrent bien à diapositives disponibles dans le commerce à charge positive, ce qui permet une manipulation aisée de l'échantillon. Diapositives chargées positivement sont modifiées de façon covalente à conférer une charge positive statique à la surface du verre. Similaire au revêtement de polylysine, ce qui favorise l'interaction des testicules wième de la surface de la diapositive.
- Laver excès DAPI en remplaçant le tampon de coloration à deux reprises avec 6 pi de PBS. Utilisez un morceau de papier filtre pour évacuer le tampon après chaque étape de lavage. Faites attention à ne pas supprimer accidentellement les testicules avec le tampon à chaque lavage.
- Ajouter 6 ul de PBS à l'échantillon. La quantité de tampon utilisée doit être adaptée à la taille de la lamelle couvre-objet. Les volumes prévus dans ce protocole sont pour une lamelle mm 18 x 18. Facultatif: Il est recommandé de percer les testicules près de l'emplacement relatif du type cellulaire d'intérêt. Cela permettra d'assurer que la pression minimale sur ces cellules au cours de l'étape d'écrasement, maintenant ainsi leur intégrité structurelle. Piercing des testicules peut être réalisée en utilisant un pointu, scalpel propre.
- Placez délicatement une lamelle sur le dessus de l'échantillon.
- Sceller les bords de la lamelle à l'aide de vernis à ongles transparent pour veiller à ce que la mémoire tampon ne s'évapore pas des spécimens vivants tout en imvieillissement.
- Utilisez un marqueur pour désigner la position des testicules pour faciliter la localisation de l'échantillon sur la lame et de procéder à l'imagerie.
- Lavez l'excès de tampon de coloration DAPI en remplaçant le tampon deux fois avec 6 pi de PBS. Utilisez un morceau de papier filtre pour évacuer le tampon après chaque étape de lavage. Faites attention de ne pas supprimer accidentellement l'échantillon avec le tampon à chaque lavage.
2. Piste B. Préparation de testicules fixes
- Préparer tampon Fix en diluant la solution mère de formaldéhyde 37% dans du PBS à une concentration finale de 3,7% de formaldéhyde dans 1x PBS
- Préparer tampon de coloration DAPI en diluant 1 mg / ml de DAPI à 1 pg / ml dans du PBS.
- Plonger les testicules dans une pi goutte de PBS 6 sur une lame de microscope en verre chargée positivement.
- Orienter manuellement les testicules dans un mode linéaire ou autrement préféré.
- Utilisez un morceau de papier filtre pour évacuer le PBS et le remplacer par 6 pi de Fixtampon pendant 5 min.
- Utilisez un morceau de papier filtre pour évacuer le tampon de Fix et immerger l'échantillon dans 6 pi de tampon de coloration DAPI pour 10 min.
- Placez délicatement une lamelle mm 18 x 18 sur le dessus de l'échantillon.
- Sceller les bords de la lamelle à l'aide de vernis à ongles transparent pour veiller à ce que la mémoire tampon ne s'évapore pas de l'échantillon tandis que l'imagerie.
- Utilisez un marqueur pour désigner la position des testicules pour faciliter la localisation de l'échantillon sur la lame et de procéder à l'imagerie.
3. Suivre C. Préparation de immunocolorées testicules
Siliconise lamelle: Plongez multiples 18 x 18 mm lamelles dans un petit bac contenant une solution de siliciuration et incuber pendant 1 min à température ambiante sous une hotte. Assurez-vous que les lamelles sont entièrement exposés et ne sont pas empilés les uns sur les autres.
- Placer l'échantillon dans une baisse de 5 pi de PBS sur la lamelle siliconé. Orientez letesticules comme vous le souhaitez et percer les testicules à l'aide d'un scalpel. Placez délicatement une lame de microscope en verre chargée positivement sur la lamelle, permettant à la PBS pour devenir uniformément dispersé entre la lamelle et la lame. Utilisez un petit morceau de papier filtre pour évacuer l'excès de tampon entre la lamelle et un toboggan. Comme le tampon est retiré par le papier filtre, l'augmentation de pression va écraser les testicules. De nombreux échantillons doivent être préparés simultanément, comme certains peuvent être perdues ou endommagées au cours du protocole. Un graveur de verre peut être utilisé pour marquer les lames si les différents types de spécimens sont préparés simultanément.
- Laver les lamelles couvre-3x pendant 1 min chacun dans l'eau, suivie par 3 x 1 min chacun dans l'éthanol 70%, et un lavage final pendant 1 min dans de l'eau. Autoriser les lamelles siliconées sécher à l'air sous une hotte.
- Laissez tomber les diapositives dans l'azote liquide et permettent l'échantillon de geler pendant 5-10 min.
- Retirez les diapositives de la liquid azote en utilisant une grande pince. Utiliser un scalpel pour enlever rapidement la lamelle. Les échantillons doivent rester sur la diapositive. Veillez à ne pas salir l'échantillon pendant ce processus en faisant glisser la lamelle le long de la glissière.
- Incuber les lames dans du methanol préalablement refroidi dans un bocal de Coplin de coloration de verre à -20 ° C pendant 15 min.
- Placer les lames dans un pot de coloration Coplin de verre contenant de l'acétone préalablement refroidie à -20 ° C pendant 30 secondes.
- Laver les lames pendant 1 min dans du PBS à température ambiante en utilisant un bocal de Coplin de coloration du verre.
- Préparer PBST-B en le complétant PBS avec 0,1% de Triton-X100 et 1% de sérum bovin Albumine (BSA). 5% de sérum normal de la même espèce hôte que l'anticorps secondaire (de l'étape 3.14) peut être utilisée à la place de la BSA à réduire le bruit de fond produit à partir de l'anticorps secondaire non spécifique de liaison.
- Incuber les lames pendant 10 minutes dans du PBST-B dans un bocal de Coplin de coloration de verre pour bloquer les sites non spécifiques.
- Remplir les puits dela chambre d'humidité avec de l'eau. Humidité à l'intérieur de la chambre permet de minimiser l'évaporation de solutions d'anticorps à partir de l'échantillon au cours des étapes d'incubation.
- Préparer PBST-BR en la complétant PBST-B avec 100 ug / ml de RNase A. RNase A se dégrade l'ARN dans l'échantillon et aussi sert d'agent de blocage supplémentaire en absorbant fortement à la surface du verre.
- Placez un morceau d'environ 1x1 cm de Parafilm sur le dessus de l'échantillon de répandre la solution d'anticorps de façon uniforme et protéger la solution d'anticorps de s'évaporer. Fermer la chambre d'humidité et incuber l'échantillon dans l'anticorps primaire pendant 1 heure à température ambiante.
- Enlever les lames de PBST-B. Utiliser un morceau de papier filtre pour sécher la surface de la lame autour de l'échantillon, en utilisant des précautions de ne pas sécher l'échantillon lui-même. Enfin, placer la lame dans la chambre humide avec l'échantillon vers le haut
- Ajouter délicatement 100 ul d'anticorps primaire dilué en PBS-BR sur le dessus de la spécificationImen (1:200 est généralement une bonne concentration de départ pour les anticorps non caractérisés).
- Couvrir l'échantillon avec une participation d'environ 1 x 1 cm morceau de Parafilm et fermer la chambre de l'humidité. Incuber l'échantillon dans l'anticorps secondaire pendant 1 heure à température ambiante.
- Ouvrez la chambre de l'humidité et utiliser une pince pour enlever délicatement le Parafilm de la diapositive. Incuber les lames pendant 5 min en PBS dans un bocal de coloration Coplin de verre à la température ambiante à laver. Répétez ce processus pour un total de trois lavages.
- Enlever les lames de PBST-B et les placer dans la chambre de l'humidité avec l'échantillon vers le haut. Ajouter délicatement 100 pi d'anticorps secondaire dilué en PBS-BR sur le dessus de l'échantillon.
- Ouvrez la chambre de l'humidité et utiliser une pince pour enlever délicatement le Parafilm de la diapositive. Encore une fois, le laver 3x spécimen pendant 5 minutes chacun dans du PBST dans une jarre de Coplin de coloration de verre, suivie par 3 fois pendant 5 minutes chacun dans du PBS.
- Utiliser un Kimwipe et un papier filtre à séchez soigneusement la surface de la lame, en prenant soin d'éviter de toucher ou de séchage de l'échantillon.
- Ajouter 6 pi de milieu de montage de spécimen, couvrir avec une lamelle propre (pas enduit de silicone), et le joint bords vernis à ongles.
- Utilisez un marqueur pour désigner la position des testicules pour faciliter la localisation de l'échantillon sur la lame et de procéder à l'imagerie.
4. Notes d'imagerie
L'imagerie peut être réalisée en utilisant un microscope à lumière ordinaire debout ou inversé ou microscope confocal. Il est important que le microscope est équipé à contraste de phase, en particulier pour l'imagerie de spécimens vivants testicules (piste A). Cette fonctionnalité est disponible depuis peu sur la microscopie confocale.
Quand les testicules se brisent spontanément (voie A), la pointe (tige région de cellule) est généralement maintenu intact et est facilement identifiable, offrant un bon marqueur pour localiser et utiliser d'abord pour l'orientation.
_content "> Centrioles sont assez petites structures et les images devraient donc être pris en utilisant 63X ou 100X objectifs, un facteur de zoom de 4-6X, et une résolution d'au moins 512 x 512 pixels lorsque cela est possible.Résultats
Centrosomes subissent de multiples transformations morphologiques et fonctionnelles au cours de la spermatogenèse. Cette caractéristique de la spermatogenèse rend les testicules d'un système utile d'étudier divers aspects de la biologie du centrosome. Un tel procédé est facilement observé allongement centrosome. Dans les spermatogonies, le marqueur centriolaire ana1-GFP marque le 0,6 m de long centriole (figure 4a). Ce centriole s'allonge cours de la spermatogenèse et atteint une longueur de 2,5 um dans les spermatides presque matures. Depuis centrioles chez la drosophile sperme sont particulièrement longue, l'imagerie peut être utilisé pour faire des déclarations quantitatives concernant l'allongement centrosome (figure 4b). L'analyse de la longueur centriole peut également être effectuée dans un fond mutant et différents mutants ont été identifiés qui modifient la croissance centriole (figure 5). Les exemples sont toujours en avance (aly) et boulet (CAN), les mutations que arrest spermatogenèse avant le début de la méiose 30 mais ne pas bloquer centriole allongement. Dans ces mutants, des spermatocytes centrioles matures atteignent environ ~ 2,4 um par rapport aux centrioles des cellules de contrôle qui atteignent un maximum de 1,8 pm.
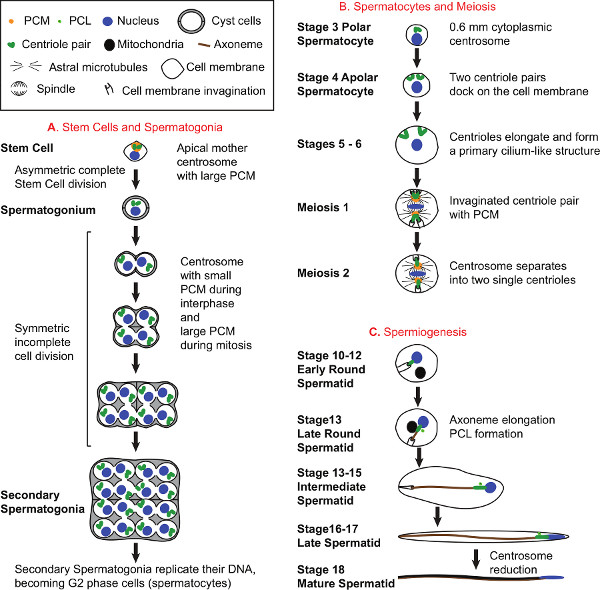
Figure 1. Spermatogenèse et biologie des centrosomes. A) le développement des cellules souches et des spermatogonies. Tous les spermatozoïdes proviennent de cellules souches trouvées à l'extrémité apicale des testicules. Chaque cellules souches divise de manière asymétrique pour former une cellule souche qui hérite du centrosome mère et un spermatogonies souches qui hérite du centrosome fille 31. Comme forme spermatogonies, ils deviennent entourées par deux cellules de kystes, qui continuent d'entourer les spermatocytes et spermatides tout au long de la spermatogenèse. Spermatogonies diviser 4 fois pour produire 16 spermatogonies, chacun contenant deux centrioles. B) Développement de spermatocytes et méiose. Au cours du développement Spermatocyte, centrioles reproduisent une fois de plus à générer quatre centrioles organisés en deux paires par cellule et 64 centrioles par kyste. Stade précoce du développement Spermatocyte, chaque centriole se déplace vers la membrane plasmique, les quais à elle, et s'allonge pour former une structure qui ressemble à un cil primaire 18,32-34. En matures spermatocytes, longueur centriole atteint environ 1,8 um. Les centrosomes jouent un rôle essentiel dans la méiose. Au cours de la méiose I, les paires centriole qui sont encore attachés au mouvement de la membrane plasmique vers le centre de la cellule et de créer des invaginations membranaires cellulaires à leur extrémité distale. Le PCM autour des centrioles se développe, nucléation des microtubules astraux, et co-localise avec le pôle de la broche. Au cours de la transition de la méiose II, la paire centriole sépare de sorte que seul un unique centriole est présent à chaque pôle du fuseau. C) spermatogenèse. A la fin de la méiose II, le début de Spermatide rond a un seul centriole attaché à la membrane plasmique invaginée. Une grande dérivé mitochondrial ronde se trouve près du noyau et plus tard commence à s'allonger le long de l'axonème de plus en plus tard Spermatides rondes. Au cours de la spermatogenèse, les formes Axoneme et s'allonge à l'intérieur du cytoplasme. En outre, une nouvelle structure centriolaire connu sous le PCL (proximal Centriole Comme) apparaît près du centriole préexistants 1. A la fin de la spermatogenèse, les cellules partageant un kyste commun séparent les uns des autres pour devenir spermatozoïdes mobiles à pleine maturité. Les schémas de développement Spermatocyte (B) et spermatogenèse (C) représentent seulement une cellule sur les 16 spermatocytes et spermatides 64, respectivement par kyste, et ne représentent pas les cellules de kystes. Cliquez ici pour afficher une grander figure.
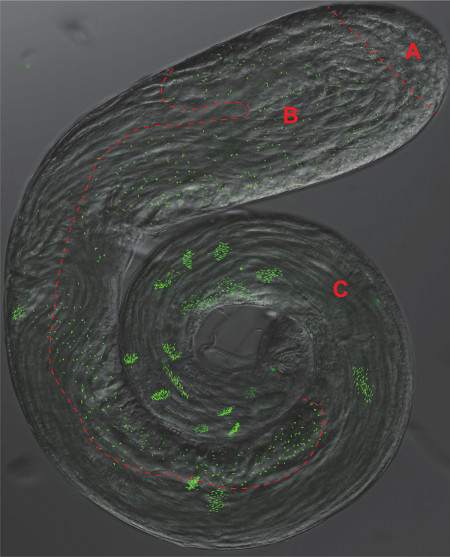
Figure 2. Les testicules drosophile. Une superposition d'un contraste de phase et fluorescence de la GFP micrographie d'un testicule l'ensemble du montage exprimant le marqueur pan-centriolaire Ana-1-GFP. Zone distincte correspondant à panneaux 1-3 de la figure 1 sont séparés par une ligne rouge en pointillés A) Cellules souches et des spermatogonies, B) spermatocytes et méiose, C) spermatogenèse.
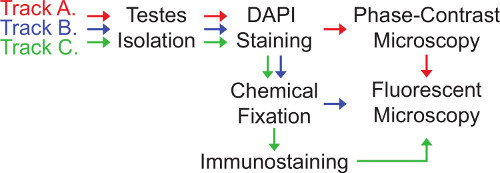
Figure 3. Pistes Vers imagerie Centrosomes chez la drosophile testicules.

Figure 4. Centrosome Allongement cours de la spermatogenèse. A) Chaque étape représente une image à contraste de phase (à gauche), image de fluorescence (au milieu), et l'image agrandie du centrosome (à droite). L'image à contraste de phase démontre l'étape particulière de la cellule sur la base de la position et de la morphologie de la cellule, le noyau, nucléole, et les mitochondries. L'image de fluorescence montre ADN coloré au DAPI (bleu). L'image montre centrosome centrosomes marqués par Asterless-GFP (Asl, meilleurs images) et ana1-GFP (ana1, image du bas). Un cercle blanc souligne la membrane cellulaire dans les deux images à contraste de phase et de fluorescence. Les cercles blancs et le cercle en pointillés gris dans l'image de fluorescence en surbrillance la position du noyau et nucléole, respectivement. La flèche jaune à l'Y-chromosomecertaines boucles. Pointillés rouges cercles marquent les mitochondries. Étapes 1-6 se réfère à 29 et stades 13-17 se réfère à la description de stades cellulaires dans 32. Étape 1: Spermatocyte primaire. Identifié comme une petite cellule d'une pointe du testicule. Etape 2a: Polar Spermatocyte. Identifié par la présence d'un capuchon de mitochondries d'un côté du noyau. Etape 3: apolaire Spermatocyte. Identifié par son rapport taille plus grande que la spermatocytes primaires et le manque d'un capuchon de mitochondries. Etape 4: Spermatocyte primaire. Marqué par l'apparition de tout: Tous les 3 boucles du chromosome Y. Etape 5: Mature Spermatocyte primaire. Le plus grand Spermatocyte produite dans la spermatogenèse, identifié par une nouvelle augmentation de la taille du noyau. Etape 6: préméiotique Spermatocyte primaire. Boucles chromosome Y se désintègrent et le noyau disparaît. Etape 13: Oignon étape Spermatide. Cellules rondes contenant le noyau et les mitochondries de taille égale. Etape 17: spermatide tard. Identifié comme un spermatide allongée qui fait toujours partie d'un bundle de 64 spermatides à noyaux trouvés près de la base des testicules., noyaux sont légèrement plus large que les spermatides matures trouvés dans la vésicule séminale. Barres d'échelle, 10 um et 1 um. B) Le graphique des moyenne et écart type pour chaque étape, telle que mesurée par Asterless-GFP (bleu) et ana1-GFP (vert). À l'étape 6, (vert) les moyennes et les écarts types Asterless-GFP (bleu) et ana1-GFP se chevauchent et ne Asterless-GFP (bleu) est apparente. À partir de l'étape 13, Asterless-GFP ne décore pas tout centriole et les mesures n'ont pas été déterminée (ND).
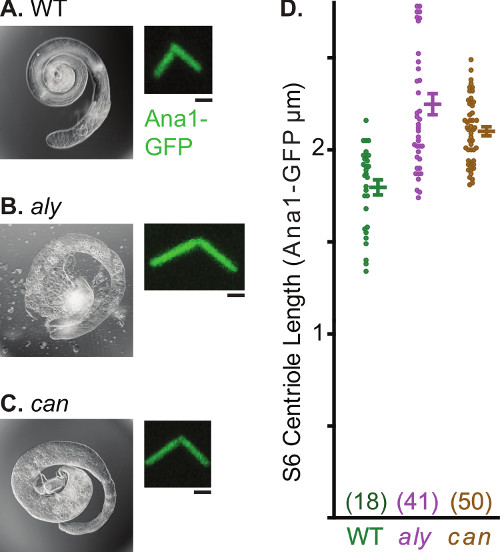
Figure 5. Anormalement longues Centrioles en scène 6 spermatocytes de aly et peuvent Mutants. AC) micrographie lumière des testicules entiers et panneau fluorescent de représentant centrosome laBeled par ana1-GFP. Notez que la forme anormale des testicules dans aly et peut mutants, qui résulte d'un manque de spermatides comme une conséquence de l'arrêt méiotique. D) Graphique dépeint moyenne, écart-type, et la distribution des données de longueur centriole dans le type sauvage, aly et peut . nombre d'échantillons pour chaque point de données est entre parenthèses. La barre d'échelle, 1 pm.
Discussion
Étude de la biologie du centrosome dans les testicules de mouches en utilisant des marqueurs centrosomales génétiquement marqués est une méthode utile pour évaluer la fonction et l'activité centrosome à la fois un contexte de type sauvage et mutant. En particulier, la piste A est adapté pour le dépistage rapide des anomalies centrosomales tels que malformation, misegregation, l'instabilité, ou la longueur anormale dans un effort pour identifier de nouveaux mutants. En outre, spermatide cils dans des préparations vivantes restent immobiles pendant environ 15 min après la dissection et l'utilisation des testicules en direct en cours A permet également la motilité des spermatozoïdes pour être facile à régler. Etant donné que l'activité des spermatozoïdes motiles cils est directement liée à la fonction du centrosome, analyses peuvent être effectuées pour déterminer les effets de diverses mutations centrosomales sur la fonction ciliaire. Voie B peut être utilisé pour des observations plus spécifiques en particulier lorsque les données statistiques est nécessaire par exemple pour compter le nombre de cellules et par les centrioles ou le nombre de cellules par kyste. Volet C est le plus useful pour les observations détaillées qui nécessitent une coloration avec des anticorps. Des exemples comprennent l'étiquetage d'un type de cellule particulier, tel que des cellules souches, la coloration d'une protéine qui ne présente pas une étiquette disponible comme tubuline acétylée, ou de vérifier l'absence ou une mauvaise localisation d'une protéine dans un mutant.
Quand l'imagerie centrosomes et des structures liées centrosome, en utilisant des marqueurs génétiquement marqués plutôt que des anticorps est non seulement plus facile expérimentalement, mais fournit également des résultats plus robustes et reproductibles. Par conséquent, l'utilisation de protéines centrosomales génétiquement marqués est une approche fiable pour les analyses mécanistes et quantitatives qui nécessitent un grand nombre de données. Par exemple, l'utilisation de marqueurs centrosomales génétiquement marqués a été particulièrement utile pour la quantification de la longueur centriole. Cette analyse a révélé que diverses mutations peuvent être classés en deux catégories en fonction de la variabilité de la longueur centriole. Une catégorie comprend les mutations qui change longueur de centriole mais n'affectent pas l'écart type 1 et l'autre catégorie comprend les mutations qui affectent à la fois la longueur de centriole et l'écart-type de longueur 11. Ces données quantitatives peuvent fournir des indications utiles sur la fonction de certains gènes centrosomales. Mutants centrosomales qui présentent défectueux longueur de centriole avec une augmentation de l'écart-type peuvent être dues à une déstabilisation de la structure centriolaire. Cependant, défectueux longueur de centriole avec un écart type normal peut indiquer que la mutation ne déstabilise pas structurellement le centriole et est plus susceptible d'être dû à un changement de mécanisme de régulation contrôlant longueur centriole. A cause des incohérences dans immunomarquage, des analyses quantitatives sont difficiles avec l'utilisation de marqueurs d'anticorps seul.
Le centrosome est une grande structure protéique complexe, et plusieurs de ses protéines ne se trouvent dans son intérieur. Utilisation centrosomale génétiquement marquémarqueurs plutôt les anticorps permet un à étiqueter systématiquement les composants internes du centrosome dont épitopes peuvent être autrement inaccessibles aux anticorps marqueurs. Par exemple, des études de localisation de BLD10 utilisant des anticorps trouve la protéine à être enrichi au niveau des extrémités distales et proximales du centriole 13, tandis que BLD10-GFP montre une répartition plus uniforme 1. Cependant, il est également important de tenir compte du niveau d'expression d'une protéine génétiquement étiqueté particulier, comme cela peut affecter la distribution de la protéine. Localisation de Sas-4-GFP et SAS-6-GFP exprimé sous leur endogène est limitée aux extrémités proximales du centriole 1,16,35 D'autre part, Sas-4-GFP et SAS-6-GFP exprimé sous la fort promoteur de l'ubiquitine sont localisés le long de toute la longueur de la centriole 12,14. Une autre considération importante est l'effet de l'étiquette génétique sur la fonction des protéines. Analyser si des protéines génétiquement marqués sont fonctionnelles peut être tesTED en introduisant la protéine transgénique dans un fond mutant et d'examiner si la protéine transgénique sauve le phénotype mutant.
Fixation de testicules de Drosophila peut être réalisée en utilisant une variété de fixateurs chimiques. Ici, nous décrivons la fixation à la fois avec le formaldéhyde (Voie B) et de méthanol et d'acétone (Track C). Toutefois, soit le fixateur peut être utilisé de manière interchangeable et depuis différents fixateurs peuvent perturber chimiquement épitopes d'anticorps natifs, la sélection de la fixation appropriée pour une immunocoloration doit être déterminée expérimentalement. Les fixateurs suivants et les conditions d'incubation sont couramment employées: 3,7% de formaldehyde, 5 min à température ambiante; méthanol, 15 min à -20 ° C; acétone, 10 min à -20 ° C; méthanol, 15 min à -20 ° C. suivi par de l'acétone, 30 sec à -20 ° C; éthanol, 20 min à -20 ° C. Bien que la fixation à l'acétone, le méthanol, l'éthanol et ne nécessitent pas une étape de perméabilisation prolongée pour une immunocoloration, une fixation wie formaldéhyde doit être suivie d'une incubation de 1 h dans du PBST-B à la température ambiante, pour perméabiliser les membranes cellulaires et permettre l'accès aux épitopes d'anticorps intracellulaires. En outre, certains fixateurs sont plus appropriés pour des antigènes particuliers. Par exemple, les fonctions de formaldéhyde et pour la fixation des petites protéines, alors que le méthanol et l'acétone sont bien adaptés pour la fixation de grands complexes moléculaires 36.
Immunomarquage de Drosophila testicules a été décrit précédemment pour l'observation des structures de la chromatine et le cytosquelette microtubulaire 29,37. Ici (Track C), la procédure a été optimisé pour l'analyse des structures centrosomales contenant des protéines génétiquement marqués. Nous fournissons une description détaillée de cette procédure pour guider les personnes qui n'ont pas d'expérience de travail dans les testicules chez la drosophile. Cette procédure comprend également des modifications pour améliorer la conservation et la morphologie des testicules, par exemple en utilisant des siliconized lamelles et lames de microscope en verre chargés positivement.
Déclarations de divulgation
Accès gratuit à cette publication a été soutenue par Leica Microsystems.
Remerciements
Ce travail a été financé par une subvention (R01GM098394) du NIH et l'Institut national des sciences médicales générales ainsi que la subvention de 1.121.176 National Science Foundation.
matériels
| Name | Company | Catalog Number | Comments |
| DAPI | Invitrogen | D1306 | |
| Positively Charged Slides | AZER Scientific | EMS200A+ | |
| Feather Microscalpel | Electron Microscopy Sciences | 72045-30 | |
| 37% Formaldehyde or Paraformaldehyde | Fisher Scientific | BP531-500 | |
| Phosphate Buffered Saline (PBS) | Boston Bioproducts | BM-220 | |
| 18x18 mm coverslips number 1.5 | VWR | 48366 205 | |
| Nail Polish | Electron Microscopy Sciences | 72180 | |
| Sigmacote | Sigma-Aldrich | SL2-100 ml | |
| Methanol | Fisher Scientific | A412-4 | |
| Acetone | Fisher Scientific | A949-1 | |
| Triton-X100 | Sigma-Aldrich | T9284-100ML | |
| BSA | Jackson ImmunoResearch | 001-000-162 | |
| RNAse A | 5 prime | 2900142 | |
| Filter paper | Whatman | 1001-055 | |
| Glass engraver | Dremel | 290-01 | |
| TCS SP5 confocal microscope | Leica | ||
| Mounting Media | Electron Microscopy Sciences | 17985-10 | |
| Immuno Stain Moisture Chamber, Black | Electron Microscopy Sciences | 62010-37 | |
| Glass Coplin Staining Jar, Screw Cap | Electron Microscopy Sciences | 70315 |
Références
- Blachon, S., et al. A proximal centriole-like structure is present in Drosophila spermatids and can serve as a model to study centriole duplication. Genetics. 182, 133-144 (2009).
- Hennig, W. Spermatogenesis in Drosophila. The International journal of developmental biology. 40, 167-176 (1996).
- Fabian, L., Brill, J. A. Drosophila spermiogenesis: Big things come from little packages. Spermatogenesis. 2, 197-212 (2012).
- White-Cooper, H. Molecular mechanisms of gene regulation during Drosophila spermatogenesis. Reproduction. 139, 11-21 (2010).
- Davies, E. L., Fuller, M. T. Regulation of self-renewal and differentiation in adult stem cell lineages: lessons from the Drosophila male germ line. Cold Spring Harb Symp Quant Biol. 73, 137-145 (2008).
- Belote, J. M., Zhong, L. Duplicated proteasome subunit genes in Drosophila and their roles in spermatogenesis. Heredity. 103, 23-31 (2009).
- Xiao, X., Yang, W. X. Actin-based dynamics during spermatogenesis and its significance. Journal of Zhejiang University. Science. B. 8, 498-506 (2007).
- Hennig, W. Chromosomal proteins in the spermatogenesis of Drosophila. Chromosoma. 111, 489-494 (2003).
- Wakimoto, B. T. Doubling the rewards: testis ESTs for Drosophila gene discovery and spermatogenesis expression profile analysis. Genome research. 10, 1841-1842 (2000).
- Avidor-Reiss, T., Gopalakrishnan, J. Building a centriole. Curr Opin Cell Biol. , (2012).
- Blachon, S., et al. Drosophila asterless and vertebrate Cep152 Are orthologs essential for centriole duplication. Genetics. 180, 2081-2094 (2008).
- Basto, R., et al. Flies without Centrioles. Cell. 125, 1375-1386 (2006).
- Mottier-Pavie, V., Megraw, T. L. Drosophila bld10 is a centriolar protein that regulates centriole, basal body, and motile cilium assembly. Mol Biol Cell. 20, 2605-2614 (2009).
- Rodrigues-Martins, A., et al. DSAS-6 Organizes a Tube-like Centriole Precursor, and Its Absence Suggests Modularity in Centriole Assembly. Curr Biol. 17, 1465-1472 (2007).
- Stevens, N. R., Dobbelaere, J., Brunk, K., Franz, A., Raff, J. W. Drosophila Ana2 is a conserved centriole duplication factor. J Cell Biol. 188, 313-323 (2010).
- Gopalakrishnan, J., et al. Sas-4 provides a scaffold for cytoplasmic complexes and tethers them in a centrosome. Nat Commun. 2, 359 (2011).
- Gopalakrishnan, J., et al. Tubulin nucleotide status controls Sas-4-dependent pericentriolar material recruitment. Nat Cell Biol. 14, 865-873 (2012).
- Riparbelli, M. G., Callaini, G., Megraw, T. L. Assembly and persistence of primary cilia in dividing Drosophila spermatocytes. Dev Cell. 23, 425-432 (2012).
- Maines, J. Z., Wasserman, S. A. Post-transcriptional regulation of the meiotic Cdc25 protein Twine by the Dazl orthologue Boule. Nat Cell Biol. 1, 171-174 (1999).
- Herrmann, S., Amorim, I., Sunkel, C. E. The POLO kinase is required at multiple stages during spermatogenesis in Drosophila melanogaster. Chromosoma. 107, 440-451 (1998).
- Yamashita, Y. M., Jones, D. L., Fuller, M. T. Orientation of asymmetric stem cell division by the APC tumor suppressor and centrosome. Science. 301, 1547-1550 (2003).
- Dix, C. I., Raff, J. W. Drosophila Spd-2 Recruits PCM to the Sperm Centriole, but Is Dispensable for Centriole Duplication. Curr Biol. , (2007).
- Stevens, N. R., Dobbelaere, J., Wainman, A., Gergely, F., Raff, J. W. Ana3 is a conserved protein required for the structural integrity of centrioles and basal bodies. J Cell Biol. 187, 355-363 (2009).
- Giansanti, M. G., Bucciarelli, E., Bonaccorsi, S., Gatti, M. Drosophila SPD-2 Is an Essential Centriole Component Required for PCM Recruitment and Astral-Microtubule Nucleation. Curr Biol. , (2008).
- Januschke, J., Llamazares, S., Reina, J., Gonzalez, C. Drosophila neuroblasts retain the daughter centrosome. Nat Commun. 2, 243 (2011).
- Cheng, J., et al. Centrosome misorientation reduces stem cell division during ageing. Nature. 456, 599-604 (2008).
- Zamore, P. D., Ma, S. Isolation of Drosophila melanogaster testes. J. Vis. Exp. , e2641 (2011).
- Fuller, M. T., Bate, M., Martinez-Arias, A. . The Development of Drosophila melanogaster. , 71-174 (1993).
- Cenci, G., Bonaccorsi, S., Pisano, C., Verni, F., Gatti, M. Chromatin and microtubule organization during premeiotic, meiotic and early postmeiotic stages of Drosophila melanogaster spermatogenesis. J Cell Sci. . 107 (Pt. 12), 3521-3534 (1994).
- White-Cooper, H., Schafer, M. A., Alphey, L. S., Fuller, M. T. Transcriptional and post-transcriptional control mechanisms coordinate the onset of spermatid differentiation with meiosis I in Drosophila. Development. 125, 125-134 (1998).
- Yamashita, Y. M., Mahowald, A. P., Perlin, J. R., Fuller, M. T. Asymmetric inheritance of mother versus daughter centrosome in stem cell division. Science. 315, 518-521 (2007).
- Tates, A. D. . Cytodifferentiation during Spermatogenesis in Drosophila melanogaster: An Electron Microscope Study. , (1971).
- Baker, J. D., Adhikarakunnathu, S., Kernan, M. J. Mechanosensory-defective, male-sterile unc mutants identify a novel basal body protein required for ciliogenesis in Drosophila. Development. 131, 3411-3422 (2004).
- Avidor-Reiss, T., Gopalakrishnan, J., Blachon, S., Polyanovsky, A., Schatten, H. . The Centrosome: Cell and Molecular Mechanisms of Functions and Dysfunctions in Disease. , (2012).
- Gopalakrishnan, J., et al. Self-assembling SAS-6 multimer is a core centriole building block. J Biol Chem. 285, 8759-8770 (2010).
- Hassell, J., Hand, A. R. Tissue fixation with diimidoesters as an alternative to aldehydes. I. Comparison of cross-linking and ultrastructure obtained with dimethylsuberimidate and glutaraldehyde. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 22, 223-229 (1974).
- Pisano, C., Bonaccorsi, S., Gatti, M. The kl-3 loop of the Y chromosome of Drosophila melanogaster binds a tektin-like protein. Genetics. 133, 569-579 (1993).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon